水与常见的溶液——自主学习导学案
文档属性
| 名称 | 水与常见的溶液——自主学习导学案 |

|
|
| 格式 | zip | ||
| 文件大小 | 1003.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-19 00:00:00 | ||
图片预览

文档简介
§水与常见的溶液——自主学习导学案
课题 §水与常见的溶液
< 自主学习:>我能解决一:
1、水的组成:______________________ 水的构成: ______________________
2、水的物理性质有: __________________________________________________
3、用化学方程式解释下列现象:
(1)为什么正常雨水pH<7? 形成知识:水的化学性质
化学方程式:______________________ 水+___________ _________
(2)为什么生石灰可用作某些食品的干燥剂?
化学方程式:______________________ 水+ __________ _________
(3)电解水
化学方程式:______________________ 水 __________+___________
4、水的人工净化的一般步骤为(在每一步后面的括号中注明可除去的杂质)
________( )___________( ) ________( )___________
5、 _______
水的分类 如何区分:_________________________________
______ 如何将硬水软化:_____________________________
激情发挥:水的自述!
激情体验一:
1、下列物质溶于水所得溶液的pH>7的( )
A、CaO B、SO2 C、NaCl D Na2CO3
2、2008年5月12日14时28分,在四川汶川县发生了 8.0级地震。震后水源受到污染,人民日常用水要经过一系列的净化才能使用。请你解决如下问题:
(1)为了除去水中的不溶性杂质,可采取的操作是____,为了除去水中的异味,可以加入_____,起_____作用。
(2)为降低水的硬度,在家里可以通过___________的方法实现。为了检验所得的水是软水,可以向水中加入_______。
(3)有人说:“饮用天然矿泉水对人体健康有利,矿泉水中微量元素的含量越多越好。”
你认为这种说法是否正确,为什么?_______________________________________
< 自主学习:>我能解决二:
1、溶液的定义________________________________________;组成:_____和____;基本特征:____、____。
2、溶液中的溶质可以是一种,也可以是____,溶质的状态可以是____、____、_____,常见的溶剂是___,除此之外还有_______________。
3、物质溶于水会伴随能量的变化,举例:___________、___________、____________。
4、溶液配制的一般步骤:_________________;每步各需用到的仪器___________________。
5、饱和溶液定义_________________________________________________________________。饱和溶液变不饱和溶液的方法_______________,不饱和变饱和的方法__________________。
硝酸钾的饱和溶液变为不饱和溶液的方法______________、_______________。
氢氧化钙的不饱和溶液变为饱和溶液的方法__________、_________、________。
6、溶解度定义___________________________________________________________________。溶解度四要素______________________________;溶解度曲线规律__________________________。溶解度曲线上任一点的意义_____________________;交点含义_________________________。
7、如何根据溶解度来确定溶解性___________________________________________________。
8、结晶的两种方法_________和_________。各适用于什么范围________________________。
9、气体溶解度的影响因素有___________;它们是如何影响的__________________________。
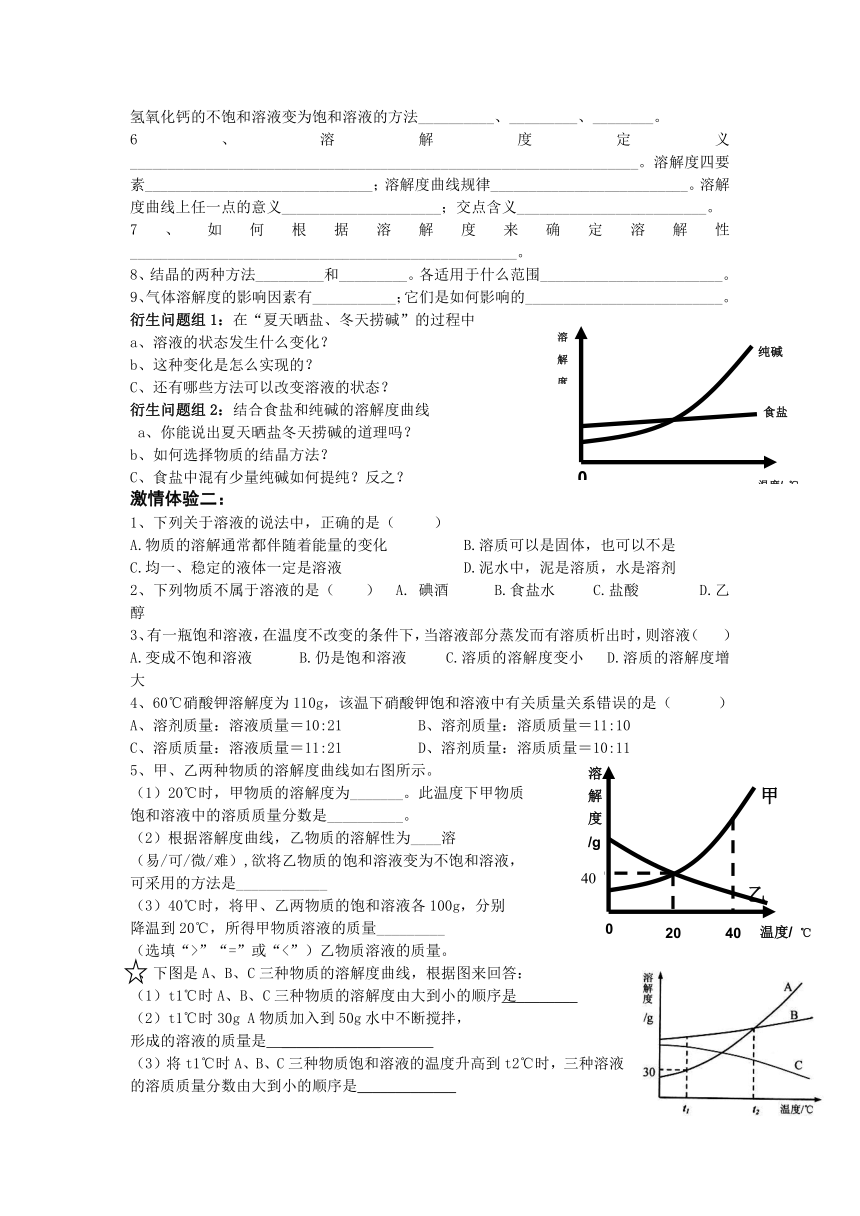
衍生问题组1:在“夏天晒盐、冬天捞碱”的过程中
a、溶液的状态发生什么变化?
b、这种变化是怎么实现的?
C、还有哪些方法可以改变溶液的状态?
衍生问题组2:结合食盐和纯碱的溶解度曲线
a、你能说出夏天晒盐冬天捞碱的道理吗?
b、如何选择物质的结晶方法?
C、食盐中混有少量纯碱如何提纯?反之?
激情体验二:
1、下列关于溶液的说法中,正确的是( )
A.物质的溶解通常都伴随着能量的变化 B.溶质可以是固体,也可以不是
C.均一、稳定的液体一定是溶液 D.泥水中,泥是溶质,水是溶剂
2、下列物质不属于溶液的是( ) A. 碘酒 B.食盐水 C.盐酸 D.乙醇
3、有一瓶饱和溶液,在温度不改变的条件下,当溶液部分蒸发而有溶质析出时,则溶液( )
A.变成不饱和溶液 B.仍是饱和溶液 C.溶质的溶解度变小 D.溶质的溶解度增大
4、60℃硝酸钾溶解度为110g,该温下硝酸钾饱和溶液中有关质量关系错误的是( )
A、溶剂质量:溶液质量=10:21 B、溶剂质量:溶质质量=11:10
C、溶质质量:溶液质量=11:21 D、溶剂质量:溶质质量=10:11
5、甲、乙两种物质的溶解度曲线如右图所示。
(1)20℃时,甲物质的溶解度为_______。此温度下甲物质
饱和溶液中的溶质质量分数是__________。
(2)根据溶解度曲线,乙物质的溶解性为____溶
(易/可/微/难),欲将乙物质的饱和溶液变为不饱和溶液,
可采用的方法是____________
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别
降温到20℃,所得甲物质溶液的质量_________
(选填“>”“=”或“<”)乙物质溶液的质量。
6、下图是A、B、C三种物质的溶解度曲线,根据图来回答:
(1)t1℃时A、B、C三种物质的溶解度由大到小的顺序是________
(2)t1℃时30g A物质加入到50g水中不断搅拌,
形成的溶液的质量是 _____________
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是_____________
我会总结:基础要夯实、能力要培养、方法要形成!
形成知识网络:
观念提升:微粒观、元素观、分类观、能量观、变化观
体验中考:
1、下列说法中正确的是( )
A.用洗洁精洗去餐具上的油污,洗洁精起到溶解作用
B.温度一定时,析出硝酸钾晶体的溶液未必是硝酸钾的饱和溶液
C.水浑浊时可加入明矾,使杂质沉降除去 D.75%的医用酒精消毒液,溶剂是酒精
2、下列说法正确的是( )
A、溶液的组成中一定含水 B、浓溶液不一定是饱和溶液
C、温度升高时物质的溶解度增大
D、20℃时36g氯化钠溶于100g水中,恰好达到饱和,则溶液中溶质的质量分数为36%
3、海洋是地球上最大的储水库,浩瀚的海洋蕴含着丰富的化学资源。我市具有较长的海岸线,海洋资源开发前景广阔。海水晒盐能够得到粗盐和卤水。
①卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是______。将t1℃的三种物质的饱和溶液加热到t2℃以上时,_______会析出晶体。
②将粗盐提纯可以得到纯净的NaCl。欲用纯净的NaCl配制100g 0.9%的生理盐水,需要NaCl的质量为_____。配制该溶液时需要用到的玻璃仪器有____________________________。
如果配制的溶液的溶质质量分数低于0.9%,可能的原因是_______________(任写一个)
③在粗盐提纯的过程中,用到的分离混合物的方法有哪些?
情感培养:节约用水、爱护水资源!
作业布置:1、完成复习指导:P26--29
2、海洋是人类千万年来取之不尽、用之不竭的巨大资源宝库。我们还可以从海洋中获得哪些物质?具体的方法是?请你进行整理并利用学案后面的补充习题进行自我检测。
自我提升:海水是一种重要的自然资源.以下是对海水资源的部分利用.
(1)从海水中获取淡水.常用的操作方法是_____________.证明得到的水是淡水的方法是_____________________________。
(2)从海水中提取溴.从海水中提取的溴约占世界溴产量的 ,工业上常用“吹出法”制溴,主要化学原理是2NaBr+C12=2NaCl+Br2,其反应类型是_____________.
(3)海底不仅蕴藏着大量的煤、石油、天然气等常规化石燃料,人们还在海底发现了一种新型矿产资源___________,被科学家誉为“21世纪能源”。
(4)从海水中得到金属镁.下图是从海水中提取镁的简单流程.
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B_________;由无水MgCl2制取Mg的化学方程式为_______________________.海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:_________________________________。
(5)从海水中获得氯化钠.将海水进行____________可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤.正确的操作顺序是_____________________.(用序号填一种合理组合).
(6)海水“制碱”.下图是海水“制碱”的部分简单流程.
制氨盐水的过程中要先通入氨气,再通入二氧化碳.如果反过来,二氧化碳的吸收率会降低.这是因为_____________________________.步骤Ⅳ反应的化学方程式为:____________________________________。
溶解度/g
0
温度/ ℃
食盐
纯碱
溶解度/g
0
温度/ ℃
乙
甲
40
20
40
4.
课题 §水与常见的溶液
< 自主学习:>我能解决一:
1、水的组成:______________________ 水的构成: ______________________
2、水的物理性质有: __________________________________________________
3、用化学方程式解释下列现象:
(1)为什么正常雨水pH<7? 形成知识:水的化学性质
化学方程式:______________________ 水+___________ _________
(2)为什么生石灰可用作某些食品的干燥剂?
化学方程式:______________________ 水+ __________ _________
(3)电解水
化学方程式:______________________ 水 __________+___________
4、水的人工净化的一般步骤为(在每一步后面的括号中注明可除去的杂质)
________( )___________( ) ________( )___________
5、 _______
水的分类 如何区分:_________________________________
______ 如何将硬水软化:_____________________________
激情发挥:水的自述!
激情体验一:
1、下列物质溶于水所得溶液的pH>7的( )
A、CaO B、SO2 C、NaCl D Na2CO3
2、2008年5月12日14时28分,在四川汶川县发生了 8.0级地震。震后水源受到污染,人民日常用水要经过一系列的净化才能使用。请你解决如下问题:
(1)为了除去水中的不溶性杂质,可采取的操作是____,为了除去水中的异味,可以加入_____,起_____作用。
(2)为降低水的硬度,在家里可以通过___________的方法实现。为了检验所得的水是软水,可以向水中加入_______。
(3)有人说:“饮用天然矿泉水对人体健康有利,矿泉水中微量元素的含量越多越好。”
你认为这种说法是否正确,为什么?_______________________________________
< 自主学习:>我能解决二:
1、溶液的定义________________________________________;组成:_____和____;基本特征:____、____。
2、溶液中的溶质可以是一种,也可以是____,溶质的状态可以是____、____、_____,常见的溶剂是___,除此之外还有_______________。
3、物质溶于水会伴随能量的变化,举例:___________、___________、____________。
4、溶液配制的一般步骤:_________________;每步各需用到的仪器___________________。
5、饱和溶液定义_________________________________________________________________。饱和溶液变不饱和溶液的方法_______________,不饱和变饱和的方法__________________。
硝酸钾的饱和溶液变为不饱和溶液的方法______________、_______________。
氢氧化钙的不饱和溶液变为饱和溶液的方法__________、_________、________。
6、溶解度定义___________________________________________________________________。溶解度四要素______________________________;溶解度曲线规律__________________________。溶解度曲线上任一点的意义_____________________;交点含义_________________________。
7、如何根据溶解度来确定溶解性___________________________________________________。
8、结晶的两种方法_________和_________。各适用于什么范围________________________。
9、气体溶解度的影响因素有___________;它们是如何影响的__________________________。
衍生问题组1:在“夏天晒盐、冬天捞碱”的过程中
a、溶液的状态发生什么变化?
b、这种变化是怎么实现的?
C、还有哪些方法可以改变溶液的状态?
衍生问题组2:结合食盐和纯碱的溶解度曲线
a、你能说出夏天晒盐冬天捞碱的道理吗?
b、如何选择物质的结晶方法?
C、食盐中混有少量纯碱如何提纯?反之?
激情体验二:
1、下列关于溶液的说法中,正确的是( )
A.物质的溶解通常都伴随着能量的变化 B.溶质可以是固体,也可以不是
C.均一、稳定的液体一定是溶液 D.泥水中,泥是溶质,水是溶剂
2、下列物质不属于溶液的是( ) A. 碘酒 B.食盐水 C.盐酸 D.乙醇
3、有一瓶饱和溶液,在温度不改变的条件下,当溶液部分蒸发而有溶质析出时,则溶液( )
A.变成不饱和溶液 B.仍是饱和溶液 C.溶质的溶解度变小 D.溶质的溶解度增大
4、60℃硝酸钾溶解度为110g,该温下硝酸钾饱和溶液中有关质量关系错误的是( )
A、溶剂质量:溶液质量=10:21 B、溶剂质量:溶质质量=11:10
C、溶质质量:溶液质量=11:21 D、溶剂质量:溶质质量=10:11
5、甲、乙两种物质的溶解度曲线如右图所示。
(1)20℃时,甲物质的溶解度为_______。此温度下甲物质
饱和溶液中的溶质质量分数是__________。
(2)根据溶解度曲线,乙物质的溶解性为____溶
(易/可/微/难),欲将乙物质的饱和溶液变为不饱和溶液,
可采用的方法是____________
(3)40℃时,将甲、乙两物质的饱和溶液各100g,分别
降温到20℃,所得甲物质溶液的质量_________
(选填“>”“=”或“<”)乙物质溶液的质量。
6、下图是A、B、C三种物质的溶解度曲线,根据图来回答:
(1)t1℃时A、B、C三种物质的溶解度由大到小的顺序是________
(2)t1℃时30g A物质加入到50g水中不断搅拌,
形成的溶液的质量是 _____________
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大到小的顺序是_____________
我会总结:基础要夯实、能力要培养、方法要形成!
形成知识网络:
观念提升:微粒观、元素观、分类观、能量观、变化观
体验中考:
1、下列说法中正确的是( )
A.用洗洁精洗去餐具上的油污,洗洁精起到溶解作用
B.温度一定时,析出硝酸钾晶体的溶液未必是硝酸钾的饱和溶液
C.水浑浊时可加入明矾,使杂质沉降除去 D.75%的医用酒精消毒液,溶剂是酒精
2、下列说法正确的是( )
A、溶液的组成中一定含水 B、浓溶液不一定是饱和溶液
C、温度升高时物质的溶解度增大
D、20℃时36g氯化钠溶于100g水中,恰好达到饱和,则溶液中溶质的质量分数为36%
3、海洋是地球上最大的储水库,浩瀚的海洋蕴含着丰富的化学资源。我市具有较长的海岸线,海洋资源开发前景广阔。海水晒盐能够得到粗盐和卤水。
①卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是______。将t1℃的三种物质的饱和溶液加热到t2℃以上时,_______会析出晶体。
②将粗盐提纯可以得到纯净的NaCl。欲用纯净的NaCl配制100g 0.9%的生理盐水,需要NaCl的质量为_____。配制该溶液时需要用到的玻璃仪器有____________________________。
如果配制的溶液的溶质质量分数低于0.9%,可能的原因是_______________(任写一个)
③在粗盐提纯的过程中,用到的分离混合物的方法有哪些?
情感培养:节约用水、爱护水资源!
作业布置:1、完成复习指导:P26--29
2、海洋是人类千万年来取之不尽、用之不竭的巨大资源宝库。我们还可以从海洋中获得哪些物质?具体的方法是?请你进行整理并利用学案后面的补充习题进行自我检测。
自我提升:海水是一种重要的自然资源.以下是对海水资源的部分利用.
(1)从海水中获取淡水.常用的操作方法是_____________.证明得到的水是淡水的方法是_____________________________。
(2)从海水中提取溴.从海水中提取的溴约占世界溴产量的 ,工业上常用“吹出法”制溴,主要化学原理是2NaBr+C12=2NaCl+Br2,其反应类型是_____________.
(3)海底不仅蕴藏着大量的煤、石油、天然气等常规化石燃料,人们还在海底发现了一种新型矿产资源___________,被科学家誉为“21世纪能源”。
(4)从海水中得到金属镁.下图是从海水中提取镁的简单流程.
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B_________;由无水MgCl2制取Mg的化学方程式为_______________________.海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:_________________________________。
(5)从海水中获得氯化钠.将海水进行____________可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤.正确的操作顺序是_____________________.(用序号填一种合理组合).
(6)海水“制碱”.下图是海水“制碱”的部分简单流程.
制氨盐水的过程中要先通入氨气,再通入二氧化碳.如果反过来,二氧化碳的吸收率会降低.这是因为_____________________________.步骤Ⅳ反应的化学方程式为:____________________________________。
溶解度/g
0
温度/ ℃
食盐
纯碱
溶解度/g
0
温度/ ℃
乙
甲
40
20
40
4.
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
