第二章_第二节_影响化学反应速率的因素
图片预览










文档简介
(共40张PPT)
第二节 影响化学反应速率的因素
(提高篇)
2012.2.16
1、认识浓度、压强、温度和催化剂等对化学反应速率的影响。
2、通过实验探究浓度、温度和催 化剂对化学反应速率的影响,以及合理推导压强对化学反应速率的影响,认识其一般规律。
预习检测:对于气体有下列几种情况:
1、恒温时:增大压强→体积减少→C增大→反应速率增大
2、恒温恒容时:A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;
3、恒温恒压时:充入“无关气体”(如He等)
B、冲入“无关气体”(如He、N2等)
→引起总压增大,但容器体积不变,各物质的浓度不变
→反应速率不变
→引起体积增大,
→各反应物浓度减少
→反应速率减慢。
(1)硫在纯氧中比在空气中燃烧剧烈。
(2)香蕉采摘的时候并不是完全熟的,常用乙烯作为
它的催熟剂。
(3)新鲜的水果和食物保存在冰箱里能存放得更久。
思考与交流
用化学的观点解释下列事实:
(4)煤粉比煤块更容易燃烧。
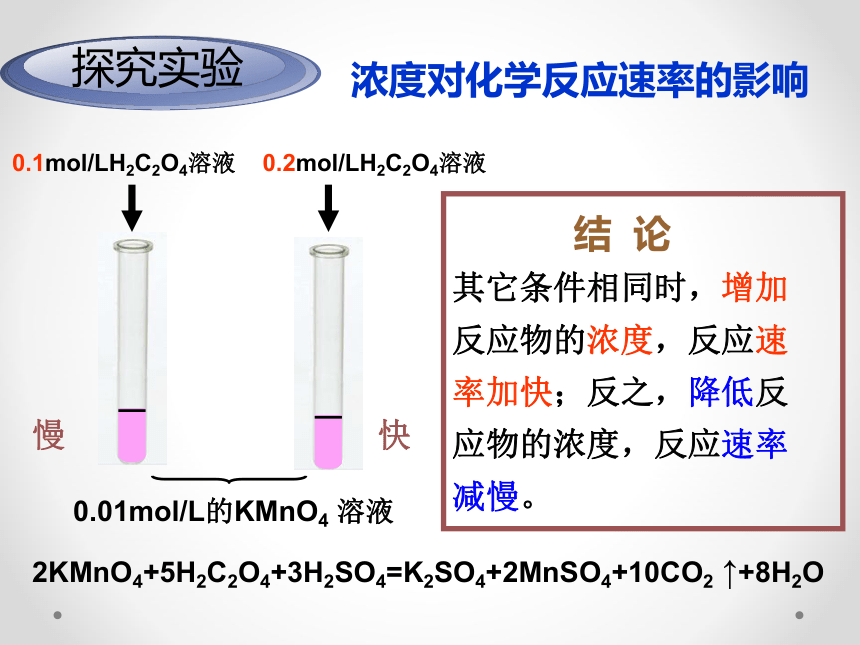
探究实验
浓度对化学反应速率的影响
0.01mol/L的KMnO4 溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
快
慢
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2 ↑+8H2O
结 论
其它条件相同时,增加
反应物的浓度,反应速
率加快;反之,降低反
应物的浓度,反应速率
减慢。
浓度对化学反应速率的影响
实验现象;紫红色逐渐褪去,褪色时间:30s,较快褪色
实验现象;紫红色逐渐褪去,褪色时间:47s,褪色较慢
一、浓度对反应速率的影响
浓度增大
→单位体积内n总↑
T不变,活%不变
n活增大
→有效碰撞↑
→V↑
1、在其他条件不变时,增大反应物浓度,可以增大反应速率
实验2-2结论:浓度大的H2C2O4(aq)先褪色
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。
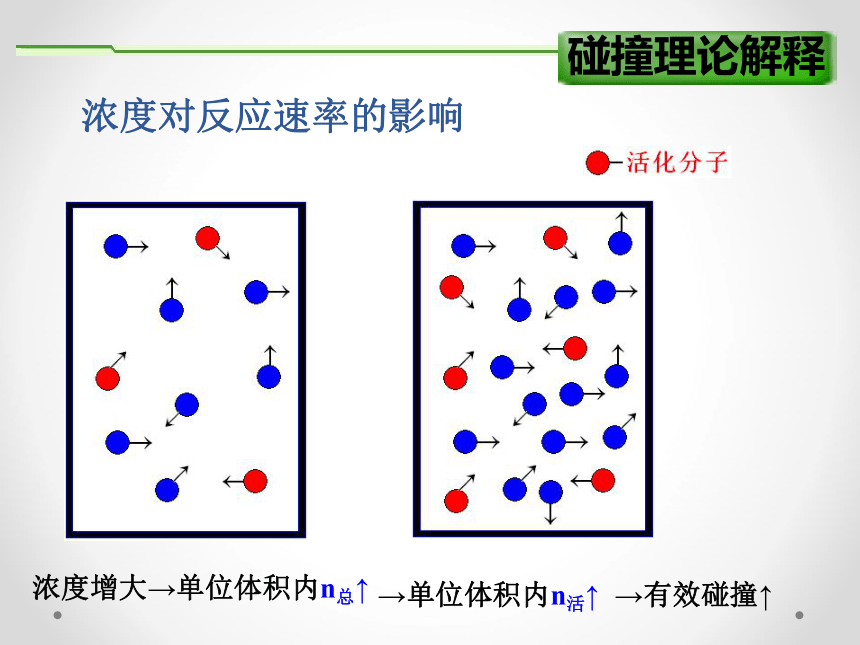
碰撞理论解释
浓度对反应速率的影响
浓度增大
→单位体积内n总↑
→单位体积内n活↑
→有效碰撞↑
注意
增加固体物质或纯液体的量,因其浓度
是个定值,故不影响反应速率(不考虑表
面积的影响)。
●基元反应是指反应物粒子(原子、离子、分子等)在碰撞中相互作用直接转变为新产物的反应。
○指只包含一个基元步骤的反应,即没有中间产物一步完成的反应
19世纪中期,G.M.古德贝格和 P.瓦格提出了质量作用定律(law of mass action)。
质量作用定律:基元反应的反应速率与各反应物的浓度的幂的乘积成正比,其中各反应物的浓度的幂的指数即为元反应方程式中该反应物化学计量数的绝对值。
对于一般的基元反应
有, ,k为速率常数,取决于反应的本性,
(与浓度无关);通常随温度升高而增大。
压强对化学反应速率的影响
对于有气体参加的反应,当其他条件不变时,
增大压强,气体的体积减小,浓度增大,反应
速率加快。
由于压强对固体、液体的体积几乎无影响,
因此,对无气体参加的反应,压强对反应
速率的影响可忽略不计。
说明
注意
恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。
压强的“真变”与“假变”
压强对速率的影响是通过改变气体的浓度来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。
压强对反应速率的影响
碰撞理论解释
压强增大
→浓度增大
→单位体积内n活↑
→有效碰撞↑
探究实验
温度对化学反应速率的影响
5mL0.1mol/L的H2SO4
+ 5mL0.1mol/LNa2S2O3
热水
冷水
快
慢
Na2S2O3+H2SO4 = Na2SO4 + SO2 +S↓+ H2O
结 论
其它条件相同时,升高
温度,反应速率加快;
反之,降低温度,反应
速率减慢。
温度对化学反应速率的影响
常温下(25℃)
出现浑浊时间:16s,
反应较慢
65℃,
出现浑浊时间:2s,
反应较快
本质原因
升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞机率变大,故反应速率增大。
3、温度对反应速率的影响
实验2-3结论:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
温度高的溶液先出现浑浊
溶液加热
三、温度对反应速率的影响
1、其他条件不变,温度升高,反应速率加快
T↑
→普通分子变为活化分子
→活%↑
→ n活↑
→V↑
2、一般说来,温度每升高10℃,速率增加2-4倍。
3、温度对反应速率影响的规律,对吸热反应,放热反应都适用。
4、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
科学探究
已知:4H++4I-+O2=2I2+2H2O 现有1mol/L KI溶液、0.1mol/LH2SO4溶液和淀粉溶液,请设计实验探究溶液出现蓝色的时间与温度的关系?
【结论】
其它条件相同时,温度高,出现蓝色的时间短;温度低,出现蓝色的时间长。
*阿伦尼乌斯公式
k为速率常数,R为摩尔气体常量,T为热力学温度,Ea为表观活化能,A为指前因子(也称频率因子)。
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能。活化分子的平均能量与反应物分子(包括活化分子)平均能量的差值即为活化能。
○实验证明,只有发生碰撞的分子的能量等于或超过某一定的能量Ec(可称为临界能)时,才可能发生有效碰撞。具有能量大于或等于Ec的分子称为活化分子。
Activation Energy: Even chemical reactions that release energy do not always occur spontaneously. That's good thing because if they did, the pages of this book might burst into flames. The cellulose in paper burns in the presence of oxygen and releases heat and light. However, the cellulose will burn only if you light it with a match, which supplies enough energy to get the reaction started. Chemists call the energy that is needed to get a reaction stared the activation energy
在一定温度下,反应的活化能越大,即能垒越高,得到的活化分子数目减少,反应速率越慢;反之,活化能越小反应速率越快。可见活化能是决定化学反应速率的内因。
探究实验
催化剂对化学反应速率的影响
2H2O2 2H2O+O2↑
MnO2
【结论】其它条件不变时,选用适当的催化剂可以改变
反应速率;正催化剂使反应速率加快,负催化剂使反应
速率减慢。
科学探究
〖探究1〗设计实验比较在2mL 5%的H2O2中加入
FeCl3和CuSO4溶液各1mL,比较二者分解速率?
加入试剂 0.1mol/LFeCl3 0.1mol/L CuSO4
产生气泡快慢
结 论
快
慢
FeCl3对该反应的催化效果更好
科学探究
〖探究2〗设计实验比较在4mL 0.01mol/L KMnO4
和2mL 0.1mol/L H2C2O4,加不加MnSO4对反应
速率有否影响?
加入试剂 0.01mol/LKMnO4
0.1mol/LH2C2O4
0.01mol/L KMnO4
0.1mol/LH2C2O4
MnSO4溶液
褪色时间
结 论
快
慢
MnSO4对该反应有催化作用
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
催化剂对反应速率的影响
科学探究
〖探究3〗现有5mL 淀粉溶液、碘水、2mol/L硫酸溶液。
设计实验比较唾液、稀硫酸对反应速率影响效果如何?
加入试剂
硫酸溶液、淀粉
溶液、碘水 唾液、淀粉溶液
碘水
反应现象
结 论
蓝色很快褪去
蓝色很难褪去
唾液对该反应的催化效果更好
催化剂是有选择性的
●凡是能改变反应速率而自身在化学变化前后化学性质和质量没有发生变化的物质叫催化剂。
●使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
●没特别指明一般指正催化剂
●催化剂只能催化可能发生的反应,对不发生的反应无作用
●催化剂一定的具有选择性
●催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。
注意:
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
四、催化剂对反应速率的影响
使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。
催化剂之所以能改变反应速率,是因为它参与了变化过程,改变了原来反应的途径,降低了反应的活化能。
催化剂同等程度地加快正、逆反应速率。
催化剂对反应速率的影响效果十分明显,试利用阿伦尼乌斯公式分析原因。
五、其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。
各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应具体分析。
总结:
1、 在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2、将等物质的量的碳酸钠与碳酸氢钠放入等体积等浓度的盐酸中,产生CO2的速率哪个较快?为什么?
3、石油的形成要多少年?炸药的爆炸呢?
以上说明化学反应速率的决定因素是什么?
决定化学反应速率的主要因素
决定化学反应速率的因素是参加反应的物质本身的化学性质。
(2)外因:
(1)内因(主要因素) :参加反应物质的性质
反应物分子中的化学键断裂、生成物分子中的化学键形成过程
——旧键断裂,新键生成——
化学反应的本质:
①浓度:②压强:③温度:④催化剂:
⑤其他因素:光、颗粒大小、溶剂等。
【知识归纳】——影响化学反应速率的因素:
没合适的取向
没足够的能量
足够的能量 +合适的取向
类比法:借鉴投篮
碰 撞 理 论
三、碰撞理论:有效碰撞和活化分子
1. 活化分子的碰撞不一定都是有效碰撞。
活化分子
取向合适
有效碰撞
(能量足够)
2. 活化分子数越多,有效碰撞次数越多,反应速率越快。单位体积内活化分子数与单位体积内反应物分子总数成正比。
n活=n总×活%
活化分子百分数: (活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
一个反应经历的过程
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
有效碰撞的机率
外界条件对化学反应速率的影响(总结)
影响因素 分子总数 活化分子
百分数 活化分子总数 活化分子浓度
(单位体积活化分子数)
增大浓度
增大压强
升高温度
正催化剂
增加
不变
不变
不变
不变
不变
增加
增加
增加
增加
增加
增加
增加
增加
增加
不变
影响化学反应速率的因素
不同化学反应
的速率
反应物本身性质
(内因)
同一化学反应
的速率
外界条件
(外因)
内因——物质本身的性质(决定性因素)
(1)催化剂:能大大改变速率
(2)浓度:反应物浓度越大,速率越大
(3)温度:体系温度越高,速率越大
(4)压强:有气体参与的反应压强越大,速率越大
(5)固体表面积:块装固体反应速率小于粉末状
固体反应速率。
(6)溶剂的性质、光、超声波、磁场等
外因
影响化学反应速率的因素
第二节 影响化学反应速率的因素
(提高篇)
2012.2.16
1、认识浓度、压强、温度和催化剂等对化学反应速率的影响。
2、通过实验探究浓度、温度和催 化剂对化学反应速率的影响,以及合理推导压强对化学反应速率的影响,认识其一般规律。
预习检测:对于气体有下列几种情况:
1、恒温时:增大压强→体积减少→C增大→反应速率增大
2、恒温恒容时:A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;
3、恒温恒压时:充入“无关气体”(如He等)
B、冲入“无关气体”(如He、N2等)
→引起总压增大,但容器体积不变,各物质的浓度不变
→反应速率不变
→引起体积增大,
→各反应物浓度减少
→反应速率减慢。
(1)硫在纯氧中比在空气中燃烧剧烈。
(2)香蕉采摘的时候并不是完全熟的,常用乙烯作为
它的催熟剂。
(3)新鲜的水果和食物保存在冰箱里能存放得更久。
思考与交流
用化学的观点解释下列事实:
(4)煤粉比煤块更容易燃烧。
探究实验
浓度对化学反应速率的影响
0.01mol/L的KMnO4 溶液
0.1mol/LH2C2O4溶液
0.2mol/LH2C2O4溶液
快
慢
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2 ↑+8H2O
结 论
其它条件相同时,增加
反应物的浓度,反应速
率加快;反之,降低反
应物的浓度,反应速率
减慢。
浓度对化学反应速率的影响
实验现象;紫红色逐渐褪去,褪色时间:30s,较快褪色
实验现象;紫红色逐渐褪去,褪色时间:47s,褪色较慢
一、浓度对反应速率的影响
浓度增大
→单位体积内n总↑
T不变,活%不变
n活增大
→有效碰撞↑
→V↑
1、在其他条件不变时,增大反应物浓度,可以增大反应速率
实验2-2结论:浓度大的H2C2O4(aq)先褪色
2KMnO4 + 5H2C2O4 +3H2SO4=K2SO4 +2MnSO4 +10CO2↑+8H2O
规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。
碰撞理论解释
浓度对反应速率的影响
浓度增大
→单位体积内n总↑
→单位体积内n活↑
→有效碰撞↑
注意
增加固体物质或纯液体的量,因其浓度
是个定值,故不影响反应速率(不考虑表
面积的影响)。
●基元反应是指反应物粒子(原子、离子、分子等)在碰撞中相互作用直接转变为新产物的反应。
○指只包含一个基元步骤的反应,即没有中间产物一步完成的反应
19世纪中期,G.M.古德贝格和 P.瓦格提出了质量作用定律(law of mass action)。
质量作用定律:基元反应的反应速率与各反应物的浓度的幂的乘积成正比,其中各反应物的浓度的幂的指数即为元反应方程式中该反应物化学计量数的绝对值。
对于一般的基元反应
有, ,k为速率常数,取决于反应的本性,
(与浓度无关);通常随温度升高而增大。
压强对化学反应速率的影响
对于有气体参加的反应,当其他条件不变时,
增大压强,气体的体积减小,浓度增大,反应
速率加快。
由于压强对固体、液体的体积几乎无影响,
因此,对无气体参加的反应,压强对反应
速率的影响可忽略不计。
说明
注意
恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。
压强的“真变”与“假变”
压强对速率的影响是通过改变气体的浓度来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。
压强对反应速率的影响
碰撞理论解释
压强增大
→浓度增大
→单位体积内n活↑
→有效碰撞↑
探究实验
温度对化学反应速率的影响
5mL0.1mol/L的H2SO4
+ 5mL0.1mol/LNa2S2O3
热水
冷水
快
慢
Na2S2O3+H2SO4 = Na2SO4 + SO2 +S↓+ H2O
结 论
其它条件相同时,升高
温度,反应速率加快;
反之,降低温度,反应
速率减慢。
温度对化学反应速率的影响
常温下(25℃)
出现浑浊时间:16s,
反应较慢
65℃,
出现浑浊时间:2s,
反应较快
本质原因
升高温度,一部分非活化分子吸收能量转化为活化分子,使得活化分子百分数提高,活化分子间的有效碰撞机率变大,故反应速率增大。
3、温度对反应速率的影响
实验2-3结论:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
温度高的溶液先出现浑浊
溶液加热
三、温度对反应速率的影响
1、其他条件不变,温度升高,反应速率加快
T↑
→普通分子变为活化分子
→活%↑
→ n活↑
→V↑
2、一般说来,温度每升高10℃,速率增加2-4倍。
3、温度对反应速率影响的规律,对吸热反应,放热反应都适用。
4、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
科学探究
已知:4H++4I-+O2=2I2+2H2O 现有1mol/L KI溶液、0.1mol/LH2SO4溶液和淀粉溶液,请设计实验探究溶液出现蓝色的时间与温度的关系?
【结论】
其它条件相同时,温度高,出现蓝色的时间短;温度低,出现蓝色的时间长。
*阿伦尼乌斯公式
k为速率常数,R为摩尔气体常量,T为热力学温度,Ea为表观活化能,A为指前因子(也称频率因子)。
分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能。活化分子的平均能量与反应物分子(包括活化分子)平均能量的差值即为活化能。
○实验证明,只有发生碰撞的分子的能量等于或超过某一定的能量Ec(可称为临界能)时,才可能发生有效碰撞。具有能量大于或等于Ec的分子称为活化分子。
Activation Energy: Even chemical reactions that release energy do not always occur spontaneously. That's good thing because if they did, the pages of this book might burst into flames. The cellulose in paper burns in the presence of oxygen and releases heat and light. However, the cellulose will burn only if you light it with a match, which supplies enough energy to get the reaction started. Chemists call the energy that is needed to get a reaction stared the activation energy
在一定温度下,反应的活化能越大,即能垒越高,得到的活化分子数目减少,反应速率越慢;反之,活化能越小反应速率越快。可见活化能是决定化学反应速率的内因。
探究实验
催化剂对化学反应速率的影响
2H2O2 2H2O+O2↑
MnO2
【结论】其它条件不变时,选用适当的催化剂可以改变
反应速率;正催化剂使反应速率加快,负催化剂使反应
速率减慢。
科学探究
〖探究1〗设计实验比较在2mL 5%的H2O2中加入
FeCl3和CuSO4溶液各1mL,比较二者分解速率?
加入试剂 0.1mol/LFeCl3 0.1mol/L CuSO4
产生气泡快慢
结 论
快
慢
FeCl3对该反应的催化效果更好
科学探究
〖探究2〗设计实验比较在4mL 0.01mol/L KMnO4
和2mL 0.1mol/L H2C2O4,加不加MnSO4对反应
速率有否影响?
加入试剂 0.01mol/LKMnO4
0.1mol/LH2C2O4
0.01mol/L KMnO4
0.1mol/LH2C2O4
MnSO4溶液
褪色时间
结 论
快
慢
MnSO4对该反应有催化作用
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
催化剂对反应速率的影响
科学探究
〖探究3〗现有5mL 淀粉溶液、碘水、2mol/L硫酸溶液。
设计实验比较唾液、稀硫酸对反应速率影响效果如何?
加入试剂
硫酸溶液、淀粉
溶液、碘水 唾液、淀粉溶液
碘水
反应现象
结 论
蓝色很快褪去
蓝色很难褪去
唾液对该反应的催化效果更好
催化剂是有选择性的
●凡是能改变反应速率而自身在化学变化前后化学性质和质量没有发生变化的物质叫催化剂。
●使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
●没特别指明一般指正催化剂
●催化剂只能催化可能发生的反应,对不发生的反应无作用
●催化剂一定的具有选择性
●催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。
注意:
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
四、催化剂对反应速率的影响
使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。因而使反应速率加快。
催化剂之所以能改变反应速率,是因为它参与了变化过程,改变了原来反应的途径,降低了反应的活化能。
催化剂同等程度地加快正、逆反应速率。
催化剂对反应速率的影响效果十分明显,试利用阿伦尼乌斯公式分析原因。
五、其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。
各条件对速率的影响大小是:
催化剂 >>温度>浓度=压强(体积变化引起的)。
各种影响都有其局限性,要针对具体反应具体分析。
总结:
1、 在通常情况下,Na与水的反应和Mg与水的反应哪个剧烈(反应速率快)?为什么?
2、将等物质的量的碳酸钠与碳酸氢钠放入等体积等浓度的盐酸中,产生CO2的速率哪个较快?为什么?
3、石油的形成要多少年?炸药的爆炸呢?
以上说明化学反应速率的决定因素是什么?
决定化学反应速率的主要因素
决定化学反应速率的因素是参加反应的物质本身的化学性质。
(2)外因:
(1)内因(主要因素) :参加反应物质的性质
反应物分子中的化学键断裂、生成物分子中的化学键形成过程
——旧键断裂,新键生成——
化学反应的本质:
①浓度:②压强:③温度:④催化剂:
⑤其他因素:光、颗粒大小、溶剂等。
【知识归纳】——影响化学反应速率的因素:
没合适的取向
没足够的能量
足够的能量 +合适的取向
类比法:借鉴投篮
碰 撞 理 论
三、碰撞理论:有效碰撞和活化分子
1. 活化分子的碰撞不一定都是有效碰撞。
活化分子
取向合适
有效碰撞
(能量足够)
2. 活化分子数越多,有效碰撞次数越多,反应速率越快。单位体积内活化分子数与单位体积内反应物分子总数成正比。
n活=n总×活%
活化分子百分数: (活化分子数/反应物分子数)×100%
化学反应速率主要取决于:
一个反应经历的过程
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
有效碰撞的机率
外界条件对化学反应速率的影响(总结)
影响因素 分子总数 活化分子
百分数 活化分子总数 活化分子浓度
(单位体积活化分子数)
增大浓度
增大压强
升高温度
正催化剂
增加
不变
不变
不变
不变
不变
增加
增加
增加
增加
增加
增加
增加
增加
增加
不变
影响化学反应速率的因素
不同化学反应
的速率
反应物本身性质
(内因)
同一化学反应
的速率
外界条件
(外因)
内因——物质本身的性质(决定性因素)
(1)催化剂:能大大改变速率
(2)浓度:反应物浓度越大,速率越大
(3)温度:体系温度越高,速率越大
(4)压强:有气体参与的反应压强越大,速率越大
(5)固体表面积:块装固体反应速率小于粉末状
固体反应速率。
(6)溶剂的性质、光、超声波、磁场等
外因
影响化学反应速率的因素
