福建省宁德市高中同心顺联盟校2020-2021学年高一下学期期中考试化学试题(word版,含答案)
文档属性
| 名称 | 福建省宁德市高中同心顺联盟校2020-2021学年高一下学期期中考试化学试题(word版,含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 324.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-14 17:26:14 | ||
图片预览




文档简介
2020–2021学年同心顺联盟校第二学期期中考试
高一化学试题
(考试时间:90分钟 满分:100分)
注意:1.请将试题的全部答案填写在答题卡上。
2.可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Cu-64
第I卷(选择题,共 50分)
一、选择题(1-10题,每题2分,11-20题,每题3分,每小题只有1个选项)
1. 日本政府2021年4月13日召开会议,正式决定向海洋排放福岛核废水,其中含有的放射性元素氚31H是很难消除的,有关氚的描述正确的是( )
A.质子数 为1 B. 核外电子数为2
C.中子数3 D. 31H2与21H2互为同位素
2. 下列物质中,不属于“城市空气质量日报”报道内容的是( )
A. 悬浮颗粒 B. 氮氧化物 C. 二氧化硫 D. 二氧化碳
3. 从溴水中提取Br2单质时,常加入四氯化碳并振荡,这种操作方法是( )
A.过滤 B.萃取 C.蒸发 D.结晶
4.下列化学用语描述不正确的是( )
A. 中子数为18 的Cl 原子:falseCl B. false的结构示意图:
C.false的电子式: D. H2O的结构式:
5.木薯粉(主要成分是淀粉)、食盐(主要成分是氯化钠)、料酒(有效成分为乙醇)、食醋(有效成分为乙酸)等都是厨房常备的物品,它们主要成分或有效成分对应物质属于离子化合物的是( )
A.木薯粉 B.料酒 C.食盐 D.食醋
6.锂不仅在军事工业中占有举足轻重的地位,而且在民用工业也是一种重要的材料。下列说法错误的是( )
A.锂原子核外有3个电子 B.锂的原子半径比铍小
C.锂是第二周期IA族元素 D.LiOH的碱性比KOH弱
7.下列比较中不正确的是
A.金属性:Na>Mg>Al B.离子半径:Na+ >O2- >F-
C.酸性:HClO4>H2SO4>H2SiO3 D.还原性:I- > Br- > Cl-
8. 下列反应既是氧化还原反应,又是放热反应的是( )
A.盐酸和氢氧化钠反应 B. 灼热的炭与二氧化碳反应
C. 氢氧化钙与氯化铵反应 D. 铝片和稀硫酸反应
9. 下列关于元素周期表的说法正确的是( )
A. 有7个主族和8个副族
B. 在主族元素中寻找各种优良的催化剂
C. 在金属和非金属的分界线附近寻找半导体材料
D. 不可以预测元素的主要性质
10.右图为某兴趣小组制作的土豆电池,连接仪器,闭合开关。下列说法正确的是( )
330517576200A.该装置将电能转化为化学能
B.电子由锌通过导线流向铜
C.铜电极是负极,质量会不断减少
D.锌电极发生还原反应
11. 《青花瓷》中所描述的“瓶身描述的牡丹一如你初妆”“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列有关硅酸铜钡的说法不正确的是( )
A. 难溶于水 B. x=6
C. 性质稳定,不易脱色 D. SiO2与NaOH和HF均可反应,属于两性氧化物
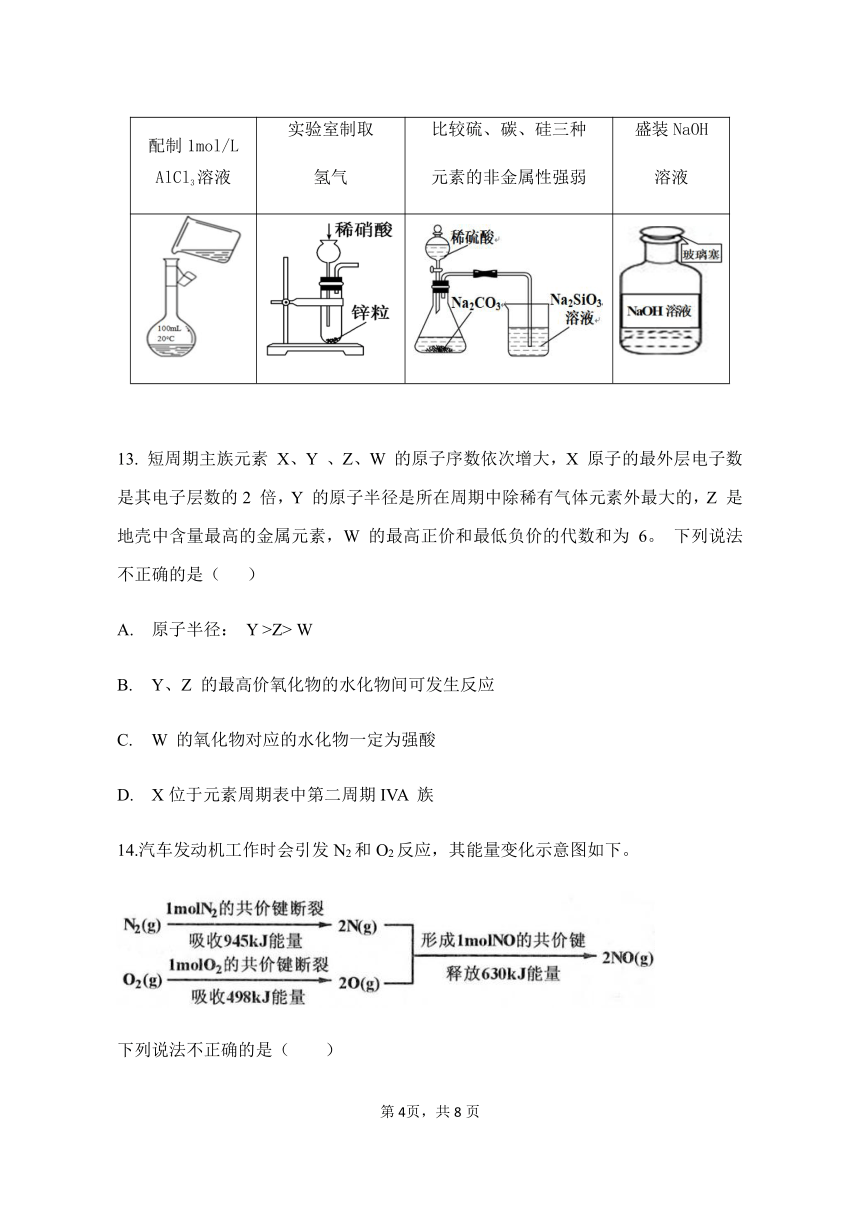
12.下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A
B
C
D
配制1mol/L AlCl3溶液
实验室制取
氢气
比较硫、碳、硅三种
元素的非金属性强弱
盛装49434756255385NaOH溶液
NaOH溶液
49434756255385NaOH溶液
NaOH溶液
NaOH
溶液
13. 短周期主族元素 X、Y 、Z、W 的原子序数依次增大,X 原子的最外层电子数是其电子层数的2 倍,Y 的原子半径是所在周期中除稀有气体元素外最大的,Z 是地壳中含量最高的金属元素,W 的最高正价和最低负价的代数和为 6。 下列说法不正确的是( )
A. 原子半径: Y >Z> W
B. Y、Z 的最高价氧化物的水化物间可发生反应
C. W 的氧化物对应的水化物一定为强酸
D. X位于元素周期表中第二周期IVA 族
14.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下。
下列说法不正确的是( )
A. N2和O2反应生成NO的反应为吸热反应
B. 1molN2(g)和1mol O2(g)的总能量大于2mol NO(g)的总能量
C.2mol气态氮原子结合生成1 mol N2(g)时,能放出945kJ的热量
D.从图中数据可知N2比O2更稳定
15. 温度为500℃时,反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率(x)为( )
A、(O2)=0.01mol/(L?s) B、(NO)=0.08mol/(L?s)
C、(H2O)=0.003mol/(L?s) D、(NH3)=0.003mol/(L?s)
16.下列不属于安全气囊中的主要物质的是( )
A.叠氮化钠 B.氧化铁 C.硝酸铵 D.水玻璃
17. 向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,反应速率最大的是( )
序号
温度
n(SO2)
n(O2)
催化剂
A
500℃
10 mol
5 mol
无
B
500℃
10 mol
5 mol
V2O5
C
450℃
8 mol
5mol
无
D
500℃
8 mol
5 mol
无
18.为研究碳酸钙与稀盐酸的反应速率,标准状况下测得生成CO2体积随时间变化情况如图所示 ,下列分析正确的是( )
A. EF段的反应速率最快
B. F 点收集到CO2的量最多
C. 影响EF 段反应速率的主要因素是c( HCl)
D. OE、EF、FG 三段中,CO2的生成速率之比为1 :3:4
19.t ℃ 时,反应 N2+3H2 2NH3在容积固定的密闭容器中进行,达到平衡状态的标志是( )
A. v(NH3)= 2v(N2) B. H2的物质的量浓度不再发生变化C. 单位时间内消耗2 mol NH3的同时生成1 mol N2
D.1mol N2和3molH2完全转化为2molNH3
20.往10mL 0.2mol·L-1 NaI溶液中滴加4~5滴0.1 mol·L-1 FeCl3溶液后,再进行下列实验,可证明FeCl3溶液和NaI溶液的反应为可逆反应的是 ( )
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色
第II卷(非选择题,共50分)
二、非选择题(共4题)
21. (14分)下表是元素周期表的一部分,针对表中的①~⑦元素回答以下问题:
(1)在这些元素原子中,金属性最强的是_______________(填元素符号)。
(2)单质化学性质最不活泼的元素是_________(填元素符号),其原子结构示意图为 _________________ 。
(3)①~⑦中元素的最高价氧化物对应的水化物呈两性的是_____________ (填化学式)。
(4)④、⑤所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是 ______(填化学式)。
(5)写出表中元素①和⑥所形成的化合物的电子式_______________ 。
(6)写出元素①、③的最高价氧化物对应的水化物反应的离子方程式_______________。
22 (10分).如图所示,组成一个原电池。
(1)当电解质溶液为稀硫酸时:
Zn电极是______(填“正”或“负”)极,其电极反应为______。
(2)当电解质溶液为硫酸铜时,原电池总反应方程式是_____(写离子方程式),内电路SO42-往 极移动,当外电路有0.2mol电子通过时,理论上铜极会增重 g.
23.(12分)
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但形状不同的MnO2分别加入盛有15 mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2
触摸试管情况
观察结果
反应完成所需的时间
粉末状
很烫
剧烈反应,带火星的木条复燃
3.5 min
块状
微热
反应较慢,火星红亮但木条未复燃
30 min
(1)该反应是 反应(填放热或吸热)。
(2)实验结果表明,粉末状催化剂的催化效果比较好,原因是 。
Ⅱ.某可逆反应在体积为2 L的密闭容器中进行,0~3分钟各物质的物质的量的变化情况如图所示(A、B、C均为气体)
(3)该反应的化学方程式为 。
(4)反应开始至2分钟末,用C的浓度变化表示的反应速率为 。
(5)能说明该反应已达到平衡状态的是 (填字母符号)。
A.v(A)=2v(B) B.容器内压强保持不变
C.2v(A)逆=v(B)正 D.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会增大的是 (填字母符号)。
A.升高温度 B.加入催化剂 C.增大容器体积 D.通入不参加反应的其他气体,增大压强
24.(14分)某化学兴趣小组用下列实验装置和试剂,设计实验比较硫和氯的非金属性强弱,并收集纯净干燥的氯气,D为尾气吸收装置,回答下列问题:(已知:false)
A B C D E F
(1)仪器a的名称为
(2)E装置的作用是 ,D装置中反应的离子方程式为
(3)装置连接顺序为A-
(4)若F中出现 现象,可证明非金属性:硫 氯(填“>”或“<”)
(5) 在A装置的反应中,当有0.2mol电子发生转移时,理论上有 L标准状况下的Cl2产生。
2020~2021学年(下)同心顺联盟校期中考试
化学试题参考答案及评分标准
一、单项选择题(1-10每小题2分,11-20每小题3分,共50分,多选错选均不得分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
D
B
A
C
B
B
D
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
C
B
C
D
B
A
B
D
二、非选择题(4大题,共50分,每空2分)
21题(14分)
(1) Na (2)Ar 、 略 ( 3)Al(OH)3 (4) H2O (5) 略
(6) OH- + Al(OH)3 = [Al(OH)4]-
22、题(10分)
(1)负 Zn-2e- =Zn2+, (2)Zn+Cu2+ = Cu+Zn2+, Zn, 64.
23题(12分)
(1)放热 (2) 接触面积增大,速率加快 。
(3) 2A +B 2C (4) 0.5mol/(L?min) (5) B (6)AB
24题(14分)
(1)分液漏斗 (2)除去HCl 气体 Cl2+2OH- = Cl- +ClO- + H2O
(3) F - E -B-C-D或 E-F -B-C-D
(4) 淡黄色沉淀(浑浊) < (5) 2.24
高一化学试题
(考试时间:90分钟 满分:100分)
注意:1.请将试题的全部答案填写在答题卡上。
2.可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Cu-64
第I卷(选择题,共 50分)
一、选择题(1-10题,每题2分,11-20题,每题3分,每小题只有1个选项)
1. 日本政府2021年4月13日召开会议,正式决定向海洋排放福岛核废水,其中含有的放射性元素氚31H是很难消除的,有关氚的描述正确的是( )
A.质子数 为1 B. 核外电子数为2
C.中子数3 D. 31H2与21H2互为同位素
2. 下列物质中,不属于“城市空气质量日报”报道内容的是( )
A. 悬浮颗粒 B. 氮氧化物 C. 二氧化硫 D. 二氧化碳
3. 从溴水中提取Br2单质时,常加入四氯化碳并振荡,这种操作方法是( )
A.过滤 B.萃取 C.蒸发 D.结晶
4.下列化学用语描述不正确的是( )
A. 中子数为18 的Cl 原子:falseCl B. false的结构示意图:
C.false的电子式: D. H2O的结构式:
5.木薯粉(主要成分是淀粉)、食盐(主要成分是氯化钠)、料酒(有效成分为乙醇)、食醋(有效成分为乙酸)等都是厨房常备的物品,它们主要成分或有效成分对应物质属于离子化合物的是( )
A.木薯粉 B.料酒 C.食盐 D.食醋
6.锂不仅在军事工业中占有举足轻重的地位,而且在民用工业也是一种重要的材料。下列说法错误的是( )
A.锂原子核外有3个电子 B.锂的原子半径比铍小
C.锂是第二周期IA族元素 D.LiOH的碱性比KOH弱
7.下列比较中不正确的是
A.金属性:Na>Mg>Al B.离子半径:Na+ >O2- >F-
C.酸性:HClO4>H2SO4>H2SiO3 D.还原性:I- > Br- > Cl-
8. 下列反应既是氧化还原反应,又是放热反应的是( )
A.盐酸和氢氧化钠反应 B. 灼热的炭与二氧化碳反应
C. 氢氧化钙与氯化铵反应 D. 铝片和稀硫酸反应
9. 下列关于元素周期表的说法正确的是( )
A. 有7个主族和8个副族
B. 在主族元素中寻找各种优良的催化剂
C. 在金属和非金属的分界线附近寻找半导体材料
D. 不可以预测元素的主要性质
10.右图为某兴趣小组制作的土豆电池,连接仪器,闭合开关。下列说法正确的是( )
330517576200A.该装置将电能转化为化学能
B.电子由锌通过导线流向铜
C.铜电极是负极,质量会不断减少
D.锌电极发生还原反应
11. 《青花瓷》中所描述的“瓶身描述的牡丹一如你初妆”“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列有关硅酸铜钡的说法不正确的是( )
A. 难溶于水 B. x=6
C. 性质稳定,不易脱色 D. SiO2与NaOH和HF均可反应,属于两性氧化物
12.下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A
B
C
D
配制1mol/L AlCl3溶液
实验室制取
氢气
比较硫、碳、硅三种
元素的非金属性强弱
盛装49434756255385NaOH溶液
NaOH溶液
49434756255385NaOH溶液
NaOH溶液
NaOH
溶液
13. 短周期主族元素 X、Y 、Z、W 的原子序数依次增大,X 原子的最外层电子数是其电子层数的2 倍,Y 的原子半径是所在周期中除稀有气体元素外最大的,Z 是地壳中含量最高的金属元素,W 的最高正价和最低负价的代数和为 6。 下列说法不正确的是( )
A. 原子半径: Y >Z> W
B. Y、Z 的最高价氧化物的水化物间可发生反应
C. W 的氧化物对应的水化物一定为强酸
D. X位于元素周期表中第二周期IVA 族
14.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下。
下列说法不正确的是( )
A. N2和O2反应生成NO的反应为吸热反应
B. 1molN2(g)和1mol O2(g)的总能量大于2mol NO(g)的总能量
C.2mol气态氮原子结合生成1 mol N2(g)时,能放出945kJ的热量
D.从图中数据可知N2比O2更稳定
15. 温度为500℃时,反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率(x)为( )
A、(O2)=0.01mol/(L?s) B、(NO)=0.08mol/(L?s)
C、(H2O)=0.003mol/(L?s) D、(NH3)=0.003mol/(L?s)
16.下列不属于安全气囊中的主要物质的是( )
A.叠氮化钠 B.氧化铁 C.硝酸铵 D.水玻璃
17. 向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,反应速率最大的是( )
序号
温度
n(SO2)
n(O2)
催化剂
A
500℃
10 mol
5 mol
无
B
500℃
10 mol
5 mol
V2O5
C
450℃
8 mol
5mol
无
D
500℃
8 mol
5 mol
无
18.为研究碳酸钙与稀盐酸的反应速率,标准状况下测得生成CO2体积随时间变化情况如图所示 ,下列分析正确的是( )
A. EF段的反应速率最快
B. F 点收集到CO2的量最多
C. 影响EF 段反应速率的主要因素是c( HCl)
D. OE、EF、FG 三段中,CO2的生成速率之比为1 :3:4
19.t ℃ 时,反应 N2+3H2 2NH3在容积固定的密闭容器中进行,达到平衡状态的标志是( )
A. v(NH3)= 2v(N2) B. H2的物质的量浓度不再发生变化C. 单位时间内消耗2 mol NH3的同时生成1 mol N2
D.1mol N2和3molH2完全转化为2molNH3
20.往10mL 0.2mol·L-1 NaI溶液中滴加4~5滴0.1 mol·L-1 FeCl3溶液后,再进行下列实验,可证明FeCl3溶液和NaI溶液的反应为可逆反应的是 ( )
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色
第II卷(非选择题,共50分)
二、非选择题(共4题)
21. (14分)下表是元素周期表的一部分,针对表中的①~⑦元素回答以下问题:
(1)在这些元素原子中,金属性最强的是_______________(填元素符号)。
(2)单质化学性质最不活泼的元素是_________(填元素符号),其原子结构示意图为 _________________ 。
(3)①~⑦中元素的最高价氧化物对应的水化物呈两性的是_____________ (填化学式)。
(4)④、⑤所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是 ______(填化学式)。
(5)写出表中元素①和⑥所形成的化合物的电子式_______________ 。
(6)写出元素①、③的最高价氧化物对应的水化物反应的离子方程式_______________。
22 (10分).如图所示,组成一个原电池。
(1)当电解质溶液为稀硫酸时:
Zn电极是______(填“正”或“负”)极,其电极反应为______。
(2)当电解质溶液为硫酸铜时,原电池总反应方程式是_____(写离子方程式),内电路SO42-往 极移动,当外电路有0.2mol电子通过时,理论上铜极会增重 g.
23.(12分)
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但形状不同的MnO2分别加入盛有15 mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2
触摸试管情况
观察结果
反应完成所需的时间
粉末状
很烫
剧烈反应,带火星的木条复燃
3.5 min
块状
微热
反应较慢,火星红亮但木条未复燃
30 min
(1)该反应是 反应(填放热或吸热)。
(2)实验结果表明,粉末状催化剂的催化效果比较好,原因是 。
Ⅱ.某可逆反应在体积为2 L的密闭容器中进行,0~3分钟各物质的物质的量的变化情况如图所示(A、B、C均为气体)
(3)该反应的化学方程式为 。
(4)反应开始至2分钟末,用C的浓度变化表示的反应速率为 。
(5)能说明该反应已达到平衡状态的是 (填字母符号)。
A.v(A)=2v(B) B.容器内压强保持不变
C.2v(A)逆=v(B)正 D.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A(g)、b mol B(g)、c mol C(g),发生上述反应,当改变下列条件时,反应速率会增大的是 (填字母符号)。
A.升高温度 B.加入催化剂 C.增大容器体积 D.通入不参加反应的其他气体,增大压强
24.(14分)某化学兴趣小组用下列实验装置和试剂,设计实验比较硫和氯的非金属性强弱,并收集纯净干燥的氯气,D为尾气吸收装置,回答下列问题:(已知:false)
A B C D E F
(1)仪器a的名称为
(2)E装置的作用是 ,D装置中反应的离子方程式为
(3)装置连接顺序为A-
(4)若F中出现 现象,可证明非金属性:硫 氯(填“>”或“<”)
(5) 在A装置的反应中,当有0.2mol电子发生转移时,理论上有 L标准状况下的Cl2产生。
2020~2021学年(下)同心顺联盟校期中考试
化学试题参考答案及评分标准
一、单项选择题(1-10每小题2分,11-20每小题3分,共50分,多选错选均不得分)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
D
B
A
C
B
B
D
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
C
B
C
D
B
A
B
D
二、非选择题(4大题,共50分,每空2分)
21题(14分)
(1) Na (2)Ar 、 略 ( 3)Al(OH)3 (4) H2O (5) 略
(6) OH- + Al(OH)3 = [Al(OH)4]-
22、题(10分)
(1)负 Zn-2e- =Zn2+, (2)Zn+Cu2+ = Cu+Zn2+, Zn, 64.
23题(12分)
(1)放热 (2) 接触面积增大,速率加快 。
(3) 2A +B 2C (4) 0.5mol/(L?min) (5) B (6)AB
24题(14分)
(1)分液漏斗 (2)除去HCl 气体 Cl2+2OH- = Cl- +ClO- + H2O
(3) F - E -B-C-D或 E-F -B-C-D
(4) 淡黄色沉淀(浑浊) < (5) 2.24
同课章节目录
