2020-2021学年高二化学人教版选修三第3章 晶体结构与性质(习题)含答案
文档属性
| 名称 | 2020-2021学年高二化学人教版选修三第3章 晶体结构与性质(习题)含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 793.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-14 17:56:16 | ||
图片预览




文档简介
2020—2021人教化学选修三第3章 晶体结构与性质(习题)含答案
人教选修三第3章 晶体结构与性质
一、选择题
1、(双选)在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得了原子晶体干冰。下列推断正确的是( )
A.原子晶体干冰有很高的熔、沸点
B.原子晶体干冰易汽化,可用作制冷材料
C.原子晶体干冰硬度大,可作耐磨材料
D.每摩原子晶体干冰中含2 mol C—O键
2、下列各项是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中:—X,—Y,—Z。其中对应的化学式不正确的是( )
3、(双选)下列有关物质的结构和性质的叙述错误的是( )
A.水是一种非常稳定的化合物,这是由于水中存在氢键
B.由极性键形成的分子可能是非极性分子
C.水蒸气、水、冰中都含氢键
D.分子晶体中一定存在分子间作用力,可能有共价键
4、根据下列性质判断,属于原子晶体的物质是( )
A.熔点2700 ℃,导电性好,延展性强
B.无色晶体,熔点3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点56.6 ℃,微溶于水,硬度小,固态或液态时不导电
5、磷化硼是一种超硬耐磨涂层材料。如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
A.磷化硼晶体的化学式为BP,属于分子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
6、石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A.8 B.12
C.24 D.60
7、氧化钙在2973 K时熔化,而氯化钠在1074 K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是( )
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定
8、将一块缺角的胆矾晶体悬置于饱和硫酸铜溶液中,一段时间后(温度不变),发现缺角的晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体质量减小,溶液质量变大
B.晶体质量变大,溶液质量减小
C.晶体和溶液质量都不变
D.无法确定
9、下列均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SO3、C60 D.CCl4、Na2S、H2O2
10、美国lawrence livermore国家实验室(LLNL)的V·Lota·C·S·Y和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定的条件下,转化为分子晶体是物理变化
C.CO2的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合
11、已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合。下列关于该晶体的说法正确的是( )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体微粒间通过离子键相结合
12、下列关于金属键或金属的性质说法正确的是( )
①金属的导电性是由金属阳离子和自由电子的定向运动实现的
②金属键是金属阳离子和自由电子之间仅存在的强烈的静电吸引作用
③第三周期金属元素Na、Mg、Al的沸点依次升高
④金属键没有方向性和饱和性,其中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
13、下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
14、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的。玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述中正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.X?射线通过玻璃态水时,能产生谱线
15、下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te D.CI4、CBr4、CCl4、CF4
16、金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体。在立方体中,若一碳原子位于立方体体心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体)。请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
A.12,大立方体的12条棱的中点
B.8,大立方体的8个顶角
C.6,大立方体的6个面的中心
D.14,大立方体的8个顶角和6个面的中心
二、非选择题
1、(1)在下列物质中,__________________(填序号,下同)是晶体,__________________是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体一般都具有__________________,而非晶体______________________;另外非晶体具有物理性质____________________的特点,而晶体具有物理性质____________________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
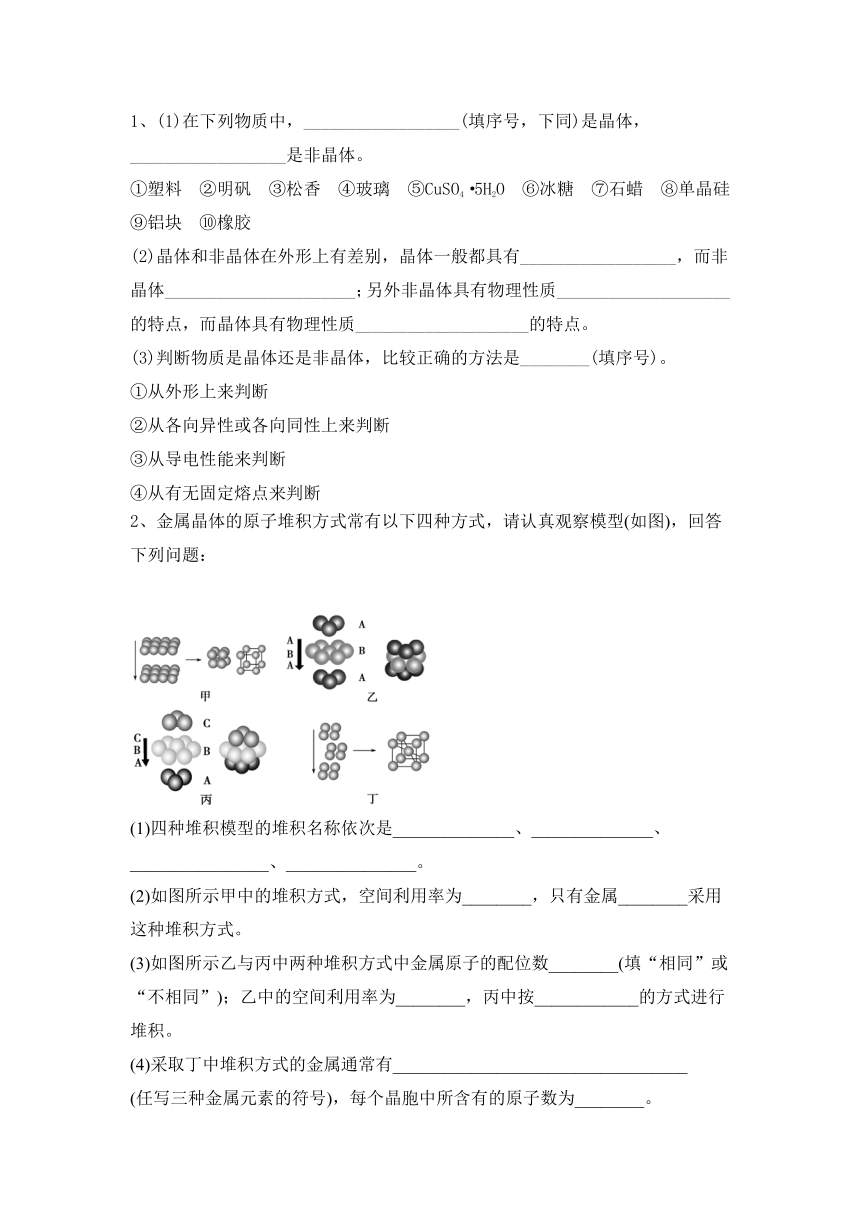
2、金属晶体的原子堆积方式常有以下四种方式,请认真观察模型(如图),回答下列问题:
(1)四种堆积模型的堆积名称依次是______________、______________、________________、_______________。
(2)如图所示甲中的堆积方式,空间利用率为________,只有金属________采用这种堆积方式。
(3)如图所示乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________,丙中按____________的方式进行堆积。
(4)采取丁中堆积方式的金属通常有__________________________________
(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
2020—2021人教化学选修三第3章 晶体结构与性质(习题)含答案
人教选修三第3章 晶体结构与性质
一、选择题
1、(双选)在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得了原子晶体干冰。下列推断正确的是( )
A.原子晶体干冰有很高的熔、沸点
B.原子晶体干冰易汽化,可用作制冷材料
C.原子晶体干冰硬度大,可作耐磨材料
D.每摩原子晶体干冰中含2 mol C—O键
【答案】AC
2、下列各项是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中:—X,—Y,—Z。其中对应的化学式不正确的是( )
【答案】B
3、(双选)下列有关物质的结构和性质的叙述错误的是( )
A.水是一种非常稳定的化合物,这是由于水中存在氢键
B.由极性键形成的分子可能是非极性分子
C.水蒸气、水、冰中都含氢键
D.分子晶体中一定存在分子间作用力,可能有共价键
【答案】AC
4、根据下列性质判断,属于原子晶体的物质是( )
A.熔点2700 ℃,导电性好,延展性强
B.无色晶体,熔点3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点56.6 ℃,微溶于水,硬度小,固态或液态时不导电
【答案】B
5、磷化硼是一种超硬耐磨涂层材料。如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
A.磷化硼晶体的化学式为BP,属于分子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
【答案】C
6、石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A.8 B.12
C.24 D.60
【答案】A
7、氧化钙在2973 K时熔化,而氯化钠在1074 K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是( )
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定
【答案】C
8、将一块缺角的胆矾晶体悬置于饱和硫酸铜溶液中,一段时间后(温度不变),发现缺角的晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体质量减小,溶液质量变大
B.晶体质量变大,溶液质量减小
C.晶体和溶液质量都不变
D.无法确定
【答案】C
9、下列均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SO3、C60 D.CCl4、Na2S、H2O2
【答案】B
10、美国lawrence livermore国家实验室(LLNL)的V·Lota·C·S·Y和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定的条件下,转化为分子晶体是物理变化
C.CO2的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合
【答案】D
11、已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合。下列关于该晶体的说法正确的是( )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体微粒间通过离子键相结合
【答案】C
12、下列关于金属键或金属的性质说法正确的是( )
①金属的导电性是由金属阳离子和自由电子的定向运动实现的
②金属键是金属阳离子和自由电子之间仅存在的强烈的静电吸引作用
③第三周期金属元素Na、Mg、Al的沸点依次升高
④金属键没有方向性和饱和性,其中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
【答案】C
13、下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
【答案】A
14、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的。玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述中正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.X?射线通过玻璃态水时,能产生谱线
【答案】C
15、下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te D.CI4、CBr4、CCl4、CF4
【答案】D
16、金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体。在立方体中,若一碳原子位于立方体体心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体)。请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
A.12,大立方体的12条棱的中点
B.8,大立方体的8个顶角
C.6,大立方体的6个面的中心
D.14,大立方体的8个顶角和6个面的中心
【答案】A
二、非选择题
1、(1)在下列物质中,__________________(填序号,下同)是晶体,__________________是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体一般都具有__________________,而非晶体______________________;另外非晶体具有物理性质____________________的特点,而晶体具有物理性质____________________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
【答案】(1)②⑤⑥⑧⑨ ①③④⑦⑩
(2)规则的几何外形 没有规则的几何外形 各向同性 各向异性
(3)②④
2、金属晶体的原子堆积方式常有以下四种方式,请认真观察模型(如图),回答下列问题:
(1)四种堆积模型的堆积名称依次是______________、______________、________________、_______________。
(2)如图所示甲中的堆积方式,空间利用率为________,只有金属________采用这种堆积方式。
(3)如图所示乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________,丙中按____________的方式进行堆积。
(4)采取丁中堆积方式的金属通常有__________________________________
(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
【答案】(1)简单立方堆积 六方最密堆积 面心立方最密堆积 体心立方堆积 (2)52% Po
3)相同 74% ABCABCABC…… (4)K、Na、Fe(合理即可) 2
人教选修三第3章 晶体结构与性质
一、选择题
1、(双选)在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得了原子晶体干冰。下列推断正确的是( )
A.原子晶体干冰有很高的熔、沸点
B.原子晶体干冰易汽化,可用作制冷材料
C.原子晶体干冰硬度大,可作耐磨材料
D.每摩原子晶体干冰中含2 mol C—O键
2、下列各项是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中:—X,—Y,—Z。其中对应的化学式不正确的是( )
3、(双选)下列有关物质的结构和性质的叙述错误的是( )
A.水是一种非常稳定的化合物,这是由于水中存在氢键
B.由极性键形成的分子可能是非极性分子
C.水蒸气、水、冰中都含氢键
D.分子晶体中一定存在分子间作用力,可能有共价键
4、根据下列性质判断,属于原子晶体的物质是( )
A.熔点2700 ℃,导电性好,延展性强
B.无色晶体,熔点3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点56.6 ℃,微溶于水,硬度小,固态或液态时不导电
5、磷化硼是一种超硬耐磨涂层材料。如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
A.磷化硼晶体的化学式为BP,属于分子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
6、石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A.8 B.12
C.24 D.60
7、氧化钙在2973 K时熔化,而氯化钠在1074 K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是( )
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定
8、将一块缺角的胆矾晶体悬置于饱和硫酸铜溶液中,一段时间后(温度不变),发现缺角的晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体质量减小,溶液质量变大
B.晶体质量变大,溶液质量减小
C.晶体和溶液质量都不变
D.无法确定
9、下列均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SO3、C60 D.CCl4、Na2S、H2O2
10、美国lawrence livermore国家实验室(LLNL)的V·Lota·C·S·Y和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定的条件下,转化为分子晶体是物理变化
C.CO2的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合
11、已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合。下列关于该晶体的说法正确的是( )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体微粒间通过离子键相结合
12、下列关于金属键或金属的性质说法正确的是( )
①金属的导电性是由金属阳离子和自由电子的定向运动实现的
②金属键是金属阳离子和自由电子之间仅存在的强烈的静电吸引作用
③第三周期金属元素Na、Mg、Al的沸点依次升高
④金属键没有方向性和饱和性,其中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
13、下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
14、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的。玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述中正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.X?射线通过玻璃态水时,能产生谱线
15、下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te D.CI4、CBr4、CCl4、CF4
16、金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体。在立方体中,若一碳原子位于立方体体心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体)。请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
A.12,大立方体的12条棱的中点
B.8,大立方体的8个顶角
C.6,大立方体的6个面的中心
D.14,大立方体的8个顶角和6个面的中心
二、非选择题
1、(1)在下列物质中,__________________(填序号,下同)是晶体,__________________是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体一般都具有__________________,而非晶体______________________;另外非晶体具有物理性质____________________的特点,而晶体具有物理性质____________________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
2、金属晶体的原子堆积方式常有以下四种方式,请认真观察模型(如图),回答下列问题:
(1)四种堆积模型的堆积名称依次是______________、______________、________________、_______________。
(2)如图所示甲中的堆积方式,空间利用率为________,只有金属________采用这种堆积方式。
(3)如图所示乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________,丙中按____________的方式进行堆积。
(4)采取丁中堆积方式的金属通常有__________________________________
(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
2020—2021人教化学选修三第3章 晶体结构与性质(习题)含答案
人教选修三第3章 晶体结构与性质
一、选择题
1、(双选)在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得了原子晶体干冰。下列推断正确的是( )
A.原子晶体干冰有很高的熔、沸点
B.原子晶体干冰易汽化,可用作制冷材料
C.原子晶体干冰硬度大,可作耐磨材料
D.每摩原子晶体干冰中含2 mol C—O键
【答案】AC
2、下列各项是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中:—X,—Y,—Z。其中对应的化学式不正确的是( )
【答案】B
3、(双选)下列有关物质的结构和性质的叙述错误的是( )
A.水是一种非常稳定的化合物,这是由于水中存在氢键
B.由极性键形成的分子可能是非极性分子
C.水蒸气、水、冰中都含氢键
D.分子晶体中一定存在分子间作用力,可能有共价键
【答案】AC
4、根据下列性质判断,属于原子晶体的物质是( )
A.熔点2700 ℃,导电性好,延展性强
B.无色晶体,熔点3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点56.6 ℃,微溶于水,硬度小,固态或液态时不导电
【答案】B
5、磷化硼是一种超硬耐磨涂层材料。如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
A.磷化硼晶体的化学式为BP,属于分子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
【答案】C
6、石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为CxK,其平面图形如图所示。x的值为( )
A.8 B.12
C.24 D.60
【答案】A
7、氧化钙在2973 K时熔化,而氯化钠在1074 K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是( )
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定
【答案】C
8、将一块缺角的胆矾晶体悬置于饱和硫酸铜溶液中,一段时间后(温度不变),发现缺角的晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体质量减小,溶液质量变大
B.晶体质量变大,溶液质量减小
C.晶体和溶液质量都不变
D.无法确定
【答案】C
9、下列均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SO3、C60 D.CCl4、Na2S、H2O2
【答案】B
10、美国lawrence livermore国家实验室(LLNL)的V·Lota·C·S·Y和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定的条件下,转化为分子晶体是物理变化
C.CO2的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合
【答案】D
11、已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合。下列关于该晶体的说法正确的是( )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体微粒间通过离子键相结合
【答案】C
12、下列关于金属键或金属的性质说法正确的是( )
①金属的导电性是由金属阳离子和自由电子的定向运动实现的
②金属键是金属阳离子和自由电子之间仅存在的强烈的静电吸引作用
③第三周期金属元素Na、Mg、Al的沸点依次升高
④金属键没有方向性和饱和性,其中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
【答案】C
13、下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
【答案】A
14、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的。玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述中正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.X?射线通过玻璃态水时,能产生谱线
【答案】C
15、下列物质,按沸点降低顺序排列的一组是( )
A.HF、HCl、HBr、HI B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te D.CI4、CBr4、CCl4、CF4
【答案】D
16、金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体。在立方体中,若一碳原子位于立方体体心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体)。请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
A.12,大立方体的12条棱的中点
B.8,大立方体的8个顶角
C.6,大立方体的6个面的中心
D.14,大立方体的8个顶角和6个面的中心
【答案】A
二、非选择题
1、(1)在下列物质中,__________________(填序号,下同)是晶体,__________________是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体一般都具有__________________,而非晶体______________________;另外非晶体具有物理性质____________________的特点,而晶体具有物理性质____________________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
【答案】(1)②⑤⑥⑧⑨ ①③④⑦⑩
(2)规则的几何外形 没有规则的几何外形 各向同性 各向异性
(3)②④
2、金属晶体的原子堆积方式常有以下四种方式,请认真观察模型(如图),回答下列问题:
(1)四种堆积模型的堆积名称依次是______________、______________、________________、_______________。
(2)如图所示甲中的堆积方式,空间利用率为________,只有金属________采用这种堆积方式。
(3)如图所示乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________,丙中按____________的方式进行堆积。
(4)采取丁中堆积方式的金属通常有__________________________________
(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
【答案】(1)简单立方堆积 六方最密堆积 面心立方最密堆积 体心立方堆积 (2)52% Po
3)相同 74% ABCABCABC…… (4)K、Na、Fe(合理即可) 2
