科学版九年级下册化学课件 第六章 阶段核心整合专训 金属的化学性质及应用 (ppt 共33张)
文档属性
| 名称 | 科学版九年级下册化学课件 第六章 阶段核心整合专训 金属的化学性质及应用 (ppt 共33张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 610.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-14 09:13:34 | ||
图片预览










文档简介
第六章 金属
阶段核心整合专训
金属的化学性质及应用
A
A
1
2
3
4
提示:点击 进入讲评
答案呈现
5
C
D
6
7
8
9
10
C
11
12
A
13
14
B
D
D
1.【中考·鞍山】从化学的角度对下列词句进行解释,错误的是( )
A.金(即铜)柔锡柔,合两柔则为刚——说明合金的熔点比组成它的纯金属高
B.真金不怕火炼——金(Au)化学性质不活泼
C.釜底抽薪——通过清除可燃物达到灭火的目的
D.百炼成钢——使生铁中碳等杂质的含量降低,达到钢的标准
A
【点拨】“金(即铜)柔锡柔,合两柔则为刚”,说明合金的硬度比组成它的纯金属大,A错误。
2.【中考·兰州】黄铜是铜与锌的合金。下列关于黄铜的说法正确的是( )
A.比纯铜耐腐蚀
B.加热时不与空气反应
C.硬度小于纯铜
D.可以完全溶解在稀盐酸中
A
3.【2020·苏州节选】铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(1)人类冶炼和使用金属铝的时间较晚,可能是因为________(填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
b
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和_____________________(写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式:__________________________________。
密度小(或质轻等)
3Li2O+2Al=====6Li+Al2O3
高温
(3)用砂纸除去铝片表面的氧化膜,将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。
①写出生成红色物质的化学方程式:_____________________________________________;
②硫酸铜溶液中的阳离子有____________(填离子符号)。
2Al+3CuSO4===Al2(SO4)3+3Cu
H+、Cu2+
【点拨】(1)铝是地壳中含量最多的金属元素,人类冶炼和使用金属铝的时间较晚,是因为冶炼铝的技术要求高,故选b。(2)铝锂合金具有强度高、耐腐蚀和密度小等性质。高温下,铝与Li2O反应的化学方程式为3Li2O+2Al=====6Li+Al2O3。(3)①铝和硫酸铜溶液反应,生成硫酸铝和铜,其化学方程式为2Al+3CuSO4===Al2(SO4)3+3Cu。②硫酸铜溶液中加入铝时,产生氢气,说明溶液中含有氢离子,因此硫酸铜溶液中的阳离子有氢离子和铜离子。
高温
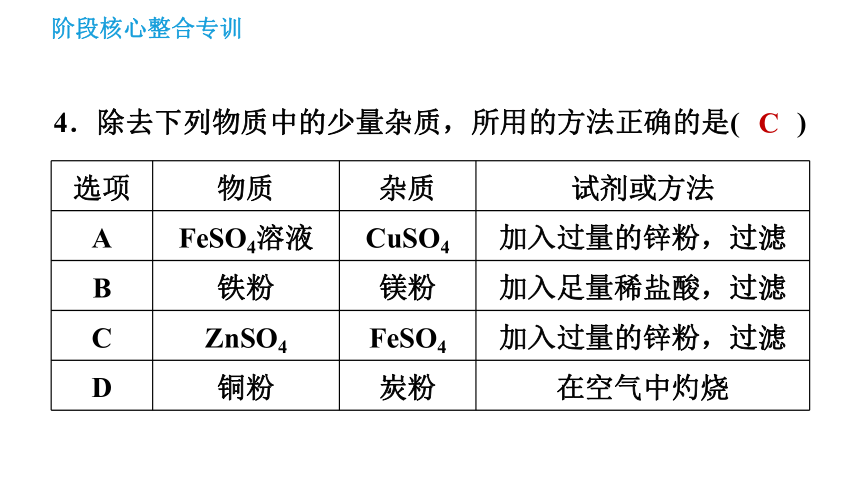
4.除去下列物质中的少量杂质,所用的方法正确的是( )
C
选项
物质
杂质
试剂或方法
A
FeSO4溶液
CuSO4
加入过量的锌粉,过滤
B
铁粉
镁粉
加入足量稀盐酸,过滤
C
ZnSO4
FeSO4
加入过量的锌粉,过滤
D
铜粉
炭粉
在空气中灼烧
【点拨】除杂时注意不能引入新杂质,不能改变原来需要的物质。A中加入Zn粉,Zn与FeSO4、CuSO4都能发生反应,不可取;B中Fe、Mg都能与稀盐酸反应,不正确;C中Zn与FeSO4反应生成Fe和ZnSO4,过滤即可得到ZnSO4溶液,正确;D中在空气中加热铜粉和炭粉的混合物,可将炭粉转化为气体除去,而铜与氧气反应最终生成氧化铜,不正确。
5.【中考·铜仁】金属材料包括铁、铝、铜等纯金属和合金。
(1)人体中含量最高的金属元素是________。
(2)因性能优良,被认为是21世纪的重要金属材料的是________________。
(3)铝具有较好的抗腐蚀性能,是因为铝与空气中氧气反应,其表面生成一层致密的氧化膜,该氧化膜的化学式为________。
钙
钛和钛的合金
Al2O3
(4)FeCl2溶液中混有少量杂质CuCl2,简要叙述除杂的操作步骤是______________________________________________,除杂反应的化学方程式为_______________________。
向混合溶液中加入过量的铁粉,充分反应后过滤
CuCl2+Fe===FeCl2+Cu
【点拨】(1)钙元素是人体中含量最高的金属元素。(2)钛和钛合金的性能优良,被认为是21世纪的重要金属材料。(3)铝与空气中氧气反应,其表面生成一层致密的氧化膜是氧化铝。(4)FeCl2溶液中混有少量杂质CuCl2,要除去氯化铜,可以向混合溶液中加入过量的铁粉,充分反应后,过滤掉剩余的铁粉和生成的铜即可。
6.【中考·安顺】“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利。下列关于鉴别“愚人金”与黄金的实验方案,合理的是( )
①比较硬度,硬度小的是“愚人金”
②灼烧,表面变色的是“愚人金”
③浸没在稀硫酸中,表面有气泡产生的是“愚人金”
④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A.①③ B.②④ C.①④ D.②③
D
【点拨】加热时,铜锌合金表面变黑,发生反应2Cu+O2=====2CuO,黄金的化学性质稳定,表面无明显变化,②正确;浸没在稀硫酸中,Zn+H2SO4=== ZnSO4+H2↑,铜、金与稀硫酸不反应,③正确;铜、金、锌与ZnSO4溶液都不发生反应,④不正确。
△
7.【中考·大庆】某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计的流程如图所示。
请回答:
(1)过滤操作中用到的玻璃仪器为_____________________。
(2)Ⅰ中有关反应的化学方程式为________________________。
漏斗、玻璃棒、烧杯
Fe+CuSO4===FeSO4+Cu
(3)溶液B中所含的金属化合物是_________________;
固体A的成分是__________。(均填化学式)
(4)Ⅱ中加入过量的稀硫酸的目的是_______________。
Al2(SO4)3、FeSO4
Cu、Fe
使铁完全反应
【点拨】(1)过滤操作中用到的玻璃仪器为漏斗、玻璃棒、烧杯。(2)Ⅰ中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO4===FeSO4+Cu。(3)溶液B中所含的金属化合物是没有反应的Al2(SO4)3及反应生成的FeSO4;固体A的成分是反应生成的Cu及过量的Fe。(4)Ⅱ中加入过量的稀硫酸的目的是使铁完全反应。
8.【2020·滨州】已知A、B、C、D是四种金属单质,A能从B的化合物溶液中置换出B,但A不能与稀盐酸反应;相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.D>C>A>B B.A>B>C>D
C.B>A>C>D D.D>C>B>A
A
【点拨】A能从B的化合物溶液中置换出B,说明A比B活泼;C、D能与稀盐酸反应产生H2,且D比C反应剧烈,而A不能与稀盐酸反应,说明D比C活泼,C比 A活泼,故活动性顺序为D>C>A>B。
9.【中考·福建】如图“→”表示一种金属能把另一种金属从其化合物溶液中置换出来,则甲、乙、丙三种金属的活动性由强到弱的顺序是( )
A.甲、乙、丙
B.乙、丙、甲
C.丙、甲、乙
D.甲、丙、乙
D
10.【中考·黄石】用盐酸与金属单质反应,探究锌、镁、铜的金属活动性。下列有关现象、分析或结论正确的是( )
A.铜片表面可以观察到气泡
B.放锌片的试管比放镁片的试管更热
C.金属活动性由强到弱的顺序为镁>锌>铜
D.三支试管中盐酸的
浓度可以不同
C
【点拨】Mg、Zn、Cu分别放入盐酸中,可观察到铜片表面无气泡产生,Mg、Zn的表面产生气泡,且Mg的反应速率比Zn快,则三种金属活动性:Mg>Zn>Cu;镁与盐酸反应更剧烈,放出大量的热,管壁更热;为控制变量,三支试管中盐酸的浓度应相同,A、B、D均错误。
11.【节选·重庆】成功着陆月球背面的“嫦娥四号”探测器使用了 多种材料。
(1)探测器使用的铝合金硬度比纯铝的硬度________(填“大” 或“小”)。
(2)探测器广泛使用了Al、Fe、Cu,利用它们完成如下实验:
①将未打磨的铝片放入FeSO4溶液中,没有明显现象;
②将打磨过的铝片放入FeSO4溶液中,铝片表面有明显变化;
③将打磨过的铁片放入CuSO4溶液中,铁片表面变红。
大
实验①中无明显现象是因为铝片表面有一层致密的________(填化学式)薄膜;
实验②中发生反应的化学方程式为_____________________________________________;
实验③中铁片足量,充分反应后溶液变为_______色。
Al2O3
2Al+3FeSO4===Al2(SO4)3+3Fe
浅绿
【点拨】(1)合金的硬度一般大于其成分金属的硬度,所以铝合金的硬度比纯铝的硬度大。(2)①常温下,铝的化学性质比较活泼,易与空气中的氧气反应生成致密的氧化铝保护膜,从而阻止反应的进一步发生。②铝的活动性强于铁,所以铝能与硫酸亚铁发生置换反应生成铁和硫酸铝。③铁的活动性强于铜,所以铁能与硫酸铜发生反应生成铜和硫酸亚铁,硫酸铜溶液是蓝色的,硫酸亚铁溶液是浅绿色的。
12.【2020·泰安】向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤,不可能存在的情况是( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+
D
【点拨】锌活动性小于镁,不能从Mg(NO3)2溶液中把镁置换出来,所以滤纸上不可能有镁,D错误。
13.【中考·十堰】为探究金属活动性顺序,学习小组设计并进行实验Ⅰ和Ⅱ。实验结束后,将两实验的废液全部倒入一洁净烧杯中,反应后得到溶液A和固体B。实验过程
及现象如图所示:
据此得出以下结论:①通过实验Ⅰ和Ⅱ能验证Al、Ag、Cu的金属活动性顺序;②此实验反应后固体B中一定含有Cu;③若A是无色溶液,则A中可能含有AgNO3;④若A呈蓝色,则溶液A中至少有两种金属化合物;⑤若A呈蓝色,固体B中一定不含Cu。
其中正确结论的个数有( )
A.1个 B.2个 C.3个 D.4个
B
【点拨】①由实验 Ⅰ 可知Al与Cu(NO3)2发生化学反应,活动性:Al>Cu,由实验 Ⅱ 可知Cu能置换出Ag,则活动性:Cu>Ag,所以能验证活动性:Al>Cu>Ag,①正确;②Ⅰ、Ⅱ 反应后的物质混合后,Ⅰ中生成的Cu可能与 Ⅱ 中过量的AgNO3反应,固体B中不一定含有Cu,②错误;③若A是无色溶液,则说明 Ⅰ 中的Al与 Ⅱ 中得到的Cu(NO3)2发生反应,说明一定没有AgNO3,③错误;④若A呈蓝色,则一定有Cu(NO3)2,还有Al(NO3)3,可能有AgNO3,④正确;⑤若A呈蓝色,可能是Al置换了部分Cu(NO3)2,可能有Cu生成,⑤错误。
14.【中考·达州】人类社会的文明进步与金属材料的关系密切。
(1)钢铁容易与空气中的___________________等物质接触发生反应生成铁锈。
(2)某化学兴趣小组同学在实验室将一定质量的锌粉放入盛有硝酸银、硝酸铜和硝酸镁的混合溶液中,充分反应后过滤,得到滤渣和滤液,滤液呈无色。
①滤渣中一定含有的金属是____________________;
②滤液中一定含有的阳离子是__________________。
氧气和水蒸气
Cu和Ag
Mg2+和Zn2+
【点拨】(1)钢铁容易与空气中的氧气和水蒸气等物质接触发生反应生成铁锈。(2)由于锌的活动性比镁弱,比银和铜强,因此锌不与硝酸镁反应,可以和硝酸银、硝酸铜反应,锌先和硝酸银溶液反应,后与硝酸铜溶液反应,故滤渣中一定含有金属银,又因为滤液呈无色,则硝酸铜全部反应,故滤渣中一定含有银和铜,滤液中一定含有未反应的硝酸镁和新生成的硝酸锌,故滤液中一定含有的阳离子是Mg2+和Zn2+。
阶段核心整合专训
金属的化学性质及应用
A
A
1
2
3
4
提示:点击 进入讲评
答案呈现
5
C
D
6
7
8
9
10
C
11
12
A
13
14
B
D
D
1.【中考·鞍山】从化学的角度对下列词句进行解释,错误的是( )
A.金(即铜)柔锡柔,合两柔则为刚——说明合金的熔点比组成它的纯金属高
B.真金不怕火炼——金(Au)化学性质不活泼
C.釜底抽薪——通过清除可燃物达到灭火的目的
D.百炼成钢——使生铁中碳等杂质的含量降低,达到钢的标准
A
【点拨】“金(即铜)柔锡柔,合两柔则为刚”,说明合金的硬度比组成它的纯金属大,A错误。
2.【中考·兰州】黄铜是铜与锌的合金。下列关于黄铜的说法正确的是( )
A.比纯铜耐腐蚀
B.加热时不与空气反应
C.硬度小于纯铜
D.可以完全溶解在稀盐酸中
A
3.【2020·苏州节选】铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(1)人类冶炼和使用金属铝的时间较晚,可能是因为________(填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
b
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和_____________________(写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式:__________________________________。
密度小(或质轻等)
3Li2O+2Al=====6Li+Al2O3
高温
(3)用砂纸除去铝片表面的氧化膜,将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。
①写出生成红色物质的化学方程式:_____________________________________________;
②硫酸铜溶液中的阳离子有____________(填离子符号)。
2Al+3CuSO4===Al2(SO4)3+3Cu
H+、Cu2+
【点拨】(1)铝是地壳中含量最多的金属元素,人类冶炼和使用金属铝的时间较晚,是因为冶炼铝的技术要求高,故选b。(2)铝锂合金具有强度高、耐腐蚀和密度小等性质。高温下,铝与Li2O反应的化学方程式为3Li2O+2Al=====6Li+Al2O3。(3)①铝和硫酸铜溶液反应,生成硫酸铝和铜,其化学方程式为2Al+3CuSO4===Al2(SO4)3+3Cu。②硫酸铜溶液中加入铝时,产生氢气,说明溶液中含有氢离子,因此硫酸铜溶液中的阳离子有氢离子和铜离子。
高温
4.除去下列物质中的少量杂质,所用的方法正确的是( )
C
选项
物质
杂质
试剂或方法
A
FeSO4溶液
CuSO4
加入过量的锌粉,过滤
B
铁粉
镁粉
加入足量稀盐酸,过滤
C
ZnSO4
FeSO4
加入过量的锌粉,过滤
D
铜粉
炭粉
在空气中灼烧
【点拨】除杂时注意不能引入新杂质,不能改变原来需要的物质。A中加入Zn粉,Zn与FeSO4、CuSO4都能发生反应,不可取;B中Fe、Mg都能与稀盐酸反应,不正确;C中Zn与FeSO4反应生成Fe和ZnSO4,过滤即可得到ZnSO4溶液,正确;D中在空气中加热铜粉和炭粉的混合物,可将炭粉转化为气体除去,而铜与氧气反应最终生成氧化铜,不正确。
5.【中考·铜仁】金属材料包括铁、铝、铜等纯金属和合金。
(1)人体中含量最高的金属元素是________。
(2)因性能优良,被认为是21世纪的重要金属材料的是________________。
(3)铝具有较好的抗腐蚀性能,是因为铝与空气中氧气反应,其表面生成一层致密的氧化膜,该氧化膜的化学式为________。
钙
钛和钛的合金
Al2O3
(4)FeCl2溶液中混有少量杂质CuCl2,简要叙述除杂的操作步骤是______________________________________________,除杂反应的化学方程式为_______________________。
向混合溶液中加入过量的铁粉,充分反应后过滤
CuCl2+Fe===FeCl2+Cu
【点拨】(1)钙元素是人体中含量最高的金属元素。(2)钛和钛合金的性能优良,被认为是21世纪的重要金属材料。(3)铝与空气中氧气反应,其表面生成一层致密的氧化膜是氧化铝。(4)FeCl2溶液中混有少量杂质CuCl2,要除去氯化铜,可以向混合溶液中加入过量的铁粉,充分反应后,过滤掉剩余的铁粉和生成的铜即可。
6.【中考·安顺】“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利。下列关于鉴别“愚人金”与黄金的实验方案,合理的是( )
①比较硬度,硬度小的是“愚人金”
②灼烧,表面变色的是“愚人金”
③浸没在稀硫酸中,表面有气泡产生的是“愚人金”
④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A.①③ B.②④ C.①④ D.②③
D
【点拨】加热时,铜锌合金表面变黑,发生反应2Cu+O2=====2CuO,黄金的化学性质稳定,表面无明显变化,②正确;浸没在稀硫酸中,Zn+H2SO4=== ZnSO4+H2↑,铜、金与稀硫酸不反应,③正确;铜、金、锌与ZnSO4溶液都不发生反应,④不正确。
△
7.【中考·大庆】某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计的流程如图所示。
请回答:
(1)过滤操作中用到的玻璃仪器为_____________________。
(2)Ⅰ中有关反应的化学方程式为________________________。
漏斗、玻璃棒、烧杯
Fe+CuSO4===FeSO4+Cu
(3)溶液B中所含的金属化合物是_________________;
固体A的成分是__________。(均填化学式)
(4)Ⅱ中加入过量的稀硫酸的目的是_______________。
Al2(SO4)3、FeSO4
Cu、Fe
使铁完全反应
【点拨】(1)过滤操作中用到的玻璃仪器为漏斗、玻璃棒、烧杯。(2)Ⅰ中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO4===FeSO4+Cu。(3)溶液B中所含的金属化合物是没有反应的Al2(SO4)3及反应生成的FeSO4;固体A的成分是反应生成的Cu及过量的Fe。(4)Ⅱ中加入过量的稀硫酸的目的是使铁完全反应。
8.【2020·滨州】已知A、B、C、D是四种金属单质,A能从B的化合物溶液中置换出B,但A不能与稀盐酸反应;相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.D>C>A>B B.A>B>C>D
C.B>A>C>D D.D>C>B>A
A
【点拨】A能从B的化合物溶液中置换出B,说明A比B活泼;C、D能与稀盐酸反应产生H2,且D比C反应剧烈,而A不能与稀盐酸反应,说明D比C活泼,C比 A活泼,故活动性顺序为D>C>A>B。
9.【中考·福建】如图“→”表示一种金属能把另一种金属从其化合物溶液中置换出来,则甲、乙、丙三种金属的活动性由强到弱的顺序是( )
A.甲、乙、丙
B.乙、丙、甲
C.丙、甲、乙
D.甲、丙、乙
D
10.【中考·黄石】用盐酸与金属单质反应,探究锌、镁、铜的金属活动性。下列有关现象、分析或结论正确的是( )
A.铜片表面可以观察到气泡
B.放锌片的试管比放镁片的试管更热
C.金属活动性由强到弱的顺序为镁>锌>铜
D.三支试管中盐酸的
浓度可以不同
C
【点拨】Mg、Zn、Cu分别放入盐酸中,可观察到铜片表面无气泡产生,Mg、Zn的表面产生气泡,且Mg的反应速率比Zn快,则三种金属活动性:Mg>Zn>Cu;镁与盐酸反应更剧烈,放出大量的热,管壁更热;为控制变量,三支试管中盐酸的浓度应相同,A、B、D均错误。
11.【节选·重庆】成功着陆月球背面的“嫦娥四号”探测器使用了 多种材料。
(1)探测器使用的铝合金硬度比纯铝的硬度________(填“大” 或“小”)。
(2)探测器广泛使用了Al、Fe、Cu,利用它们完成如下实验:
①将未打磨的铝片放入FeSO4溶液中,没有明显现象;
②将打磨过的铝片放入FeSO4溶液中,铝片表面有明显变化;
③将打磨过的铁片放入CuSO4溶液中,铁片表面变红。
大
实验①中无明显现象是因为铝片表面有一层致密的________(填化学式)薄膜;
实验②中发生反应的化学方程式为_____________________________________________;
实验③中铁片足量,充分反应后溶液变为_______色。
Al2O3
2Al+3FeSO4===Al2(SO4)3+3Fe
浅绿
【点拨】(1)合金的硬度一般大于其成分金属的硬度,所以铝合金的硬度比纯铝的硬度大。(2)①常温下,铝的化学性质比较活泼,易与空气中的氧气反应生成致密的氧化铝保护膜,从而阻止反应的进一步发生。②铝的活动性强于铁,所以铝能与硫酸亚铁发生置换反应生成铁和硫酸铝。③铁的活动性强于铜,所以铁能与硫酸铜发生反应生成铜和硫酸亚铁,硫酸铜溶液是蓝色的,硫酸亚铁溶液是浅绿色的。
12.【2020·泰安】向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中加入一些锌粉,完全反应后过滤,不可能存在的情况是( )
A.滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Mg2+
B.滤纸上有Ag、Cu,滤液中有Zn2+、Mg2+
C.滤纸上有Ag、Cu、Zn,滤液中有Zn2+、Mg2+
D.滤纸上有Ag、Cu、Zn、Mg,滤液中有Zn2+
D
【点拨】锌活动性小于镁,不能从Mg(NO3)2溶液中把镁置换出来,所以滤纸上不可能有镁,D错误。
13.【中考·十堰】为探究金属活动性顺序,学习小组设计并进行实验Ⅰ和Ⅱ。实验结束后,将两实验的废液全部倒入一洁净烧杯中,反应后得到溶液A和固体B。实验过程
及现象如图所示:
据此得出以下结论:①通过实验Ⅰ和Ⅱ能验证Al、Ag、Cu的金属活动性顺序;②此实验反应后固体B中一定含有Cu;③若A是无色溶液,则A中可能含有AgNO3;④若A呈蓝色,则溶液A中至少有两种金属化合物;⑤若A呈蓝色,固体B中一定不含Cu。
其中正确结论的个数有( )
A.1个 B.2个 C.3个 D.4个
B
【点拨】①由实验 Ⅰ 可知Al与Cu(NO3)2发生化学反应,活动性:Al>Cu,由实验 Ⅱ 可知Cu能置换出Ag,则活动性:Cu>Ag,所以能验证活动性:Al>Cu>Ag,①正确;②Ⅰ、Ⅱ 反应后的物质混合后,Ⅰ中生成的Cu可能与 Ⅱ 中过量的AgNO3反应,固体B中不一定含有Cu,②错误;③若A是无色溶液,则说明 Ⅰ 中的Al与 Ⅱ 中得到的Cu(NO3)2发生反应,说明一定没有AgNO3,③错误;④若A呈蓝色,则一定有Cu(NO3)2,还有Al(NO3)3,可能有AgNO3,④正确;⑤若A呈蓝色,可能是Al置换了部分Cu(NO3)2,可能有Cu生成,⑤错误。
14.【中考·达州】人类社会的文明进步与金属材料的关系密切。
(1)钢铁容易与空气中的___________________等物质接触发生反应生成铁锈。
(2)某化学兴趣小组同学在实验室将一定质量的锌粉放入盛有硝酸银、硝酸铜和硝酸镁的混合溶液中,充分反应后过滤,得到滤渣和滤液,滤液呈无色。
①滤渣中一定含有的金属是____________________;
②滤液中一定含有的阳离子是__________________。
氧气和水蒸气
Cu和Ag
Mg2+和Zn2+
【点拨】(1)钢铁容易与空气中的氧气和水蒸气等物质接触发生反应生成铁锈。(2)由于锌的活动性比镁弱,比银和铜强,因此锌不与硝酸镁反应,可以和硝酸银、硝酸铜反应,锌先和硝酸银溶液反应,后与硝酸铜溶液反应,故滤渣中一定含有金属银,又因为滤液呈无色,则硝酸铜全部反应,故滤渣中一定含有银和铜,滤液中一定含有未反应的硝酸镁和新生成的硝酸锌,故滤液中一定含有的阳离子是Mg2+和Zn2+。
同课章节目录
