2020-2021九年级化学人教版第十一单元课题1 生活中常见的盐课件(共21张PPT)
文档属性
| 名称 | 2020-2021九年级化学人教版第十一单元课题1 生活中常见的盐课件(共21张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-14 15:00:13 | ||
图片预览






文档简介
(共21张PPT)
你能写出这些物质的化学式吗?
碳酸钙
碳酸钠
碳酸氢钠
CaCO3
Na2CO3
NaHCO3
1.
化学式
看图说用途
华表
人民大会堂中南海
酒店大厅大理石地面
名
称
俗
称
主
要
用
途
碳酸钠
碳酸氢钠
碳酸钙
纯碱
苏打
小苏打
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
2.
用途
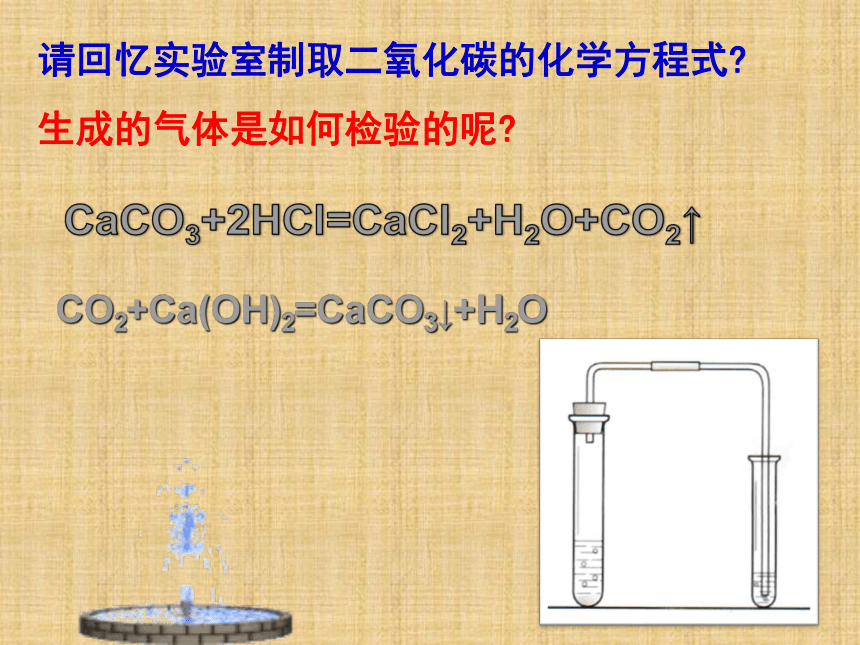
请回忆实验室制取二氧化碳的化学方程式?
生成的气体是如何检验的呢?
CO2+Ca(OH)2=CaCO3↓+H2O
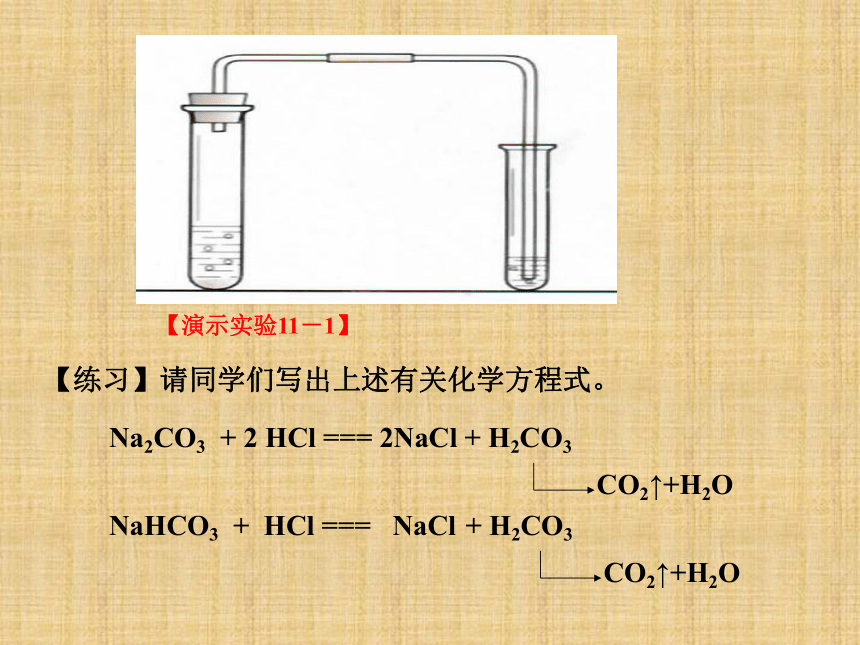
【演示实验11-1】
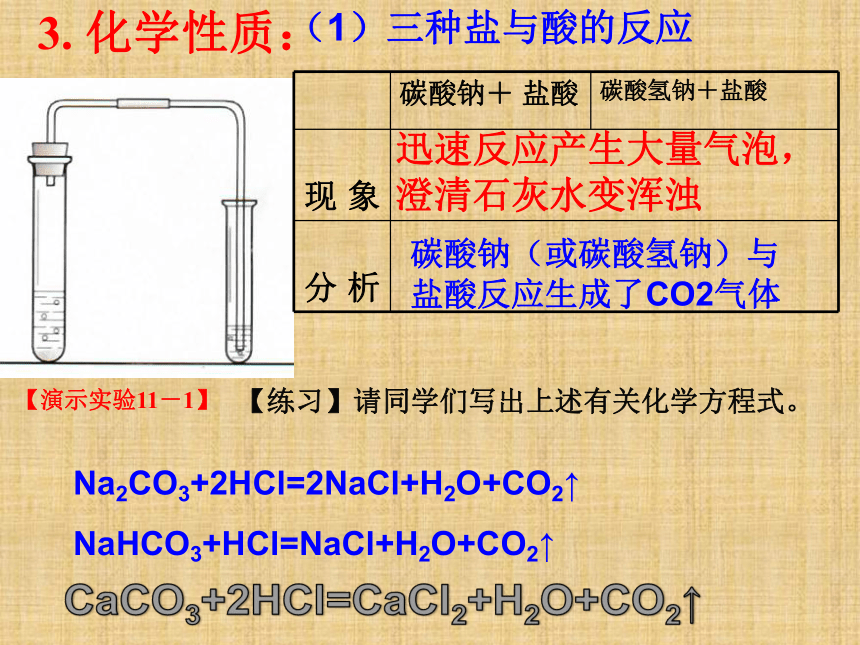
碳酸钠+
盐酸
碳酸氢钠+盐酸
现
象
分
析
迅速反应产生大量气泡,澄清石灰水变浑浊
【练习】请同学们写出上述有关化学方程式。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
3.
化学性质:
(1)三种盐与酸的反应
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
【演示实验11-1】
【练习】请同学们写出上述有关化学方程式。
Na2CO3
+
2
HCl
===
2NaCl
+
H2CO3
CO2↑+H2O
NaHCO3
+
HCl
===
NaCl
+
H2CO3
CO2↑+H2O
怎样检验这些物质中含有碳酸根或碳酸氢根呢?
4.
CO32-、HCO3-的检验
CaCO3
+
2HCl
==
CaCl2
+
H2O
+
CO2↑
Na2CO3
+
2HCl==2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
==
NaCl
+
H2O
+
CO2↑
某物质
+稀盐酸
产生气体
变浑浊
+Ca(OH)2
CO2
CaCO3
含CO32-或HCO32-
某同学往一无色溶液中滴加稀盐酸,发现生成一种无色气体,将生成的气体通入澄清石灰水,发现石灰水变浑浊,于是他得出了该溶液中含有碳酸根离子,你认为他的结论正确么?为什么?
请小结碳酸根或碳酸氢根离子检验方法?
实验操作
实验现象
实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水。
有无色气体生成,澄清石灰水变浑浊。
该样品中含
CO32-
是碳酸盐或含
HCO3-
实验11-2
向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。
现象
分析
溶液变浑浊
Na2CO3
+
Ca(OH)2
==
CaCO3↓+
2NaOH
NaOH的工业制取
纯碱Na2CO3和熟石灰Ca(OH)2制取烧碱
Na2CO3
+
Ca(OH)2
==
CaCO3↓+
2NaOH
由纯碱制烧碱
纯碱
烧碱
(2)与碱反应
补充资料1:说到纯碱,我们一定要记得一位我国化学史上的科学家——侯德榜,希望大家课后去查查关于他的资料,碳酸钠为何叫纯碱呢?
侯德榜(1890~1974)
侯德榜,中国化学家,“侯氏制碱法”的创始人。侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,他为发展小化肥工业所做的贡献。1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,毅然放弃自己热爱的制革专业,回到祖国。
(候氏制碱法)反应分三步进行
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3=Na2CO3+H2O+CO2↑
△
补充资料2:溶洞、钟乳石、石笋和石柱的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑
当堂检测反馈
1、目前从海水中提取食盐的方法主要是利用海水晒盐,它所利用的物质分离方法是(
)
A、溶解法
B、过滤法
C、结晶法
D、蒸馏法
C
2、根据物质的性质,下列物质允许带上客车的是(
)
A、白磷
B、鞭炮
C、酒精
D、食盐
D
3、图是某精制碘盐包装袋上的部分文字。根据该文字判断,下列有关猜测正确的是(
)
A、精制碘盐是一种纯净物
B、碘盐中的碘指的是碘元素
C、碘盐由碘和盐组成
D、一袋碘盐中含氯化钠500g
B
4、下列实验中都要用到玻璃棒,其中玻璃棒的作用相同的是(
)
B
A、①和②
B、②和③
C、②和④
D、③和④
5、请从一氧化碳、氮气、食盐、熟石灰四种物质中选择适当的物质用化学式填空:
(1)用作粮食瓜果保护气的是
;
(2)日常生活中用来调味和防腐的
;
(3)农业上用来配制农药波尔多液的是
;
(4)工业上用来冶炼金属的气体氧化物是
。
N2
NaCl
Ca(OH)2
CO
6、为了测定粗盐中氯化钠(混有少量的泥沙及不溶性杂质)的纯度,进行如下实验:
(1)主要的实验步骤有:a.溶解;b.称量;c.过滤;d.计算;e.蒸发
正确的操作顺序是
。
A、abcde
B、bcaed
C、bacebd
D、bdaec
C
B
(2)蒸发时有如下注意事项,你认为错误的是
(填代号)
A、将澄清的滤液全部注入蒸发皿
B、蒸发皿必须放在石棉网上加热
C、加热时用玻璃棒不断搅拌,防止滤液溅出
D、当蒸发皿中出现较多固体时,停止加热
(3)某同学实验后,计算出氯化钠的纯度大于100%,分析引起错误的两点原因可能是
;
。
(4)某同学要配制1000g生理盐水,他要称取
g食盐,量取
mL水。
蒸发时水未完全蒸干
称量错误或计算错误
9
991
本节课作业:
学习新策略:
P151-152
再见
你能写出这些物质的化学式吗?
碳酸钙
碳酸钠
碳酸氢钠
CaCO3
Na2CO3
NaHCO3
1.
化学式
看图说用途
华表
人民大会堂中南海
酒店大厅大理石地面
名
称
俗
称
主
要
用
途
碳酸钠
碳酸氢钠
碳酸钙
纯碱
苏打
小苏打
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
2.
用途
请回忆实验室制取二氧化碳的化学方程式?
生成的气体是如何检验的呢?
CO2+Ca(OH)2=CaCO3↓+H2O
【演示实验11-1】
碳酸钠+
盐酸
碳酸氢钠+盐酸
现
象
分
析
迅速反应产生大量气泡,澄清石灰水变浑浊
【练习】请同学们写出上述有关化学方程式。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
3.
化学性质:
(1)三种盐与酸的反应
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
【演示实验11-1】
【练习】请同学们写出上述有关化学方程式。
Na2CO3
+
2
HCl
===
2NaCl
+
H2CO3
CO2↑+H2O
NaHCO3
+
HCl
===
NaCl
+
H2CO3
CO2↑+H2O
怎样检验这些物质中含有碳酸根或碳酸氢根呢?
4.
CO32-、HCO3-的检验
CaCO3
+
2HCl
==
CaCl2
+
H2O
+
CO2↑
Na2CO3
+
2HCl==2NaCl
+
H2O
+
CO2↑
NaHCO3
+
HCl
==
NaCl
+
H2O
+
CO2↑
某物质
+稀盐酸
产生气体
变浑浊
+Ca(OH)2
CO2
CaCO3
含CO32-或HCO32-
某同学往一无色溶液中滴加稀盐酸,发现生成一种无色气体,将生成的气体通入澄清石灰水,发现石灰水变浑浊,于是他得出了该溶液中含有碳酸根离子,你认为他的结论正确么?为什么?
请小结碳酸根或碳酸氢根离子检验方法?
实验操作
实验现象
实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水。
有无色气体生成,澄清石灰水变浑浊。
该样品中含
CO32-
是碳酸盐或含
HCO3-
实验11-2
向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。
现象
分析
溶液变浑浊
Na2CO3
+
Ca(OH)2
==
CaCO3↓+
2NaOH
NaOH的工业制取
纯碱Na2CO3和熟石灰Ca(OH)2制取烧碱
Na2CO3
+
Ca(OH)2
==
CaCO3↓+
2NaOH
由纯碱制烧碱
纯碱
烧碱
(2)与碱反应
补充资料1:说到纯碱,我们一定要记得一位我国化学史上的科学家——侯德榜,希望大家课后去查查关于他的资料,碳酸钠为何叫纯碱呢?
侯德榜(1890~1974)
侯德榜,中国化学家,“侯氏制碱法”的创始人。侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,他为发展小化肥工业所做的贡献。1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,毅然放弃自己热爱的制革专业,回到祖国。
(候氏制碱法)反应分三步进行
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3=Na2CO3+H2O+CO2↑
△
补充资料2:溶洞、钟乳石、石笋和石柱的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑
当堂检测反馈
1、目前从海水中提取食盐的方法主要是利用海水晒盐,它所利用的物质分离方法是(
)
A、溶解法
B、过滤法
C、结晶法
D、蒸馏法
C
2、根据物质的性质,下列物质允许带上客车的是(
)
A、白磷
B、鞭炮
C、酒精
D、食盐
D
3、图是某精制碘盐包装袋上的部分文字。根据该文字判断,下列有关猜测正确的是(
)
A、精制碘盐是一种纯净物
B、碘盐中的碘指的是碘元素
C、碘盐由碘和盐组成
D、一袋碘盐中含氯化钠500g
B
4、下列实验中都要用到玻璃棒,其中玻璃棒的作用相同的是(
)
B
A、①和②
B、②和③
C、②和④
D、③和④
5、请从一氧化碳、氮气、食盐、熟石灰四种物质中选择适当的物质用化学式填空:
(1)用作粮食瓜果保护气的是
;
(2)日常生活中用来调味和防腐的
;
(3)农业上用来配制农药波尔多液的是
;
(4)工业上用来冶炼金属的气体氧化物是
。
N2
NaCl
Ca(OH)2
CO
6、为了测定粗盐中氯化钠(混有少量的泥沙及不溶性杂质)的纯度,进行如下实验:
(1)主要的实验步骤有:a.溶解;b.称量;c.过滤;d.计算;e.蒸发
正确的操作顺序是
。
A、abcde
B、bcaed
C、bacebd
D、bdaec
C
B
(2)蒸发时有如下注意事项,你认为错误的是
(填代号)
A、将澄清的滤液全部注入蒸发皿
B、蒸发皿必须放在石棉网上加热
C、加热时用玻璃棒不断搅拌,防止滤液溅出
D、当蒸发皿中出现较多固体时,停止加热
(3)某同学实验后,计算出氯化钠的纯度大于100%,分析引起错误的两点原因可能是
;
。
(4)某同学要配制1000g生理盐水,他要称取
g食盐,量取
mL水。
蒸发时水未完全蒸干
称量错误或计算错误
9
991
本节课作业:
学习新策略:
P151-152
再见
同课章节目录
