2020-2021学年鲁教版初中化学九年级下册第八单元第二节 海水“晒盐” 课件(共19张PPT)
文档属性
| 名称 | 2020-2021学年鲁教版初中化学九年级下册第八单元第二节 海水“晒盐” 课件(共19张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-17 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
九年级
化学下册
8.2
海水晒盐
(
粗盐提纯)
粗盐
粗盐中的杂质一:
难溶杂质
(泥沙等)
精盐
活动一、粗盐的简单提纯
实验目的:除去粗盐中混有的泥沙
实验步骤:
粗盐
溶解
过滤
蒸发结晶
产品
烧杯、玻璃棒
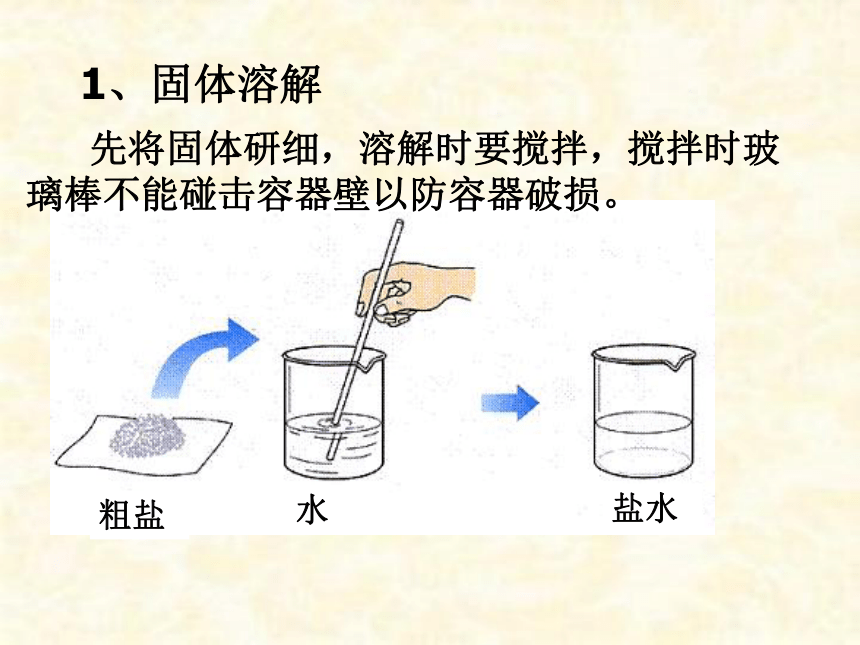
1、固体溶解
先将固体研细,溶解时要搅拌,搅拌时玻璃棒不能碰击容器壁以防容器破损。
水
盐水
粗盐
注:滤液浑浊应再过滤一次
2、过滤:
“一贴”:
滤纸紧贴漏斗的内壁,中间不留有气泡
(操作时要用手压住,用水润湿)
“二低”:
1、滤纸的边缘低于漏斗口
2、漏斗里的液体低于滤纸边缘
“三靠”:
1、倾倒液体的烧杯尖口要紧靠玻璃棒,
2、玻璃棒的末端轻靠在三层滤纸的一边,
3、漏斗下端的管口靠烧杯内壁。
蒸发操作
①蒸发的目的是什么?
②蒸发操作需要哪些仪器?
③蒸发操作时的注意事项?
1、蒸发过程中要用玻棒不断搅拌。
2、加热至有大量晶体析出时,应停止加热,利用余温使滤液蒸干,也要继续搅拌。
3、加入的液体不超过蒸发皿容积的2/3。
4、热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
除去溶液中的溶剂,使溶质析出
铁架台(带铁圈)、蒸发皿、酒精灯、玻璃棒
3、蒸发
你认为通过上述操作得到的是比较纯的氯化钠吗?可能还有什么杂质没有除去?
想一想
海水中溶解的主要离子:
Cl-、Na+、SO42-、Mg2+、Ca2+
粗盐中的杂质二:
可溶杂质
Na2SO4、MgCl2、CaCl2
利用什么试剂除去粗盐中的可溶性杂质CaCl2
、MgCl2及一些硫酸盐(Na2SO4)杂质
?
一些物质的溶解性
资料:
OH-
Cl-
SO4
2-
CO3
2-
H+
溶、挥
溶
溶、挥
Na+
溶
溶
溶
溶
Ca2+
微
溶
微
不
Ba2+
溶
溶
不
不
Mg2+
不
溶
溶
微
试一试:
杂?
质
加入的试剂
化学方程式
硫酸盐
(Na2SO4)
MgCl2
CaCl2
过量的BaCl2溶液
过量的NaOH溶液
过量的Na2CO3溶液
BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
活动二、粗盐的精确提纯
粗盐的精确提纯
除去可溶性杂质:Na2SO4、
MgCl2、CaCl2
除去Na2SO4,(BaCl2过量引入新的杂质BaCl2)
除去MgCl2,(NaOH过量引入新的杂质NaOH)
除去CaCl2
,(Na2CO3过量引入新的杂质Na2CO3)
除去过量的NaOH和过量的Na2CO3
BaCl2+Na2CO3=BaCO3↓+2NaCl
和过量的BaCl2
√
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2
粗盐
溶
解
过量BaCl2
溶液
过量NaOH
溶液
过量Na2CO3
溶液
过滤
沉淀
滤液
稀盐酸
蒸发、结晶
精盐
在BaCl2溶液后面加入
(HCl)
加入除杂试剂的顺序可以是:
1.BaCl2→NaOH
→Na2CO3
→
HCl
过滤
注意
☆先加BaCl2溶液,后加Na2CO3溶液
☆稀盐酸在过滤后加入
2.
BaCl2→
Na2CO3
→
NaOH
→
HCl
过滤
3.
NaOH
→BaCl2→
Na2CO3
→
HCl
过滤
化学除杂
1、除杂方法
转化成气体
2H+
+
CO32-
=
H2O
+
CO2
转化成沉淀
转化成水
H+
+
OH-
=
H2O
CaCO3、BaCO3、BaSO4、Mg(OH)2等
2、除杂原则:
1)除杂试剂只与杂质反应,不引入新杂质
2)除杂试剂要过量,过量试剂要除尽
3)要考虑设计所加试剂的先后顺序
我的收获是?
1、从海水得到的粗盐,往往含有可溶性杂质(主要有Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活。粗盐提纯的部分流程如下:
请回答:(1)操作②中的物质X为________,正确的操作顺序为________(填序号),为最终获得精盐,操作①、②和③后还需增加的操作是___;
(2)滤液二中加入适量稀盐酸的目的是__________________________________________________。
粗盐
溶解过滤
不溶性杂质
滤液一
操作?、?、?
滤液二
适量盐酸
调至pH=7
气体
NaCl溶液
蒸发结晶
精盐
其中,滤液一→滤液二之间需进行三步操作:
操作①:加入过量Na2CO3,除去滤液中的Ca2+
操作②:加入过量X,除去滤液中的Mg2+
操作③:加入过量BaCl2,除去滤液中的SO42-
[点击中考试题]
NaOH
过滤
除去过量的NaOH和Na2CO3
???或???或???
2、除去下列物质中的少量杂质(括号内为杂质)的方法错误的是( )
A.O2(H2O)—用生石灰
B.NaCl溶液(KNO3)—降温结晶
C.CaCO3粉末(Na2CO3)—加水过滤
D.KCl溶液(K2CO3)加适量盐酸
B
3、某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):
根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是_____________。
(2)第⑤步操作的名称是_____________。
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、_______、_______。
(4)实验中加入“Na2CO3溶液”的目的是
(5)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号):_____________。
加速溶解
过滤
蒸发皿
酒精灯
除去CaCl2和过量的BaCl2
BaCl2、Na2CO3、NaOH
4、粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。
⑴仪器B的名称是
,在实验中用得最多的仪器是
(填序号)。
⑵称量食盐应放在仪器A的
盘,蒸发时防止液滴飞溅的操作是
。
⑶“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为
(填序号)。
漏斗
F
左
用玻璃棒不断搅拌
??④①
祝大家开心快乐!
九年级
化学下册
8.2
海水晒盐
(
粗盐提纯)
粗盐
粗盐中的杂质一:
难溶杂质
(泥沙等)
精盐
活动一、粗盐的简单提纯
实验目的:除去粗盐中混有的泥沙
实验步骤:
粗盐
溶解
过滤
蒸发结晶
产品
烧杯、玻璃棒
1、固体溶解
先将固体研细,溶解时要搅拌,搅拌时玻璃棒不能碰击容器壁以防容器破损。
水
盐水
粗盐
注:滤液浑浊应再过滤一次
2、过滤:
“一贴”:
滤纸紧贴漏斗的内壁,中间不留有气泡
(操作时要用手压住,用水润湿)
“二低”:
1、滤纸的边缘低于漏斗口
2、漏斗里的液体低于滤纸边缘
“三靠”:
1、倾倒液体的烧杯尖口要紧靠玻璃棒,
2、玻璃棒的末端轻靠在三层滤纸的一边,
3、漏斗下端的管口靠烧杯内壁。
蒸发操作
①蒸发的目的是什么?
②蒸发操作需要哪些仪器?
③蒸发操作时的注意事项?
1、蒸发过程中要用玻棒不断搅拌。
2、加热至有大量晶体析出时,应停止加热,利用余温使滤液蒸干,也要继续搅拌。
3、加入的液体不超过蒸发皿容积的2/3。
4、热的蒸发皿不可直接放在实验桌上,要垫上石棉网。
除去溶液中的溶剂,使溶质析出
铁架台(带铁圈)、蒸发皿、酒精灯、玻璃棒
3、蒸发
你认为通过上述操作得到的是比较纯的氯化钠吗?可能还有什么杂质没有除去?
想一想
海水中溶解的主要离子:
Cl-、Na+、SO42-、Mg2+、Ca2+
粗盐中的杂质二:
可溶杂质
Na2SO4、MgCl2、CaCl2
利用什么试剂除去粗盐中的可溶性杂质CaCl2
、MgCl2及一些硫酸盐(Na2SO4)杂质
?
一些物质的溶解性
资料:
OH-
Cl-
SO4
2-
CO3
2-
H+
溶、挥
溶
溶、挥
Na+
溶
溶
溶
溶
Ca2+
微
溶
微
不
Ba2+
溶
溶
不
不
Mg2+
不
溶
溶
微
试一试:
杂?
质
加入的试剂
化学方程式
硫酸盐
(Na2SO4)
MgCl2
CaCl2
过量的BaCl2溶液
过量的NaOH溶液
过量的Na2CO3溶液
BaCl2+Na2SO4=BaSO4↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
活动二、粗盐的精确提纯
粗盐的精确提纯
除去可溶性杂质:Na2SO4、
MgCl2、CaCl2
除去Na2SO4,(BaCl2过量引入新的杂质BaCl2)
除去MgCl2,(NaOH过量引入新的杂质NaOH)
除去CaCl2
,(Na2CO3过量引入新的杂质Na2CO3)
除去过量的NaOH和过量的Na2CO3
BaCl2+Na2CO3=BaCO3↓+2NaCl
和过量的BaCl2
√
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2
粗盐
溶
解
过量BaCl2
溶液
过量NaOH
溶液
过量Na2CO3
溶液
过滤
沉淀
滤液
稀盐酸
蒸发、结晶
精盐
在BaCl2溶液后面加入
(HCl)
加入除杂试剂的顺序可以是:
1.BaCl2→NaOH
→Na2CO3
→
HCl
过滤
注意
☆先加BaCl2溶液,后加Na2CO3溶液
☆稀盐酸在过滤后加入
2.
BaCl2→
Na2CO3
→
NaOH
→
HCl
过滤
3.
NaOH
→BaCl2→
Na2CO3
→
HCl
过滤
化学除杂
1、除杂方法
转化成气体
2H+
+
CO32-
=
H2O
+
CO2
转化成沉淀
转化成水
H+
+
OH-
=
H2O
CaCO3、BaCO3、BaSO4、Mg(OH)2等
2、除杂原则:
1)除杂试剂只与杂质反应,不引入新杂质
2)除杂试剂要过量,过量试剂要除尽
3)要考虑设计所加试剂的先后顺序
我的收获是?
1、从海水得到的粗盐,往往含有可溶性杂质(主要有Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活。粗盐提纯的部分流程如下:
请回答:(1)操作②中的物质X为________,正确的操作顺序为________(填序号),为最终获得精盐,操作①、②和③后还需增加的操作是___;
(2)滤液二中加入适量稀盐酸的目的是__________________________________________________。
粗盐
溶解过滤
不溶性杂质
滤液一
操作?、?、?
滤液二
适量盐酸
调至pH=7
气体
NaCl溶液
蒸发结晶
精盐
其中,滤液一→滤液二之间需进行三步操作:
操作①:加入过量Na2CO3,除去滤液中的Ca2+
操作②:加入过量X,除去滤液中的Mg2+
操作③:加入过量BaCl2,除去滤液中的SO42-
[点击中考试题]
NaOH
过滤
除去过量的NaOH和Na2CO3
???或???或???
2、除去下列物质中的少量杂质(括号内为杂质)的方法错误的是( )
A.O2(H2O)—用生石灰
B.NaCl溶液(KNO3)—降温结晶
C.CaCO3粉末(Na2CO3)—加水过滤
D.KCl溶液(K2CO3)加适量盐酸
B
3、某校化学活动小组查阅资料发现,粗盐中除NaCl外,还含有MgCl2、CaCl2、MgSO4以及泥沙等杂质。他们要除去杂质得到精盐,设计了下列实验方案(序号①~⑧表示实验操作,用于沉淀的试剂稍过量):
根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是_____________。
(2)第⑤步操作的名称是_____________。
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、_______、_______。
(4)实验中加入“Na2CO3溶液”的目的是
(5)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号):_____________。
加速溶解
过滤
蒸发皿
酒精灯
除去CaCl2和过量的BaCl2
BaCl2、Na2CO3、NaOH
4、粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。
⑴仪器B的名称是
,在实验中用得最多的仪器是
(填序号)。
⑵称量食盐应放在仪器A的
盘,蒸发时防止液滴飞溅的操作是
。
⑶“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为
(填序号)。
漏斗
F
左
用玻璃棒不断搅拌
??④①
祝大家开心快乐!
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
