2021年中考化学三轮复习学案 常见的酸和pH
文档属性
| 名称 | 2021年中考化学三轮复习学案 常见的酸和pH |
|
|
| 格式 | doc | ||
| 文件大小 | 132.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-17 15:25:51 | ||
图片预览



文档简介
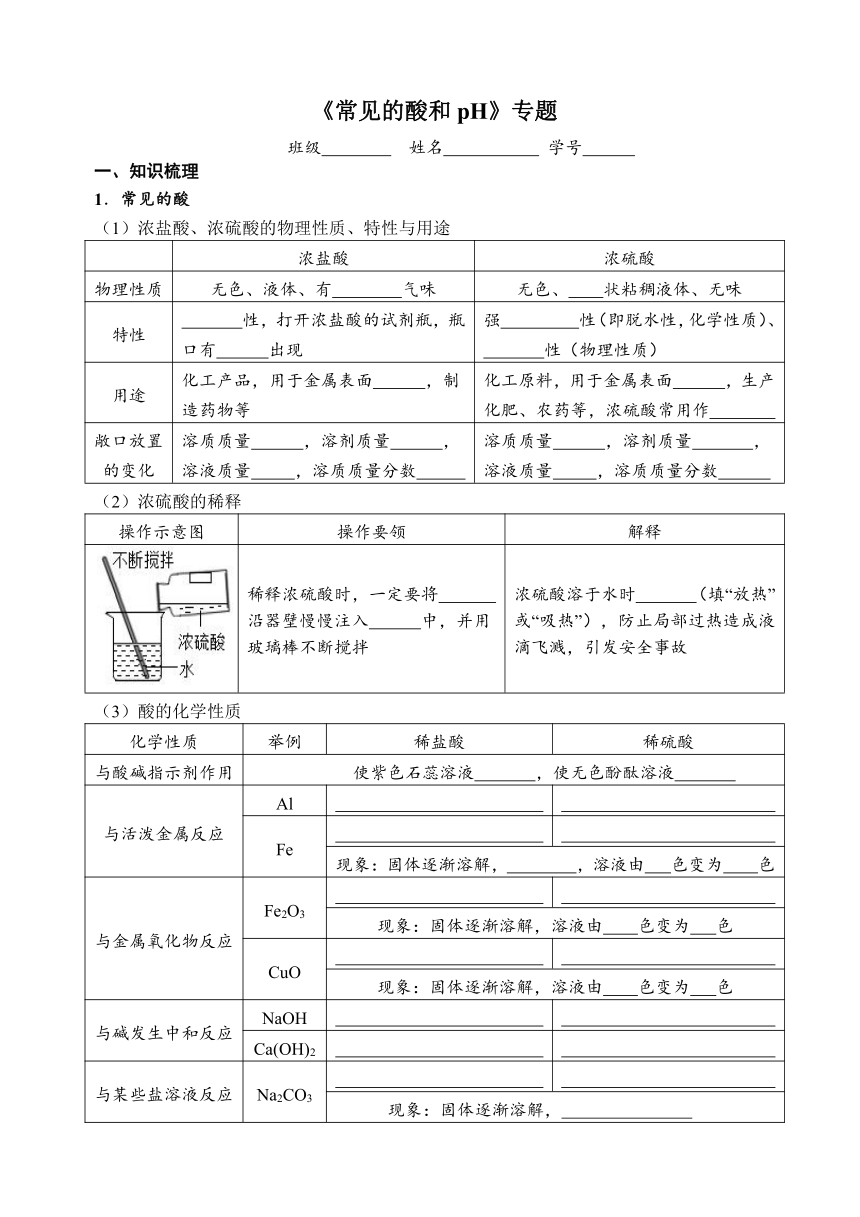
《常见的酸和pH》专题
班级 姓名 学号
知识梳理
1.常见的酸
(1)浓盐酸、浓硫酸的物理性质、特性与用途
浓盐酸 浓硫酸
物理性质 无色、液体、有 气味 无色、 状粘稠液体、无味
特性 性,打开浓盐酸的试剂瓶,瓶口有 出现 强 性(即脱水性,化学性质)、
性(物理性质)
用途 化工产品,用于金属表面 ,制造药物等 化工原料,用于金属表面 ,生产化肥、农药等,浓硫酸常用作
敞口放置的变化 溶质质量 ,溶剂质量 ,溶液质量 ,溶质质量分数 溶质质量 ,溶剂质量 ,溶液质量 ,溶质质量分数
(2)浓硫酸的稀释
操作示意图 操作要领 解释
稀释浓硫酸时,一定要将 沿器壁慢慢注入 中,并用玻璃棒不断搅拌 浓硫酸溶于水时 (填“放热”或“吸热”),防止局部过热造成液滴飞溅,引发安全事故
酸的化学性质
化学性质 举例 稀盐酸 稀硫酸
与酸碱指示剂作用 使紫色石蕊溶液 ,使无色酚酞溶液
与活泼金属反应 Al
Fe
现象:固体逐渐溶解, ,溶液由 色变为 色
与金属氧化物反应 Fe2O3
现象:固体逐渐溶解,溶液由 色变为 色
CuO
现象:固体逐渐溶解,溶液由 色变为 色
与碱发生中和反应 NaOH
Ca(OH)2
与某些盐溶液反应 Na2CO3
现象:固体逐渐溶解,
2.常见的酸碱指示剂和pH
(1)常见的酸碱指示剂:
酸性 中性 碱性
石蕊试液 色 色 色
酚酞试液 色 无色 色
(2)酸碱度的表示方法—pH:
①pH与酸碱性的关系:
pH<7,显 性,且pH越小, 性越 ;
pH=7,显 性;
pH>7,显 性,且pH越大, 性越 。
②pH的测定方法:
最简便的方法是使用 。测定时,用 蘸取待测试液滴到 上,把试纸显示的颜色与 对照,读出pH。
③应用:
pH 的降雨为酸雨,正常雨水的pH≈5.6的原因是 (用化学方程式表示)。
考点透视
考点1 常见酸的性质和用途
例1 在①氧化铁②金属锌③氢氧化铜④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )
A.①②③④ B.①②③ C.①③④ D.②③④
例2 下列化学方程式书写都存在问题,请改正:
2Fe+6HCl==2FeCl3+3H2↑
(2)Al+2HCl==AlCl2+H2↑
例3 学了酸的化学性质后,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若想实现①,需要加入的试剂是 。
(2)若用Cu(OH)2实现②,会得到 色溶液。
(3)若想实现③,得到浅绿色溶液,选用的单质是 (填物质名称)。
(4)若想实现④,得到黄色溶液,可选用的金属氧化物是
(填化学式),利用该性质,生活中可用稀硫酸 。
(5)若选用BaCl2溶液实现⑤,此反应的化学方程式为 ,基本反应类型为 反应。
考点2 溶液的酸碱性和pH
例4 某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是( )
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将pH试纸放入该物质的稀溶液中测其pH
D.向该物质的水溶液中滴加稀盐酸,溶液的pH一定变小
例5 某学习小组用黑枸杞提取液作了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
颜色 粉红 粉红 粉红 浅紫 浅紫 紫 紫 蓝 蓝 深蓝 深蓝 灰绿 黄 黄棕
(1)测定pH所需的实验用品有pH试纸、标准比色卡、玻璃片、剪刀和 。用剪刀将pH试纸剪成小片而不用手撕的原因是 。
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。
实验结果如下:
物质 稀盐酸 牛奶 蒸馏水 炉具清洁剂
颜色 粉红 紫 紫 黄
回答下列问题:
(2)炉具清洁剂的pH为 。
(3)根据实验现象,不能确定牛奶呈中性的理由是 。
(4)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴人稀盐酸至过量,观察到的实验现象为 。
三、课堂训练
1.下列物质的溶液能使无色酚酞变红色的是( )
A.醋酸 B.氨水 C.蔗糖 D.食盐
2.下列关于硫酸的认识,正确的是( )
A.组成:硫酸溶液中H+和SO42﹣的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
3.下列现象描述错误的是( )
A.打开盛有浓盐酸的试剂瓶瓶盖,出现白雾
B.CO2通入紫色石蕊溶液,溶液变蓝
C.将浓硫酸滴到白纸上,白纸变黑
D.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
4.证据推理是化学学科核心素养的重要内容,下列推理正确的是( )
A.酸雨的pH<7,所以pH<7的雨水一定是酸雨
B.酸性溶液不能使无色酚酞试液变色,所以不能使无色酚酞变色的溶液一定显酸性
C.酸在水溶液中会解离出H+,所以在水溶液中解离出H+的化合物一定是酸
D.碱性溶液能使无色酚酞试液变红色,所以碳酸钠溶液也能使无色酚酞试液变红色
5.某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定土壤酸碱度。以下三种取样位置设定合理的是 。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在 上,将其呈现的颜色与标准比色卡比色,确定了空地土壤的pH约为7。查阅资料,常见作物最适宜生长的土壤pH范围如下表,则这块空地上适合种植的作物有 。
作物 大蒜 丝瓜 茄子 沙枣
最适pH范围 5.6~6.0 6.0~6.5 6.8~7.3 8.0~8.7
6.某化学兴趣小组为验证酸的通性,做了以下5组实验,请分析并回答问题:
【演示实验】
【提出质疑】实验③没有明显现象,甲同学对该实验是否发生化学反应提出质疑,并设计了以下实验进行验证。
【实验探究】
实验方案 实验操作 实验现象 实验结论
一 测定氢氧化钠溶液的pH=a,滴加稀盐酸后测得溶液pH=b(忽略体积的变化) a b
(填“>”、“<”或“=”) 发生了反应
二 向实验③所得混合溶液中加入硝酸银溶液 有白色沉淀产生 发生了反应
【评价交流】乙同学认为甲同学的验证实验中方案二不可行,理由是 。
【拓展延伸】演示实验中有一组没有验证酸的通性,该组是 (填序号)。请你补充一个演示实验(不改变反应物的类别)完整验证酸的通性,该实验的化学方程式为 。
参考答案
一、知识梳理
1.(1)
浓盐酸 浓硫酸
物理性质 无色、液体、有刺激性气味 无色、油状粘稠液体、无味
特性 挥发 性,打开浓盐酸的试剂瓶,瓶口有 白雾 出现 强 腐蚀 性(即脱水性,化学性质)、
吸水 性(物理性质)
用途 化工产品,用于金属表面除锈,制造药物等 化工原料,用于金属表面 除锈 ,生产化肥、农药等,浓硫酸常用作 干燥剂
敞口放置的变化 溶质质量减小 ,溶剂质量 不变 ,溶液质量减小,溶质质量分数 减小 溶质质量不变 ,溶剂质量增大 ,溶液质量 增大,溶质质量分数减小
(2)
操作示意图 操作要领 解释
稀释浓硫酸时,一定要将 浓硫酸 沿器壁慢慢注入水 中,并用玻璃棒不断搅拌 浓硫酸溶于水时 放热 (填“放热”或“吸热”),防止局部过热造成液滴飞溅,引发安全事故
(3)
化学性质 举例 稀盐酸 稀硫酸
与酸碱指示剂作用 使紫色石蕊溶液 变红 ,使无色酚酞溶液不变色
与活泼金属反应 Al 2Al+6HCl==2AlCl3+3H2↑ 2Al+3H2SO4==Al2(SO4)3+3H2↑
Fe Fe+2HCl==FeCl2+H2↑ Fe+H2SO4==FeSO4+H2↑
现象:固体逐渐溶解,产生气泡,溶液由无色变为浅绿色
与金属氧化物反应 Fe2O3 Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
现象:固体逐渐溶解,溶液由 无 色变为黄色
CuO CuO+2HCl==CuCl2+H2O CuO+H2SO4==CuSO4+H2O
现象:固体逐渐溶解,溶液由无色变为蓝色
与碱发生中和反应 NaOH NaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O
Ca(OH)2 Ca(OH)2+2HCl==CaCl2+2H2O Ca(OH)2+H2SO4==CaSO4+2H2O
与某些盐溶液反应 Na2CO3 Na2CO3+2HCl==2NaCl+H2O+CO2↑ Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
现象:固体逐渐溶解, 产生气泡
2.(1)
酸性 中性 碱性
石蕊试液 红 色 紫 色 蓝色
酚酞试液 无 色 无色 红 色
(2)
①酸 酸 强 中 碱 碱 强
②pH试纸 玻璃棒 pH试纸 标准比色卡
③<5.6 CO2+H2O==H2CO3
二、考点透视
例1 B
例2
(1)Fe+2HCl==FeCl2+H2↑
(2)2Al+6HCl==2AlCl3+3H2↑
例3
紫色石蕊溶液
蓝
铁
Fe2O3 除铁锈
BaCl2+H2SO4== BaSO4↓+2HCl 复分解
例4 D
例5
玻璃棒 避免产生的杂质沾在试纸上影响测定结果
13
牛奶中滴加黑枸杞提取液后为紫色,而紫色对应的pH为6—7
有气泡产生,溶液由蓝色变为紫色,再变为粉红色
三、课堂训练
1.B
2.C
3.C
4.D
5.(1)B
(2)pH试纸 茄子
6.> 盐酸中含有氯离子,加入硝酸银溶液也可以反应生成氯化银沉淀 ④
Na2CO3+2HCl==2NaCl+H2O+CO2↑
班级 姓名 学号
知识梳理
1.常见的酸
(1)浓盐酸、浓硫酸的物理性质、特性与用途
浓盐酸 浓硫酸
物理性质 无色、液体、有 气味 无色、 状粘稠液体、无味
特性 性,打开浓盐酸的试剂瓶,瓶口有 出现 强 性(即脱水性,化学性质)、
性(物理性质)
用途 化工产品,用于金属表面 ,制造药物等 化工原料,用于金属表面 ,生产化肥、农药等,浓硫酸常用作
敞口放置的变化 溶质质量 ,溶剂质量 ,溶液质量 ,溶质质量分数 溶质质量 ,溶剂质量 ,溶液质量 ,溶质质量分数
(2)浓硫酸的稀释
操作示意图 操作要领 解释
稀释浓硫酸时,一定要将 沿器壁慢慢注入 中,并用玻璃棒不断搅拌 浓硫酸溶于水时 (填“放热”或“吸热”),防止局部过热造成液滴飞溅,引发安全事故
酸的化学性质
化学性质 举例 稀盐酸 稀硫酸
与酸碱指示剂作用 使紫色石蕊溶液 ,使无色酚酞溶液
与活泼金属反应 Al
Fe
现象:固体逐渐溶解, ,溶液由 色变为 色
与金属氧化物反应 Fe2O3
现象:固体逐渐溶解,溶液由 色变为 色
CuO
现象:固体逐渐溶解,溶液由 色变为 色
与碱发生中和反应 NaOH
Ca(OH)2
与某些盐溶液反应 Na2CO3
现象:固体逐渐溶解,
2.常见的酸碱指示剂和pH
(1)常见的酸碱指示剂:
酸性 中性 碱性
石蕊试液 色 色 色
酚酞试液 色 无色 色
(2)酸碱度的表示方法—pH:
①pH与酸碱性的关系:
pH<7,显 性,且pH越小, 性越 ;
pH=7,显 性;
pH>7,显 性,且pH越大, 性越 。
②pH的测定方法:
最简便的方法是使用 。测定时,用 蘸取待测试液滴到 上,把试纸显示的颜色与 对照,读出pH。
③应用:
pH 的降雨为酸雨,正常雨水的pH≈5.6的原因是 (用化学方程式表示)。
考点透视
考点1 常见酸的性质和用途
例1 在①氧化铁②金属锌③氢氧化铜④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )
A.①②③④ B.①②③ C.①③④ D.②③④
例2 下列化学方程式书写都存在问题,请改正:
2Fe+6HCl==2FeCl3+3H2↑
(2)Al+2HCl==AlCl2+H2↑
例3 学了酸的化学性质后,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若想实现①,需要加入的试剂是 。
(2)若用Cu(OH)2实现②,会得到 色溶液。
(3)若想实现③,得到浅绿色溶液,选用的单质是 (填物质名称)。
(4)若想实现④,得到黄色溶液,可选用的金属氧化物是
(填化学式),利用该性质,生活中可用稀硫酸 。
(5)若选用BaCl2溶液实现⑤,此反应的化学方程式为 ,基本反应类型为 反应。
考点2 溶液的酸碱性和pH
例4 某物质能使紫色石蕊溶液变为蓝色,关于该物质的下列说法中正确的是( )
A.该物质可能是氢氧化铜
B.该物质一定是纯碱的水溶液
C.可以将pH试纸放入该物质的稀溶液中测其pH
D.向该物质的水溶液中滴加稀盐酸,溶液的pH一定变小
例5 某学习小组用黑枸杞提取液作了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
颜色 粉红 粉红 粉红 浅紫 浅紫 紫 紫 蓝 蓝 深蓝 深蓝 灰绿 黄 黄棕
(1)测定pH所需的实验用品有pH试纸、标准比色卡、玻璃片、剪刀和 。用剪刀将pH试纸剪成小片而不用手撕的原因是 。
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。
实验结果如下:
物质 稀盐酸 牛奶 蒸馏水 炉具清洁剂
颜色 粉红 紫 紫 黄
回答下列问题:
(2)炉具清洁剂的pH为 。
(3)根据实验现象,不能确定牛奶呈中性的理由是 。
(4)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴人稀盐酸至过量,观察到的实验现象为 。
三、课堂训练
1.下列物质的溶液能使无色酚酞变红色的是( )
A.醋酸 B.氨水 C.蔗糖 D.食盐
2.下列关于硫酸的认识,正确的是( )
A.组成:硫酸溶液中H+和SO42﹣的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
3.下列现象描述错误的是( )
A.打开盛有浓盐酸的试剂瓶瓶盖,出现白雾
B.CO2通入紫色石蕊溶液,溶液变蓝
C.将浓硫酸滴到白纸上,白纸变黑
D.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
4.证据推理是化学学科核心素养的重要内容,下列推理正确的是( )
A.酸雨的pH<7,所以pH<7的雨水一定是酸雨
B.酸性溶液不能使无色酚酞试液变色,所以不能使无色酚酞变色的溶液一定显酸性
C.酸在水溶液中会解离出H+,所以在水溶液中解离出H+的化合物一定是酸
D.碱性溶液能使无色酚酞试液变红色,所以碳酸钠溶液也能使无色酚酞试液变红色
5.某同学要在一块空地上种植作物,于是对这块空地的土壤酸碱度进行测定。
(1)在空地上确定5~6个位置进行取样测定土壤酸碱度。以下三种取样位置设定合理的是 。
(2)将采集到的土样进行处理后,用玻璃棒蘸取土壤浸出液,滴在 上,将其呈现的颜色与标准比色卡比色,确定了空地土壤的pH约为7。查阅资料,常见作物最适宜生长的土壤pH范围如下表,则这块空地上适合种植的作物有 。
作物 大蒜 丝瓜 茄子 沙枣
最适pH范围 5.6~6.0 6.0~6.5 6.8~7.3 8.0~8.7
6.某化学兴趣小组为验证酸的通性,做了以下5组实验,请分析并回答问题:
【演示实验】
【提出质疑】实验③没有明显现象,甲同学对该实验是否发生化学反应提出质疑,并设计了以下实验进行验证。
【实验探究】
实验方案 实验操作 实验现象 实验结论
一 测定氢氧化钠溶液的pH=a,滴加稀盐酸后测得溶液pH=b(忽略体积的变化) a b
(填“>”、“<”或“=”) 发生了反应
二 向实验③所得混合溶液中加入硝酸银溶液 有白色沉淀产生 发生了反应
【评价交流】乙同学认为甲同学的验证实验中方案二不可行,理由是 。
【拓展延伸】演示实验中有一组没有验证酸的通性,该组是 (填序号)。请你补充一个演示实验(不改变反应物的类别)完整验证酸的通性,该实验的化学方程式为 。
参考答案
一、知识梳理
1.(1)
浓盐酸 浓硫酸
物理性质 无色、液体、有刺激性气味 无色、油状粘稠液体、无味
特性 挥发 性,打开浓盐酸的试剂瓶,瓶口有 白雾 出现 强 腐蚀 性(即脱水性,化学性质)、
吸水 性(物理性质)
用途 化工产品,用于金属表面除锈,制造药物等 化工原料,用于金属表面 除锈 ,生产化肥、农药等,浓硫酸常用作 干燥剂
敞口放置的变化 溶质质量减小 ,溶剂质量 不变 ,溶液质量减小,溶质质量分数 减小 溶质质量不变 ,溶剂质量增大 ,溶液质量 增大,溶质质量分数减小
(2)
操作示意图 操作要领 解释
稀释浓硫酸时,一定要将 浓硫酸 沿器壁慢慢注入水 中,并用玻璃棒不断搅拌 浓硫酸溶于水时 放热 (填“放热”或“吸热”),防止局部过热造成液滴飞溅,引发安全事故
(3)
化学性质 举例 稀盐酸 稀硫酸
与酸碱指示剂作用 使紫色石蕊溶液 变红 ,使无色酚酞溶液不变色
与活泼金属反应 Al 2Al+6HCl==2AlCl3+3H2↑ 2Al+3H2SO4==Al2(SO4)3+3H2↑
Fe Fe+2HCl==FeCl2+H2↑ Fe+H2SO4==FeSO4+H2↑
现象:固体逐渐溶解,产生气泡,溶液由无色变为浅绿色
与金属氧化物反应 Fe2O3 Fe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
现象:固体逐渐溶解,溶液由 无 色变为黄色
CuO CuO+2HCl==CuCl2+H2O CuO+H2SO4==CuSO4+H2O
现象:固体逐渐溶解,溶液由无色变为蓝色
与碱发生中和反应 NaOH NaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O
Ca(OH)2 Ca(OH)2+2HCl==CaCl2+2H2O Ca(OH)2+H2SO4==CaSO4+2H2O
与某些盐溶液反应 Na2CO3 Na2CO3+2HCl==2NaCl+H2O+CO2↑ Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
现象:固体逐渐溶解, 产生气泡
2.(1)
酸性 中性 碱性
石蕊试液 红 色 紫 色 蓝色
酚酞试液 无 色 无色 红 色
(2)
①酸 酸 强 中 碱 碱 强
②pH试纸 玻璃棒 pH试纸 标准比色卡
③<5.6 CO2+H2O==H2CO3
二、考点透视
例1 B
例2
(1)Fe+2HCl==FeCl2+H2↑
(2)2Al+6HCl==2AlCl3+3H2↑
例3
紫色石蕊溶液
蓝
铁
Fe2O3 除铁锈
BaCl2+H2SO4== BaSO4↓+2HCl 复分解
例4 D
例5
玻璃棒 避免产生的杂质沾在试纸上影响测定结果
13
牛奶中滴加黑枸杞提取液后为紫色,而紫色对应的pH为6—7
有气泡产生,溶液由蓝色变为紫色,再变为粉红色
三、课堂训练
1.B
2.C
3.C
4.D
5.(1)B
(2)pH试纸 茄子
6.> 盐酸中含有氯离子,加入硝酸银溶液也可以反应生成氯化银沉淀 ④
Na2CO3+2HCl==2NaCl+H2O+CO2↑
同课章节目录
