2020-2021学年高一化学人教版必修2第三章第三节生活中两种常见的有机物--乙醇(共25张PPT)
文档属性
| 名称 | 2020-2021学年高一化学人教版必修2第三章第三节生活中两种常见的有机物--乙醇(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 857.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-16 00:00:00 | ||
图片预览








文档简介
第三章 有机化合物
第三节 生活中两种常见的有机物
乙醇
1.白日放歌须纵___,青春作伴好还乡。
2.明月几时有,把___问青天。
3.借问_____何处有,牧童遥指杏花村。
4.何以解忧,唯有_____。
酒
酒
酒家
杜康
古往今来无数咏叹酒的诗篇都证明酒是一种奇特而富有魅力的饮料。那么同学们可知酒的主要化学成分是什么?它的分子式如何写?它有哪些主要性质和用途?
阅读教材,归纳总结乙醇的物理性质。
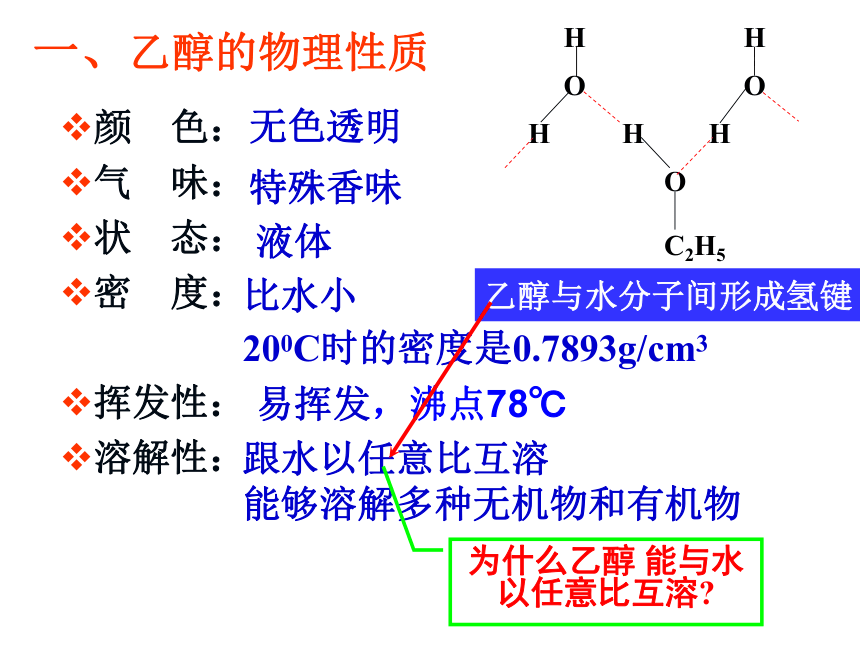
一、乙醇的物理性质
颜 色:
气 味:
状 态:
密 度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发,沸点78℃
为什么乙醇 能与水以任意比互溶?
H H
O O
H H H
O
C2H5
乙醇与水分子间形成氢键
工业酒精 约含乙醇96%以上(质量分数)
无水酒精 99.5%以上(质量分数)
医用酒精 75%(体积分数)
饮用酒 视度数而定体积分数。
啤酒的度数指麦芽含量
⑵ 如何检验酒精是否含水?
用工业酒精与新制生石灰混合蒸馏,可得无水酒精。
用无水硫酸铜检验
⑴ 如何由工业酒精制取无水酒精?
【问题】
小常识
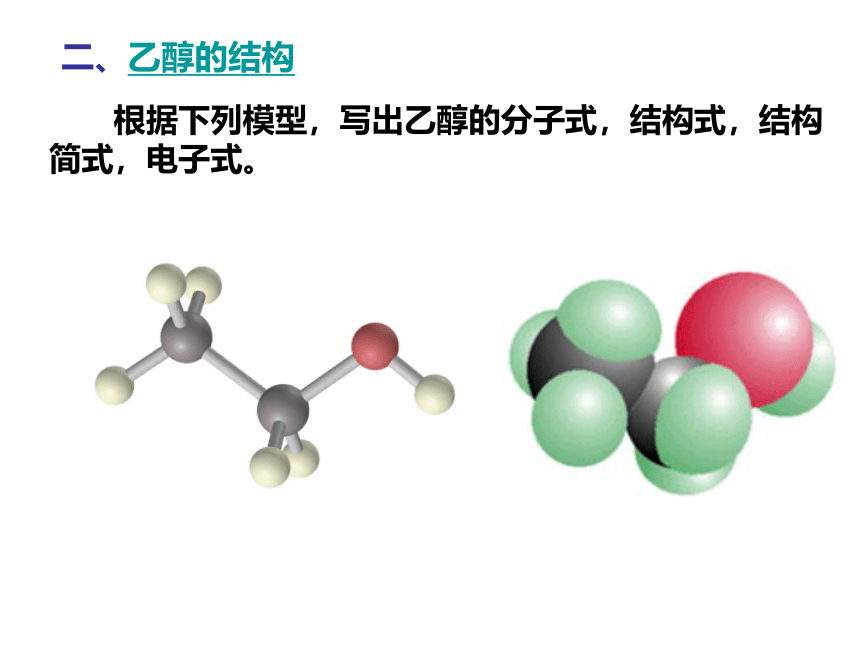
二、乙醇的结构
根据下列模型,写出乙醇的分子式,结构式,结构简式,电子式。
结构式:
H-C-C-O-H
-
H
-
H
-
-
H
H
结构简式:
CH3CH2OH
或C2H5OH
分子式:
C2H6O
电子式:
羟基:-OH
烃的衍生物:
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物
二.分子结构
C—C—O—H
H
H
H
H
H
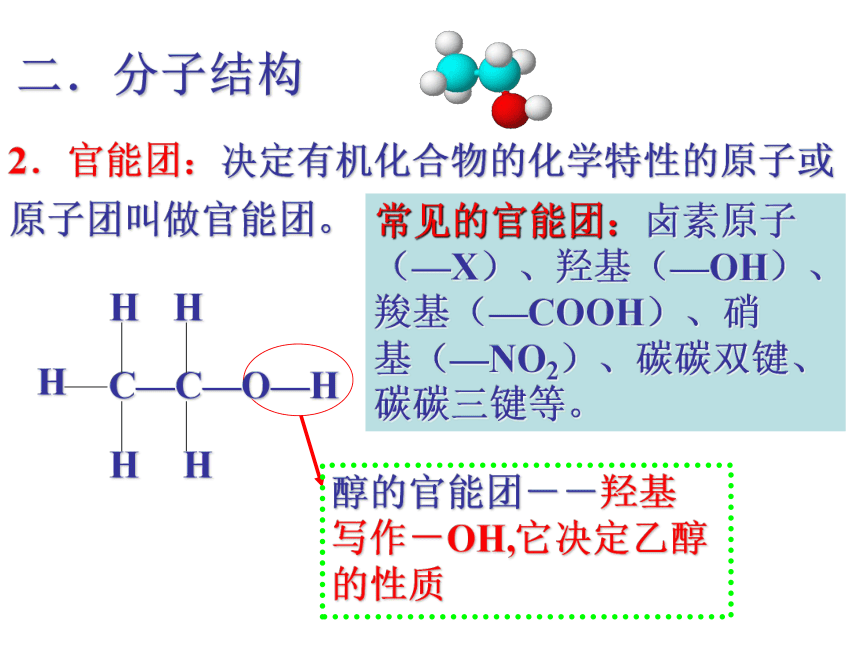
醇的官能团--羟基
写作-OH,它决定乙醇的性质
二.分子结构
C—C—O—H
H
H
H
H
H
醇的官能团--羟基
写作-OH,它决定乙醇的性质
2.官能团:决定有机化合物的化学特性的原子或原子团叫做官能团。
常见的官能团:卤素原子(—X)、羟基(—OH)、羧基(—COOH)、硝
基(—NO2)、碳碳双键、碳碳三键等。
(3)实例。
物 质
官能团符号
官能团名称
是否为烃的衍生物
CH3Cl
_____
_______
___
CH3CH2OH
_____
_____
___
_____
_____
___
CH2=CH2
_______
_________
_____
—Cl
氯原子
是
—OH
羟基
是
—NO2
硝基
是
碳碳双键
不是
练习
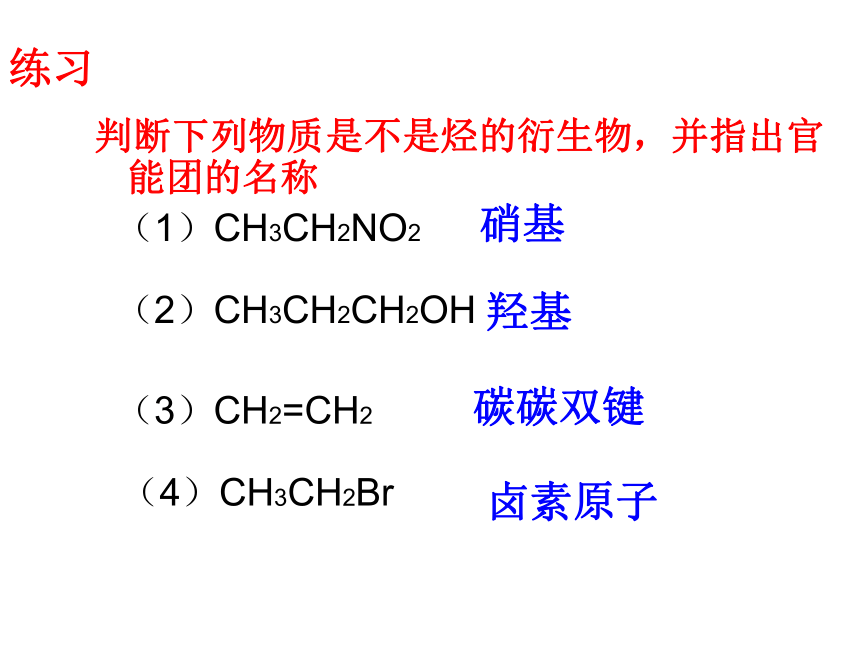
判断下列物质是不是烃的衍生物,并指出官能团的名称
(1)CH3CH2NO2
(2)CH3CH2CH2OH
(3)CH2=CH2
(4)CH3CH2Br
羟基
碳碳双键
卤素原子
硝基
氢氧根OH-
羟基-OH
电子式
带电性
稳定性
存在
[ ]-
O H
·
·
·
·
×
·
·
×
O H
·
·
·
·
×
·
·
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
深入探究:羟基(-OH)和氢氧根(OH-)一样吗?有什么区别?
实验探究
在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有尖嘴导管的单孔塞,用小试管倒扣在导管头上,收集并验纯气体;然后点燃气体,并把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清的石灰水,观察实验现象。
项目
物质
金属钠的
变化
气体燃烧
现象
检验产物
水
乙醇
浮、游、熔、响
火焰呈淡蓝色
火焰呈淡蓝色
反应后的溶液加入酚酞,变红,说明有碱性物质生成
沉在底部,不熔成小球也不发出声响
干燥小烧杯有水珠,加入澄清石灰水无明显变化
想一想:实验现象说明了什么问题?
钠浮在水面上,而沉在乙醇中
水的密度>钠的密度>乙醇的密度
钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基中的H原子的活泼性:
乙醇的性质是由它的 决定的
结构
乙醇<水
钠与水的反应
乙醇与钠的反应
钠浮在水面上
钠沉在乙醇底部
钠熔化成小亮球
缓慢放出气泡
钠在水面来回游动
发出嘶嘶的响声
比较水、乙醇与钠反应
三 、乙醇的化学性质
1.与活泼金属反应(如Na、K、Mg、Al等)
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
该反应属于 反应。
取代
2、与卤化氢(HX)的反应
取代反应
注意断键的位置
CH3CH2—O—H + H—Br → CH3CH2—Br + H2O
△
三、化学性质
你知道吗?
在实验室和日常生活中酒精的最常见的用途是用作燃料和勾兑饮料酒。你能写出酒精燃烧的化学方程式吗?
你知道酒精在人体内是如何代谢的吗?
3.氧化反应
酒精燃料飞机
酒精火锅
a、燃烧(彻底氧化)
C2H5OH +3O2 → 2CO2+3H2O
点燃
现象:发出淡蓝色火焰,并放出大量热
铜丝放在酒精灯外焰灼烧,慢慢移向内焰,上下几次。观察铜丝的变化。
铜丝
外焰
变黑
变红
内焰
实验:把灼热的铜丝插入乙醇中,观察铜丝颜色变化,并小心闻试管中液体产生的气味。
铜丝
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
观看实验演示
2Cu + O2 2CuO
△
b、催化氧化
乙醛
Δ
C2H5OH+CuO CH3CHO+H2O+Cu
总反应方程式:
2C2H5OH+O2 2CH3CHO+2H2O
Cu
工业上利用该反应制取乙醛
△
反应历程
醇氧化机理:
①-③位断键
①
③
CH3—C—O—H
H
H
+ O=O
2
生成醛或酮
+ 2H2 O
—C=O
H
CH3
2
Cu
△
②
醇催化氧化机理:
练习:写出CH3CH2CH2OH发生催化氧化的反应方程式。
①-③位断键
①
③
R—C—O—H
H
H
+ O=O
2
醛
+ 2H2O
—C=O
H
R
2
Cu
△
连接-OH的碳原子上必须有H,才能发生催化氧化
[延伸拓展] 下列醇在Cu或Ag的作用下将如何催化氧化?
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛.
与-OH相连的C原子上有1个H原子的,氧化成酮.
与-OH相连的C原子上没有H原子的,不能催化氧化.
(2)乙醇的催化氧化(断键①③ )
2CH3CH2OH + O2 CH3CHO + 2H2O
(3)可直接被氧化为乙酸
2CH3CHO + O2 2CH3COOH
Cu或Ag
催化剂
∣
H—C—C—O—H
H
①
②
③
④
∣
∣
∣
H
H
H
⑤
CH3CH2OH CH2=CH2↑+H2O
浓H2SO4
170°
3.乙醇的消去反应
浓硫酸的作用:脱水剂,催化剂
∣
H—C—C—O—H
H
①
②
③
④
∣
∣
∣
H
H
H
⑤
1、发酵法
发酵法是制取乙醇的一种重要方法,所用原料是含糖类很丰富的各种农产品,如高梁、玉米、薯类以及多种野生的果实等,也常利用废糖蜜。这些物质经过发酵,再进行分馏,可以得到95%(质量分数)的乙醇。
2、乙烯水化法
以石油裂解产生的乙烯为原料,在加热、加压和有催化剂(硫酸或磷酸) 存在的条件下,使乙烯跟水反应,生成乙醇。这种方法叫做乙烯水化法。用乙烯水化法生产乙醇,成本低,产量大,能节约大量粮食,所以随着石油化工的发展,这种方法发展很快。
CH2=CH2+H2O CH3CH2OH
催化剂
加热加压
四、乙醇的工业制法
酶
C6H12O6 2CH3CH2OH + 2CO2 ↑
酶
五、乙醇的用途
用作燃料,如酒精灯等
制造饮料和香精,食品加工业
一种重要的有机化工原料,如制造乙酸、乙醚等。
乙醇又是一种有机溶剂,用于溶解树脂,制造涂料。
医疗上常用75%(体积分数)的酒精作消毒剂。
乙醇小结
1、分子结构( CH3CH2OH )及官能团 ( -OH )
2、重要化学性质:
A、与活泼金属发生取代反应产生H2 ;
B、和HX发生取代反应
C、燃烧(优质燃料);
催化氧化(制醛);
〖实验探究〗
1、向试管中加入1mL酸性重铬酸钾溶液,然后滴入0.5mL乙醇,振荡,观察现象
下列反应可以用来检验司机是否酒后驾车
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
2Cr2(SO4)3 + 3CH3-C-OH + 2K2SO4 + 11H2O
橙红色
蓝绿色
O=
上述反应中,被检测的气体是( ???????? ),氧化剂是_____________;氧化产物是________.
K2Cr2O7
CH3COOH
CH3CH2OH
2.下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过
分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用
乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾
兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子
深”的说法
3.在下列物质中,分别加入金属钠,不能产生氢气的是( )
A. 苯 B、蒸馏水
C、无水酒精 D、75%的酒精
A
A
4、比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子都以单键相连
B.分子里都含有6个相同的氢原子
C. 乙醇可以看成是乙烷分子中的一个氢原子被羟基
取代后的产物
D.乙醇与钠反应非常平缓,所以乙醇羟基上
的氢原子不如水中的氢原子活泼
B
5、将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加的是 ( )
A.硝酸 B.无水乙醇 C.石灰水 D.盐酸
c
6、能用来检验酒精中是否含有水的试剂是( )
A: CuSO4·5H2O B: 无水硫酸铜
C: 浓硫酸 D:金属钠
B
7:与钠反应时在何处断键( )
A: ① B: ②
C: ③ D: ④
C—C—O—H
H
H
H
H
H
①
②
④
③
A
乙醇可能的结构
思考:乙醇分子里的氢跟烃分子里的氢有不同吗?乙醇分子可能是哪一种结构呢?
活动二:实验探究
在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有针头的单孔塞,用小试管倒扣在针头之上,收集并验纯气体;然后点燃气体,并把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清的石灰水,观察实验现象。比较前面做过的水与钠反应的实验,完成下表。
经测定在0.1mol无水乙醇中加入足量的金属钠,收集到氢气1.12 L(标准状况)。根据以上能推断乙醇的结构是哪种吗?
练习:
实验测得,4.6克乙醇完全燃烧后只生成0.2molCO2和0.3molH2O,且乙醇蒸汽对H2的相对密度为23,求乙醇的分子式?
答案:C2H6O
第三节 生活中两种常见的有机物
乙醇
1.白日放歌须纵___,青春作伴好还乡。
2.明月几时有,把___问青天。
3.借问_____何处有,牧童遥指杏花村。
4.何以解忧,唯有_____。
酒
酒
酒家
杜康
古往今来无数咏叹酒的诗篇都证明酒是一种奇特而富有魅力的饮料。那么同学们可知酒的主要化学成分是什么?它的分子式如何写?它有哪些主要性质和用途?
阅读教材,归纳总结乙醇的物理性质。
一、乙醇的物理性质
颜 色:
气 味:
状 态:
密 度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小
200C时的密度是0.7893g/cm3
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发,沸点78℃
为什么乙醇 能与水以任意比互溶?
H H
O O
H H H
O
C2H5
乙醇与水分子间形成氢键
工业酒精 约含乙醇96%以上(质量分数)
无水酒精 99.5%以上(质量分数)
医用酒精 75%(体积分数)
饮用酒 视度数而定体积分数。
啤酒的度数指麦芽含量
⑵ 如何检验酒精是否含水?
用工业酒精与新制生石灰混合蒸馏,可得无水酒精。
用无水硫酸铜检验
⑴ 如何由工业酒精制取无水酒精?
【问题】
小常识
二、乙醇的结构
根据下列模型,写出乙醇的分子式,结构式,结构简式,电子式。
结构式:
H-C-C-O-H
-
H
-
H
-
-
H
H
结构简式:
CH3CH2OH
或C2H5OH
分子式:
C2H6O
电子式:
羟基:-OH
烃的衍生物:
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物
二.分子结构
C—C—O—H
H
H
H
H
H
醇的官能团--羟基
写作-OH,它决定乙醇的性质
二.分子结构
C—C—O—H
H
H
H
H
H
醇的官能团--羟基
写作-OH,它决定乙醇的性质
2.官能团:决定有机化合物的化学特性的原子或原子团叫做官能团。
常见的官能团:卤素原子(—X)、羟基(—OH)、羧基(—COOH)、硝
基(—NO2)、碳碳双键、碳碳三键等。
(3)实例。
物 质
官能团符号
官能团名称
是否为烃的衍生物
CH3Cl
_____
_______
___
CH3CH2OH
_____
_____
___
_____
_____
___
CH2=CH2
_______
_________
_____
—Cl
氯原子
是
—OH
羟基
是
—NO2
硝基
是
碳碳双键
不是
练习
判断下列物质是不是烃的衍生物,并指出官能团的名称
(1)CH3CH2NO2
(2)CH3CH2CH2OH
(3)CH2=CH2
(4)CH3CH2Br
羟基
碳碳双键
卤素原子
硝基
氢氧根OH-
羟基-OH
电子式
带电性
稳定性
存在
[ ]-
O H
·
·
·
·
×
·
·
×
O H
·
·
·
·
×
·
·
带负电的阴离子
电中性的原子团
稳定
不稳定
能独立存在于溶液或离子化合物中
不能单独存在,必须与其他原子或基结合
深入探究:羟基(-OH)和氢氧根(OH-)一样吗?有什么区别?
实验探究
在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有尖嘴导管的单孔塞,用小试管倒扣在导管头上,收集并验纯气体;然后点燃气体,并把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清的石灰水,观察实验现象。
项目
物质
金属钠的
变化
气体燃烧
现象
检验产物
水
乙醇
浮、游、熔、响
火焰呈淡蓝色
火焰呈淡蓝色
反应后的溶液加入酚酞,变红,说明有碱性物质生成
沉在底部,不熔成小球也不发出声响
干燥小烧杯有水珠,加入澄清石灰水无明显变化
想一想:实验现象说明了什么问题?
钠浮在水面上,而沉在乙醇中
水的密度>钠的密度>乙醇的密度
钠与乙醇的反应速率比钠与水的反应速率慢, 说明羟基中的H原子的活泼性:
乙醇的性质是由它的 决定的
结构
乙醇<水
钠与水的反应
乙醇与钠的反应
钠浮在水面上
钠沉在乙醇底部
钠熔化成小亮球
缓慢放出气泡
钠在水面来回游动
发出嘶嘶的响声
比较水、乙醇与钠反应
三 、乙醇的化学性质
1.与活泼金属反应(如Na、K、Mg、Al等)
乙醇钠
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
该反应属于 反应。
取代
2、与卤化氢(HX)的反应
取代反应
注意断键的位置
CH3CH2—O—H + H—Br → CH3CH2—Br + H2O
△
三、化学性质
你知道吗?
在实验室和日常生活中酒精的最常见的用途是用作燃料和勾兑饮料酒。你能写出酒精燃烧的化学方程式吗?
你知道酒精在人体内是如何代谢的吗?
3.氧化反应
酒精燃料飞机
酒精火锅
a、燃烧(彻底氧化)
C2H5OH +3O2 → 2CO2+3H2O
点燃
现象:发出淡蓝色火焰,并放出大量热
铜丝放在酒精灯外焰灼烧,慢慢移向内焰,上下几次。观察铜丝的变化。
铜丝
外焰
变黑
变红
内焰
实验:把灼热的铜丝插入乙醇中,观察铜丝颜色变化,并小心闻试管中液体产生的气味。
铜丝
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
观看实验演示
2Cu + O2 2CuO
△
b、催化氧化
乙醛
Δ
C2H5OH+CuO CH3CHO+H2O+Cu
总反应方程式:
2C2H5OH+O2 2CH3CHO+2H2O
Cu
工业上利用该反应制取乙醛
△
反应历程
醇氧化机理:
①-③位断键
①
③
CH3—C—O—H
H
H
+ O=O
2
生成醛或酮
+ 2H2 O
—C=O
H
CH3
2
Cu
△
②
醇催化氧化机理:
练习:写出CH3CH2CH2OH发生催化氧化的反应方程式。
①-③位断键
①
③
R—C—O—H
H
H
+ O=O
2
醛
+ 2H2O
—C=O
H
R
2
Cu
△
连接-OH的碳原子上必须有H,才能发生催化氧化
[延伸拓展] 下列醇在Cu或Ag的作用下将如何催化氧化?
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛.
与-OH相连的C原子上有1个H原子的,氧化成酮.
与-OH相连的C原子上没有H原子的,不能催化氧化.
(2)乙醇的催化氧化(断键①③ )
2CH3CH2OH + O2 CH3CHO + 2H2O
(3)可直接被氧化为乙酸
2CH3CHO + O2 2CH3COOH
Cu或Ag
催化剂
∣
H—C—C—O—H
H
①
②
③
④
∣
∣
∣
H
H
H
⑤
CH3CH2OH CH2=CH2↑+H2O
浓H2SO4
170°
3.乙醇的消去反应
浓硫酸的作用:脱水剂,催化剂
∣
H—C—C—O—H
H
①
②
③
④
∣
∣
∣
H
H
H
⑤
1、发酵法
发酵法是制取乙醇的一种重要方法,所用原料是含糖类很丰富的各种农产品,如高梁、玉米、薯类以及多种野生的果实等,也常利用废糖蜜。这些物质经过发酵,再进行分馏,可以得到95%(质量分数)的乙醇。
2、乙烯水化法
以石油裂解产生的乙烯为原料,在加热、加压和有催化剂(硫酸或磷酸) 存在的条件下,使乙烯跟水反应,生成乙醇。这种方法叫做乙烯水化法。用乙烯水化法生产乙醇,成本低,产量大,能节约大量粮食,所以随着石油化工的发展,这种方法发展很快。
CH2=CH2+H2O CH3CH2OH
催化剂
加热加压
四、乙醇的工业制法
酶
C6H12O6 2CH3CH2OH + 2CO2 ↑
酶
五、乙醇的用途
用作燃料,如酒精灯等
制造饮料和香精,食品加工业
一种重要的有机化工原料,如制造乙酸、乙醚等。
乙醇又是一种有机溶剂,用于溶解树脂,制造涂料。
医疗上常用75%(体积分数)的酒精作消毒剂。
乙醇小结
1、分子结构( CH3CH2OH )及官能团 ( -OH )
2、重要化学性质:
A、与活泼金属发生取代反应产生H2 ;
B、和HX发生取代反应
C、燃烧(优质燃料);
催化氧化(制醛);
〖实验探究〗
1、向试管中加入1mL酸性重铬酸钾溶液,然后滴入0.5mL乙醇,振荡,观察现象
下列反应可以用来检验司机是否酒后驾车
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
2Cr2(SO4)3 + 3CH3-C-OH + 2K2SO4 + 11H2O
橙红色
蓝绿色
O=
上述反应中,被检测的气体是( ???????? ),氧化剂是_____________;氧化产物是________.
K2Cr2O7
CH3COOH
CH3CH2OH
2.下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过
分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用
乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾
兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子
深”的说法
3.在下列物质中,分别加入金属钠,不能产生氢气的是( )
A. 苯 B、蒸馏水
C、无水酒精 D、75%的酒精
A
A
4、比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子都以单键相连
B.分子里都含有6个相同的氢原子
C. 乙醇可以看成是乙烷分子中的一个氢原子被羟基
取代后的产物
D.乙醇与钠反应非常平缓,所以乙醇羟基上
的氢原子不如水中的氢原子活泼
B
5、将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加的是 ( )
A.硝酸 B.无水乙醇 C.石灰水 D.盐酸
c
6、能用来检验酒精中是否含有水的试剂是( )
A: CuSO4·5H2O B: 无水硫酸铜
C: 浓硫酸 D:金属钠
B
7:与钠反应时在何处断键( )
A: ① B: ②
C: ③ D: ④
C—C—O—H
H
H
H
H
H
①
②
④
③
A
乙醇可能的结构
思考:乙醇分子里的氢跟烃分子里的氢有不同吗?乙醇分子可能是哪一种结构呢?
活动二:实验探究
在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有针头的单孔塞,用小试管倒扣在针头之上,收集并验纯气体;然后点燃气体,并把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清的石灰水,观察实验现象。比较前面做过的水与钠反应的实验,完成下表。
经测定在0.1mol无水乙醇中加入足量的金属钠,收集到氢气1.12 L(标准状况)。根据以上能推断乙醇的结构是哪种吗?
练习:
实验测得,4.6克乙醇完全燃烧后只生成0.2molCO2和0.3molH2O,且乙醇蒸汽对H2的相对密度为23,求乙醇的分子式?
答案:C2H6O
