必修1专题三 从矿物到基础材料(综合复习+练习)
文档属性
| 名称 | 必修1专题三 从矿物到基础材料(综合复习+练习) |
|
|
| 格式 | zip | ||
| 文件大小 | 183.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-23 00:00:00 | ||
图片预览



文档简介
第一讲 金属元素综合复习
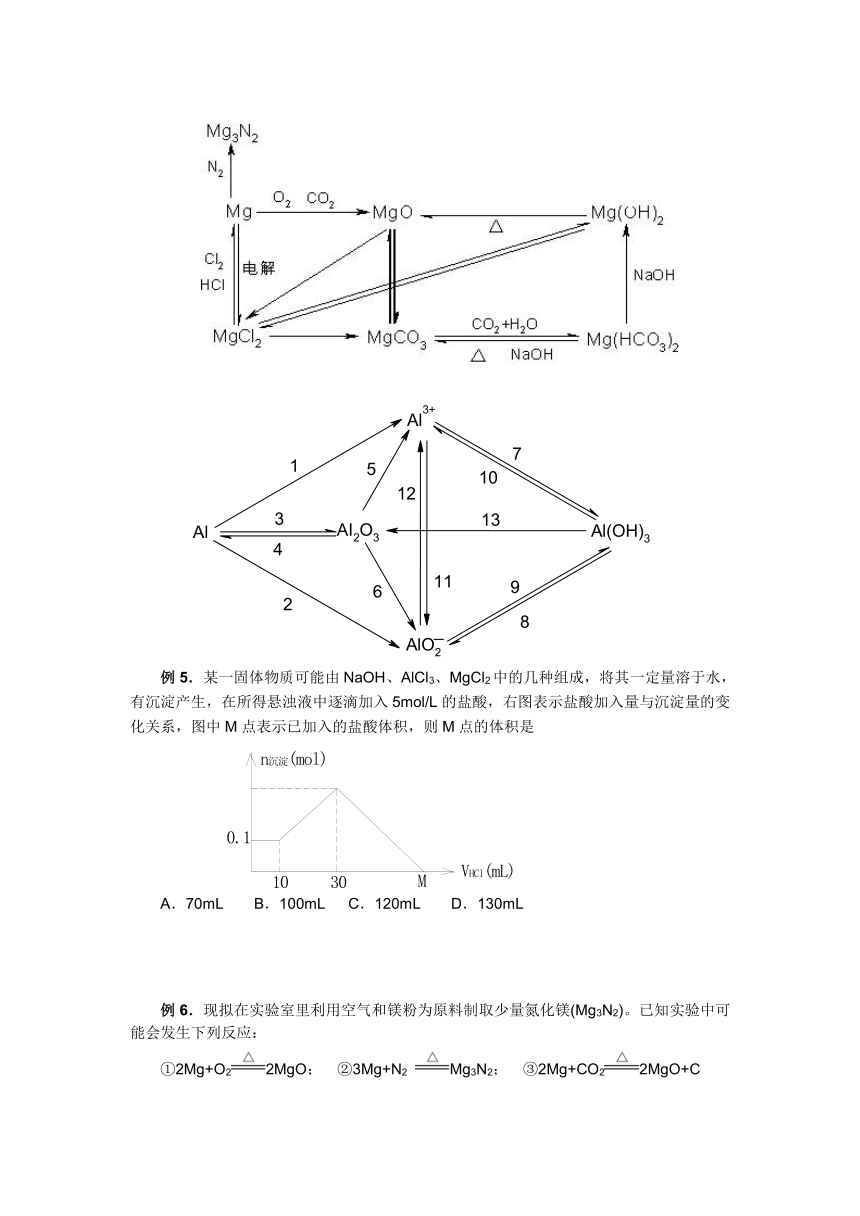
【重要知识点复习之一】钠及其化合物
例1.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
A.分别在这两种物质的溶液中,加入少量澄清石灰水
B.分别加热这两种固体,并将生成的气体通入澄清石灰水中
C.分别在这两种物质的溶液中,加入少量氯化钙溶液
D.分别在这两种物质的等浓度的溶液中,加入等量的稀盐酸
例2.称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱溶液。若生成的氢气的质量相同,则两份铝粉的质量比为
A.1 : 1 B.2 : 3 C.3 : 2 D.1 : 6
例3.表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠溶液可用于治疗胃病 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2O2的水溶液中滴入酚酞变红色 Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯发出透雾性强的黄光 Ⅰ对,Ⅱ对,有
D 过氧化钠可用于航天供氧 Na2O2能和CO2和H2O反应生成O2 Ⅰ对,Ⅱ对,有
例4.把含少量Na2CO3和水分的NaHCO3样品2克,加热到质量不再减少为止,把生成的气体通入足量澄清石灰水,得白色沉淀1克。求样品中NaHCO3的质量分数?
【重要知识点复习之二】镁铝及其重要化合物
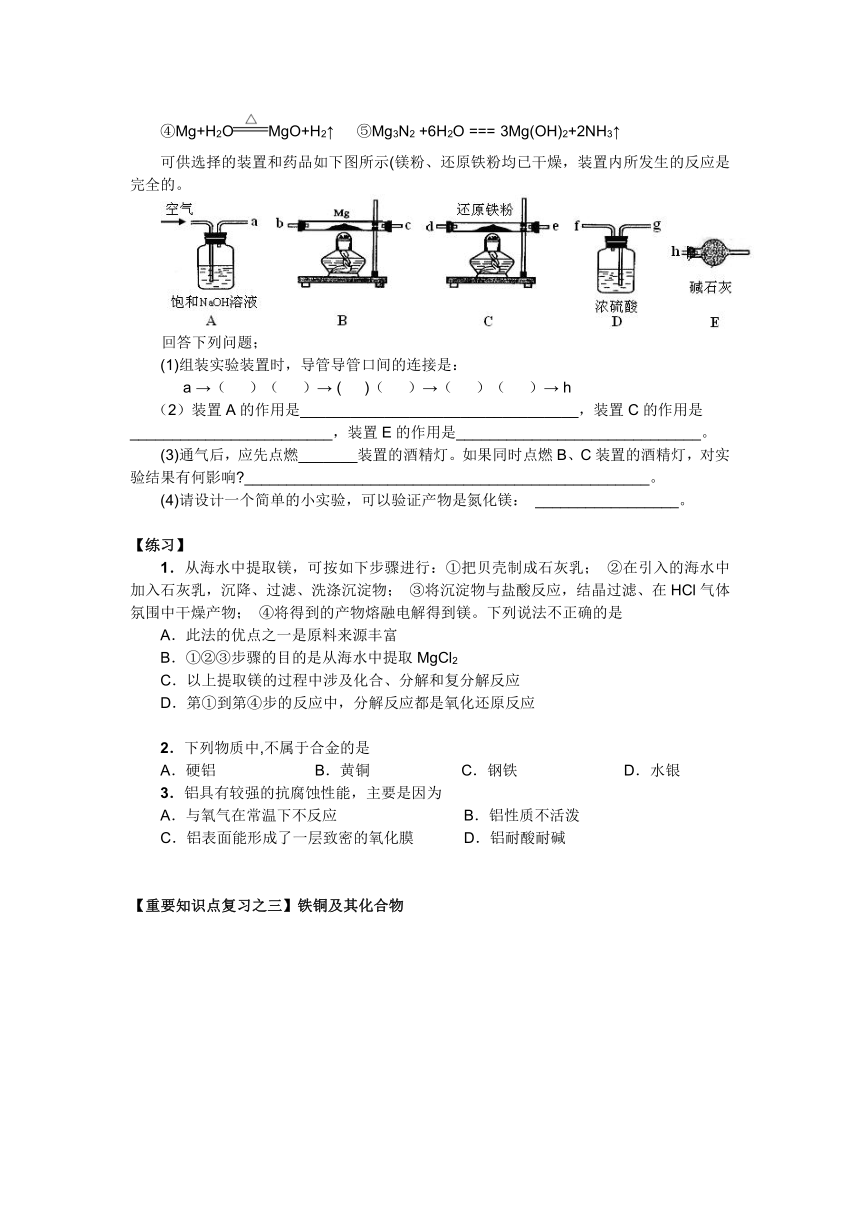
例5.某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,右图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是
A.70mL B.100mL C.120mL D.130mL
例6.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O22MgO; ②3Mg+N2 Mg3N2; ③2Mg+CO22MgO+C
④Mg+H2OMgO+H2↑ ⑤Mg3N2 +6H2O === 3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的。
回答下列问题;
(1)组装实验装置时,导管导管口间的连接是:
a →( )( )→ ( )( )→( )( )→ h
(2)装置A的作用是_________________________________,装置C的作用是________________________,装置E的作用是_____________________________。
(3)通气后,应先点燃_______装置的酒精灯。如果同时点燃B、C装置的酒精灯,对实验结果有何影响 ________________________________________________。
(4)请设计一个简单的小实验,可以验证产物是氮化镁: _________________。
【练习】
1.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第①到第④步的反应中,分解反应都是氧化还原反应
2.下列物质中,不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
3.铝具有较强的抗腐蚀性能,主要是因为
A.与氧气在常温下不反应 B.铝性质不活泼
C.铝表面能形成了一层致密的氧化膜 D.铝耐酸耐碱
【重要知识点复习之三】铁铜及其化合物
例7.铜、铁、锌等质量组成的合金W g,加入到和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有_______,还可能有________.
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有________,可能还有_____.
(3)若剩余固体为,则溶液中的阳离子一定有_______,一定没有________.
例8.某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为
A.5.6 g B.11.2g C.22.4g D.33.6g
例9.某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
操作II必须用到的仪器是 。(填下列编号)
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式 ,
加入氨水要过量的原因是 。
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素
的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 (写出一种原因即可)
【练习】海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产。若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2 = Cu2S+2FeS+S…………………………… ①
2Cu2S+3O2=2Cu2O+2SO2……………………………… ②
Cu2O+FeS = Cu2S+FeO……………………………… ③
2FeS+3O2+SiO2 = 2FeO·SiO2+2SO2……………… ④
2FeO+SiO2 = 2FeO·SiO2……………………………… ⑤
Cu2S+2Cu2O = 6Cu +SO2 ……………………………… ⑥
下列有关说法不正确的是
A.上述反应均属于氧化还原反应 B.该厂可同时建硫酸厂和炼铁厂
C.该厂的原料除富铜矿外,还需空气和硅石 D.反应④转移12e-
【综合习题】
1.某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体。其实验方案如下:
(1)所加试剂①、②分别是 。
(2)从滤液E中得到绿矾晶体的实验操作是 ;从滤渣F制取胆矾的第一步操作最好采用 。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由
。你认为正确的设计方案是
。
2.A、B、C、D四种物质,焰色反应均为黄色,其中A、B、C中一种是碱、一种是单质、一种是正盐,当正盐和稀盐酸反应时有无色无味的气体生成,该气体能使澄清的石灰水变浑浊。A、B、C和盐酸反应都可得到D,B与水反应可以生成A。
(1)各物质的化学式为:
A B C D
(2)有关反应的化学反应方程式为:
B D
C D
B A
3.利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有 。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是 。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是 。
【综合习题】答案
第1题答案
1.
(1)NaOH溶液和稀硫酸
(2)在隔绝空气的条件下,蒸发浓缩、冷却结晶;将滤渣F在空气中灼烧
(3)由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质。向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解
2.
(1)A NaOH ; B Na ; C Na2CO3 ; D NaCl
(2) B D 2Na + 2HCl = 2NaCl + H2↑
C D Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
B A 2Na + 2H2O = 2NaOH + H2↑
3.
(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O,2Fe3+ + Fe = 3Fe2+,Fe + 2H+ = Fe2+ + H2↑
(2)C或CO, 2 CuO+C==2Cu+CO2↑
(3)2Cu+O2+2H2SO4==2CuSO4+2H2O
或2Cu + O2== 2CuO , CuO + H2SO4 == CuSO4 + H2O
(4)生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2
第一讲 金属元素综合复习课后习题
1.下列关于钠的叙述错误的是
A.钠在常温下就容易被氧化 B.钠在空气中燃烧生成Na2O
C.钠燃烧时发出黄色的火焰 D.钠的密度比水小,熔点低于100℃
2.下列灭火剂能用于扑灭金属钠着火的是
A.干冰 B.黄沙
C.干粉(含NaHCO3)灭火剂 D.煤油
3.把一小块金属钠长期放置于空气中,最终得到的物质是
A.NaHCO3 B. Na2CO3 C.NaOH D.Na2O2
4.用等质量的金属钠进行下列实验,产生氢气最多的是
A.将钠放入足量的稀盐酸中
B.将钠放入足量的稀硫酸中
C.将钠放入足量的氯化钠溶液中
D.将钠用铝箔包好,并刺一些小孔,放入足量的水中
5.下列物质中可用于治疗胃酸过多的是
A.碳酸氢钠 B.氢氧化铜 C.氧化钠 D.碳酸钠
6.把一块钠投入预先滴入2~3滴紫色石蕊试液的水溶液中,可观察到的现象正确的一组为:
①钠沉到水下面; ②钠浮在水面上,四处游动;
③钠熔成闪亮的小球,听到滋滋的响声; ④溶液变红; ⑤溶液变蓝
A. ①③④ B.②③⑤ C.①③⑤ D.②③④
7.下列实验中,溶液颜色有明显变化的是
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO3溶液中
D.往酸性高锰酸钾溶液中滴入足量FeSO4浓溶液
8.一定量的Mg和MgO的混合物投入100ml 2mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是
A.100ml B.50ml
C.25ml D.由于Mg、MgO的质量未知无法判断
9.关于下列物质的用途,下列说法不正确的是
A.碳酸钠和碳酸氢钠在厨房都用作食用碱
B.氧化铝是较好的耐火材料
C.铝制餐具可以长时间存放酸性、碱性或咸的食物
D.氧化铁常用于制造红色油漆
10.铝在人体内是慢慢蓄积的,其引起的毒性缓慢,且不易察觉。然而,一旦发生代谢紊乱的毒性反应,则后果严重。下列关于铝毒的防治策略正确的一组为
①引导人们合理开发和利用各种铝资源,从根本上减少铝的排放和流失。
②有节制地使用铝制品,避免食物或饮用水与铝制品之间的接触或沾染。
③改良不合理的饮食习惯,尽量减少铝的入口途径,如丢开Al(OH)3制剂,改用胃动力药物等。
④利用现代科技手段设法消除或减轻铝毒危害,如改进水处理工艺,采用新型产品和高新技术。
A.只有①② B.只有②④ C.只有②③④ D.全部
11.从海水中提取镁的正确途径是
A.海水Mg(OH)2Mg
B.海水MgCl2Mg
C.海水Mg(OH)2 MgOMg
D.海水Mg(OH)2MgCl2Mg
12.在Al2(SO4)3和MgSO4的混合溶液中,滴加
NaOH溶液,生成沉淀的量与滴入NaOH溶
液的体积关系如下图所示,则原混合液中
Al2(SO4)3与MgSO4的物质的量浓度之比为
A.6:1 B.3:1
C.2:1 D.1:2
13.将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈血红色的是
A.Fe2O3 B.FeCl3 C.Fe2(SO4)3 D.FeO
14.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是
A.苹果汁中的Fe2+变成Fe3+ B.苹果汁中含有Cu2+
C.苹果汁含有OH- D.苹果汁含有Na+
15.北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明甲、乙、丙猜想的正误,该试剂应是
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
16.向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液一定不变红色 B.溶液中一定含Fe2+
C.溶液中一定含Cu2+ D.剩余固体中一定含Cu
17.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数。设计了如下实验方案:
方案I:铜铝混合物测定生成气体的体积
方案Ⅱ:铜铝混合物测定剩余固体的质量
下列有关判断中正确的是
A.溶液A和溶液B选用稀硝酸 B.溶液A和溶液B均可以是盐酸或NaOH溶液
C.溶液B可以选用浓硝酸 D.实验室中方案I更便于实施
18.某固体混合物可能含Al、(NH4)2SO4、MgCl2、AlCl3、FeCl3中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下的体积):
请回答:
(1)混合物中是否存在FeCl2 (填“是”或“否”); ,
(2)混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是_______。
(3)写出反应⑤的离子反应方程式; 。
(4)请根据图中数据分析,原固体混合物中一定含有的物质为 (写化学式),不写计算过程。
19.某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们
展示两个方案,并提出下列问题:
方案甲:
方案乙:
⑴两个方案哪个符合当前的绿色理念: ;
⑵写出方案甲中步骤②、⑧反应的离子方程式:_____________、______________;
⑶无论是甲还是乙方案,在“加铁屑”时,都加入稍过量的铁屑,你认为这么做的道理是:__________________________________________________________________;
⑷①用简便的方法检验红色粉末中含有过量的铁屑:_________________________;
②如何除去红色粉末中所含过量的Fe得干燥的红色粉末:______________________。
20.取a g Na2O2与Al粉组成的混合物,投入适量的水中,固体完全溶解,在标准状况下放出气体V L(设产生的气体全部放出)。
(1)有关反应的化学方程式为:_______________________________________,___________________________________________________________。
(2)若VL气体点燃时恰好完全反应,则原混合物中Na2O2与Al的物质的量之比是________。
(3)V的取值范围是_______________________(用含a的代数式表示,可不约简)。
习题答案
1.B 2.B 3.B 4.D 5.A 6.B 7.BD 8.B 9.C 10.D 11.D 12.D 13.D 14.A 15.C 16.C 17.B
18.(1)否 (2)是(2分)气体通过浓硫酸减少4.48L
(3)A1(OH)3++3H+=A13++3H2O(2分)
(4)一定含有A1、(NH4)2SO4和MgCl2三种物质
19. (1)乙(2分)
(2)②CuO+2H+=Cu2++H2O ③Fe+Cu2+=Fe2++Cu
(3)确保Cu完全置换出来
(4)①可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);
②将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥。
20.(1)2Na2O2 + 2H2O === 4NaOH + O2↑
2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑ (2)3:2
(3)
2,4,6
样品a g
250.00
mL
溶液
25.00mL
溶液
沉淀
红棕色
固体
盐酸
水
操作Ⅰ
操作Ⅱ
①溴水
②过量氨水
过滤
洗涤
灼烧
28.1g固体
过量浓NaOH溶液
△ ①
11.2L气体 体积不变 6.72L气体
碱石灰
浓硫酸
②
白色沉淀5.80g 无明显变化
久置
③
无色溶液 白色沉淀 白色沉淀
适量稀盐酸
过量稀盐酸
④
⑤
含铜废料
黑色固体及残留物
蓝色溶液及不溶物
在空气中灼烧
足量稀硫酸、加热
过滤
加铁屑
①
②
滤液
浅绿色溶液及红色沉淀
红色粉末
③
通入空气并加热
加入足量稀硫酸
粉碎
蓝色溶液及不溶物
碎铜、其他杂质
含铜废料
红色粉末
浅绿色溶液及红色沉淀
滤液
过滤
加铁屑
【重要知识点复习之一】钠及其化合物
例1.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
A.分别在这两种物质的溶液中,加入少量澄清石灰水
B.分别加热这两种固体,并将生成的气体通入澄清石灰水中
C.分别在这两种物质的溶液中,加入少量氯化钙溶液
D.分别在这两种物质的等浓度的溶液中,加入等量的稀盐酸
例2.称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱溶液。若生成的氢气的质量相同,则两份铝粉的质量比为
A.1 : 1 B.2 : 3 C.3 : 2 D.1 : 6
例3.表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠溶液可用于治疗胃病 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2O2的水溶液中滴入酚酞变红色 Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯发出透雾性强的黄光 Ⅰ对,Ⅱ对,有
D 过氧化钠可用于航天供氧 Na2O2能和CO2和H2O反应生成O2 Ⅰ对,Ⅱ对,有
例4.把含少量Na2CO3和水分的NaHCO3样品2克,加热到质量不再减少为止,把生成的气体通入足量澄清石灰水,得白色沉淀1克。求样品中NaHCO3的质量分数?
【重要知识点复习之二】镁铝及其重要化合物
例5.某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,右图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是
A.70mL B.100mL C.120mL D.130mL
例6.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O22MgO; ②3Mg+N2 Mg3N2; ③2Mg+CO22MgO+C
④Mg+H2OMgO+H2↑ ⑤Mg3N2 +6H2O === 3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的。
回答下列问题;
(1)组装实验装置时,导管导管口间的连接是:
a →( )( )→ ( )( )→( )( )→ h
(2)装置A的作用是_________________________________,装置C的作用是________________________,装置E的作用是_____________________________。
(3)通气后,应先点燃_______装置的酒精灯。如果同时点燃B、C装置的酒精灯,对实验结果有何影响 ________________________________________________。
(4)请设计一个简单的小实验,可以验证产物是氮化镁: _________________。
【练习】
1.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第①到第④步的反应中,分解反应都是氧化还原反应
2.下列物质中,不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
3.铝具有较强的抗腐蚀性能,主要是因为
A.与氧气在常温下不反应 B.铝性质不活泼
C.铝表面能形成了一层致密的氧化膜 D.铝耐酸耐碱
【重要知识点复习之三】铁铜及其化合物
例7.铜、铁、锌等质量组成的合金W g,加入到和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有_______,还可能有________.
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有________,可能还有_____.
(3)若剩余固体为,则溶液中的阳离子一定有_______,一定没有________.
例8.某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为
A.5.6 g B.11.2g C.22.4g D.33.6g
例9.某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
操作II必须用到的仪器是 。(填下列编号)
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式 ,
加入氨水要过量的原因是 。
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素
的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 (写出一种原因即可)
【练习】海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产。若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2 = Cu2S+2FeS+S…………………………… ①
2Cu2S+3O2=2Cu2O+2SO2……………………………… ②
Cu2O+FeS = Cu2S+FeO……………………………… ③
2FeS+3O2+SiO2 = 2FeO·SiO2+2SO2……………… ④
2FeO+SiO2 = 2FeO·SiO2……………………………… ⑤
Cu2S+2Cu2O = 6Cu +SO2 ……………………………… ⑥
下列有关说法不正确的是
A.上述反应均属于氧化还原反应 B.该厂可同时建硫酸厂和炼铁厂
C.该厂的原料除富铜矿外,还需空气和硅石 D.反应④转移12e-
【综合习题】
1.某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体。其实验方案如下:
(1)所加试剂①、②分别是 。
(2)从滤液E中得到绿矾晶体的实验操作是 ;从滤渣F制取胆矾的第一步操作最好采用 。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由
。你认为正确的设计方案是
。
2.A、B、C、D四种物质,焰色反应均为黄色,其中A、B、C中一种是碱、一种是单质、一种是正盐,当正盐和稀盐酸反应时有无色无味的气体生成,该气体能使澄清的石灰水变浑浊。A、B、C和盐酸反应都可得到D,B与水反应可以生成A。
(1)各物质的化学式为:
A B C D
(2)有关反应的化学反应方程式为:
B D
C D
B A
3.利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有 。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是 。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是 。
【综合习题】答案
第1题答案
1.
(1)NaOH溶液和稀硫酸
(2)在隔绝空气的条件下,蒸发浓缩、冷却结晶;将滤渣F在空气中灼烧
(3)由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质。向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解
2.
(1)A NaOH ; B Na ; C Na2CO3 ; D NaCl
(2) B D 2Na + 2HCl = 2NaCl + H2↑
C D Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
B A 2Na + 2H2O = 2NaOH + H2↑
3.
(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O,2Fe3+ + Fe = 3Fe2+,Fe + 2H+ = Fe2+ + H2↑
(2)C或CO, 2 CuO+C==2Cu+CO2↑
(3)2Cu+O2+2H2SO4==2CuSO4+2H2O
或2Cu + O2== 2CuO , CuO + H2SO4 == CuSO4 + H2O
(4)生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2
第一讲 金属元素综合复习课后习题
1.下列关于钠的叙述错误的是
A.钠在常温下就容易被氧化 B.钠在空气中燃烧生成Na2O
C.钠燃烧时发出黄色的火焰 D.钠的密度比水小,熔点低于100℃
2.下列灭火剂能用于扑灭金属钠着火的是
A.干冰 B.黄沙
C.干粉(含NaHCO3)灭火剂 D.煤油
3.把一小块金属钠长期放置于空气中,最终得到的物质是
A.NaHCO3 B. Na2CO3 C.NaOH D.Na2O2
4.用等质量的金属钠进行下列实验,产生氢气最多的是
A.将钠放入足量的稀盐酸中
B.将钠放入足量的稀硫酸中
C.将钠放入足量的氯化钠溶液中
D.将钠用铝箔包好,并刺一些小孔,放入足量的水中
5.下列物质中可用于治疗胃酸过多的是
A.碳酸氢钠 B.氢氧化铜 C.氧化钠 D.碳酸钠
6.把一块钠投入预先滴入2~3滴紫色石蕊试液的水溶液中,可观察到的现象正确的一组为:
①钠沉到水下面; ②钠浮在水面上,四处游动;
③钠熔成闪亮的小球,听到滋滋的响声; ④溶液变红; ⑤溶液变蓝
A. ①③④ B.②③⑤ C.①③⑤ D.②③④
7.下列实验中,溶液颜色有明显变化的是
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO3溶液中
D.往酸性高锰酸钾溶液中滴入足量FeSO4浓溶液
8.一定量的Mg和MgO的混合物投入100ml 2mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是
A.100ml B.50ml
C.25ml D.由于Mg、MgO的质量未知无法判断
9.关于下列物质的用途,下列说法不正确的是
A.碳酸钠和碳酸氢钠在厨房都用作食用碱
B.氧化铝是较好的耐火材料
C.铝制餐具可以长时间存放酸性、碱性或咸的食物
D.氧化铁常用于制造红色油漆
10.铝在人体内是慢慢蓄积的,其引起的毒性缓慢,且不易察觉。然而,一旦发生代谢紊乱的毒性反应,则后果严重。下列关于铝毒的防治策略正确的一组为
①引导人们合理开发和利用各种铝资源,从根本上减少铝的排放和流失。
②有节制地使用铝制品,避免食物或饮用水与铝制品之间的接触或沾染。
③改良不合理的饮食习惯,尽量减少铝的入口途径,如丢开Al(OH)3制剂,改用胃动力药物等。
④利用现代科技手段设法消除或减轻铝毒危害,如改进水处理工艺,采用新型产品和高新技术。
A.只有①② B.只有②④ C.只有②③④ D.全部
11.从海水中提取镁的正确途径是
A.海水Mg(OH)2Mg
B.海水MgCl2Mg
C.海水Mg(OH)2 MgOMg
D.海水Mg(OH)2MgCl2Mg
12.在Al2(SO4)3和MgSO4的混合溶液中,滴加
NaOH溶液,生成沉淀的量与滴入NaOH溶
液的体积关系如下图所示,则原混合液中
Al2(SO4)3与MgSO4的物质的量浓度之比为
A.6:1 B.3:1
C.2:1 D.1:2
13.将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈血红色的是
A.Fe2O3 B.FeCl3 C.Fe2(SO4)3 D.FeO
14.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是
A.苹果汁中的Fe2+变成Fe3+ B.苹果汁中含有Cu2+
C.苹果汁含有OH- D.苹果汁含有Na+
15.北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明甲、乙、丙猜想的正误,该试剂应是
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
16.向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液一定不变红色 B.溶液中一定含Fe2+
C.溶液中一定含Cu2+ D.剩余固体中一定含Cu
17.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数。设计了如下实验方案:
方案I:铜铝混合物测定生成气体的体积
方案Ⅱ:铜铝混合物测定剩余固体的质量
下列有关判断中正确的是
A.溶液A和溶液B选用稀硝酸 B.溶液A和溶液B均可以是盐酸或NaOH溶液
C.溶液B可以选用浓硝酸 D.实验室中方案I更便于实施
18.某固体混合物可能含Al、(NH4)2SO4、MgCl2、AlCl3、FeCl3中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下的体积):
请回答:
(1)混合物中是否存在FeCl2 (填“是”或“否”); ,
(2)混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是_______。
(3)写出反应⑤的离子反应方程式; 。
(4)请根据图中数据分析,原固体混合物中一定含有的物质为 (写化学式),不写计算过程。
19.某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们
展示两个方案,并提出下列问题:
方案甲:
方案乙:
⑴两个方案哪个符合当前的绿色理念: ;
⑵写出方案甲中步骤②、⑧反应的离子方程式:_____________、______________;
⑶无论是甲还是乙方案,在“加铁屑”时,都加入稍过量的铁屑,你认为这么做的道理是:__________________________________________________________________;
⑷①用简便的方法检验红色粉末中含有过量的铁屑:_________________________;
②如何除去红色粉末中所含过量的Fe得干燥的红色粉末:______________________。
20.取a g Na2O2与Al粉组成的混合物,投入适量的水中,固体完全溶解,在标准状况下放出气体V L(设产生的气体全部放出)。
(1)有关反应的化学方程式为:_______________________________________,___________________________________________________________。
(2)若VL气体点燃时恰好完全反应,则原混合物中Na2O2与Al的物质的量之比是________。
(3)V的取值范围是_______________________(用含a的代数式表示,可不约简)。
习题答案
1.B 2.B 3.B 4.D 5.A 6.B 7.BD 8.B 9.C 10.D 11.D 12.D 13.D 14.A 15.C 16.C 17.B
18.(1)否 (2)是(2分)气体通过浓硫酸减少4.48L
(3)A1(OH)3++3H+=A13++3H2O(2分)
(4)一定含有A1、(NH4)2SO4和MgCl2三种物质
19. (1)乙(2分)
(2)②CuO+2H+=Cu2++H2O ③Fe+Cu2+=Fe2++Cu
(3)确保Cu完全置换出来
(4)①可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);
②将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥。
20.(1)2Na2O2 + 2H2O === 4NaOH + O2↑
2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑ (2)3:2
(3)
2,4,6
样品a g
250.00
mL
溶液
25.00mL
溶液
沉淀
红棕色
固体
盐酸
水
操作Ⅰ
操作Ⅱ
①溴水
②过量氨水
过滤
洗涤
灼烧
28.1g固体
过量浓NaOH溶液
△ ①
11.2L气体 体积不变 6.72L气体
碱石灰
浓硫酸
②
白色沉淀5.80g 无明显变化
久置
③
无色溶液 白色沉淀 白色沉淀
适量稀盐酸
过量稀盐酸
④
⑤
含铜废料
黑色固体及残留物
蓝色溶液及不溶物
在空气中灼烧
足量稀硫酸、加热
过滤
加铁屑
①
②
滤液
浅绿色溶液及红色沉淀
红色粉末
③
通入空气并加热
加入足量稀硫酸
粉碎
蓝色溶液及不溶物
碎铜、其他杂质
含铜废料
红色粉末
浅绿色溶液及红色沉淀
滤液
过滤
加铁屑
