1.4配制溶液 同步练习(word版,含解析)
文档属性
| 名称 | 1.4配制溶液 同步练习(word版,含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 294.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-05-17 19:16:53 | ||
图片预览


文档简介
配制溶液
一、单选题
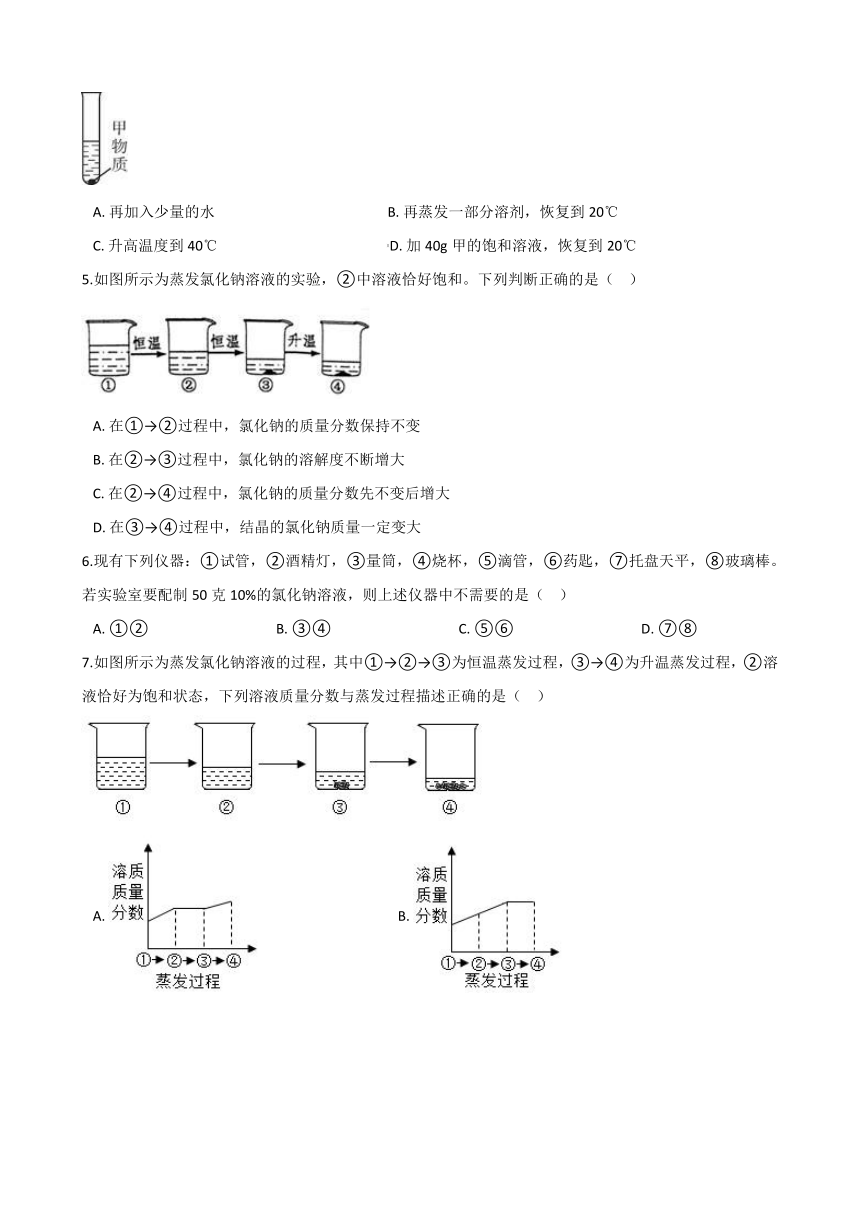
1.在 2021年的初中毕业生实验操作考查中,小科抽到的试题是配制40克5%的氯化钠溶液,下列操作中会导致所配溶液溶质质量分数大于5%的是( ??)
A.?调平时指针左偏
B.?量取水
C.?转移氯化钠时有固体洒出
D.?装瓶时有液体洒出
2.mg硝酸钾的不饱和溶液,恒温蒸发水分,直到有少量晶体析出.在此变化过程中,溶液溶质质量分数(a%)与时间(t)的变化关系可用图(?? )
A.???????????????B.???????????????C.???????????????D.?
3.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致其质量分数偏小的是( ??)
①称量的氯化钠固体中含有不溶性杂质;
②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;
④将配制好的溶液装入试剂瓶中时有少量溅出。
A.?①②?????????????????????????????????????B.?①③?????????????????????????????????????C.?②④?????????????????????????????????????D.?③④
4.已知甲物质在水中的溶解度随温度的升高而增大。20℃时,将甲物质加到盛有10g水的试管中,充分溶解后,观察到试管中有剩余的甲物质(如图)。下列操作中一定会改变溶质质量分数的是(?? )
A.?再加入少量的水??????????????????????????????????????????????????B.?再蒸发一部分溶剂,恢复到20℃
C.?升高温度到40℃?????????????????????????????????????????????????D.?加40g甲的饱和溶液,恢复到20℃
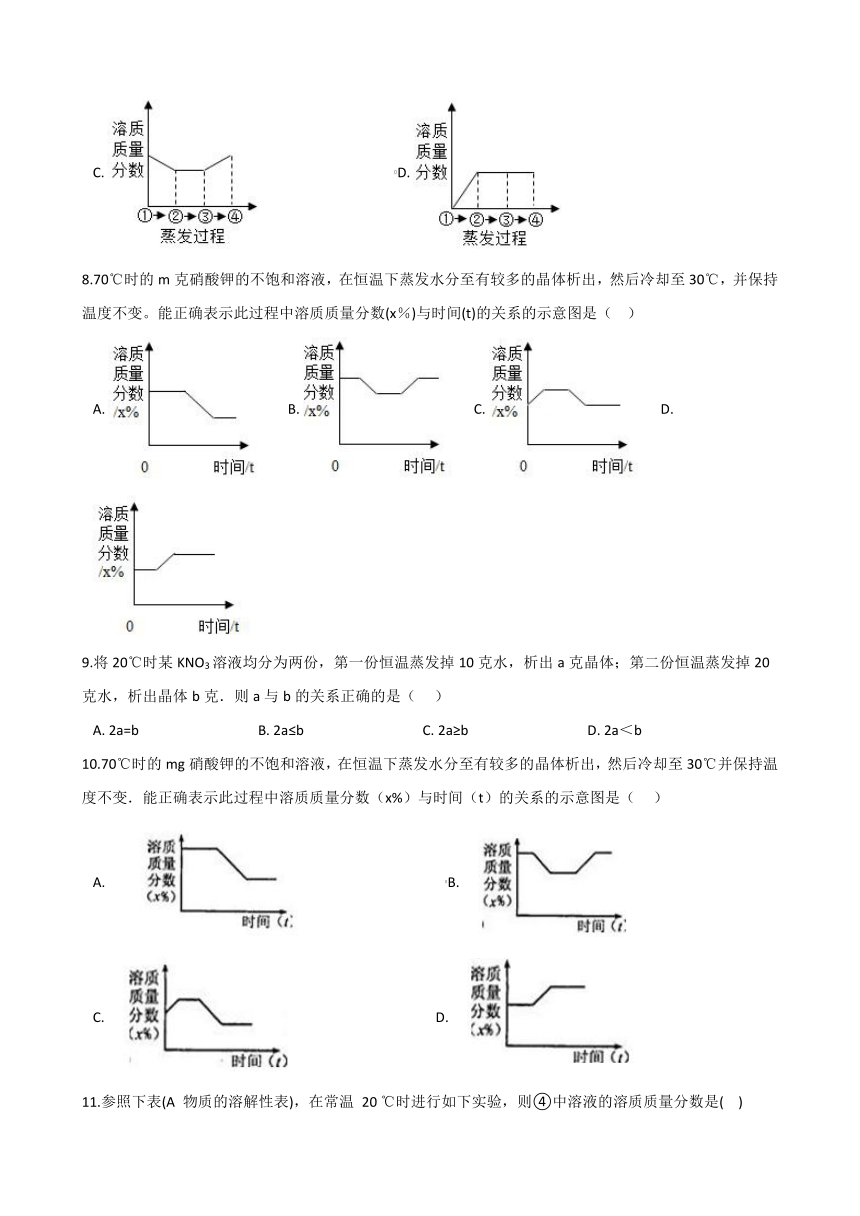
5.如图所示为蒸发氯化钠溶液的实验,②中溶液恰好饱和。下列判断正确的是(?? )
A.?在①→②过程中,氯化钠的质量分数保持不变
B.?在②→③过程中,氯化钠的溶解度不断增大
C.?在②→④过程中,氯化钠的质量分数先不变后增大
D.?在③→④过程中,结晶的氯化钠质量一定变大
6.现有下列仪器:①试管,②酒精灯,③量筒,④烧杯,⑤滴管,⑥药匙,⑦托盘天平,⑧玻璃棒。若实验室要配制50克10%的氯化钠溶液,则上述仪器中不需要的是(?? )
A.?①②?????????????????????????????????????B.?③④?????????????????????????????????????C.?⑤⑥?????????????????????????????????????D.?⑦⑧
7.如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,下列溶液质量分数与蒸发过程描述正确的是(?? )
A.????????????????????????????????????????B.?
C.????????????????????????????????????????D.?
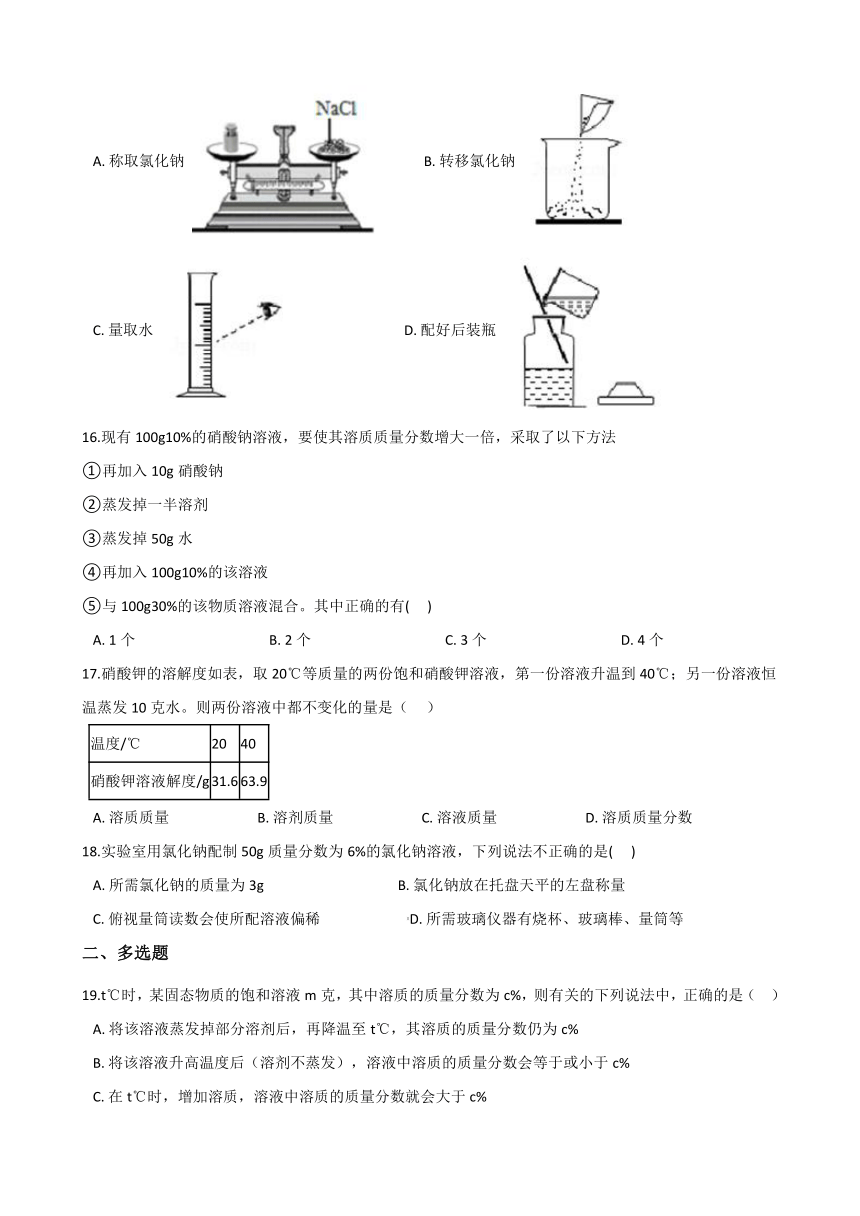
8.70℃时的m克硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃,并保持温度不变。能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是(?? )
A.???????B.???????C.???????D.?
9.将20℃时某KNO3溶液均分为两份,第一份恒温蒸发掉10克水,析出a克晶体;第二份恒温蒸发掉20克水,析出晶体b克.则a与b的关系正确的是(??? )
A.?2a=b??????????????????????????????????B.?2a≤b??????????????????????????????????C.?2a≥b??????????????????????????????????D.?2a<b
10.70℃时的mg硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是(??? )
A.?????????????????????????????????????????B.???
C.???????????????????????????????????????D.???
11.参照下表(A 物质的溶解性表),在常温 20 ℃时进行如下实验,则④中溶液的溶质质量分数是( ??)
温度(℃)
20
50
溶解度(g)
30
100
A.?37.5%??????????????????????????????????B.?23.1%??????????????????????????????????C.?28.6%??????????????????????????????????D.?60%
12.现有40g质量分数为10%的食盐溶液,要使其溶质的质量分数达到20%(无晶体析出),可采用的方法是(? )
①蒸发掉20克水; ②蒸发后18克水; ③加入 3.2克食盐;④加入5克食盐;
A.?①④????????????????????????????????????B.?①②????????????????????????????????????C.?②④????????????????????????????????????D.?①②④
13.如图为配制50g溶质质量分数为10%的氯化钠溶液的操作过程,下列有关操作与目的分析均正确的是( ???)
选项
操作
目的
A
用剩的食盐放回原试剂瓶
避免浪费
B
天平调平后在左、右托盘中各垫一张相同的纸
保证称取的食盐质量更准确
C
用50mL量筒替代天平量取所需的水
更加简便
D
溶解时用玻璃棒搅拌
增加食盐的溶解能力
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
14.某甲醇(CH4O)水溶液中,甲醇所含氢原子的个数是水中所含氢原子个数的 2 倍,求该溶液中溶质质量分数(?? )
A.?47%?????????????????????????????????????B.?64%?????????????????????????????????????C.?67%?????????????????????????????????????D.?78%
15.配制70克16%的NaCl溶液,下列操作会使所配溶液溶质质量分数大于16%的是(??? )
A.?称取氯化钠 ??????????????B.?转移氯化钠
C.?量取水 ???????????????????????????????????D.?配好后装瓶
16.现有100g10%的硝酸钠溶液,要使其溶质质量分数增大一倍,采取了以下方法
①再加入10g硝酸钠
②蒸发掉一半溶剂
③蒸发掉50g水
④再加入100g10%的该溶液
⑤与100g30%的该物质溶液混合。其中正确的有(??? )
A.?1个???????????????????????????????????????B.?2个???????????????????????????????????????C.?3个???????????????????????????????????????D.?4个
17.硝酸钾的溶解度如表,取20℃等质量的两份饱和硝酸钾溶液,第一份溶液升温到40℃;另一份溶液恒温蒸发10克水。则两份溶液中都不变化的量是( ???)
温度/℃
20
40
硝酸钾溶液解度/g
31.6
63.9
A.?溶质质量?????????????????????????B.?溶剂质量?????????????????????????C.?溶液质量?????????????????????????D.?溶质质量分数
18.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液,下列说法不正确的是(??? )
A.?所需氯化钠的质量为3g???????????????????????????????????????B.?氯化钠放在托盘天平的左盘称量
C.?俯视量筒读数会使所配溶液偏稀?????????????????????????D.?所需玻璃仪器有烧杯、玻璃棒、量筒等
二、多选题
19.t℃时,某固态物质的饱和溶液m克,其中溶质的质量分数为c%,则有关的下列说法中,正确的是(?? )
A.?将该溶液蒸发掉部分溶剂后,再降温至t℃,其溶质的质量分数仍为c%
B.?将该溶液升高温度后(溶剂不蒸发),溶液中溶质的质量分数会等于或小于c%
C.?在t℃时,增加溶质,溶液中溶质的质量分数就会大于c%
D.?在t℃时,这种物质的溶解度小于c克
三、填空题
20.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→________④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是????? 。
A.称取的食盐不纯,有杂质
B.配制好的溶液转移时,不小心有少量液体溅出
四、解答题
21.二氧化氯消毒液是国际上公认的新一代强力、安全、高效的消毒剂,能够迅速,彻底杀灭各种细菌(大肠杆菌、白色念珠菌等)和病毒(肝炎病毒、流感病毒等)。小应同学观察到瓶上的标签如表所示,试回答:
二氧化氯(ClO2)1000毫升
溶质质量分数
80%
密度
1.2克/厘米3
强腐蚀性,阴冷、密封储藏
(1)这1000毫升二氧化氯消毒液中含溶质二氧化氯多少克?
(2)若将这1000毫升二氧化氯消毒液与5000克水均匀混合,所得稀二氧化氧消毒液中二氧化氯的质量分数是多少?(小数点后保留一位有效数字)
(3)该校欲配置30千克20%的稀二氧化氯消毒液用以消毒,需多少千克这样二氧化氧消毒液和多少升水?
五、实验探究题
22.某同学配制60g溶质质量分数为5%的NaCl溶液,准备了下列实验用品。回答下列问题:
(1)配制过程中还缺少的一种玻璃仪器是________(填仪器名称),该仪器有的作用是________。
(2)计算所需NaCl的质量为________克。
(3)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用________(填仪器名称)滴加蒸馏水至刻度线。
(4)经检测,实验所得的溶液,溶质质量分数偏小,其原因可能有________(填序号)。
①氯化钠固体仍然不纯②量取水时,俯视读数
③称量时砝码端忘垫质量相同的纸片④装瓶时,有少量溶液洒出
答案解析部分
一、单选题
1. B
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数偏小,要么是溶质质量偏小,要么是溶剂质量偏小,据此分析判断。
解答:A. 调平时指针左偏,说明左盘重,当放入药品,天平达到平衡时,左盘药品的质量会偏小,故A错误;?
B. 量取水时,俯视读数,根据“俯视大仰视小”的规律可知,读出的示数偏大,而实际得到的体积偏小, 故B正确;
C. 转移氯化钠时有固体洒出,会使溶质的质量偏小,故C错误;?
D. 装瓶时有液体洒出,由于溶液具有均一稳定性,因此不会影响溶质质量分数的变化,故D错误。
故选B。?
2. B
分析:根据溶质质量分数=溶质质量溶液质量×100%分析即可。
解答:当硝酸钾溶液为不饱和溶液时,随着时间的延长,溶质的质量不变,而溶剂的质量减小,根据溶质质量溶液质量×100%可知,这段时间内溶质质量分数不断增大;
当硝酸钾溶液达到饱和后,不断有晶体析出,溶质的质量和溶剂的质量都在减小。硝酸钾的溶解度不变,根据溶解度溶解度+100g×100%可知,此时溶液的溶质质量分数保持不变。
故B符合题意,而A、C、D不合题意。
故选B。
3. A
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量偏小,要么是溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
解答:①称量的氯化钠固体中含有不溶性杂质,导致溶质质量偏小,故①符合题意;
②用量筒量取水时仰视读数,根据“俯视大仰视小”可知,读出的示数偏小,而实际量取的偏大,故②符合题意;
③往烧杯中加水时有水洒出,会导致溶剂质量偏小,溶质质量分数偏大,故③不合题意;
④将配制好的溶液装入试剂瓶中时有少量溅出,由于溶液均一稳定,所以不会影响溶质质量分数,故④不合题意。
那么导致溶质质量分数偏小的是①②。
故选A。
4. C
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数发生变化,要么是溶质质量变化,要么是溶剂质量变化,据此分析判断。
解答:由于试管中有剩余的甲物质,因此甲溶液是饱和的。
A.再加入少量的水,甲物质继续溶解,但还是饱和的。因为溶解度保持不变,所溶质质量分数不变,故A不合题意;
B.再蒸发一部分溶剂,恢复到20℃,此时溶液依然饱和。温度不变,溶解度不变,那么溶质质量分数不变,故B不合题意;?
C.升高温度到40℃,甲的溶解度增大,甲物质继续溶解,即溶质质量增大而溶剂质量不变,因此溶质质量分数肯定增大,故C符合题意;?
D.加40g甲的饱和溶液,恢复到20℃,此时溶液依然饱和。温度不变,溶解度不变,那么溶质质量分数不变,故D不合题意。
故选C。?
5. C
分析:(1)根据溶质质量分数=溶质质量溶液质量×100%分析;
(2)(3)物质的溶解度与温度有关;当温度不变时,溶解度不变,那么饱和溶液的溶质质量分数不变;
(4)溶剂的质量和溶解度的大小都会影响溶质的质量。
解答:根据图片可知,②③④都是饱和溶液。
A.在①→②过程中,溶质质量不变,但是溶剂质量变小,因此溶质质量分数变大,故A错误;?
B.在②→③过程中,氯化钠的的温度不变,那么它的溶解度保持不变,故B错误;
C.在②→③时,氯化钠的溶解度不变,那么饱和溶液的溶质质量分数保持不变;从③→④,温度升高,氯化钠的溶解度变大,那么溶质质量分数变大,故C正确;
D.在③→④过程中,虽然水的质量变小了,但是溶解度却变大了,因此结晶的氯化钠质量是否变大无法确定,故D错误。
故选C。
6. A
分析:根据配制一定溶质质量分数的溶液的实验过程选择实验器材即可。
解答:配制50克10%的氯化钠溶液的实验过程如下:
①计算;根据溶质质量=溶液质量×溶质质量分数计算出需要氯化钠的质量,用溶液质量减去氯化钠质量得到水的质量,根据密度公式计算出水的体积;
②用药匙从试剂瓶中取出氯化钠,并用托盘天平称量出规定质量的氯化钠,用量筒和滴管配合量出规定体积的水;
③将氯化钠和水倒入烧杯,并用玻璃棒不断搅拌,直到全部溶解即可。
因此不需要的是试管和酒精灯。
故选A。
7. A
分析:根据溶质质量分数=溶质质量溶液质量×100%计算比较即可。
解答:①和②中,溶质的质量不变,但是溶液质量减小,根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数增大;
②和③都是同一温度下的饱和溶液,因为溶解度不变,所以溶质质量分数保持不变;
③和④都是饱和溶液,但是④的温度较高,所以溶解度较大,溶质质量分数较大,因此溶质质量分数变大。因此溶质质量分数先变大、再保持不变,然后再变大。
故选A。
8. C
分析:(1)同种物质,温度不变时,饱和溶液的溶质质量分数肯定大于不饱和溶液;
(2)当物质的溶解度改变时,溶解度越大,饱和溶液的溶质质量分数越大,据此分析判断。
解答:①70℃的硝酸钾的不饱和溶液,蒸发水分,先变成70℃的饱和溶液,在这段时间内,溶质质量分数不断增大;
②70℃的硝酸钾饱和溶液恒温蒸发水分时,它始终处于饱和状态;因为溶解度不变,所以溶质质量分数不变;
③硝酸钾的饱和溶液从70℃降低到30℃的过程中,溶解度不断减小,因此溶质质量分数不断减小;
④30℃的硝酸钾的饱和溶液温度不变,恒温蒸发,那么溶质质量分数保持不变。
故C正确,A、B、D错误。
故选C。
9. B
分析:当饱和溶液析出晶体时,析出晶体的质量与溶剂减少的质量正正比,据此分析判断。
解答:根据“饱和溶液析出晶体质量与溶剂减少质量成正比”的规律可知,如果原来的硝酸钾溶液是饱和的,那么蒸发掉20g水析出的晶体质量肯定是10g水析出晶体的2倍,即2a=b;
? ? ? 如果原来的硝酸钾溶液不是饱和的,那么当水蒸发时,开始不会析出晶体,当溶液达到饱和时才会析出晶体。因此第一次蒸发10g水析出的晶体质量a肯定小于溶液饱和后蒸发10g水析出的晶体质量c,即a 那么a+a 即:即2a 故选B。
10. C
分析:(1)同一温度下,同种物质的饱和溶液的溶质质量分数肯定大于不饱和溶液;
(2)根据溶质质量分数=溶质质量溶液质量×100%可知,溶解度越大,饱和溶液的溶质质量分数越大。
解答:①70℃时的mg硝酸钾的不饱和溶液,在恒温下蒸发水分,先从不饱和溶液变为饱和溶液,这段时间内,溶质质量分数在不断增大;
②当70℃饱和溶液继续恒温蒸发时,溶解度不变,那么它的溶质质量分数不变;
③当70℃饱和溶液降温时,由于溶解度不断减小,因此它的溶质质量分数减小;
④当溶液到达30℃时保持温度不变,那么溶解度不变,因此它的溶质质量分数不变。
故C正确,而A、B、D错误。
故选C。
11. A
分析:根据溶质质量分数=溶质质量溶液质量×100%计算即可。
解答:根据图片可知,在溶液4中,加入的溶质质量为:20g+20g+20g=60g,全部溶解,那么溶质质量分数为:60g100g+60g×100%=37.5%。
故选A。
12. A
分析:根据溶质质量分数=溶质质量溶液质量×100%计算即可。
解答:(1)设需要蒸发水的质量为x,
40g×10%=(40g-x)×20%;
解得:x=20g。
故①正确,②错误。
(2)设需要加入食盐的质量为y,
40g×10%+y=(40g+y)×20%;
解得:y=5g。
故③错误,④正确。
那么正确的是①④。
故选A。
13. C
分析:根据配制一定质量分数的溶液的实验操作过程分析判断。
解答:A.将剩下的实验放回试剂瓶,可能会污染整瓶药品,故A错误;
B.应该在天平调平前在两个托盘上各放一张纸,这样会更准确,故B错误;
C.根据公式m=ρV可知,用量筒测出规定体积的水,就能得到规定质量的水,故C正确;
D.溶解时用玻璃棒搅拌,不能增加实验的溶解能力,但是能够加快溶解速度,故D错误。
故选C。
14. B
分析:根据甲醇和水分子中氢原子个数分析,先确定出溶液中甲醇和水的分子个数比,再用相对质量计算溶液的溶质质量分数。
解答:1个甲醇分子中含有4个氢原子,一个水分子中含有2个氢原子,溶液甲醇所含氢原子的个数是水中所含氢原子个数的 2 倍,则甲醇分子和水分子个数比为1:1,则该溶液的溶质质量分数为12+4+1612+4+16+18×100%=64%;
故选B。
15. C
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数偏大,要么是氯化钠的质量偏大,要么是水的质量偏小,据此分析即可。
解答:A.称取氯化钠时,如果氯化钠和砝码的位置放反了,那么氯化钠的质量=砝码质量-游码质量,因此会偏小,故A错误;
B.转移氯化钠时,垫纸上会残留部分氯化钠,使其质量偏小,故B错误;?
C.量取水时俯视读数,读出的示数偏大,而实际得到的水的质量偏小,故C正确;?
D.配好后装瓶 ,对溶液的溶质质量分数没有影响,故D错误。
故选C。
16. B
分析:溶质的质量分数=溶质质量溶液质量×100% , 据此进行计算即可。
解答:100g10%的硝酸钠溶液中,溶质的质量为:100g×10%=10g,水的质量为:100g-10g=90g;
①再加入10g硝酸钠,溶质质量分数:10g+10g100g+10g×100%=18.18%≠20%;
②蒸发掉一半溶剂,溶质质量分数:10g10g+90g×12×100%=18.18%≠20%;
③蒸发掉50g水,溶质质量分数:10g100g-50g×100%=20%;
④再加入100g10%的该溶液,由于前后两种溶质质量分数相同,所以混合后溶质质量分数还是10%;
⑤100g30%的该物质溶液中溶质质量为:100g×30%=30g,那么混合后溶质质量分数:10g+30g100g+100g×100%=20%。
那么正确的是③⑤。
故选B。
17. D
分析:1、 40℃ 时的硝酸钾的溶解度大于 20℃ 时的硝酸钾的溶解度;
2、结晶的方法有蒸发溶剂和冷却热饱和溶液;
3、计算溶质质量分数的公式为:溶质质量分数=溶质质量溶液质量×100%。同温度下同种溶质的饱和溶液的溶质质量分数都相等。
解答:A、硝酸钾饱溶液温度升高时溶解度增大,20℃ 时的硝酸钾饱和溶液 升温到40℃ 时,变成不饱和溶液但是溶质质量是不变的 。但另一份溶液恒温蒸发10克水 后,会有部分硝酸钾晶体析出,溶质质量减少,A错误;
B、第一份升温时溶剂是不变的,另一份蒸发10克水后溶剂减少10克,B错误;
C、第一份由饱和变为不饱和,溶液质量不变。另一份蒸发10克水并有部分晶体析出,所以溶液质量是减少的,C错误;
D、温度由20℃ 上升到40℃时,溶质质量不变,溶剂质量不变,所以溶液的溶质质量分数是不变的。另一份恒温蒸发10克水后,仍是该温度下的饱和溶液溶质质量分数也不变,所以两份溶液的溶质质量分数均不变,D正确。
???????故选D
18. C
分析:根据配制溶液的操作步骤分析,结合天平的使用要求及俯视读数量取溶剂时实际体积楄大解答。
解答:A、 配制50g质量分数为6%的氯化钠溶液需氯化钠的质量为50g×6%=3g,不符合题意;
B、天平称量药品质量时要左物右码,不符合题意;
C、俯视量筒读数会使所量实际水的体积偏小,所配溶液偏浓,符合题意;
D、配制溶液所需玻璃仪器有烧杯、玻璃棒、量筒等,不符合题意;
故答案为:C。
二、多选题
19. A,B
分析:根据饱和溶液的溶质质量分数、溶液的转化以及溶解度的知识进行分析解答即可.
解答:解:A、将该溶液蒸发掉部分溶剂后,再降温至t℃,其溶质的质量分数仍为c%,正确;
B、将该溶液升高温度后(溶剂不蒸发),若是溶解度随温度的升高而增大,则溶液中溶质的质量分数不变,若是溶解度随温度的升高而减小,则溶液中的溶质质量分数变小,正确;
C、在t℃时,增加溶质,不能继续溶解,故溶液中溶质的质量分数不变,错误;
D、设在t℃时,这种物质的溶解度为x,则有: x100g+x=c100 ,故x大于c克,错误;
故选AB.
三、填空题
20. (1)⑤→①
(2)A
分析:(1)根据配制一定溶质质量分数的溶液的实验过程解答;
(2)根据溶质质量分数=溶质质量溶液质量×100%可知,食盐溶液的溶质质量分数偏小,要么是因为溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
解答:(1)配制溶液的步骤:
②从试剂瓶中取出食盐;
⑤用天平称量规定质量的食盐;
①将食盐倒入烧杯中;
④用量筒量取合适体积的水,然后倒入烧杯中;
③用玻璃棒搅拌,直至食盐完全溶解即可。
即②→⑤→①→④→③。
(2)A.称取的食盐不纯,那么食盐的质量偏小,从而导致溶质质量分析偏小,故①正确;
B.配制好的溶液是均一稳定的,即使有少量液体溅出,也不会影响溶质质量分数,故②错误。
故选A。
四、解答题
21. (1)解:m液=ρ液V液=1.2g/cm3×1000ml=1200g m质=80%m液=960g
(2)解:由于m质前=m质后 所以960g=P%×(1200g+5000g) 得到:P%=15.5%
(3)解:由于m质前=m质后 所以80%×m液=20%×30kg m液=7.5kgV加水=m加水ρ水=30kg?7.5kg1×103kg/m3=22.5L
分析:(1)首先根据密度公式m液=ρ液V液计算消毒液的质量,再根据溶质质量=溶液质量×溶质质量分数计算即可。
(2)稀释前后,溶质的质量保持不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程,计算出所得溶液的溶质质量分数。
(3)用(2)中的方法列出方程,计算出需要消毒液的质量,然后两个消毒液的质量之差就是需要加水的质量,最后根据V加水=m加水ρ水计算需要加水的体积。
解答:(1)二氧化氯消毒液的质量:m液=ρ液V液=1.2g/cm3×1000ml=1200g;
溶质的质量: m质=80%m液=80%×1200g=960g。
(2)由于m质前=m质后?,
所以960g=P%×(1200g+5000g);
得到:P%=15.5%。
(3)由于m质前=m质后,
所以80%×m液=20%×30kg ;
解得:m液=7.5kg;
需要加水的体积V加水=m加水ρ水=30kg-7.5kg1×103kg/m3=22.5×10-3m3=22.5L。
五、实验探究题
22. (1)玻璃棒;加速溶解
(2)3
(3)滴管
(4)①③
分析:(1)根据配制一定溶质质量分数溶液的实验过程分析所缺器材,并分析它的作用。
(2)根据溶质质量=溶液质量×溶质质量分数计算氯化钠的质量;
(3)根据量取一定体积液体的操作过程解答;
(4)根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数偏小的原因:①溶质质量偏小;②溶剂质量偏大,据此分析判断。
解答:(1)将氯化钠和水倒入烧杯后,需要用玻璃棒进行搅拌,加快溶解,因此缺少的玻璃仪器为玻璃棒,它的作用是加速溶解。
(2)需要NaCl的质量:60g×5%=3g;
(3)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用滴管滴加蒸馏水至刻度线。
(4)①氯化钠固体仍然不纯,会导致溶质的质量偏小,故①符合题意;
②量取水时,俯视读数,根据“俯视大仰视小”的规律可知,此时读数偏大,而实际得到水的质量偏小,故②不合题意;
③称量时砝码端忘垫质量相同的纸片,那么氯化钠的质量+垫纸的质量=砝码的质量,则氯化钠的质量偏小,故③符合题意;
④装瓶时,有少量溶液洒出,由于溶液均一稳定,因此不影响溶液的溶质质量分数,故④不合题意。
故选①③。
一、单选题
1.在 2021年的初中毕业生实验操作考查中,小科抽到的试题是配制40克5%的氯化钠溶液,下列操作中会导致所配溶液溶质质量分数大于5%的是( ??)
A.?调平时指针左偏
B.?量取水
C.?转移氯化钠时有固体洒出
D.?装瓶时有液体洒出
2.mg硝酸钾的不饱和溶液,恒温蒸发水分,直到有少量晶体析出.在此变化过程中,溶液溶质质量分数(a%)与时间(t)的变化关系可用图(?? )
A.???????????????B.???????????????C.???????????????D.?
3.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致其质量分数偏小的是( ??)
①称量的氯化钠固体中含有不溶性杂质;
②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;
④将配制好的溶液装入试剂瓶中时有少量溅出。
A.?①②?????????????????????????????????????B.?①③?????????????????????????????????????C.?②④?????????????????????????????????????D.?③④
4.已知甲物质在水中的溶解度随温度的升高而增大。20℃时,将甲物质加到盛有10g水的试管中,充分溶解后,观察到试管中有剩余的甲物质(如图)。下列操作中一定会改变溶质质量分数的是(?? )
A.?再加入少量的水??????????????????????????????????????????????????B.?再蒸发一部分溶剂,恢复到20℃
C.?升高温度到40℃?????????????????????????????????????????????????D.?加40g甲的饱和溶液,恢复到20℃
5.如图所示为蒸发氯化钠溶液的实验,②中溶液恰好饱和。下列判断正确的是(?? )
A.?在①→②过程中,氯化钠的质量分数保持不变
B.?在②→③过程中,氯化钠的溶解度不断增大
C.?在②→④过程中,氯化钠的质量分数先不变后增大
D.?在③→④过程中,结晶的氯化钠质量一定变大
6.现有下列仪器:①试管,②酒精灯,③量筒,④烧杯,⑤滴管,⑥药匙,⑦托盘天平,⑧玻璃棒。若实验室要配制50克10%的氯化钠溶液,则上述仪器中不需要的是(?? )
A.?①②?????????????????????????????????????B.?③④?????????????????????????????????????C.?⑤⑥?????????????????????????????????????D.?⑦⑧
7.如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,下列溶液质量分数与蒸发过程描述正确的是(?? )
A.????????????????????????????????????????B.?
C.????????????????????????????????????????D.?
8.70℃时的m克硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃,并保持温度不变。能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是(?? )
A.???????B.???????C.???????D.?
9.将20℃时某KNO3溶液均分为两份,第一份恒温蒸发掉10克水,析出a克晶体;第二份恒温蒸发掉20克水,析出晶体b克.则a与b的关系正确的是(??? )
A.?2a=b??????????????????????????????????B.?2a≤b??????????????????????????????????C.?2a≥b??????????????????????????????????D.?2a<b
10.70℃时的mg硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是(??? )
A.?????????????????????????????????????????B.???
C.???????????????????????????????????????D.???
11.参照下表(A 物质的溶解性表),在常温 20 ℃时进行如下实验,则④中溶液的溶质质量分数是( ??)
温度(℃)
20
50
溶解度(g)
30
100
A.?37.5%??????????????????????????????????B.?23.1%??????????????????????????????????C.?28.6%??????????????????????????????????D.?60%
12.现有40g质量分数为10%的食盐溶液,要使其溶质的质量分数达到20%(无晶体析出),可采用的方法是(? )
①蒸发掉20克水; ②蒸发后18克水; ③加入 3.2克食盐;④加入5克食盐;
A.?①④????????????????????????????????????B.?①②????????????????????????????????????C.?②④????????????????????????????????????D.?①②④
13.如图为配制50g溶质质量分数为10%的氯化钠溶液的操作过程,下列有关操作与目的分析均正确的是( ???)
选项
操作
目的
A
用剩的食盐放回原试剂瓶
避免浪费
B
天平调平后在左、右托盘中各垫一张相同的纸
保证称取的食盐质量更准确
C
用50mL量筒替代天平量取所需的水
更加简便
D
溶解时用玻璃棒搅拌
增加食盐的溶解能力
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
14.某甲醇(CH4O)水溶液中,甲醇所含氢原子的个数是水中所含氢原子个数的 2 倍,求该溶液中溶质质量分数(?? )
A.?47%?????????????????????????????????????B.?64%?????????????????????????????????????C.?67%?????????????????????????????????????D.?78%
15.配制70克16%的NaCl溶液,下列操作会使所配溶液溶质质量分数大于16%的是(??? )
A.?称取氯化钠 ??????????????B.?转移氯化钠
C.?量取水 ???????????????????????????????????D.?配好后装瓶
16.现有100g10%的硝酸钠溶液,要使其溶质质量分数增大一倍,采取了以下方法
①再加入10g硝酸钠
②蒸发掉一半溶剂
③蒸发掉50g水
④再加入100g10%的该溶液
⑤与100g30%的该物质溶液混合。其中正确的有(??? )
A.?1个???????????????????????????????????????B.?2个???????????????????????????????????????C.?3个???????????????????????????????????????D.?4个
17.硝酸钾的溶解度如表,取20℃等质量的两份饱和硝酸钾溶液,第一份溶液升温到40℃;另一份溶液恒温蒸发10克水。则两份溶液中都不变化的量是( ???)
温度/℃
20
40
硝酸钾溶液解度/g
31.6
63.9
A.?溶质质量?????????????????????????B.?溶剂质量?????????????????????????C.?溶液质量?????????????????????????D.?溶质质量分数
18.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液,下列说法不正确的是(??? )
A.?所需氯化钠的质量为3g???????????????????????????????????????B.?氯化钠放在托盘天平的左盘称量
C.?俯视量筒读数会使所配溶液偏稀?????????????????????????D.?所需玻璃仪器有烧杯、玻璃棒、量筒等
二、多选题
19.t℃时,某固态物质的饱和溶液m克,其中溶质的质量分数为c%,则有关的下列说法中,正确的是(?? )
A.?将该溶液蒸发掉部分溶剂后,再降温至t℃,其溶质的质量分数仍为c%
B.?将该溶液升高温度后(溶剂不蒸发),溶液中溶质的质量分数会等于或小于c%
C.?在t℃时,增加溶质,溶液中溶质的质量分数就会大于c%
D.?在t℃时,这种物质的溶解度小于c克
三、填空题
20.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→________④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是????? 。
A.称取的食盐不纯,有杂质
B.配制好的溶液转移时,不小心有少量液体溅出
四、解答题
21.二氧化氯消毒液是国际上公认的新一代强力、安全、高效的消毒剂,能够迅速,彻底杀灭各种细菌(大肠杆菌、白色念珠菌等)和病毒(肝炎病毒、流感病毒等)。小应同学观察到瓶上的标签如表所示,试回答:
二氧化氯(ClO2)1000毫升
溶质质量分数
80%
密度
1.2克/厘米3
强腐蚀性,阴冷、密封储藏
(1)这1000毫升二氧化氯消毒液中含溶质二氧化氯多少克?
(2)若将这1000毫升二氧化氯消毒液与5000克水均匀混合,所得稀二氧化氧消毒液中二氧化氯的质量分数是多少?(小数点后保留一位有效数字)
(3)该校欲配置30千克20%的稀二氧化氯消毒液用以消毒,需多少千克这样二氧化氧消毒液和多少升水?
五、实验探究题
22.某同学配制60g溶质质量分数为5%的NaCl溶液,准备了下列实验用品。回答下列问题:
(1)配制过程中还缺少的一种玻璃仪器是________(填仪器名称),该仪器有的作用是________。
(2)计算所需NaCl的质量为________克。
(3)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用________(填仪器名称)滴加蒸馏水至刻度线。
(4)经检测,实验所得的溶液,溶质质量分数偏小,其原因可能有________(填序号)。
①氯化钠固体仍然不纯②量取水时,俯视读数
③称量时砝码端忘垫质量相同的纸片④装瓶时,有少量溶液洒出
答案解析部分
一、单选题
1. B
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数偏小,要么是溶质质量偏小,要么是溶剂质量偏小,据此分析判断。
解答:A. 调平时指针左偏,说明左盘重,当放入药品,天平达到平衡时,左盘药品的质量会偏小,故A错误;?
B. 量取水时,俯视读数,根据“俯视大仰视小”的规律可知,读出的示数偏大,而实际得到的体积偏小, 故B正确;
C. 转移氯化钠时有固体洒出,会使溶质的质量偏小,故C错误;?
D. 装瓶时有液体洒出,由于溶液具有均一稳定性,因此不会影响溶质质量分数的变化,故D错误。
故选B。?
2. B
分析:根据溶质质量分数=溶质质量溶液质量×100%分析即可。
解答:当硝酸钾溶液为不饱和溶液时,随着时间的延长,溶质的质量不变,而溶剂的质量减小,根据溶质质量溶液质量×100%可知,这段时间内溶质质量分数不断增大;
当硝酸钾溶液达到饱和后,不断有晶体析出,溶质的质量和溶剂的质量都在减小。硝酸钾的溶解度不变,根据溶解度溶解度+100g×100%可知,此时溶液的溶质质量分数保持不变。
故B符合题意,而A、C、D不合题意。
故选B。
3. A
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量偏小,要么是溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
解答:①称量的氯化钠固体中含有不溶性杂质,导致溶质质量偏小,故①符合题意;
②用量筒量取水时仰视读数,根据“俯视大仰视小”可知,读出的示数偏小,而实际量取的偏大,故②符合题意;
③往烧杯中加水时有水洒出,会导致溶剂质量偏小,溶质质量分数偏大,故③不合题意;
④将配制好的溶液装入试剂瓶中时有少量溅出,由于溶液均一稳定,所以不会影响溶质质量分数,故④不合题意。
那么导致溶质质量分数偏小的是①②。
故选A。
4. C
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数发生变化,要么是溶质质量变化,要么是溶剂质量变化,据此分析判断。
解答:由于试管中有剩余的甲物质,因此甲溶液是饱和的。
A.再加入少量的水,甲物质继续溶解,但还是饱和的。因为溶解度保持不变,所溶质质量分数不变,故A不合题意;
B.再蒸发一部分溶剂,恢复到20℃,此时溶液依然饱和。温度不变,溶解度不变,那么溶质质量分数不变,故B不合题意;?
C.升高温度到40℃,甲的溶解度增大,甲物质继续溶解,即溶质质量增大而溶剂质量不变,因此溶质质量分数肯定增大,故C符合题意;?
D.加40g甲的饱和溶液,恢复到20℃,此时溶液依然饱和。温度不变,溶解度不变,那么溶质质量分数不变,故D不合题意。
故选C。?
5. C
分析:(1)根据溶质质量分数=溶质质量溶液质量×100%分析;
(2)(3)物质的溶解度与温度有关;当温度不变时,溶解度不变,那么饱和溶液的溶质质量分数不变;
(4)溶剂的质量和溶解度的大小都会影响溶质的质量。
解答:根据图片可知,②③④都是饱和溶液。
A.在①→②过程中,溶质质量不变,但是溶剂质量变小,因此溶质质量分数变大,故A错误;?
B.在②→③过程中,氯化钠的的温度不变,那么它的溶解度保持不变,故B错误;
C.在②→③时,氯化钠的溶解度不变,那么饱和溶液的溶质质量分数保持不变;从③→④,温度升高,氯化钠的溶解度变大,那么溶质质量分数变大,故C正确;
D.在③→④过程中,虽然水的质量变小了,但是溶解度却变大了,因此结晶的氯化钠质量是否变大无法确定,故D错误。
故选C。
6. A
分析:根据配制一定溶质质量分数的溶液的实验过程选择实验器材即可。
解答:配制50克10%的氯化钠溶液的实验过程如下:
①计算;根据溶质质量=溶液质量×溶质质量分数计算出需要氯化钠的质量,用溶液质量减去氯化钠质量得到水的质量,根据密度公式计算出水的体积;
②用药匙从试剂瓶中取出氯化钠,并用托盘天平称量出规定质量的氯化钠,用量筒和滴管配合量出规定体积的水;
③将氯化钠和水倒入烧杯,并用玻璃棒不断搅拌,直到全部溶解即可。
因此不需要的是试管和酒精灯。
故选A。
7. A
分析:根据溶质质量分数=溶质质量溶液质量×100%计算比较即可。
解答:①和②中,溶质的质量不变,但是溶液质量减小,根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数增大;
②和③都是同一温度下的饱和溶液,因为溶解度不变,所以溶质质量分数保持不变;
③和④都是饱和溶液,但是④的温度较高,所以溶解度较大,溶质质量分数较大,因此溶质质量分数变大。因此溶质质量分数先变大、再保持不变,然后再变大。
故选A。
8. C
分析:(1)同种物质,温度不变时,饱和溶液的溶质质量分数肯定大于不饱和溶液;
(2)当物质的溶解度改变时,溶解度越大,饱和溶液的溶质质量分数越大,据此分析判断。
解答:①70℃的硝酸钾的不饱和溶液,蒸发水分,先变成70℃的饱和溶液,在这段时间内,溶质质量分数不断增大;
②70℃的硝酸钾饱和溶液恒温蒸发水分时,它始终处于饱和状态;因为溶解度不变,所以溶质质量分数不变;
③硝酸钾的饱和溶液从70℃降低到30℃的过程中,溶解度不断减小,因此溶质质量分数不断减小;
④30℃的硝酸钾的饱和溶液温度不变,恒温蒸发,那么溶质质量分数保持不变。
故C正确,A、B、D错误。
故选C。
9. B
分析:当饱和溶液析出晶体时,析出晶体的质量与溶剂减少的质量正正比,据此分析判断。
解答:根据“饱和溶液析出晶体质量与溶剂减少质量成正比”的规律可知,如果原来的硝酸钾溶液是饱和的,那么蒸发掉20g水析出的晶体质量肯定是10g水析出晶体的2倍,即2a=b;
? ? ? 如果原来的硝酸钾溶液不是饱和的,那么当水蒸发时,开始不会析出晶体,当溶液达到饱和时才会析出晶体。因此第一次蒸发10g水析出的晶体质量a肯定小于溶液饱和后蒸发10g水析出的晶体质量c,即a
10. C
分析:(1)同一温度下,同种物质的饱和溶液的溶质质量分数肯定大于不饱和溶液;
(2)根据溶质质量分数=溶质质量溶液质量×100%可知,溶解度越大,饱和溶液的溶质质量分数越大。
解答:①70℃时的mg硝酸钾的不饱和溶液,在恒温下蒸发水分,先从不饱和溶液变为饱和溶液,这段时间内,溶质质量分数在不断增大;
②当70℃饱和溶液继续恒温蒸发时,溶解度不变,那么它的溶质质量分数不变;
③当70℃饱和溶液降温时,由于溶解度不断减小,因此它的溶质质量分数减小;
④当溶液到达30℃时保持温度不变,那么溶解度不变,因此它的溶质质量分数不变。
故C正确,而A、B、D错误。
故选C。
11. A
分析:根据溶质质量分数=溶质质量溶液质量×100%计算即可。
解答:根据图片可知,在溶液4中,加入的溶质质量为:20g+20g+20g=60g,全部溶解,那么溶质质量分数为:60g100g+60g×100%=37.5%。
故选A。
12. A
分析:根据溶质质量分数=溶质质量溶液质量×100%计算即可。
解答:(1)设需要蒸发水的质量为x,
40g×10%=(40g-x)×20%;
解得:x=20g。
故①正确,②错误。
(2)设需要加入食盐的质量为y,
40g×10%+y=(40g+y)×20%;
解得:y=5g。
故③错误,④正确。
那么正确的是①④。
故选A。
13. C
分析:根据配制一定质量分数的溶液的实验操作过程分析判断。
解答:A.将剩下的实验放回试剂瓶,可能会污染整瓶药品,故A错误;
B.应该在天平调平前在两个托盘上各放一张纸,这样会更准确,故B错误;
C.根据公式m=ρV可知,用量筒测出规定体积的水,就能得到规定质量的水,故C正确;
D.溶解时用玻璃棒搅拌,不能增加实验的溶解能力,但是能够加快溶解速度,故D错误。
故选C。
14. B
分析:根据甲醇和水分子中氢原子个数分析,先确定出溶液中甲醇和水的分子个数比,再用相对质量计算溶液的溶质质量分数。
解答:1个甲醇分子中含有4个氢原子,一个水分子中含有2个氢原子,溶液甲醇所含氢原子的个数是水中所含氢原子个数的 2 倍,则甲醇分子和水分子个数比为1:1,则该溶液的溶质质量分数为12+4+1612+4+16+18×100%=64%;
故选B。
15. C
分析:根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数偏大,要么是氯化钠的质量偏大,要么是水的质量偏小,据此分析即可。
解答:A.称取氯化钠时,如果氯化钠和砝码的位置放反了,那么氯化钠的质量=砝码质量-游码质量,因此会偏小,故A错误;
B.转移氯化钠时,垫纸上会残留部分氯化钠,使其质量偏小,故B错误;?
C.量取水时俯视读数,读出的示数偏大,而实际得到的水的质量偏小,故C正确;?
D.配好后装瓶 ,对溶液的溶质质量分数没有影响,故D错误。
故选C。
16. B
分析:溶质的质量分数=溶质质量溶液质量×100% , 据此进行计算即可。
解答:100g10%的硝酸钠溶液中,溶质的质量为:100g×10%=10g,水的质量为:100g-10g=90g;
①再加入10g硝酸钠,溶质质量分数:10g+10g100g+10g×100%=18.18%≠20%;
②蒸发掉一半溶剂,溶质质量分数:10g10g+90g×12×100%=18.18%≠20%;
③蒸发掉50g水,溶质质量分数:10g100g-50g×100%=20%;
④再加入100g10%的该溶液,由于前后两种溶质质量分数相同,所以混合后溶质质量分数还是10%;
⑤100g30%的该物质溶液中溶质质量为:100g×30%=30g,那么混合后溶质质量分数:10g+30g100g+100g×100%=20%。
那么正确的是③⑤。
故选B。
17. D
分析:1、 40℃ 时的硝酸钾的溶解度大于 20℃ 时的硝酸钾的溶解度;
2、结晶的方法有蒸发溶剂和冷却热饱和溶液;
3、计算溶质质量分数的公式为:溶质质量分数=溶质质量溶液质量×100%。同温度下同种溶质的饱和溶液的溶质质量分数都相等。
解答:A、硝酸钾饱溶液温度升高时溶解度增大,20℃ 时的硝酸钾饱和溶液 升温到40℃ 时,变成不饱和溶液但是溶质质量是不变的 。但另一份溶液恒温蒸发10克水 后,会有部分硝酸钾晶体析出,溶质质量减少,A错误;
B、第一份升温时溶剂是不变的,另一份蒸发10克水后溶剂减少10克,B错误;
C、第一份由饱和变为不饱和,溶液质量不变。另一份蒸发10克水并有部分晶体析出,所以溶液质量是减少的,C错误;
D、温度由20℃ 上升到40℃时,溶质质量不变,溶剂质量不变,所以溶液的溶质质量分数是不变的。另一份恒温蒸发10克水后,仍是该温度下的饱和溶液溶质质量分数也不变,所以两份溶液的溶质质量分数均不变,D正确。
???????故选D
18. C
分析:根据配制溶液的操作步骤分析,结合天平的使用要求及俯视读数量取溶剂时实际体积楄大解答。
解答:A、 配制50g质量分数为6%的氯化钠溶液需氯化钠的质量为50g×6%=3g,不符合题意;
B、天平称量药品质量时要左物右码,不符合题意;
C、俯视量筒读数会使所量实际水的体积偏小,所配溶液偏浓,符合题意;
D、配制溶液所需玻璃仪器有烧杯、玻璃棒、量筒等,不符合题意;
故答案为:C。
二、多选题
19. A,B
分析:根据饱和溶液的溶质质量分数、溶液的转化以及溶解度的知识进行分析解答即可.
解答:解:A、将该溶液蒸发掉部分溶剂后,再降温至t℃,其溶质的质量分数仍为c%,正确;
B、将该溶液升高温度后(溶剂不蒸发),若是溶解度随温度的升高而增大,则溶液中溶质的质量分数不变,若是溶解度随温度的升高而减小,则溶液中的溶质质量分数变小,正确;
C、在t℃时,增加溶质,不能继续溶解,故溶液中溶质的质量分数不变,错误;
D、设在t℃时,这种物质的溶解度为x,则有: x100g+x=c100 ,故x大于c克,错误;
故选AB.
三、填空题
20. (1)⑤→①
(2)A
分析:(1)根据配制一定溶质质量分数的溶液的实验过程解答;
(2)根据溶质质量分数=溶质质量溶液质量×100%可知,食盐溶液的溶质质量分数偏小,要么是因为溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
解答:(1)配制溶液的步骤:
②从试剂瓶中取出食盐;
⑤用天平称量规定质量的食盐;
①将食盐倒入烧杯中;
④用量筒量取合适体积的水,然后倒入烧杯中;
③用玻璃棒搅拌,直至食盐完全溶解即可。
即②→⑤→①→④→③。
(2)A.称取的食盐不纯,那么食盐的质量偏小,从而导致溶质质量分析偏小,故①正确;
B.配制好的溶液是均一稳定的,即使有少量液体溅出,也不会影响溶质质量分数,故②错误。
故选A。
四、解答题
21. (1)解:m液=ρ液V液=1.2g/cm3×1000ml=1200g m质=80%m液=960g
(2)解:由于m质前=m质后 所以960g=P%×(1200g+5000g) 得到:P%=15.5%
(3)解:由于m质前=m质后 所以80%×m液=20%×30kg m液=7.5kgV加水=m加水ρ水=30kg?7.5kg1×103kg/m3=22.5L
分析:(1)首先根据密度公式m液=ρ液V液计算消毒液的质量,再根据溶质质量=溶液质量×溶质质量分数计算即可。
(2)稀释前后,溶质的质量保持不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程,计算出所得溶液的溶质质量分数。
(3)用(2)中的方法列出方程,计算出需要消毒液的质量,然后两个消毒液的质量之差就是需要加水的质量,最后根据V加水=m加水ρ水计算需要加水的体积。
解答:(1)二氧化氯消毒液的质量:m液=ρ液V液=1.2g/cm3×1000ml=1200g;
溶质的质量: m质=80%m液=80%×1200g=960g。
(2)由于m质前=m质后?,
所以960g=P%×(1200g+5000g);
得到:P%=15.5%。
(3)由于m质前=m质后,
所以80%×m液=20%×30kg ;
解得:m液=7.5kg;
需要加水的体积V加水=m加水ρ水=30kg-7.5kg1×103kg/m3=22.5×10-3m3=22.5L。
五、实验探究题
22. (1)玻璃棒;加速溶解
(2)3
(3)滴管
(4)①③
分析:(1)根据配制一定溶质质量分数溶液的实验过程分析所缺器材,并分析它的作用。
(2)根据溶质质量=溶液质量×溶质质量分数计算氯化钠的质量;
(3)根据量取一定体积液体的操作过程解答;
(4)根据溶质质量分数=溶质质量溶液质量×100%可知,溶质质量分数偏小的原因:①溶质质量偏小;②溶剂质量偏大,据此分析判断。
解答:(1)将氯化钠和水倒入烧杯后,需要用玻璃棒进行搅拌,加快溶解,因此缺少的玻璃仪器为玻璃棒,它的作用是加速溶解。
(2)需要NaCl的质量:60g×5%=3g;
(3)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用滴管滴加蒸馏水至刻度线。
(4)①氯化钠固体仍然不纯,会导致溶质的质量偏小,故①符合题意;
②量取水时,俯视读数,根据“俯视大仰视小”的规律可知,此时读数偏大,而实际得到水的质量偏小,故②不合题意;
③称量时砝码端忘垫质量相同的纸片,那么氯化钠的质量+垫纸的质量=砝码的质量,则氯化钠的质量偏小,故③符合题意;
④装瓶时,有少量溶液洒出,由于溶液均一稳定,因此不影响溶液的溶质质量分数,故④不合题意。
故选①③。
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
