溶液复习课件
图片预览






文档简介
(共15张PPT)
第二单元 溶液
复 习 课
肥城市边院镇初级中学 宿光洋
(1)通过对概念的复习,巩固同学们对概念的理解和掌握;
(2)使同学们对整单元的知识有一种系统的认知结构
(3) 加强对有关溶液稀释和配制的计算的训练;
1.知识目标:
2.能力目标:
培养同学们分析能力、思维能力、推理、归纳等能力。
3.情感态度及价值观:
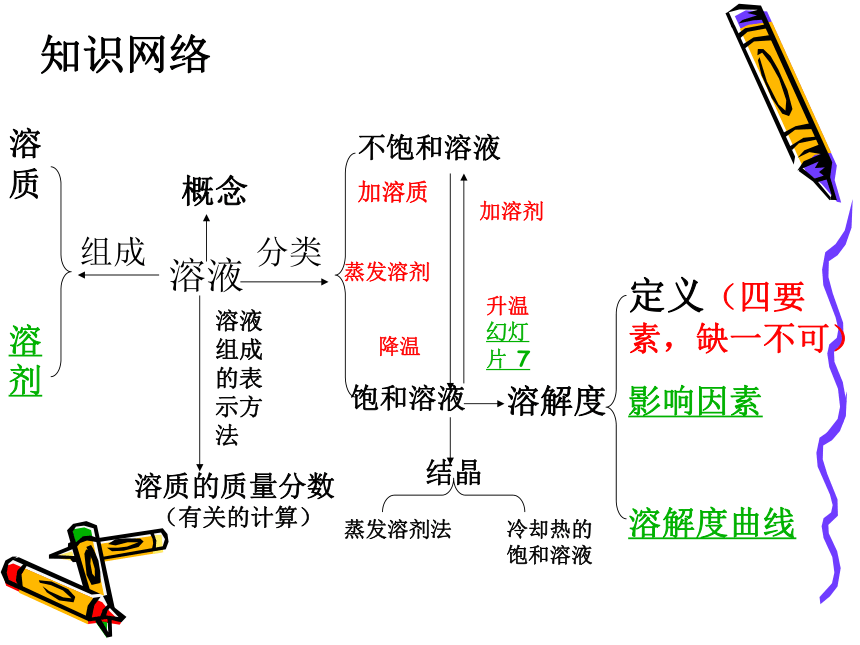
知识网络
溶液
组成
溶质
溶剂
分类
饱和溶液
不饱和溶液
加溶质
蒸发溶剂
降温
加溶剂
升温幻灯片 7
溶解度
定义(四要素,缺一不可)
影响因素
溶解度曲线
溶液组成的表示方法
溶质的质量分数
概念
结晶
蒸发溶剂法
冷却热的饱和溶液
(有关的计算)
(1).溶液质量=溶质质量+溶剂质量
×100%
(4).配制前溶质的质量=配制后溶质的质量
溶质质量
溶液质量
(2).溶质质量分数=
(3) .溶液的质量=体积×密度
3、指出下列溶液中的溶质:
稀硫酸______,澄清的石灰水______,稀盐酸______,
锌与稀盐酸完全反应得到的溶液______,白酒_______,
碘酒___。
H2SO4
Ca(OH)2
HCl
ZnCl2
I2
C2H5OH
1.下列常见物质中不属于溶液的是( )。
A.矿泉水 B.蒸馏水
C.盐水 D.汽水
训练题
B
2.下列关于溶液的说法错误的是( ) ①溶质只能是固体;②溶剂一定是水;③一种溶液只含有一种溶质;④溶液是无色的纯净物 A.①③④ B.①②③ C.②③④ D.①②③④
D
4.下列做法一定能把饱和溶液变成不饱和溶液的是( )
A.升高温度 B.增加溶剂
C.增加溶质 D.降低温度
5.判断一种溶液是否达到饱和状态的依据是( )
A.溶液中是否有不可溶解的固体存在
B.溶液能否继续溶解该种溶质
C.溶液颜色的深浅程度
D.测量溶液的密度
B
B
6、判断下列说法是否正确,如不正确,请说明理由。
(1)、向100g水中加入37g的NaCl刚好达到饱和状态,则NaCl的溶解度是37g。
(2)200C时,把15g的NaOH完全溶解于100g水,则该温度下NaOH的溶解度是15g。
(3) 200C时,向水中加入15g的NaOH刚好达到饱和状态,则该温度下NaOH溶解度是15g。
(4) 200C时,把36gNaCl溶于100g水中刚好达到饱和状态,则该温度下NaCl的溶解度是36g。
×
√
×
×
7.煮开水时,在水沸腾前就可以看到水中有气泡冒出,这是因为( )
A.温度升高使空气的溶解度变小
B.温度升高使空气的溶解度变大
C.压强增大使空气的溶解度变小
D.压强增大使空气的溶解度变
A
A
B
C
0
t1
t2
温度/℃
溶解度
g
t3
8、右图中是A、B、C三种固体物质的溶解度曲线。
请根据图像回答下列问题:
(1)在A、B、C三种物质中,溶解度受温度影响变化不大的物质是 ;
(2)在t2℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(3)相同质量的A、B两种物质的饱和溶液,温度从t3℃降低至t1℃时,析出晶体质量较多的是 。
C
C>A>B
A
9.在一定温度下,向一盛有10g氯化钠的烧杯内加入90 g水,充分搅拌后静置,烧杯底部的氯化钠固体完全溶解.求:该溶液中溶质的质量
该溶液中溶剂的质量
该溶液的质量
该溶液中溶质的质量分数
10g
90g
100g
10%
10.某温度时,有W g硝酸钾的不饱和溶液,在其他条件不变的情况下,向其中逐渐加入硝酸钾固体,图9-3中能正确表示此过程溶液中溶质的质量分数与加硝酸钾的质量的关系是( )
C
化学纯(CP)
体 积:500ml
品 名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
11.右图是硫酸厂刚生产一批的硫酸的标签上的部分内容,请阅读后完成:
(1)该硫酸未开启前溶液的质量为 ;
(2)该硫酸溶液的溶质的质量为 。
920g
901.6g
500mlX1.84g/cm3=920g
500mlX1.84g/cm3X98%=901.6g
12、右图是硫酸厂刚生产一批的硫酸的标签上的部分内容,请阅读后计算:实验室需要配制500g溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少ml ?需水多少ml
化学纯(CP)
体 积:500mL
品 名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
设需要这种硫酸的体积为V
500gX19.6%=VX1.84g/cm3X98%
V=?
需要水的质量=500g-VX1.84g/cm3 (数值上相当于体积)
第二单元 溶液
复 习 课
肥城市边院镇初级中学 宿光洋
(1)通过对概念的复习,巩固同学们对概念的理解和掌握;
(2)使同学们对整单元的知识有一种系统的认知结构
(3) 加强对有关溶液稀释和配制的计算的训练;
1.知识目标:
2.能力目标:
培养同学们分析能力、思维能力、推理、归纳等能力。
3.情感态度及价值观:
知识网络
溶液
组成
溶质
溶剂
分类
饱和溶液
不饱和溶液
加溶质
蒸发溶剂
降温
加溶剂
升温幻灯片 7
溶解度
定义(四要素,缺一不可)
影响因素
溶解度曲线
溶液组成的表示方法
溶质的质量分数
概念
结晶
蒸发溶剂法
冷却热的饱和溶液
(有关的计算)
(1).溶液质量=溶质质量+溶剂质量
×100%
(4).配制前溶质的质量=配制后溶质的质量
溶质质量
溶液质量
(2).溶质质量分数=
(3) .溶液的质量=体积×密度
3、指出下列溶液中的溶质:
稀硫酸______,澄清的石灰水______,稀盐酸______,
锌与稀盐酸完全反应得到的溶液______,白酒_______,
碘酒___。
H2SO4
Ca(OH)2
HCl
ZnCl2
I2
C2H5OH
1.下列常见物质中不属于溶液的是( )。
A.矿泉水 B.蒸馏水
C.盐水 D.汽水
训练题
B
2.下列关于溶液的说法错误的是( ) ①溶质只能是固体;②溶剂一定是水;③一种溶液只含有一种溶质;④溶液是无色的纯净物 A.①③④ B.①②③ C.②③④ D.①②③④
D
4.下列做法一定能把饱和溶液变成不饱和溶液的是( )
A.升高温度 B.增加溶剂
C.增加溶质 D.降低温度
5.判断一种溶液是否达到饱和状态的依据是( )
A.溶液中是否有不可溶解的固体存在
B.溶液能否继续溶解该种溶质
C.溶液颜色的深浅程度
D.测量溶液的密度
B
B
6、判断下列说法是否正确,如不正确,请说明理由。
(1)、向100g水中加入37g的NaCl刚好达到饱和状态,则NaCl的溶解度是37g。
(2)200C时,把15g的NaOH完全溶解于100g水,则该温度下NaOH的溶解度是15g。
(3) 200C时,向水中加入15g的NaOH刚好达到饱和状态,则该温度下NaOH溶解度是15g。
(4) 200C时,把36gNaCl溶于100g水中刚好达到饱和状态,则该温度下NaCl的溶解度是36g。
×
√
×
×
7.煮开水时,在水沸腾前就可以看到水中有气泡冒出,这是因为( )
A.温度升高使空气的溶解度变小
B.温度升高使空气的溶解度变大
C.压强增大使空气的溶解度变小
D.压强增大使空气的溶解度变
A
A
B
C
0
t1
t2
温度/℃
溶解度
g
t3
8、右图中是A、B、C三种固体物质的溶解度曲线。
请根据图像回答下列问题:
(1)在A、B、C三种物质中,溶解度受温度影响变化不大的物质是 ;
(2)在t2℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(3)相同质量的A、B两种物质的饱和溶液,温度从t3℃降低至t1℃时,析出晶体质量较多的是 。
C
C>A>B
A
9.在一定温度下,向一盛有10g氯化钠的烧杯内加入90 g水,充分搅拌后静置,烧杯底部的氯化钠固体完全溶解.求:该溶液中溶质的质量
该溶液中溶剂的质量
该溶液的质量
该溶液中溶质的质量分数
10g
90g
100g
10%
10.某温度时,有W g硝酸钾的不饱和溶液,在其他条件不变的情况下,向其中逐渐加入硝酸钾固体,图9-3中能正确表示此过程溶液中溶质的质量分数与加硝酸钾的质量的关系是( )
C
化学纯(CP)
体 积:500ml
品 名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
11.右图是硫酸厂刚生产一批的硫酸的标签上的部分内容,请阅读后完成:
(1)该硫酸未开启前溶液的质量为 ;
(2)该硫酸溶液的溶质的质量为 。
920g
901.6g
500mlX1.84g/cm3=920g
500mlX1.84g/cm3X98%=901.6g
12、右图是硫酸厂刚生产一批的硫酸的标签上的部分内容,请阅读后计算:实验室需要配制500g溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少ml ?需水多少ml
化学纯(CP)
体 积:500mL
品 名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
设需要这种硫酸的体积为V
500gX19.6%=VX1.84g/cm3X98%
V=?
需要水的质量=500g-VX1.84g/cm3 (数值上相当于体积)
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
