辽宁省六校2020-2021学年高一下学期期中联考化学试卷 Word版含答案
文档属性
| 名称 | 辽宁省六校2020-2021学年高一下学期期中联考化学试卷 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 284.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-17 22:12:09 | ||
图片预览


文档简介
____________________________________________________________________________________________
2020——2021学年度(下)省六校协作体高一期中联考
化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H 1 Li 7 N 14 O 16 Mg 24 Cu 64
Ⅰ客观试卷(45分)
一、单项选择题(共15小题,每题只有一个符合题意的选项,每题3分,共45分)
1.人类在提高自身生活水平的同时还应关注环境问题,下列叙述不正确的是
A.化石燃料的高消耗、森林面积锐减是造成大气中二氧化碳浓度增高的主要原因
B.氮氧化物和硫的氧化物都是形成酸雨的主要物质
C.回收废旧电池的目的是因为废旧电池对空气产生污染以及材料的回收再利用
D.当进入水体的氮的含量增大时,会造成水体的富营养化从而破坏水质
2.下列说法正确的是
A.氮化硅陶瓷,光导纤维,石英玻璃都属于新型无机非金属材料
B.刚玉、金刚砂,红宝石、蓝宝石的主要成分是氧化铝
C.石英、硅石、水晶、珍珠、玛瑙主要成分都是SiO2
D.钾长石(K2Al2Si6O16)写成氧化物的形式为K2O·Al2O3·6SiO2
3.某反应由两步反应A→B→C构成,它的反应能量曲线如图,下列叙述正确的是
A.三种化合物中C最稳定
B.两步反应均为吸热反应
C.A与C的能量差为E4
D.A→B的反应条件一定要加热
4.已知金属单质X、Y、Z、W之间有下列关系:
①2X+3Y2+===2X3++3Y;
②Z元素最高价氧化物对应的水化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极。
则X、Y、Z、W的还原性由强到弱的顺序为
A.X>Z>Y>W B.Z>W>X>Y C.Z>Y>X>W D.Z>X>Y>W
5.下列实验结论正确的是
A.向某无色溶液中滴加BaCl2溶液产生白色沉淀,再加盐酸沉淀不溶解,证明该溶液中含SO42-
B.向某溶液中加NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明该溶液中含NH4+
C.向Na2SO3溶液中加BaCl2溶液产生白色沉淀,再加稀HNO3,沉淀未溶解,说明该溶液已变质
D.Cu与浓HNO3反应生成NO2,与稀HNO3反应生成NO,说明稀HNO3的氧化性强于浓HNO3
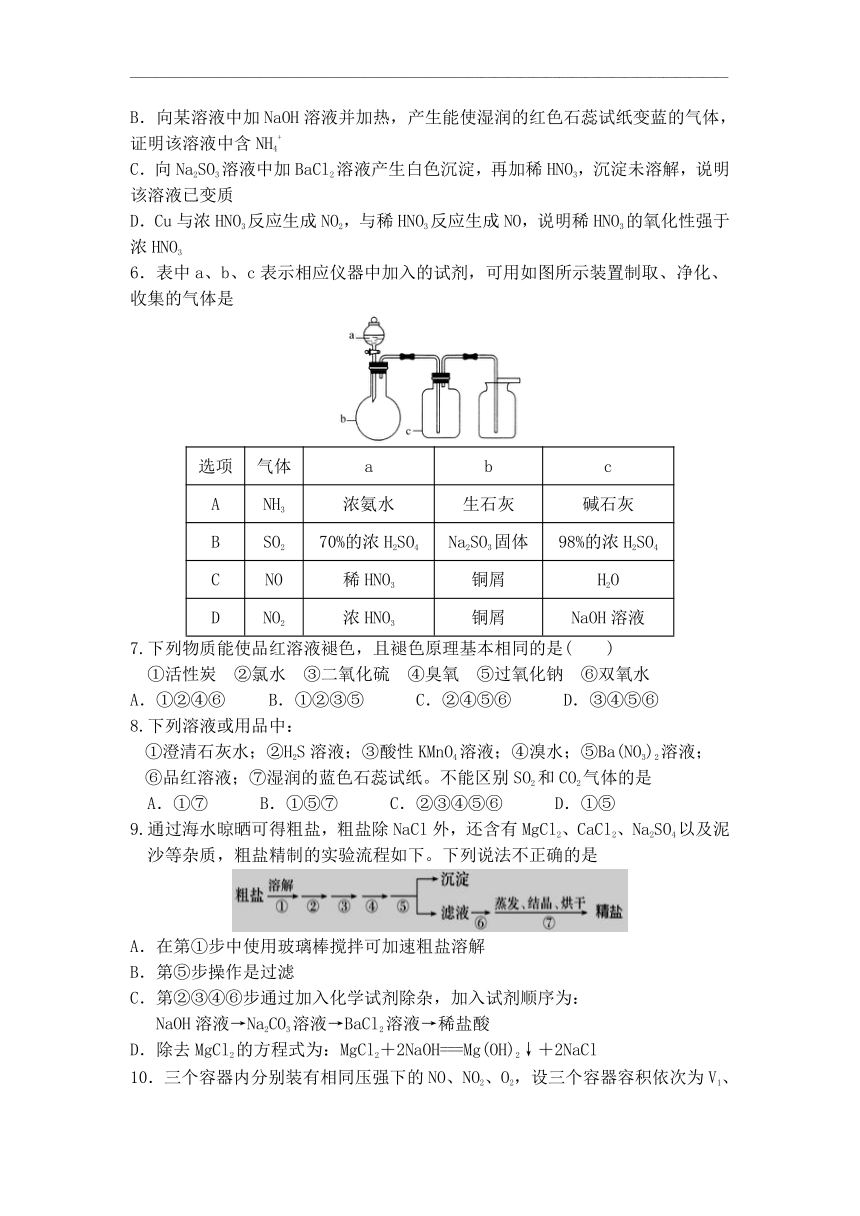
6.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是
选项 气体 a b c
A NH3 浓氨水 生石灰 碱石灰
B SO2 70%的浓H2SO4 Na2SO3固体 98%的浓H2SO4
C NO 稀HNO3 铜屑 H2O
D NO2 浓HNO3 铜屑 NaOH溶液
7.下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④⑥ B.①②③⑤ C.②④⑤⑥ D.③④⑤⑥
8.下列溶液或用品中:
①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;
⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是
A.①⑦ B.①⑤⑦ C.②③④⑤⑥ D.①⑤
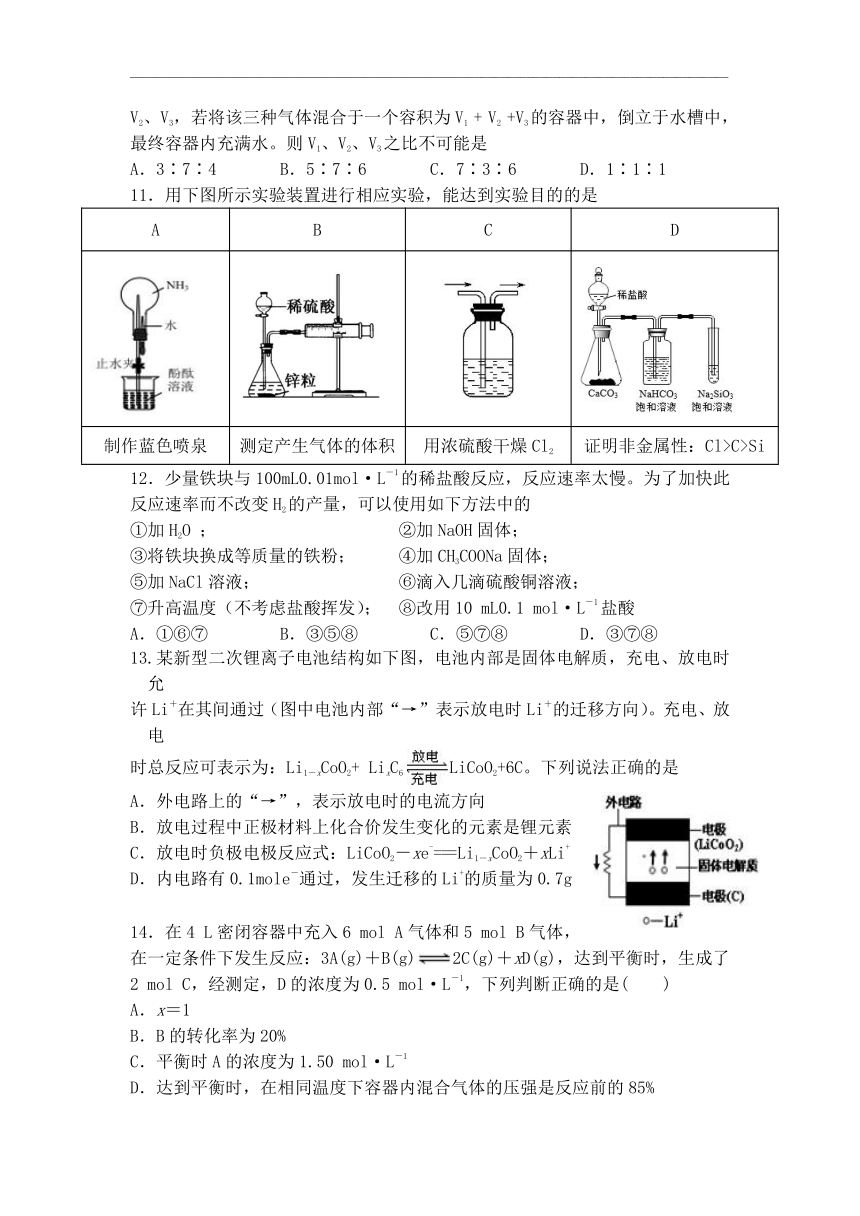
9.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:
NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去MgCl2的方程式为:MgCl2+2NaOH===Mg(OH)2↓+2NaCl
10.三个容器内分别装有相同压强下的NO、NO2、O2,设三个容器容积依次为V1、V2、V3,若将该三种气体混合于一个容积为V1 + V2 +V3的容器中,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是
A.3∶7∶4 B.5∶7∶6 C.7∶3∶6 D.1∶1∶1
11.用下图所示实验装置进行相应实验,能达到实验目的的是
A B C D
制作蓝色喷泉 测定产生气体的体积 用浓硫酸干燥Cl2 证明非金属性:Cl>C>Si
12.少量铁块与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ; ②加NaOH固体;
③将铁块换成等质量的铁粉; ④加CH3COONa固体;
⑤加NaCl溶液; ⑥滴入几滴硫酸铜溶液;
⑦升高温度(不考虑盐酸挥发); ⑧改用10 mL0.1 mol·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.⑤⑦⑧ D.③⑦⑧
13.某新型二次锂离子电池结构如下图,电池内部是固体电解质,充电、放电时允
许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向)。充电、放电
时总反应可表示为:Li1-xCoO2+ LixC6 LiCoO2+6C。下列说法正确的是
A.外电路上的“→”,表示放电时的电流方向
B.放电过程中正极材料上化合价发生变化的元素是锂元素
C.放电时负极电极反应式:LiCoO2-xe-===Li1-xCoO2+xLi+
D.内电路有0.1mole-通过,发生迁移的Li+的质量为0.7g
14.在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
15.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:
2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A.4 B.5 C.6 D.7
Ⅱ主观试卷(55分)
二、填空题(共4道题,共计55分)
16.(12分)化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_________________.
(2)最重要的人工固氮途径是_________________(用化学方程式表示);
(3)“硅材料”是无机非金属材料的主角,其中广泛应用的光导纤维成分是____;
(4)陶瓷、水泥和玻璃是常用的传统无机非金属材料,其中生产普通玻璃的主要原料有____ _____;
(5)盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是_________________(用离子方程式表示).
(6)铅蓄电池在汽车和电动车中都有广泛应用,该电池放电时的正极电极反应式为
17.(12分) X、Y、Z 是中学化学常见的三种物质,它们之间的相互转化关系如下(X、Y、Z、E、F 为英文字母,部分反应条件及产物略去)
(1).若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。
①Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,该反应的化学方程式为___ __;
②Z的水溶液可以制得某种强酸 E。实验室用 98%的浓 E(ρ = 1.84g·cm?3)溶液配制l.5mol·L?1稀 E 溶液240?mL,制该稀 E 溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、玻璃棒和___ __;
(2).若Z是淡黄色固体粉末,在呼吸面具或潜水艇中由Z和 CO2制备氧气的化学反应方程式为___ __;
(3).若Z是红棕色气体。
①试写出 Z 与水反应制备另一种强酸 F 的化学方程式____ _;
②2.0g铜镁合金完全溶解于100mL 密度为 1.40g·mL?1质量分数为 63%的浓F溶液中,得到Z 和N2O4(Z和N2O4均为浓F 溶液的还原产物)的混合气体1792mL(标准状况),向反应后的溶液中加入1.0mol·L?1NaOH 溶液,当金属离子全部沉淀,得到3.7g沉淀。则合金中铜与镁的物质的量之比为_____,加入 NaOH 溶液的体积为_____ mL 。
18.(15分)某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为______;仪器b中可选择的试剂为___ ___。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式___ ___。
(4)E装置中浓硫酸的作用____ __。
(5)读取气体体积前,应对装置F进行的操作:___ ___。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为__(用含m、n字母的代数式表示)。
19.(16分)按要求回答下列问题:
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末
③干冰汽化 ④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应 ⑥NaHCO3与盐酸的反应
(2)反应C(s)+H2O(g)CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图:
①从3 min到9 min,υ(H2)=__ (结果保留两位有效数字);
a点时v(正) _ v(逆)(填﹥、﹤或=,下同);
第9分钟时υ逆(CH3OH) ______第3分钟时υ正(CH3OH);
②若已知生成标准状况下2.24L CH3OH(g)时放出热量为 4.9kJ,而上述反应的实际放热量总小于 49 kJ,其原因是______________________________。
(4)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。
①该微生物燃料电池,负极为____(填“a”或“b”);
②该电池正极电极反应式为____________________
③当电路中有0.5 mol电子发生转移,则有____ mol的H+通过质子交换膜。
2020——2021学年度(下)省六校协作体高一期中联考
化学试题答案
1 2 3 4 5 6 7 8
C D A D B B C A
9 10 11 12 13 14 15
C B C D A B C
16.(每空2分,共12分)
(1)防止硫酸亚铁被氧化
(2)N2+3H22NH3
(3) SiO2
(4)纯碱、石英、石灰石(写化学式也可)
(5)SiO2+2OH-=SiO32-+H2O
(6)PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l)(未写状态不扣分)
17.(每空2分,共12分)
(1)①2NH3?H2O+SO2=(NH4)2SO3+H2O ②250mL容量瓶
(2)2Na2O2+2CO2=2Na2CO3+O2
(3)①3NO2+H2O=2HNO3+NO ②2:3 1300
18.(共15分)
(1)分液漏斗(1分) 固体氢氧化钠或氧化钙或碱石灰(2分)
(2)BC(2分)
(3)还原(2分) 3CuO+2NH33Cu+3H2O+N2(2分)
(4)吸收未反应的氨气,阻止F中水蒸气进入D(2分)
(5)慢慢上下移动右边漏斗,使左右两管液面相平(2分)
(6)(2分)
19.(共16分)
(1)②④⑥(2分)
(2)①③(2分)
(3)①0.042 mol/(L·min) (2分) ﹥(1分) ﹤(1分)
②该反应是可逆反应,1mol CO2和3mol H2不可能完全反应,所以放出的热量总是小于49kJ(2分)
(4)①a (2分)
②2O2+8e-+8H+===4H2O(2分)
③0.5(2分)
2020——2021学年度(下)省六校协作体高一期中联考
化学试题
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H 1 Li 7 N 14 O 16 Mg 24 Cu 64
Ⅰ客观试卷(45分)
一、单项选择题(共15小题,每题只有一个符合题意的选项,每题3分,共45分)
1.人类在提高自身生活水平的同时还应关注环境问题,下列叙述不正确的是
A.化石燃料的高消耗、森林面积锐减是造成大气中二氧化碳浓度增高的主要原因
B.氮氧化物和硫的氧化物都是形成酸雨的主要物质
C.回收废旧电池的目的是因为废旧电池对空气产生污染以及材料的回收再利用
D.当进入水体的氮的含量增大时,会造成水体的富营养化从而破坏水质
2.下列说法正确的是
A.氮化硅陶瓷,光导纤维,石英玻璃都属于新型无机非金属材料
B.刚玉、金刚砂,红宝石、蓝宝石的主要成分是氧化铝
C.石英、硅石、水晶、珍珠、玛瑙主要成分都是SiO2
D.钾长石(K2Al2Si6O16)写成氧化物的形式为K2O·Al2O3·6SiO2
3.某反应由两步反应A→B→C构成,它的反应能量曲线如图,下列叙述正确的是
A.三种化合物中C最稳定
B.两步反应均为吸热反应
C.A与C的能量差为E4
D.A→B的反应条件一定要加热
4.已知金属单质X、Y、Z、W之间有下列关系:
①2X+3Y2+===2X3++3Y;
②Z元素最高价氧化物对应的水化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极。
则X、Y、Z、W的还原性由强到弱的顺序为
A.X>Z>Y>W B.Z>W>X>Y C.Z>Y>X>W D.Z>X>Y>W
5.下列实验结论正确的是
A.向某无色溶液中滴加BaCl2溶液产生白色沉淀,再加盐酸沉淀不溶解,证明该溶液中含SO42-
B.向某溶液中加NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明该溶液中含NH4+
C.向Na2SO3溶液中加BaCl2溶液产生白色沉淀,再加稀HNO3,沉淀未溶解,说明该溶液已变质
D.Cu与浓HNO3反应生成NO2,与稀HNO3反应生成NO,说明稀HNO3的氧化性强于浓HNO3
6.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是
选项 气体 a b c
A NH3 浓氨水 生石灰 碱石灰
B SO2 70%的浓H2SO4 Na2SO3固体 98%的浓H2SO4
C NO 稀HNO3 铜屑 H2O
D NO2 浓HNO3 铜屑 NaOH溶液
7.下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④⑥ B.①②③⑤ C.②④⑤⑥ D.③④⑤⑥
8.下列溶液或用品中:
①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;
⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是
A.①⑦ B.①⑤⑦ C.②③④⑤⑥ D.①⑤
9.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.第⑤步操作是过滤
C.第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:
NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D.除去MgCl2的方程式为:MgCl2+2NaOH===Mg(OH)2↓+2NaCl
10.三个容器内分别装有相同压强下的NO、NO2、O2,设三个容器容积依次为V1、V2、V3,若将该三种气体混合于一个容积为V1 + V2 +V3的容器中,倒立于水槽中,最终容器内充满水。则V1、V2、V3之比不可能是
A.3∶7∶4 B.5∶7∶6 C.7∶3∶6 D.1∶1∶1
11.用下图所示实验装置进行相应实验,能达到实验目的的是
A B C D
制作蓝色喷泉 测定产生气体的体积 用浓硫酸干燥Cl2 证明非金属性:Cl>C>Si
12.少量铁块与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ; ②加NaOH固体;
③将铁块换成等质量的铁粉; ④加CH3COONa固体;
⑤加NaCl溶液; ⑥滴入几滴硫酸铜溶液;
⑦升高温度(不考虑盐酸挥发); ⑧改用10 mL0.1 mol·L-1盐酸
A.①⑥⑦ B.③⑤⑧ C.⑤⑦⑧ D.③⑦⑧
13.某新型二次锂离子电池结构如下图,电池内部是固体电解质,充电、放电时允
许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向)。充电、放电
时总反应可表示为:Li1-xCoO2+ LixC6 LiCoO2+6C。下列说法正确的是
A.外电路上的“→”,表示放电时的电流方向
B.放电过程中正极材料上化合价发生变化的元素是锂元素
C.放电时负极电极反应式:LiCoO2-xe-===Li1-xCoO2+xLi+
D.内电路有0.1mole-通过,发生迁移的Li+的质量为0.7g
14.在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
15.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:
2A(g)+B(s) C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A.4 B.5 C.6 D.7
Ⅱ主观试卷(55分)
二、填空题(共4道题,共计55分)
16.(12分)化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是_________________.
(2)最重要的人工固氮途径是_________________(用化学方程式表示);
(3)“硅材料”是无机非金属材料的主角,其中广泛应用的光导纤维成分是____;
(4)陶瓷、水泥和玻璃是常用的传统无机非金属材料,其中生产普通玻璃的主要原料有____ _____;
(5)盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是_________________(用离子方程式表示).
(6)铅蓄电池在汽车和电动车中都有广泛应用,该电池放电时的正极电极反应式为
17.(12分) X、Y、Z 是中学化学常见的三种物质,它们之间的相互转化关系如下(X、Y、Z、E、F 为英文字母,部分反应条件及产物略去)
(1).若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。
①Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,该反应的化学方程式为___ __;
②Z的水溶液可以制得某种强酸 E。实验室用 98%的浓 E(ρ = 1.84g·cm?3)溶液配制l.5mol·L?1稀 E 溶液240?mL,制该稀 E 溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、玻璃棒和___ __;
(2).若Z是淡黄色固体粉末,在呼吸面具或潜水艇中由Z和 CO2制备氧气的化学反应方程式为___ __;
(3).若Z是红棕色气体。
①试写出 Z 与水反应制备另一种强酸 F 的化学方程式____ _;
②2.0g铜镁合金完全溶解于100mL 密度为 1.40g·mL?1质量分数为 63%的浓F溶液中,得到Z 和N2O4(Z和N2O4均为浓F 溶液的还原产物)的混合气体1792mL(标准状况),向反应后的溶液中加入1.0mol·L?1NaOH 溶液,当金属离子全部沉淀,得到3.7g沉淀。则合金中铜与镁的物质的量之比为_____,加入 NaOH 溶液的体积为_____ mL 。
18.(15分)某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为______;仪器b中可选择的试剂为___ ___。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式___ ___。
(4)E装置中浓硫酸的作用____ __。
(5)读取气体体积前,应对装置F进行的操作:___ ___。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为__(用含m、n字母的代数式表示)。
19.(16分)按要求回答下列问题:
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末
③干冰汽化 ④氯酸钾分解制氧气
⑤甲烷在氧气中的燃烧反应 ⑥NaHCO3与盐酸的反应
(2)反应C(s)+H2O(g)CO(g)+H2(g)在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积变大
(3)在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图:
①从3 min到9 min,υ(H2)=__ (结果保留两位有效数字);
a点时v(正) _ v(逆)(填﹥、﹤或=,下同);
第9分钟时υ逆(CH3OH) ______第3分钟时υ正(CH3OH);
②若已知生成标准状况下2.24L CH3OH(g)时放出热量为 4.9kJ,而上述反应的实际放热量总小于 49 kJ,其原因是______________________________。
(4)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示。
①该微生物燃料电池,负极为____(填“a”或“b”);
②该电池正极电极反应式为____________________
③当电路中有0.5 mol电子发生转移,则有____ mol的H+通过质子交换膜。
2020——2021学年度(下)省六校协作体高一期中联考
化学试题答案
1 2 3 4 5 6 7 8
C D A D B B C A
9 10 11 12 13 14 15
C B C D A B C
16.(每空2分,共12分)
(1)防止硫酸亚铁被氧化
(2)N2+3H22NH3
(3) SiO2
(4)纯碱、石英、石灰石(写化学式也可)
(5)SiO2+2OH-=SiO32-+H2O
(6)PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l)(未写状态不扣分)
17.(每空2分,共12分)
(1)①2NH3?H2O+SO2=(NH4)2SO3+H2O ②250mL容量瓶
(2)2Na2O2+2CO2=2Na2CO3+O2
(3)①3NO2+H2O=2HNO3+NO ②2:3 1300
18.(共15分)
(1)分液漏斗(1分) 固体氢氧化钠或氧化钙或碱石灰(2分)
(2)BC(2分)
(3)还原(2分) 3CuO+2NH33Cu+3H2O+N2(2分)
(4)吸收未反应的氨气,阻止F中水蒸气进入D(2分)
(5)慢慢上下移动右边漏斗,使左右两管液面相平(2分)
(6)(2分)
19.(共16分)
(1)②④⑥(2分)
(2)①③(2分)
(3)①0.042 mol/(L·min) (2分) ﹥(1分) ﹤(1分)
②该反应是可逆反应,1mol CO2和3mol H2不可能完全反应,所以放出的热量总是小于49kJ(2分)
(4)①a (2分)
②2O2+8e-+8H+===4H2O(2分)
③0.5(2分)
同课章节目录
