第18章 第4节玻尔的原子模型 课件 18张PPT
文档属性
| 名称 | 第18章 第4节玻尔的原子模型 课件 18张PPT |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2021-05-18 14:02:48 | ||
图片预览



文档简介
(共18张PPT)
第十八章
原子结构
第四节
玻尔的原子模型
科学靠两条腿走路,一是理论,一是实验。有时一条腿走在前面,有时另一条腿走在前面。但只有使用两条腿,才能前进。
-----密立根
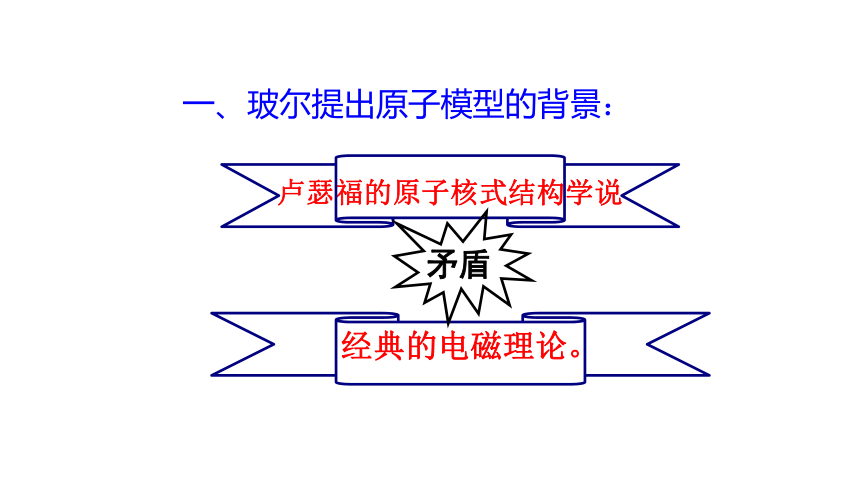
卢瑟福的原子核式结构学说
一、玻尔提出原子模型的背景:
经典的电磁理论。
矛盾
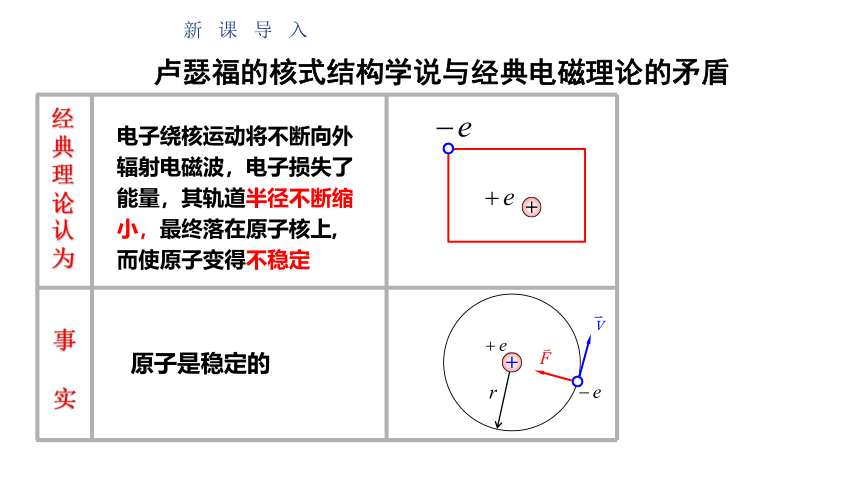
电子绕核运动将不断向外辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,而使原子变得不稳定
+
经典理论认为
事
实
+
原子是稳定的
卢瑟福的核式结构学说与经典电磁理论的矛盾
新课导入
经典理论认为
事
实
由于电子轨道的变化是连续的,辐射电磁波的频率等于绕核运动的频率,连续变化,原子光谱应该是连续光谱
原子光谱是不连续的,是线状谱
卢瑟福的核式结构学说与经典电磁理论的矛盾
新课导入
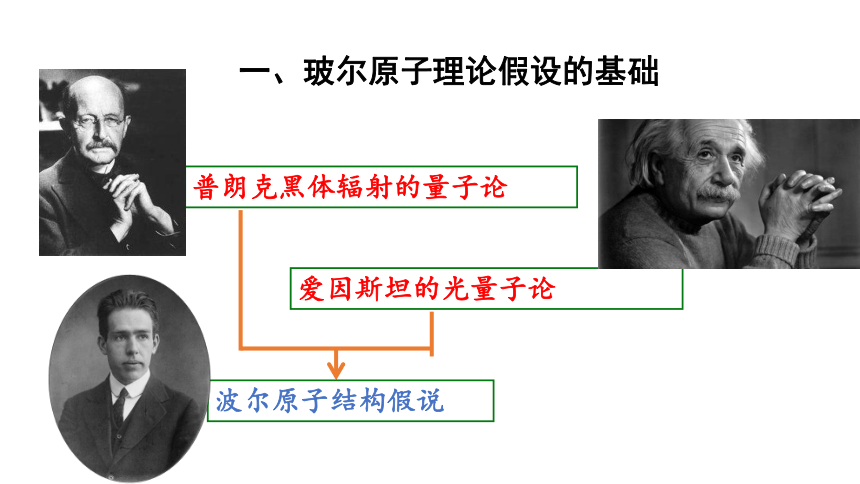
一、玻尔原子理论假设的基础
普朗克黑体辐射的量子论
爱因斯坦的光量子论
波尔原子结构假说
针对原子核式结构模型提出
【内容】
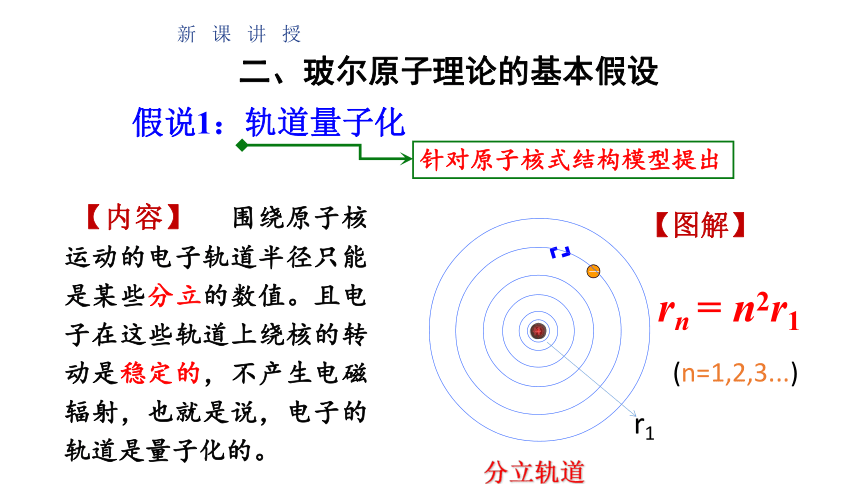
围绕原子核运动的电子轨道半径只能是某些分立的数值。且电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射,也就是说,电子的轨道是量子化的。
二、玻尔原子理论的基本假设
假说1:轨道量子化
新课讲授
分立轨道
r1
rn
=
n2r1
(n=1,2,3...)
【图解】
针对原子的稳定性提出
【内容】
电子在不同的轨道上运动,原子处于不同的状态。玻尔指出,原子在不同的状态中具有不同的能量,所以原子的能量也是量子化的。在这些状态中原子是稳定的。
假说2:能量量子化——能级(定态)
能级:量子化的能量值。
定态:原子中具有确定能量的稳
定状态。
基态:能量最低的状态(离核最近)
激发态:其他的能量状态
1
2
3
轨道与能级相对应
基态
激发态
量子数
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
【图解】
针对原子光谱是
线状谱提出
假说3:频率条件(跃迁假说)
原子在始、末两个能级
Em
和
En
(
Em>En
)
间跃迁时,发射
(或吸收)
光子的能量由前后能级的能量差决定:
【内容】
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
【图解】
rn
=
n2r1
En
=
E1/n2
r1
=
0.053
nm
?
玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢电子可能的轨道半径和对应的能量值。解释了氢原子光谱是分立的亮线,并计算出对应的波长。
三、玻尔理论对氢光谱的解释
(n
=
1,2,3,···)
(n
=
1,2,3,···)
挑战新知一
氢原子从高能级向低能级跃迁,下列物理量如何变化?
1、电子轨道半径(变大/变小)
2、原子能量(变大/变小)
3、电子动能(变大/变小)
4、电子与原子核之间的电势能(变大/变小)
挑战新知二
某个氢原子处于n=4能级,它发出的可能光子有几种?哪种光子的频率最大?那种波长最长?(画图说明)
n=6
n=5
n=4
n=1
n=3
n=2
Hδ
Hγ
Hβ
Hα
H
:如何由波尔假说推导巴尔末公式?
挑战新知三
四、玻尔理论的成功之处和局限性
1、成功之处:引入了“量子”的观念成功解释了氢原子的线状光谱
2、局限之处:
(1)对于外层电子较多元素的原子光谱,其理论
与事实相差很大
(2)过多地引用了经典的物理理论,比如轨道
1、下面关于玻尔理论的解释中,不正确的说法是(
)
A、原子只能处于一系列不连续的状态中,每个状态都对应一定的能量
B、原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量
C、原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子
D、原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的
C
【针对训练】:
【针对训练】
2.根据玻尔理论,在氢原子中量子数n越大,则( )
A.电子轨道半径越小
B.核外电子速度越小
C.原子能级能量越小
D.原子的电势能越小
离原子核越远
大
大
大
B
3.氢原子辐射出一个光子后,则( )
A.电子绕核旋转的半径增大
B.电子的动能增大
C.氢原子的电势能增大
D.原子的能级值增大
高能级到低能级
高轨道到低轨道
B
小结
一、玻尔原子结构模型内容
1、轨道量子化假设
2、能量量子化假设
3、跃迁假设
二、玻尔理论对氢光谱的解释
1、向低能级跃迁
发射光子
2、向高能级跃迁
吸收光子
三、玻尔理论的成功与局限之处
1、成功之处:
2、局限之处:
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
分立轨道
rn
=
n2r1
能级
第十八章
原子结构
第四节
玻尔的原子模型
科学靠两条腿走路,一是理论,一是实验。有时一条腿走在前面,有时另一条腿走在前面。但只有使用两条腿,才能前进。
-----密立根
卢瑟福的原子核式结构学说
一、玻尔提出原子模型的背景:
经典的电磁理论。
矛盾
电子绕核运动将不断向外辐射电磁波,电子损失了能量,其轨道半径不断缩小,最终落在原子核上,而使原子变得不稳定
+
经典理论认为
事
实
+
原子是稳定的
卢瑟福的核式结构学说与经典电磁理论的矛盾
新课导入
经典理论认为
事
实
由于电子轨道的变化是连续的,辐射电磁波的频率等于绕核运动的频率,连续变化,原子光谱应该是连续光谱
原子光谱是不连续的,是线状谱
卢瑟福的核式结构学说与经典电磁理论的矛盾
新课导入
一、玻尔原子理论假设的基础
普朗克黑体辐射的量子论
爱因斯坦的光量子论
波尔原子结构假说
针对原子核式结构模型提出
【内容】
围绕原子核运动的电子轨道半径只能是某些分立的数值。且电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射,也就是说,电子的轨道是量子化的。
二、玻尔原子理论的基本假设
假说1:轨道量子化
新课讲授
分立轨道
r1
rn
=
n2r1
(n=1,2,3...)
【图解】
针对原子的稳定性提出
【内容】
电子在不同的轨道上运动,原子处于不同的状态。玻尔指出,原子在不同的状态中具有不同的能量,所以原子的能量也是量子化的。在这些状态中原子是稳定的。
假说2:能量量子化——能级(定态)
能级:量子化的能量值。
定态:原子中具有确定能量的稳
定状态。
基态:能量最低的状态(离核最近)
激发态:其他的能量状态
1
2
3
轨道与能级相对应
基态
激发态
量子数
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
【图解】
针对原子光谱是
线状谱提出
假说3:频率条件(跃迁假说)
原子在始、末两个能级
Em
和
En
(
Em>En
)
间跃迁时,发射
(或吸收)
光子的能量由前后能级的能量差决定:
【内容】
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
【图解】
rn
=
n2r1
En
=
E1/n2
r1
=
0.053
nm
?
玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢电子可能的轨道半径和对应的能量值。解释了氢原子光谱是分立的亮线,并计算出对应的波长。
三、玻尔理论对氢光谱的解释
(n
=
1,2,3,···)
(n
=
1,2,3,···)
挑战新知一
氢原子从高能级向低能级跃迁,下列物理量如何变化?
1、电子轨道半径(变大/变小)
2、原子能量(变大/变小)
3、电子动能(变大/变小)
4、电子与原子核之间的电势能(变大/变小)
挑战新知二
某个氢原子处于n=4能级,它发出的可能光子有几种?哪种光子的频率最大?那种波长最长?(画图说明)
n=6
n=5
n=4
n=1
n=3
n=2
Hδ
Hγ
Hβ
Hα
H
:如何由波尔假说推导巴尔末公式?
挑战新知三
四、玻尔理论的成功之处和局限性
1、成功之处:引入了“量子”的观念成功解释了氢原子的线状光谱
2、局限之处:
(1)对于外层电子较多元素的原子光谱,其理论
与事实相差很大
(2)过多地引用了经典的物理理论,比如轨道
1、下面关于玻尔理论的解释中,不正确的说法是(
)
A、原子只能处于一系列不连续的状态中,每个状态都对应一定的能量
B、原子中,虽然核外电子不断做加速运动,但只要能量状态不改变,就不会向外辐射能量
C、原子从一种定态跃迁到另一种定态时,一定要辐射一定频率的光子
D、原子的每一个能量状态都对应一个电子轨道,并且这些轨道是不连续的
C
【针对训练】:
【针对训练】
2.根据玻尔理论,在氢原子中量子数n越大,则( )
A.电子轨道半径越小
B.核外电子速度越小
C.原子能级能量越小
D.原子的电势能越小
离原子核越远
大
大
大
B
3.氢原子辐射出一个光子后,则( )
A.电子绕核旋转的半径增大
B.电子的动能增大
C.氢原子的电势能增大
D.原子的能级值增大
高能级到低能级
高轨道到低轨道
B
小结
一、玻尔原子结构模型内容
1、轨道量子化假设
2、能量量子化假设
3、跃迁假设
二、玻尔理论对氢光谱的解释
1、向低能级跃迁
发射光子
2、向高能级跃迁
吸收光子
三、玻尔理论的成功与局限之处
1、成功之处:
2、局限之处:
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
分立轨道
rn
=
n2r1
能级
