山东省德州实高2020-2021学年高一下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 山东省德州实高2020-2021学年高一下学期期中考试化学试题 Word版含答案 |
|
|
| 格式 | doc | ||
| 文件大小 | 537.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-19 22:42:41 | ||
图片预览


文档简介
德州实验高中高一下学期期中考试化学试题
2021.5
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cl:35.5
第Ⅰ卷 (选择题 共40分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考号、试卷类型、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答在试卷上无效。
一、单项选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)
1.我国探月“嫦娥工程”已启动,人类探月的重要目的之一是勘察、获取地球上蕴藏量很小而月球上却极为丰富的核聚变燃料3He,以解决地球能源危机。关于3He的叙述正确的是( )
A.含有3个质子,没有中子 B.1个3He原子的质量是3g
C.He元素的相对原子质量是3 D.是4He的同位素
2.下列既有离子键,又有共价键的化合物是( )
A.MgCl2 B.Cl2 C.Na2O2 D.NH3·H2O
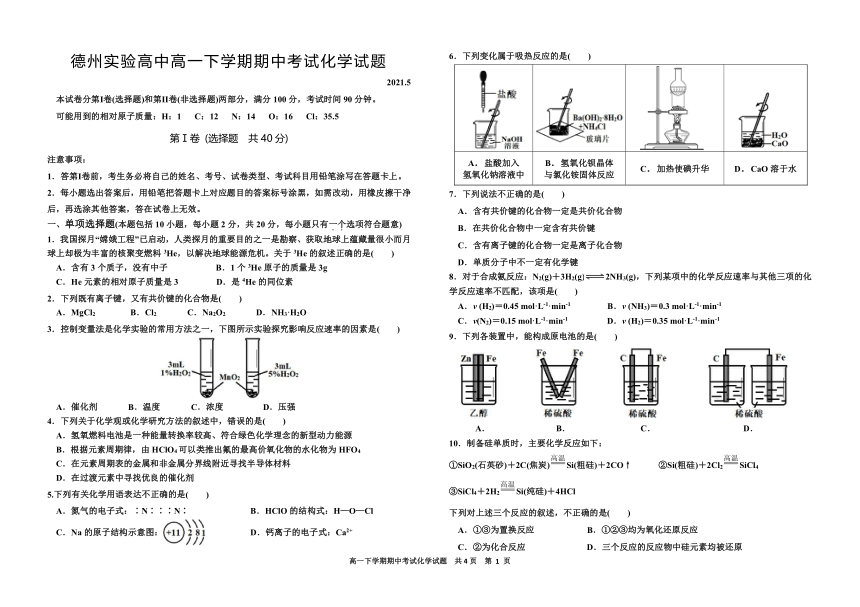
3.控制变量法是化学实验的常用方法之一,下图所示实验探究影响反应速率的因素是( )
A.催化剂 B.温度 C.浓度 D.压强
4.下列关于化学观或化学研究方法的叙述中,错误的是( )
A.氢氧燃料电池是一种能量转换率较高、符合绿色化学理念的新型动力能源
B.根据元素周期律,由HClO4可以类推出氟的最高价氧化物的水化物为HFO4
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.在过渡元素中寻找优良的催化剂
5.下列有关化学用语表达不正确的是( )
A.氮气的电子式:∶N∶∶∶N∶ B.HClO的结构式:H—O—Cl
C.Na的原子结构示意图: D.钙离子的电子式:Ca2+
6.下列变化属于吸热反应的是( )
A.盐酸加入 氢氧化钠溶液中 B.氢氧化钡晶体
与氯化铵固体反应 C.加热使碘升华 D.CaO溶于水
7.下列说法不正确的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.单质分子中不一定有化学键
8.对于合成氨反应:N2(g)+3H2(g)2NH3(g),下列某项中的化学反应速率与其他三项的化学反应速率不匹配,该项是( )
A.v (H2)=0.45 mol·L-1·min-1 B.v (NH3)=0.3 mol·L-1·min-1
C.v(N2)=0.15 mol·L-1·min-1 D.v (H2)=0.35 mol·L-1·min-1
9.下列各装置中,能构成原电池的是( )
A. B. C. D.
10.制备硅单质时,主要化学反应如下:
①SiO2(石英砂)+2C(焦炭)Si(粗硅)+2CO↑ ②Si(粗硅)+2Cl2SiCl4
③SiCl4+2H2Si(纯硅)+4HCl
下列对上述三个反应的叙述,不正确的是( )
A.①③为置换反应 B.①②③均为氧化还原反应
C.②为化合反应 D.三个反应的反应物中硅元素均被还原
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,选错得0分。
11.对于第3周期从左到右的主族元素,下列说法中正确的是( )
A.电子层数逐渐增多 B.原子半径逐渐减小
C.元素的金属性逐渐增强 D.最高正化合价逐渐增大
12.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析不正确的是( )
A.K3C60中含有离子键 B.K3C60含有共价键
C.C60与12C互为同素异形体 D.K3C60晶体在熔融状态下能导电
13.应用元素周期律的有关知识,可以预测我们不熟悉的元素的单质及化合物的性质。下列预测正确的是( )
①第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt不溶于水也不溶于稀硝酸
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.①③⑤ B.①②③④ C.②④ D.②④⑤
14.质量相等两份锌粉a和b,分别加入足量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是( )
15.科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列分析正确的是( )
A.CO和O生成CO2的过程是放热反应 B.在该过程中,CO断键形成C和O
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 D.该过程中所有化合物均为共价化合物
第Ⅱ卷 (非选择题 共60分)
16.(12分)
I.下列变化:①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤氯气溶于水
⑥氯化铵受热分解
(1)未发生化学键破坏的是_________(填序号,下同);仅发生离子键破坏的是__________。
(2)上述物质都为纯净物时,属于共价化合物的是________;属于离子化合物的是________。
II.工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O
根据题意完成下列填空:
(1)反应物中有两种元素在元素周期表中位置左右相邻,下列能判断它们的金属性或非金属性强弱的是___________(选序号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(2)反应物中有两种金属元素处于同一周期。它们最高价氧化物对应的水化物之间能发生反应,
其离子方程式为______________________________________。
17.(12分)
A、B、C、D、E均为短周期主族元素,其原子序数依次增大。A元素原子核内只有1个质子;A与C,B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。
请回答下列问题:
(1)B元素在元素周期表中的位置:______________________。
(2)D和E的最高价氧化物对应水化物酸性较强的为___________________(用化学式表示)。
(3)C2B2的电子式是____________;用电子式表示化合物C2D的形成过程:________________________________________。
(4)实验室中欲选用下列装置制取并收集纯净干燥的E2气体。
①实验中应选用的装置为________________(按由左到右的连接顺序填写);
②装置A中发生反应的化学方程式为______________________________________________。
18.(12分)
(1)某小组同学在烧杯中加入5mL 1.0mol?L-1盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是________(填“吸热”或“放热”)反应,其能量变化可用图中的________(填“B”或“C”)表示。
(2)如图是某银锌原电池装置的示意图。请回答下列问题:
①Zn电极是_______(填“正极”或“负极”),
反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),
电极反应式为_________________。
19.(12分)
现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见的无色无味液体,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是“84”消毒液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
请回答下列问题:
(1)写出H的化学式:_____________,C的化学式:______________。
(2)F溶液与澄清石灰水混合得D溶液的离子方程式:__________________________________。
(3)利用下图装置进行实验,证明氧化性强弱:KMnO4>Cl2>Br2。
限选试剂:KBr溶液、KMnO4、浓盐酸。
已知:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+8H2O
请回答下列问题:①装置a的名称是______________,
b中盛放的试剂是__________________。
②该反应每转移0.5 mol电子,消耗_______g HCl。
20.(12分)
近年来甲醇用途日益广泛,越来越引起商家的的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g)CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
时间(s) 0 1 2 3 5
n(CH3OH) (mol) 0 0.009 0.012 0.013 0.013
(1)右图中表示CH3OH的浓度变化的曲线是_______(填字母)。
(2)用CH3OH表示从0~2s内该反应的平均速率v(CH3OH)=_______________。随着反应的进行,该反应的速率在逐渐
减慢的原因是________________________。
(3)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量______形成1mol CH3OH释放的能量(填“﹤”、“=”或“﹥”)。
(4)甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示(质子交换膜可以通过H+):
通入甲醇气体的电极为电池的_______(填“正”或“负")极,
电解质溶液中H+向________(填“a"或“b")电极移动。
德州实验高中高一年级期中考试化学参考答案 2021.5
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C B A B A D C D
题号 11 12 13 14 15
答案 BD C C A AD
16.(12分,每空2分)
(1)① ②③ (错选、漏选均不得分)
(2)④ ②③⑥ (错选、漏选均不得分)
(3)ac(漏选得1分,错选不得分,多选倒扣分)
(4)Al(OH)3+OH-= [Al(OH)4]-
17.(12分,每空2分)
(1)第2周期 第ⅥA族(部分对不得分)
(2)HClO4
(3)
(4) ① AFEB ②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
18.(12分,每空2分)
(1)放热 B
(2)①负极 小
②还原 Cu2++2e-=Cu
19.(12分,每空2分)
(1)NaClO CO2
(2)Ca2++CO32-=CaCO3↓
(3)①分液漏斗 KBr溶液
②29.2
20.(12分,每空2分)
(1)b
(2)0.003 mol·L-1·s-1 反应物的浓度减小
(3) <
(4) 负 b
高一下学期期中考试化学试题 共4页 第 页
2021.5
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cl:35.5
第Ⅰ卷 (选择题 共40分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考号、试卷类型、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答在试卷上无效。
一、单项选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)
1.我国探月“嫦娥工程”已启动,人类探月的重要目的之一是勘察、获取地球上蕴藏量很小而月球上却极为丰富的核聚变燃料3He,以解决地球能源危机。关于3He的叙述正确的是( )
A.含有3个质子,没有中子 B.1个3He原子的质量是3g
C.He元素的相对原子质量是3 D.是4He的同位素
2.下列既有离子键,又有共价键的化合物是( )
A.MgCl2 B.Cl2 C.Na2O2 D.NH3·H2O
3.控制变量法是化学实验的常用方法之一,下图所示实验探究影响反应速率的因素是( )
A.催化剂 B.温度 C.浓度 D.压强
4.下列关于化学观或化学研究方法的叙述中,错误的是( )
A.氢氧燃料电池是一种能量转换率较高、符合绿色化学理念的新型动力能源
B.根据元素周期律,由HClO4可以类推出氟的最高价氧化物的水化物为HFO4
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.在过渡元素中寻找优良的催化剂
5.下列有关化学用语表达不正确的是( )
A.氮气的电子式:∶N∶∶∶N∶ B.HClO的结构式:H—O—Cl
C.Na的原子结构示意图: D.钙离子的电子式:Ca2+
6.下列变化属于吸热反应的是( )
A.盐酸加入 氢氧化钠溶液中 B.氢氧化钡晶体
与氯化铵固体反应 C.加热使碘升华 D.CaO溶于水
7.下列说法不正确的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.单质分子中不一定有化学键
8.对于合成氨反应:N2(g)+3H2(g)2NH3(g),下列某项中的化学反应速率与其他三项的化学反应速率不匹配,该项是( )
A.v (H2)=0.45 mol·L-1·min-1 B.v (NH3)=0.3 mol·L-1·min-1
C.v(N2)=0.15 mol·L-1·min-1 D.v (H2)=0.35 mol·L-1·min-1
9.下列各装置中,能构成原电池的是( )
A. B. C. D.
10.制备硅单质时,主要化学反应如下:
①SiO2(石英砂)+2C(焦炭)Si(粗硅)+2CO↑ ②Si(粗硅)+2Cl2SiCl4
③SiCl4+2H2Si(纯硅)+4HCl
下列对上述三个反应的叙述,不正确的是( )
A.①③为置换反应 B.①②③均为氧化还原反应
C.②为化合反应 D.三个反应的反应物中硅元素均被还原
二、不定项选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,选错得0分。
11.对于第3周期从左到右的主族元素,下列说法中正确的是( )
A.电子层数逐渐增多 B.原子半径逐渐减小
C.元素的金属性逐渐增强 D.最高正化合价逐渐增大
12.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析不正确的是( )
A.K3C60中含有离子键 B.K3C60含有共价键
C.C60与12C互为同素异形体 D.K3C60晶体在熔融状态下能导电
13.应用元素周期律的有关知识,可以预测我们不熟悉的元素的单质及化合物的性质。下列预测正确的是( )
①第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
②砹(At)单质为有色固体,AgAt不溶于水也不溶于稀硝酸
③Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
A.①③⑤ B.①②③④ C.②④ D.②④⑤
14.质量相等两份锌粉a和b,分别加入足量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是( )
15.科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列分析正确的是( )
A.CO和O生成CO2的过程是放热反应 B.在该过程中,CO断键形成C和O
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 D.该过程中所有化合物均为共价化合物
第Ⅱ卷 (非选择题 共60分)
16.(12分)
I.下列变化:①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤氯气溶于水
⑥氯化铵受热分解
(1)未发生化学键破坏的是_________(填序号,下同);仅发生离子键破坏的是__________。
(2)上述物质都为纯净物时,属于共价化合物的是________;属于离子化合物的是________。
II.工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O
根据题意完成下列填空:
(1)反应物中有两种元素在元素周期表中位置左右相邻,下列能判断它们的金属性或非金属性强弱的是___________(选序号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(2)反应物中有两种金属元素处于同一周期。它们最高价氧化物对应的水化物之间能发生反应,
其离子方程式为______________________________________。
17.(12分)
A、B、C、D、E均为短周期主族元素,其原子序数依次增大。A元素原子核内只有1个质子;A与C,B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。
请回答下列问题:
(1)B元素在元素周期表中的位置:______________________。
(2)D和E的最高价氧化物对应水化物酸性较强的为___________________(用化学式表示)。
(3)C2B2的电子式是____________;用电子式表示化合物C2D的形成过程:________________________________________。
(4)实验室中欲选用下列装置制取并收集纯净干燥的E2气体。
①实验中应选用的装置为________________(按由左到右的连接顺序填写);
②装置A中发生反应的化学方程式为______________________________________________。
18.(12分)
(1)某小组同学在烧杯中加入5mL 1.0mol?L-1盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是________(填“吸热”或“放热”)反应,其能量变化可用图中的________(填“B”或“C”)表示。
(2)如图是某银锌原电池装置的示意图。请回答下列问题:
①Zn电极是_______(填“正极”或“负极”),
反应中质量会变______(填“大”,“小”或“不变”)
②银电极上发生_____反应(“氧化”或“还原”),
电极反应式为_________________。
19.(12分)
现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见的无色无味液体,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是“84”消毒液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
请回答下列问题:
(1)写出H的化学式:_____________,C的化学式:______________。
(2)F溶液与澄清石灰水混合得D溶液的离子方程式:__________________________________。
(3)利用下图装置进行实验,证明氧化性强弱:KMnO4>Cl2>Br2。
限选试剂:KBr溶液、KMnO4、浓盐酸。
已知:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+8H2O
请回答下列问题:①装置a的名称是______________,
b中盛放的试剂是__________________。
②该反应每转移0.5 mol电子,消耗_______g HCl。
20.(12分)
近年来甲醇用途日益广泛,越来越引起商家的的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g)CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
时间(s) 0 1 2 3 5
n(CH3OH) (mol) 0 0.009 0.012 0.013 0.013
(1)右图中表示CH3OH的浓度变化的曲线是_______(填字母)。
(2)用CH3OH表示从0~2s内该反应的平均速率v(CH3OH)=_______________。随着反应的进行,该反应的速率在逐渐
减慢的原因是________________________。
(3)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量______形成1mol CH3OH释放的能量(填“﹤”、“=”或“﹥”)。
(4)甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示(质子交换膜可以通过H+):
通入甲醇气体的电极为电池的_______(填“正”或“负")极,
电解质溶液中H+向________(填“a"或“b")电极移动。
德州实验高中高一年级期中考试化学参考答案 2021.5
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C B A B A D C D
题号 11 12 13 14 15
答案 BD C C A AD
16.(12分,每空2分)
(1)① ②③ (错选、漏选均不得分)
(2)④ ②③⑥ (错选、漏选均不得分)
(3)ac(漏选得1分,错选不得分,多选倒扣分)
(4)Al(OH)3+OH-= [Al(OH)4]-
17.(12分,每空2分)
(1)第2周期 第ⅥA族(部分对不得分)
(2)HClO4
(3)
(4) ① AFEB ②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
18.(12分,每空2分)
(1)放热 B
(2)①负极 小
②还原 Cu2++2e-=Cu
19.(12分,每空2分)
(1)NaClO CO2
(2)Ca2++CO32-=CaCO3↓
(3)①分液漏斗 KBr溶液
②29.2
20.(12分,每空2分)
(1)b
(2)0.003 mol·L-1·s-1 反应物的浓度减小
(3) <
(4) 负 b
高一下学期期中考试化学试题 共4页 第 页
同课章节目录
