化学人教版(2019)必修第一册4.3.2共价键(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2共价键(共38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 648.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-20 16:57:09 | ||
图片预览







文档简介
(共38张PPT)
第三节
化学键
(第2课时)
Review
离子键的定义?
哪些元素化合时可形成离子键?
用电子式表示出K、S、K+、S2-、K2S?
使阴、阳离子结合成化合物的静电作用。
一般是活泼金属和活泼非金属离子间能形成
Questions
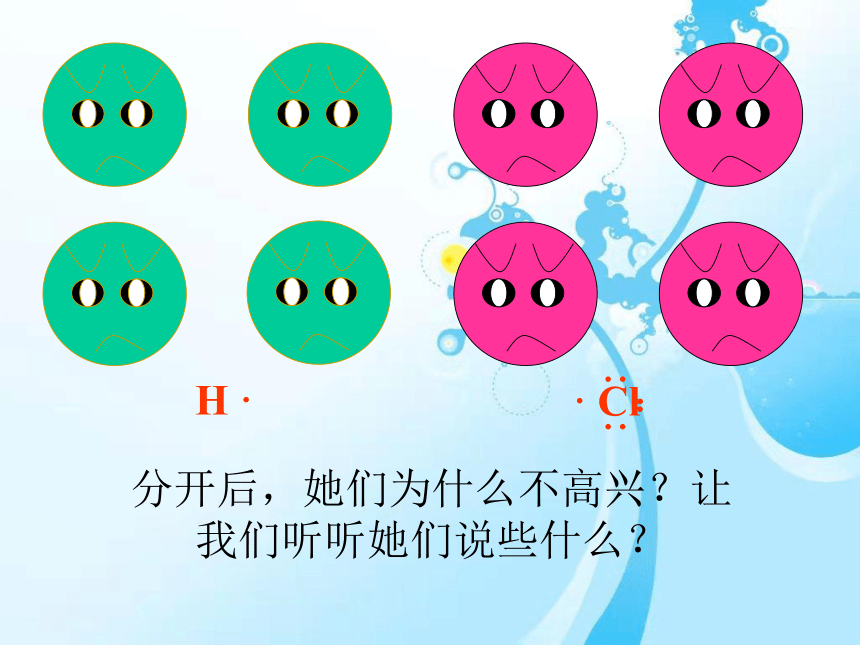
H·
和
原子形成HCl过程中,能否形成离子键?为什么?
Cl
·
··
··
··
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
不能,因非金属元素的原子均有获得电子的倾向。
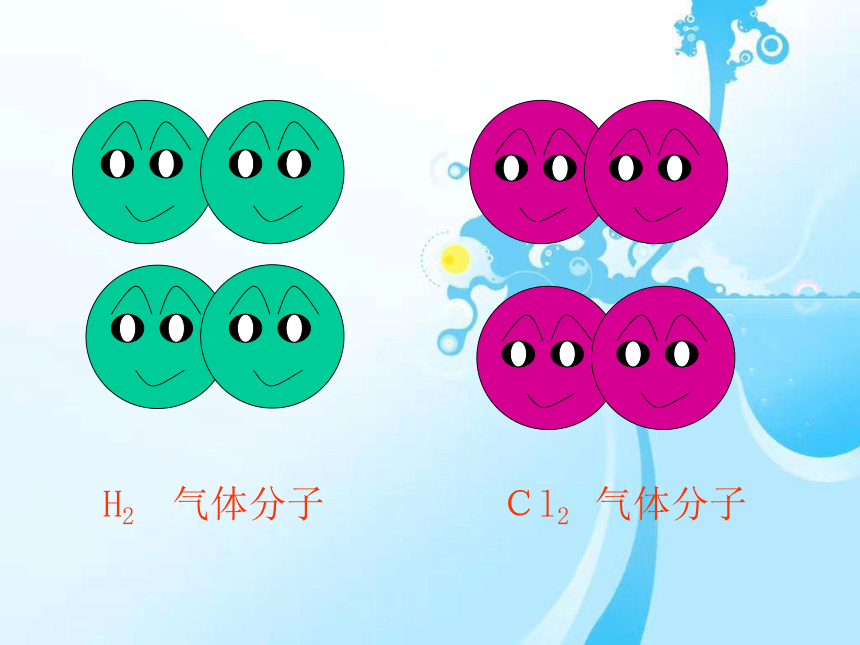
Cl2
气体分子
H2
气体分子
分开后,她们为什么不高兴?让我们听听她们说些什么?
H
·
··
·
Cl
··
:
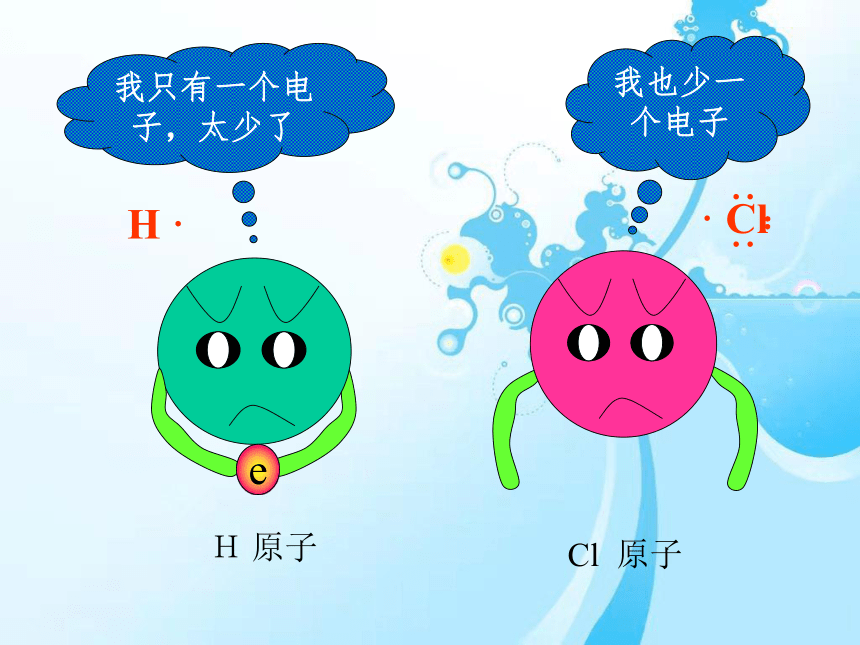
我只有一个电子,太少了
我也少一个电子
e
H
原子
Cl
原子
H
·
··
·
Cl
··
:
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
··
·
Cl
··
:
H
·
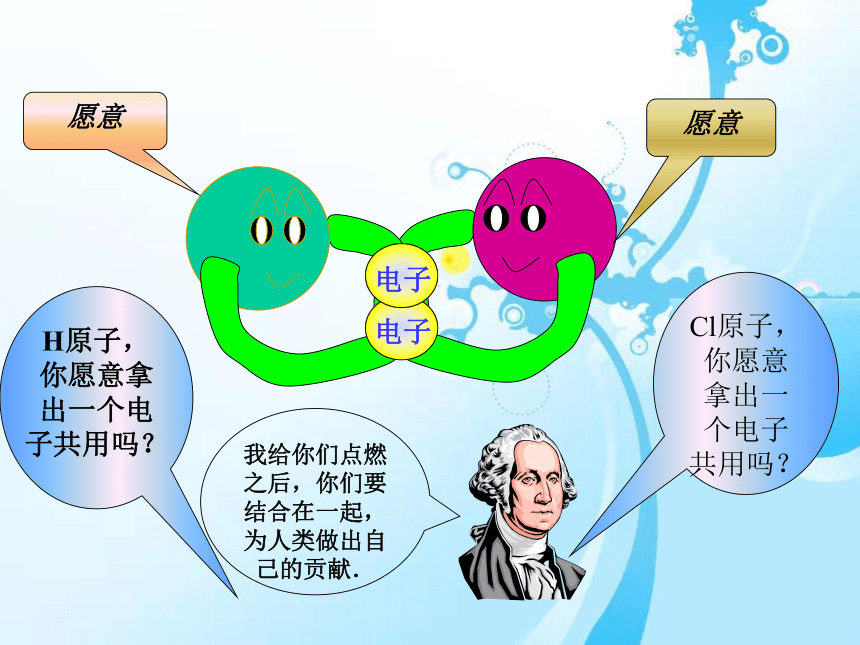
愿意
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
我们的接合使人类的生活多了一点味道
我们的接合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
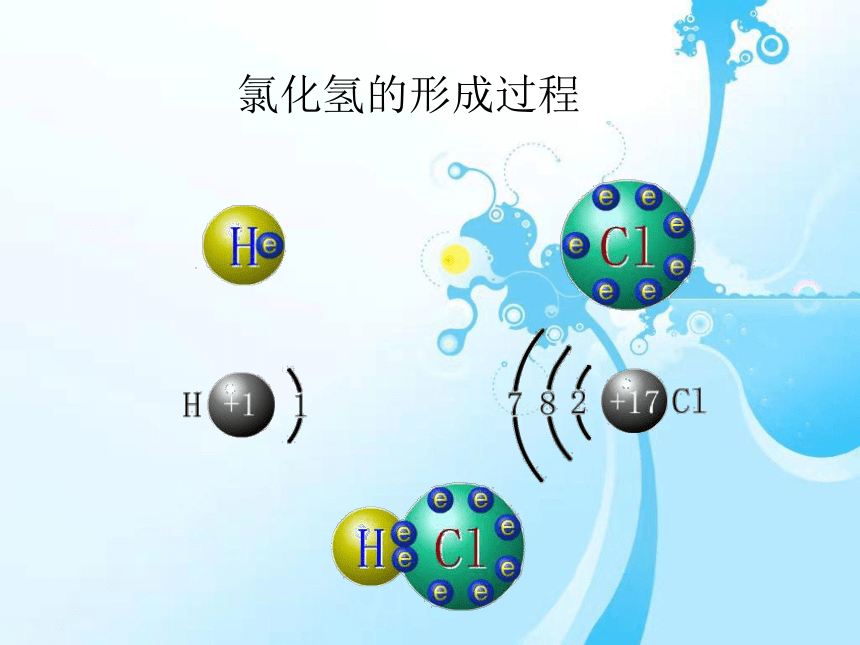
氯化氢的形成过程
二、共价键
1.定义:原子之间通过共用电子对所形成的相
互作用叫做共价键。
2.成键微粒:
原子
3.成键实质:
共用电子对
4.成键元素:
某些金属元素原子与非金属元素原子间
(如:AlCl3等)
同种或不同种非金属元素原子之间
a.存在于非金属单质和共价化合物中
b.也存在于某些离子化合物中
5.存在:
6.共价化合物:
以共用电子对形成分子的化合物
(如酸、非金属氧化物、非金属氢化物、有机物等)
只含有共价键的化合物是共价化合物
(1)电子式
H
·
氯化氢分子的形成:
··
·
Cl
··
:
·
H
+
→
H
·
+
→
Cl
··
··
H
··
··
H
H
··
氢分子的形成:
a.表示分子
b.分子的形成过程
H
H
··
Cl
··
··
H
··
··
7.共价键的表示方法
注意
(1)原则:H
原子满足2电子稳定结构,其他原子一般满足8电子稳定结构
(2)
左边写原子的电子式,中间用→连接,右边
写分子的电子式;
(3)
不用箭头表示电子的偏移;
(4)“
→”左边相同原子可以合并在一起,
右边相同原子不能合并在一起。
【练习1】1.用电子式表示下列物质的形成过程
①
H2O
②
CO2
③
NH3
④CH4
⑤N2
2.下列电子式书写正确的是(
)
A.∶N∶∶∶N∶
B.H∶N∶H
C.H+[∶O∶]2-H+
D.Na+[∶Cl∶]-
D
3.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是(
)
A.CO2
B.PCl3
C.CCl4
D.BF3
E.HCI
DE
‥
‥
‥
‥
(2).结构式:
概念:在化学上,常用一根短线来表示一对共用电子对(其他电子不写),这样的式子叫做结构式。
如:H-H、H-Cl、O=C=O等
练习2.写出下列物质的电子式与结构上
电子式
结构式
HCl
H—Cl
H2
H—H
N2
N
N
CO2
H2S
H—S—H
练习作业:
用电子式表示共价化合物的形成过程
2.
HCl
3.
H2O
1.
H2
5.
NH3
4.
CO2
H
·
·
H
+
→
H
H
··
··
·
Cl
··
:
H
·
+
→
Cl
··
··
H
··
··
→
··
·
O
·
··
H
·
+
H
·
+
O
··
··
H
H
:
:
+
··
·
O
·
··
+
:
C
:
··
·
O
·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H
·
+
→
:
·
N
·
·
··
N
H
:
:
··
H
H
注意:
不标电荷和中括号
“
[
]
”
练习3:
(1)用电子式表示氢氧化钠
[
]
+
-
·
H
·
Na
﹕
﹕
·
·
O
(2)请用电子式表示过氧化钠
O
·
·
:
:
O
·
·
:
:
·
Na
·
Na
[
]
+
+
2-
含有共价键的化合物不一定是共价化合物
Cl
··
··
H
··
··
电子对偏向
?
H
H
··
电子对偏向Cl
电子对不偏移
非极性键
极性键
思考与交流
非极性键:同种原子形成的共价键,共用电子对不偏移,成键原子不显电性。
极性键:不同种元素原子形成的共价键共用电子对发生偏移,成键原子显电性。
8.共价键的分类
【练习4】
(1)
判断下列化学键是极性键还是非极性键
O
=C
=O
H—O—O—H
(2)上述结构式代表的化合物是离子化合物吗?
极性键与非极性键的区别
非极性键
极
性
键
原子种类
原子吸引共用电子对能力
共用电子对有无偏移
成键原子的
电性
实例
巧记为:
同
非
离子键和共价键的比较
离子键
共价键
成键微粒
成键本质
表示法
成键元素
键的存在
阴、阳离子
原子
静电作用
共用电子对
以NaCl为例
[
]
+
-
·
Na
Cl
·
·
:
:
·
以HCl为例
Cl
··
··
H
··
··
典型的金属元素、典
型的非金属元素之间
同种或不同种
非金属元素之间
只存在于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
二.化学键
化学键
离子键
共价键
极性键
非极性键
﹛﹜
﹛﹜
1.定义:使离子相结合或原子相结合的作用力。
2.化学反应的本质
宏观:
微观:
旧化学键的断裂和新化学键的形成
有新物质生成
注意:化学反应中反应物的化学键并非全部被破坏
如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
只破坏反应物中的离子键,共价键未被破坏
3.化学键的破坏
(2)离子化合物的溶解或熔化过程
离子化合物
电离
阴阳离子
3.共价化合物的溶解或熔化过程
?溶解a.与水反应
共价键被破坏
b.电解质溶于水
共价键被破坏
c.非电解质溶于水
共价键不被破坏
溶解或熔化
离子键被破坏
CO2、SO2
HCl、H2SO4
乙醇、蔗糖
(1)化学反应过程中,反应物中的化学键被破坏
【练习5】
判断下列过程破坏或形成了哪种类型的化学键?
1.NaCl溶于水_______________________
2.熔融NaCl_________________________
3.蒸发结晶精制食盐水_______________
4.HCl溶于水_______________________
5.NH4Cl
NH3+HCl_________________
加热
破坏离子键
破坏离子键
形成离子键
破坏共价键
破坏离子键、共价键;形成共价键
三、分子间作用力和氢键
1.分子间作用力
(1)定义:
由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
分子间作用力的范围小,只有分子间的距离很小时才有
把分子聚集在一起的作用力叫做分子间作用力
(也叫范德华力)
(2)存在:
卤素单质的熔、沸点
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
ICI4
沸点
熔点
×
×
四卤化碳的熔、沸点
(3)规律
对组成和结构相似的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点越高,如卤素单质的熔沸点:
Cl2<Br2
<I2
为什么HF、H2O和NH3的沸点会反常呢?
思考:
一些氢化物的沸点
2.氢键
(1)概念:
N、O、F
的氢化物分子间
在NH3、H2O、HF分子间存在着一种比分子间作用力稍强的相互作用—氢键
(2)存在:
[课本P24]
(3)作用:
?解释一些反常现象
如:冰的密度小于水的密度,冰会浮在水面上
①氢键的形成会使含有氢键的物质的熔、沸点大大升高。
小
结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
1.判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物
课堂练习:
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
2.下列说法中正确的是(
)
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
E.有金属和非金属元素组成的化合物一定是离子化合物
AD
注:
离子化合物中一定含离子键也可能含有共价键
共价化合物中一定含有共价键,一定不含离子键
含有共价键的化合物不一定是共价化合物
3.下列说法是否正确?并举例说明
a、离子化合物中可能含有共价键。
b、共价化合物中可能含有离子键。
c、非金属原子间不可能形成离子键。
d、非极性键只存在于双原子单质分子里。
e、活泼金属和活泼非金属一定形成离子化合物。
4.写出下列物质的电子式,并指出化合物的类型
H2O
HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
A、KF
B、H2O
C、
N2
D、
He
E、CO2
F、CaCl2、
G、H2O2
H、CCl4
I、
KOH
J、
Na2O2
课后练习1
1.含离子键的物质是
.
2.含非极性键的物质是
.
3.含极性键的物质是
.
4.属于离子化合物的是
.
5.属于共价化合物的是
.
A、F、I、J
C、J、G
B、E、G、H、I、
A、F、I、J
B、E、G、H
2.书写下列微粒的电子式
H、C、N、O、F、Ne、Na、Mg、Al
H2、N2、O2、Cl2、CO2、CS2、CCl4
HF、HCl、H2O、H2O2、H2S、NH3、PH3、CH4、SiH4
、
Na2O、Na2O2、NaCl、NaOH、Na2S
、
MgO、MgCl2、NH4Cl
Cl-、O2-、O22-、OH-、NH4+
HClO、NaClO
1.首先要判断是形成离子键还是共价键
2.如果是形成共价键,共用的电子对数=8-最外层电子数
3.共用电子数多的原子通常放中心
第三节
化学键
(第2课时)
Review
离子键的定义?
哪些元素化合时可形成离子键?
用电子式表示出K、S、K+、S2-、K2S?
使阴、阳离子结合成化合物的静电作用。
一般是活泼金属和活泼非金属离子间能形成
Questions
H·
和
原子形成HCl过程中,能否形成离子键?为什么?
Cl
·
··
··
··
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
不能,因非金属元素的原子均有获得电子的倾向。
Cl2
气体分子
H2
气体分子
分开后,她们为什么不高兴?让我们听听她们说些什么?
H
·
··
·
Cl
··
:
我只有一个电子,太少了
我也少一个电子
e
H
原子
Cl
原子
H
·
··
·
Cl
··
:
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?
e
好
呵
谢
谢
好
呵
谢
谢
··
·
Cl
··
:
H
·
愿意
愿意
电子
电子
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.
我们的接合使人类的生活多了一点味道
我们的接合使人类的工厂有了活力
H2+Cl2===2HCl
点燃
氯化氢的形成过程
二、共价键
1.定义:原子之间通过共用电子对所形成的相
互作用叫做共价键。
2.成键微粒:
原子
3.成键实质:
共用电子对
4.成键元素:
某些金属元素原子与非金属元素原子间
(如:AlCl3等)
同种或不同种非金属元素原子之间
a.存在于非金属单质和共价化合物中
b.也存在于某些离子化合物中
5.存在:
6.共价化合物:
以共用电子对形成分子的化合物
(如酸、非金属氧化物、非金属氢化物、有机物等)
只含有共价键的化合物是共价化合物
(1)电子式
H
·
氯化氢分子的形成:
··
·
Cl
··
:
·
H
+
→
H
·
+
→
Cl
··
··
H
··
··
H
H
··
氢分子的形成:
a.表示分子
b.分子的形成过程
H
H
··
Cl
··
··
H
··
··
7.共价键的表示方法
注意
(1)原则:H
原子满足2电子稳定结构,其他原子一般满足8电子稳定结构
(2)
左边写原子的电子式,中间用→连接,右边
写分子的电子式;
(3)
不用箭头表示电子的偏移;
(4)“
→”左边相同原子可以合并在一起,
右边相同原子不能合并在一起。
【练习1】1.用电子式表示下列物质的形成过程
①
H2O
②
CO2
③
NH3
④CH4
⑤N2
2.下列电子式书写正确的是(
)
A.∶N∶∶∶N∶
B.H∶N∶H
C.H+[∶O∶]2-H+
D.Na+[∶Cl∶]-
D
3.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是(
)
A.CO2
B.PCl3
C.CCl4
D.BF3
E.HCI
DE
‥
‥
‥
‥
(2).结构式:
概念:在化学上,常用一根短线来表示一对共用电子对(其他电子不写),这样的式子叫做结构式。
如:H-H、H-Cl、O=C=O等
练习2.写出下列物质的电子式与结构上
电子式
结构式
HCl
H—Cl
H2
H—H
N2
N
N
CO2
H2S
H—S—H
练习作业:
用电子式表示共价化合物的形成过程
2.
HCl
3.
H2O
1.
H2
5.
NH3
4.
CO2
H
·
·
H
+
→
H
H
··
··
·
Cl
··
:
H
·
+
→
Cl
··
··
H
··
··
→
··
·
O
·
··
H
·
+
H
·
+
O
··
··
H
H
:
:
+
··
·
O
·
··
+
:
C
:
··
·
O
·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H
·
+
→
:
·
N
·
·
··
N
H
:
:
··
H
H
注意:
不标电荷和中括号
“
[
]
”
练习3:
(1)用电子式表示氢氧化钠
[
]
+
-
·
H
·
Na
﹕
﹕
·
·
O
(2)请用电子式表示过氧化钠
O
·
·
:
:
O
·
·
:
:
·
Na
·
Na
[
]
+
+
2-
含有共价键的化合物不一定是共价化合物
Cl
··
··
H
··
··
电子对偏向
?
H
H
··
电子对偏向Cl
电子对不偏移
非极性键
极性键
思考与交流
非极性键:同种原子形成的共价键,共用电子对不偏移,成键原子不显电性。
极性键:不同种元素原子形成的共价键共用电子对发生偏移,成键原子显电性。
8.共价键的分类
【练习4】
(1)
判断下列化学键是极性键还是非极性键
O
=C
=O
H—O—O—H
(2)上述结构式代表的化合物是离子化合物吗?
极性键与非极性键的区别
非极性键
极
性
键
原子种类
原子吸引共用电子对能力
共用电子对有无偏移
成键原子的
电性
实例
巧记为:
同
非
离子键和共价键的比较
离子键
共价键
成键微粒
成键本质
表示法
成键元素
键的存在
阴、阳离子
原子
静电作用
共用电子对
以NaCl为例
[
]
+
-
·
Na
Cl
·
·
:
:
·
以HCl为例
Cl
··
··
H
··
··
典型的金属元素、典
型的非金属元素之间
同种或不同种
非金属元素之间
只存在于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
二.化学键
化学键
离子键
共价键
极性键
非极性键
﹛﹜
﹛﹜
1.定义:使离子相结合或原子相结合的作用力。
2.化学反应的本质
宏观:
微观:
旧化学键的断裂和新化学键的形成
有新物质生成
注意:化学反应中反应物的化学键并非全部被破坏
如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
只破坏反应物中的离子键,共价键未被破坏
3.化学键的破坏
(2)离子化合物的溶解或熔化过程
离子化合物
电离
阴阳离子
3.共价化合物的溶解或熔化过程
?溶解a.与水反应
共价键被破坏
b.电解质溶于水
共价键被破坏
c.非电解质溶于水
共价键不被破坏
溶解或熔化
离子键被破坏
CO2、SO2
HCl、H2SO4
乙醇、蔗糖
(1)化学反应过程中,反应物中的化学键被破坏
【练习5】
判断下列过程破坏或形成了哪种类型的化学键?
1.NaCl溶于水_______________________
2.熔融NaCl_________________________
3.蒸发结晶精制食盐水_______________
4.HCl溶于水_______________________
5.NH4Cl
NH3+HCl_________________
加热
破坏离子键
破坏离子键
形成离子键
破坏共价键
破坏离子键、共价键;形成共价键
三、分子间作用力和氢键
1.分子间作用力
(1)定义:
由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
分子间作用力的范围小,只有分子间的距离很小时才有
把分子聚集在一起的作用力叫做分子间作用力
(也叫范德华力)
(2)存在:
卤素单质的熔、沸点
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
ICI4
沸点
熔点
×
×
四卤化碳的熔、沸点
(3)规律
对组成和结构相似的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点越高,如卤素单质的熔沸点:
Cl2<Br2
<I2
为什么HF、H2O和NH3的沸点会反常呢?
思考:
一些氢化物的沸点
2.氢键
(1)概念:
N、O、F
的氢化物分子间
在NH3、H2O、HF分子间存在着一种比分子间作用力稍强的相互作用—氢键
(2)存在:
[课本P24]
(3)作用:
?解释一些反常现象
如:冰的密度小于水的密度,冰会浮在水面上
①氢键的形成会使含有氢键的物质的熔、沸点大大升高。
小
结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
1.判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物
课堂练习:
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
2.下列说法中正确的是(
)
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
E.有金属和非金属元素组成的化合物一定是离子化合物
AD
注:
离子化合物中一定含离子键也可能含有共价键
共价化合物中一定含有共价键,一定不含离子键
含有共价键的化合物不一定是共价化合物
3.下列说法是否正确?并举例说明
a、离子化合物中可能含有共价键。
b、共价化合物中可能含有离子键。
c、非金属原子间不可能形成离子键。
d、非极性键只存在于双原子单质分子里。
e、活泼金属和活泼非金属一定形成离子化合物。
4.写出下列物质的电子式,并指出化合物的类型
H2O
HClO
NaOH
NH4Cl
共价化合物
共价化合物
离子化合物
离子化合物
A、KF
B、H2O
C、
N2
D、
He
E、CO2
F、CaCl2、
G、H2O2
H、CCl4
I、
KOH
J、
Na2O2
课后练习1
1.含离子键的物质是
.
2.含非极性键的物质是
.
3.含极性键的物质是
.
4.属于离子化合物的是
.
5.属于共价化合物的是
.
A、F、I、J
C、J、G
B、E、G、H、I、
A、F、I、J
B、E、G、H
2.书写下列微粒的电子式
H、C、N、O、F、Ne、Na、Mg、Al
H2、N2、O2、Cl2、CO2、CS2、CCl4
HF、HCl、H2O、H2O2、H2S、NH3、PH3、CH4、SiH4
、
Na2O、Na2O2、NaCl、NaOH、Na2S
、
MgO、MgCl2、NH4Cl
Cl-、O2-、O22-、OH-、NH4+
HClO、NaClO
1.首先要判断是形成离子键还是共价键
2.如果是形成共价键,共用的电子对数=8-最外层电子数
3.共用电子数多的原子通常放中心
