选修4化学反应原理第四章电化学基础第一节原电池课件
文档属性
| 名称 | 选修4化学反应原理第四章电化学基础第一节原电池课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-26 00:00:00 | ||
图片预览










文档简介
(共107张PPT)
第十章 氧化还原反应和电化学
教学基本要求
1.掌握氧化还原反应的概念及方程式配平
2.掌握原电池的原理与符号
3.理解原电池电动势、电极电势、标准电极电势、
标准电极等概念
4.掌握原电池电动势、电极电势的计算及应用;
以及电池电动势与电池反应热力学函数的关系
5.掌握元素的标准电势图
一、基本概念
1、氧化还原反应
1.1从得氧、失氧的角度
氧化反应:
还原反应:
氧化还原反应
氧化剂:
还原剂:
物质得氧的反应
物质失氧的反应
失去氧的物质
得到氧的物质
氧化性
还原性
一、基本概念
1、氧化还原反应
1.2 从电子转移的角度
氧化反应:
还原反应:
氧化还原反应
氧化剂: 、 ,发生
还原剂: 、 ,发生
氧化性:得电子能力
还原性:失电子能力
失电子
得电子
得电子
失电子
被还原
还原反应
被氧化
氧化反应
一、基本概念
1、氧化还原反应
1.3从化合价升降的角度
氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:
氧化性:处于高价态
还原性:处于低价态
化合价升高
化合价降低
化合价降低
化合价升高
氧化剂+还原剂=还原产物+氧化产物
得 e -,价降,被还原
失 e -,价升,被氧化
1、氧化还原反应
1.4、各概念间关系
一、基本概念
1.5 半反应与氧化还原电对
根据电子转移,氧化还原反应可以拆成两个半反应,或看成由两个半反应构成。
氧化半反应: Zn - 2e- → Zn 2+
还原半反应: Cu2+ + 2e - → Cu
可见:氧化还原反应中,电子有得 必有失,且失得数目相等;氧化半反应和还原半反应同时并存,不能单独存在。
例如: Zn+Cu2+ Cu+Zn 2+
式中:n=5,氧化态为MnO4-和8H+,还原态为Mn2+
(H2O是溶剂,不包括在内)。
n为电子转移的数目,氧化态(oxdidation state,Ox)应包括氧化剂及其相关介质(酸、碱等),
还原态(reduction state,Red)应包括还原剂及其相关介质。
半反应的通式为:氧化态 + ne- 还原态
Ox + ne- Red
MnO4-+8H++5e- Mn2++4H2O
如半反应
如: MnO4-/Mn2+;Cu2+/Cu;Zn2+ /Zn;
还原半反应:
氧化半反应:
Fe3+ + e- → Fe2+
Sn2+ →Sn4+ + 2e-
氧化还原电对为:Fe3+ /Fe2+ ;Sn4+ /Sn2+ ;
又如: 2Fe3+ +Sn2+ 2 Fe2+ +Sn4+
氧化还原反应中,存在氧化还原电对。即氧化态物质(电子受体)及其对应的还原态物质(电子供体) 。
记为:氧化态/还原态;或 (Ox / Red)。
酸碱质子理论中,存在共轭酸碱对。
2、氧化值(Oxidation Number)
2.1电负性(electronegativity)
表示一个原子在分子中吸引成键电子能力的量度。一般用X表示(无单位)。电负性数值越大,原子在形成化学键时对成
键电子的吸引力越强。
元素的电负性随原子序数的增加呈现明显的周期性变化。
同一周期:自左→右,增大
同一主族:自上→下,减小
过渡元素的电负性无明显的规律
一般:X>2.0, 非金属元素
X<2.0, 金属元素
一、基本概念
2.2 氧化数(氧化值)
氧化数:是指某元素的一个原子的表观电荷数。该电荷数是假定把每一化学键中的电子指定给电负性更大的原子而求得的。
一、基本概念
如何理解?
1、氧化数是一种人为规定数值 。用以表征元素在化合状态时所具有的形式电荷(表观电荷)数。
2、它只表示氧化状态的高低,与化合物结构无关,不是真实的电荷数。
3、表示元素平均的、表观的氧化状态。有大小和正负号。
对关键元素的氧化值的规定:
1、在化合物中:氧元素的氧化数一般为-2;
过氧化物(如H2O2、Na2O2等)中为-1;
超氧化合物(如KO2)中为-1/2,
2、在化合物中:氢元素的氧化值一般为+1;
与活泼金属生成的离子型氢化物中为-1。
(如NaH、 CaH2)
3、在卤化物中:卤素的氧化数均为-1;
4、在碱金属、碱土金属在化合物中:
金属的氧化数分别为+1,+2。
确定氧化数的一般规则:
1、单质中元素的氧化数为零。
如:Cu,O2,Ar,S8,P4,
2、中性分子中各元素的正负氧化数代数和为零。
如:Fe2O3, H2S,
+3,-2; +1,-2;
CH4, C2H4,
-4,+1; -2,+1;
3、多原子离子中各元素原子正、负氧化数的代数和
等于离子电荷。
如:MnO4-, BF4-
+7,-2; +3,-1
例: 求NH4+中N的氧化值。
解:已知H的氧化值为+1。设N的氧化值为x。
x +(+1)×4= +1 得: x = -3,所以N的氧化值为-3。
例 :求Fe3O4中Fe的氧化值。
解: 已知O的氧化值为-2。设Fe的氧化值为x,
则: 3x + 4×(- 2)= 0
x = +8/3
所以,Fe的氧化值为+8/3
注意:
在共价化合物中,判断元素原子的氧化值时,不要与共价数(某元素原子形成的共价键的数目,化合价)相混淆。
例如 CH4 CH3Cl CH2Cl2 CHCl3 CCl4
C的共价数 4 4 4 4 4
C的氧化值 -4 -2 0 +2 +4
从氧化值角度定义氧化还原反应:
凡化学反应中,反应前后元素的原子氧化值发生了变化的一类反应。
如: Cu2+ + Zn = Cu + Zn2+
氧化:失去电子,氧化值升高的过程。如:
Zn- 2e=Zn2+
还原:得到电子,氧化值降低的过程。如: Cu2++2e=Cu
还原剂:反应中氧化值升高的物质。发生的反应是氧化反应。如: Zn
氧化剂:反应中氧化值降低的物质。发生的反应是还原反应。如:Cu2+
元素的氧化值发生变化的反应称为
氧化还原反应。
在氧化还原反应中,元素的氧化值升高的过程
称为氧化;元素的氧化值降低的过程称为还原。
氧化过程和还原过程总是 发生的。
在氧化还原反应中,组成元素的氧化值升高的
物质称为还原剂,它的反应产物称为氧化产物。
组成元素的氧化值降低的物质称为氧化剂,它的反应产物称为还原产物。
氧化剂和还原剂
同时
判断一种物质是做氧化剂还是做还原剂,通常可以依据以下原则:
(1) 当元素的氧化值为最高值时,它的氧化
值不能再增大,只能做氧化剂。
(2) 当元素的氧化值为最低值时,它的氧化
值不能再减小,只能做还原剂。
(3) 当元素的氧化值为中间值时,它既可以做氧化剂,也可以做还原剂。
活泼非金属单质:Cl2 、Br2 、I2 、O2等
高价金属离子或不活泼金属离子:
Fe3+ 、Sn4+、 Cu2+ 、Ag+等
高价含氧化合物:H2SO4 、HNO3 、
KMnO4 、MnO2 、KClO3等
常见的强氧化剂
活泼金属单质:Na、Mg、Al、Zn、Fe 等
某些非金属单质:C、H2等
非金属阴离子:S2- 、I- 、Br- 等
低价金属离子:Fe2+ 、Sn2+ 等
低价化合物:H2S、HI、NH3、CO等
常见的还原剂
配平步骤如下:
(1)写出反应物和产物的化学式;
(2)标出氧化值发生变化的元素的氧化值,计算出氧化值升高和降低的数值;
(3)利用最小公倍数确定氧化剂和还原剂的化学计量数。
(4)配平氧化值没有变化的元素原子,并将箭号改成等号。
二、氧化还原反应方程式的配平
1 氧化值法
配平要求:(1)氧化剂的氧化数降低值等于还原剂的氧化数升高值 (氧化数变化守恒)
(2)反应式两边各元素原子数相等(质量守恒)
例 7-2 用氧化值法配平下列氧化还原反应:
解:标出氧化值发生变化的组成元素的氧化值,计算氧化值升高和降低的数值。
2× [+3 - (+6)]=- 6
2× [0 - (-1)]= +2
利用最小公倍数确定氧化剂和还原剂的化学计量数:
配平其他氧化值没有变化的元素的原子:
2、 离子电子法
配平原则:
① 电荷守恒:氧化剂得电子数等于还原剂失电子数。
② 质量守恒:反应前后各元素原子总数相等。
1、将反应物和氧化还原产物,以离子形式写出
2、将方程式分为两个未配平的半反应式
3、将原子数配平,关键在氧原子配平
配平步骤:
例1:配平反应方程式
5、两式乘以系数,使得电子数和失电子数相等,
两式相加,消去两边的“ne”,
6、检查反应式两边各原子数和电荷数是否相等。
4、将电荷数配平,反应式左边或右边加电子
“+ne”
+
-
-
-
+
+
Mn
SO
SO
MnO
①
2
2
4
2
3
4
+
-
+
-
+
=
+
+
O
4H
Mn
5e
8H
MnO
④
2
2
4
①
-
+
-
-
+
+
=
+
2e
2H
SO
O
H
SO
2
4
2
2
3
②
-
-
2 +
-
Mn
MnO
4
①
SO
SO
2
4
2
3
②
②
-
-
+
②
+
+
=
+
2H
SO
O
H
SO
2
4
2
2
3
+
-
+
+
O
4H
Mn
8H
MnO
2
2
4
①
③
+
)
4
2
-
+
-
-
+
+
=
+
10e
10H
5SO
O
5H
5SO
2
2
3
+
-
+
-
+
=
+
+
O
8H
2Mn
10e
16H
2MnO
2
2
4
⑤
①×2+②×5得
O
3H
SO
K
6
MnSO
2
2
4
2
4
+
+
=
3H SO
SO
5K
2KMnO
4
3
2
4
+
+
2
O
3H
5SO
2Mn
6H
5SO
2MnO
2
2
4
2
2
3
4
+
+
=
+
+
-
+
+
-
-
⑥
⑦
2、 离子电子法
例 配平在硫酸介质中高锰酸钾与硫酸亚铁反应的方程式:
解:(1) KMnO4+FeSO4 MnSO4+Fe2(SO4)3+K2SO4
MnO4-+Fe2+ Mn2++Fe3+
(2) 氧化反应: Fe2+ Fe3++e
还原反应:8H++ MnO4-+5e Mn2++4H2O
(3) 5 Fe2+ 5Fe3++5e
+) MnO4-+8H++5e Mn2++4H2O
MnO4-+8H++5 Fe2+ Mn2++4H2O+5Fe3+
得到用分子形式表示的反应式:
(4) 2 KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3 +8H2O+K2SO4
例 用离子-电子法配平下列氧化还原反应:
解:先写成离子方程式:
将离子方程式分成两个半反应:
分别配平两个半反应:
根据得、失电子数相等的原则,将两个半反应合
并,写出配平的离子方程式:
最后写出配平的氧化还原反应方程式:
例:配平
①×5+②得:
①
②
化简得:
二、氧化还原反应方程式的配平
两种方法比较:
离子-电子法 :不需要计算元素的氧化值,仅适用于在水溶液中进行的反应。
氧化值法 :不仅适用于在水溶液中进行的反应,也适用于在非水溶液和高温下进行的反应。
三 原电池
3.1 原电池
/Cu
Cu
,
/Zn
Zn
电对:
2
2
+
+
金属导体,如 Cu、Zn
惰性导体,如 Pt、石墨棒
电极
(aq)
Zn
2e
Zn(s)
:
)
(
极
2
-
+
-
氧化反应
电子流出
负
Cu(s)
2e
(aq)
Cu
:
)
(
极
2
+
-
+
还原反应
电子流入
正
Cu(s)
(aq)
Zn
(aq)
Cu
Zn(s)
电池反应:
2
2
+
+
+
+
还原型
e
氧化型
-
+
Z
电极反应表示的通式:
所以,上式可写为:Zn(s) Zn2-(aq) + 2e
或 Zn2-(aq) + 2e Zn(s)
=
书写原电池符号的规则:
①负极“-”在左边,正极“+”在右边,盐桥用“ ”表示。盐桥两侧是两个电极的电解质溶液。
原电池符号(电池图示):
③如果反应中没有可以作电极的导体,必须外加一惰性电极导体,惰性电极导体通常是不活泼的金属(如铂)或石墨。
②半电池中两相界面用“ ”分开,溶液中存在几种离子时,离 子间用逗号隔开。溶液、气体要注明浓度,压力 。
相界
盐桥
相界
浓度
浓度
④纯液体、固体和气体写在惰性电极一边。
====
====
例:将下列反应设计成原电池并以原电池符号
表示。
解:
-
3
2
====
)
(aq
2Cl
2e
)
g
(
Cl
极
正
2
-
+
)
(aq
Fe
+
e
)
(aq
Fe
极
负
-
+
-
例:将下列反应设计成原电池并以原电池符号表示。
例:将下列反应设计成原电池并以原电池符号表示。
解:
︱Pt(+)
电极电势
还原半反应
氧化半反应
+
-
+
+
+
-
2
3
4
2
)
(
)
(
Fe
e
Fe
-
2
)
(
1
+
Sn
+
-
e
Sn
还原半反应
氧化半反应
2
2
H
e
2
H
2
)
(
Zn
e
2
Zn
)
(
)
2
(
-
+
+
-
+
+
-
-
原电池的正极发生还原反应,负极发生氧化反应。因此组成原电池时,电对 为正极,电对 为负极。原电池符号为:
例 将氧化还原反应:
设计成原电池,写出该原电池的符号。
解:先将氧化还原反应分为两个半反应:
氧化反应:
还原反应:
====
3.2、电极种类:
1. 金属—离子电极:
电极符号: Zn(S) Zn2+(c)
单垂线“∣”表示不同物相间的界面,
电极反应式: Zn2+(aq) + 2e → Zn(s)
2.气体—离子电极:
电极符号:Pt H2(p)H+(c)
电极反应: 2H+(aq) + 2e → H2(g)
3. 氧化—还原电极:
电极反应:Fe3+ (aq)+ e- → Fe2+(aq)
电极符号:Pt Fe3+(c1),Fe2+(c2)
由于这个电极反应是在溶液中进行,不存在界面,所以对于两种不同氧化态的离子可用逗号分开。
电极反应: Hg2Cl2(s)+2e →2Hg(l)+ 2Cl-(aq)
4. 金属—难溶盐电极:
电极符号:Pt Hg(l) Hg2Cl2(s) Cl-(c)
Ag(s) AgCl(s)Cl-(c)
电极符号:
电极反应:
AgCl(s)+ e → Ag(s) + Cl- (aq)
四、电极电势
把金属插入含有该金属离子的溶液中
溶解
沉积
溶解>沉积,金属表面带负电,金属表面附近的溶液带正电;
沉积>溶解,金属表面带正电,金属表面附近的溶液带负电;
即在金属表面上形成“双电层”
产生于金属表面与含有该金属离子的溶液之间的电位差称为金属电对的电极电势, 。
金属电极的电极电势主要取决于金属和金属离子的本性,此外受离子浓度和温度的影响。
4.1 电极电势的产生
以 表示
4.2、标准电极电势的测定
标准电极电势:若组成电极的各物质均处于热力学标准态,此时的电极电势就称为标准电极电势,符号
单个电极的电极电势是无法测定的:
通常选定一个电极作比较标准,规定其标准电极电势为零,确定其它电极对此电极的相对电极电势。
采用标准氢电极作为标准电极。
4.2、标准电极电势的测定
标准氢电极是用镀有一层疏松铂黑的铂片作为电极导体,插入 H+ 活度为 1 mol·L-1的酸溶液中,不断通入 100 kPa H2,使铂片吸附氢气达到饱和。吸附在铂片上的 H2 与溶液中的 H+ 建立了如下平衡:
这种产生在 100 kPa H2 饱和了的铂片与 酸溶液之间的电势差,称为标准氢电极的电极电势。规定标准氢电极的电极电势为零。
标准氢电极的电极电势
电极反应:
(
)
g
H
2e
aq)
(
H
2
2
+
-
+
/H
H
电对:
2
+
标准电极电势,其中“ ” 指标准态
氢电极的标准电极电势等于零。
电极符号为:
H+(1mol.L-1) ︳H2(100kPa) ︳Pt
4.2、标准电极电势的测定
测定某给定电极的标准电极电势时,可将待测标准电极与标准氢电极组成原电池
测定出这个原电池的电动势,就可以得到待测电极的标准电极电势。
4.2、标准电极电势的测定
标准电动势
Galvanometer
例:测锌电极的电极电势
(-)Zn | Zn2+(c )‖H+(c ) | H2( p ) | Pt (+)
根据检流计偏转方向,测得锌电极为
负极,氢电极为正极,并测得E =0.763V
-
+
-
=
j
j
E
Zn
/
Zn
.
.
+
-
=
2
0000
0
763
0
j
V
.
Zn
/
Zn
763
0
2
-
=
+
j
例:测铜电极的电极电势
测得: 铜电极为正极,氢电极为负极
E = 0.340伏
2
.
.
0000
0
340
0
Cu
/
Cu
-
=
+
j
V
.
Cu
/
Cu
340
0
2
=
+
j
Galvanometer
① 采用298K下标准还原电势(即标准电极电势)
4.3 标准电极电势表
电极反应: 氧化型 + ne- 还原型
②
②排列顺序:上→下,
电极类型
小的电对对应的还原型物质 ;
大的电对对应的氧化型物质 。
氧化能力:Ag+>Fe3+>Zn2+
还原能力:Zn>Fe2+>Ag
还原性强
氧化性强
③ 无加和性
④ 一些电对的 与介质的酸碱性有关
⑤ 为水溶液体系标态下的 ,对非水体系不适用。
原则上只适用于热力学标态和常温下的反应。
甘汞电极(参比电极)
表示方法
由于标准氢电极的制作和使用都很困难,平时人们采用相对稳定的甘汞电极作参比电极.
4.4 电池的电动势与Gibbs函数
E — 电动势(V)
F — 法拉第常数 96485≈96500(C·mol-1)
n — 电池反应中转移的电子的物质的量
电功(J)=电量(C)×电势差(V)
电池反应:
标准状态:
nFE
G
-
=
D
当有电子自动从低电势→高电势时,反应的自由能减少转变为电能并做了功。
[例]计算在298K时下列原电池的 和
(-) Zn︱ZnSO4‖CuSO4︱Cu (+)
解:
影响因素
[例]已知下列反应的热力学数据, 试计算
解:
0
0
0
-152.4
0
-106.5
41.63
130.7
= -152.4KJ·mol-1 + 0KJ·mol-1 _ 0KJ·mol-1 - 0KJ·mol-1
= -152.4 KJ·mol-1
有
4.5、电池标准电动势和平衡常数
根据式: △rGm = -nFE
△rGm = -RTlnK
即得: RTlnK = nFE
在298.15K下,将 R= 8.314J·K-1· mol –1, F=96485C · mol –1, 代入上式
得:
该式说明:在一定温度下, 氧化还原反应的平衡常数与标准态下的电池电动势(氧化剂、还原剂本性)和电子转移数有关,而与 无关。
反应物浓度
求298.15K下 Zn+ Cu2+ Cu + Zn2+反应的平衡常数。
解: 将以上反应设计成原电池, 电极反应为:
正极反应: Cu2 ++2e- → Cu
负极反应: Zn →Zn2+ + 2e-
E = (Cu2+ / Cu ) – (Zn2+/Zn)
= 0.34192V – (-0.7618V) =1.1037V
K = 2.503× 1037
查表得 (Cu2+ / Cu ) =0.3419V
(Zn2+/ Zn)= -0.7618V
讨论:电池电动势也可表示反应进行的 。
一般认为: 当n=2时, E ﹥0.2V, 或n=1时, E ﹥0.4V,
均有K﹥106, 反应进行得比较完全了。
由
可知:
K
E
反应程度大
程度
已知:
Ag+ + e- Ag
AgCl + e- Ag + Cl-
=0.7996V
=0.22233V
求AgCl的pKsp。
Ag+ + e- Ag (1)
AgCl + e- Ag + Cl- (2)
把它们组成原电池。根据电极电位的高低, 确定(1)为正极, (2)为负极, 电池反应式为:
Ag+ + Cl- AgCl(s)
该反应的逆反应为 AgCl溶解平衡,电池反应的平衡常数
即为AgCl Ksp的倒数。
解:
pKsp= -lg Ksp = -lg(1/K ) = lg K
pKsp = 9.7578 (与实验值9.75很接近)
4.6 电极电位的Nernst方程式
及影响电极电位的因素
一、Nernst方程式
1.电池电动势的Nernst方程式
得: -nFE = -nFE + RTlnQ
热力学等温方程式:
△rGm =
+ RTlnQ
△rGm
△rGm = -nFE (8.7a)
由式(8.7a)和式(8.7b)代入:
△rGm = -nFE (8.7b)
(8.8a)
R 为气体常数(8.314J·mol-1·K-1),
T 为绝对温度,
n 为电池反应中电子转移的数目。
F 为法拉第常数(96485C·mol-1),
E 为组成电池的电动势。
Q 为反应商。
E 为标准电池电动势( + - - ),
当T =298.15K时, 代入相关常数, 式(8.8a)变为:
(8.8b)
aOx1+bRed2 dRed1+eOx2
反应商可写为:
(8.9)
—— 电池电动势的Nernst方程式。
将式(8.9)代入式(8.8a)和式(8.8b)得:
(8.10a)
(8.10b)
对于任意一个已配平的氧化还原方程式:
可得:
2.电极电位的Nernst方程式
对于任一半反应: pOx + ne- qRed
(8.11a)
(8.11b)
n为电极反应中电子转移数。p 、q 为配平的半反应中氧化态和还原态前的系数。
Q式中包括氧化剂和还原剂及其相关介质(如H+、OH-)
纯液体、纯固体和溶剂不带入Q;
若为气体为p/p ,若为溶液则c/c 。
—— 电极电位的Nernst方程式
(1)电极电位不仅取决于电极的本性, 还取决于反应
时的温度和氧化剂、还原剂及其介质的浓度(或分压)。
(2)一般地,浓度对电极电位的影响并不显著, 影响电极电位的主要因素是标准电极电位, 其次才是浓度。
讨论:
(8.11b)
(8.11a)
例:
例
已知电极反应
室温下的电极电势。
浓度对电极电势的影响
解:
n = 6
电极反应:
若Cr2O72-和Cr3+的浓度均为1mol·L-1, 求298.15K, pH=6时的电极电位。
=1.232V
酸度对电极电势的影响
因为: c(Cr2O72-)= c(Cr3+)=1mol·L-1,
pH=6, c(H+)=1×10-6mol·L-1
讨论:因此pH=6时,电极电位从+1.232V降到+0.404V, 降低了+0.828V, 表明其氧化性较标准态明显降低。
C
r
2
O
7
2
-
+
7
H
+
+
3
e
C
r
3
+
+
7/2
H
2
O
1/2
解: Ag+ + e- Ag n=1
Ag+ + Cl- AgCl
[Ag+ ][Cl-]=Ksp=1.77×10-10
[Ag+ ] = Ksp/[Cl-] =1.77×10-10
= 0.7996V - 0.577V = 0.223V
若在电极溶液中加入NaCl,使其生成AgCl沉淀,并保持Cl-浓度为1mol·L-1 ,求298.15K时的电极电位。
已知Ag+ + e- Ag =0.7996V
讨论:显然由于沉淀生成, [Ag+]急剧降低, 对 (Ag+/ Ag)影响较大。
沉淀的生成对电极电位的影响
1、比较氧化剂和还原剂的相对强弱
电极的电极电势越大,电极反应:
越容易进行,氧化型物质越易得到电子,是越强的氧化剂;而对应的还原型物质越难失去电子,是越弱的还原剂。
电极的电极电势越小,电极中的还原型物质越易失去电子,是越强的还原剂;而对应的氧化型物质越难得到电子,是越弱的氧化剂。
当电对处于非标准状态下,必须计算出各电对的电极电势,然后再进行比较。
例题
4.7 电极电势的应用
pOx + ne- qRed
在 298.15 K、标准状态下,从下列电对中选择出最强的氧化剂和最强的还原剂,并列出各种氧化型物质的氧化能力和还原型物质的还原能力的强弱顺序。
解:查得:
。
在标准状态下,上述电对中氧化型物质的氧化能力由强到弱的顺序为:
还原型物质的还原能力由强到弱的顺序为:
最强的氧化剂
最强的还原剂
2 计算原电池的电动势
把下列反应排成原电池,并计算该原电池的标准电动势E 和
2 Fe3+ + Sn2+ 2 Fe2+ + Sn4+
解:
负极(氧化反应)
Sn2+ Sn4+ + 2e- ;
)
Sn2+
/
(Sn4+
= 0.154V
4.7 电极电势的应用
正极(还原反应)
Fe3+ + e- Fe2+;
(Fe3+/Fe2+) = 0.771V
-
=
E
(Fe3+/Fe2+)
)
Sn2+
/
(Sn4+
= 0.771 – 0.154 = 0.617V
所以,电池符号为:
Pt (+
Fe3+ ,Fe2+
Sn2+,Sn4+
Pt
)
-
‖
计算下列原电池的电动势,写出电池反应式。
解:
电池电动势为: E = 0.213-(-0.433)=0.646>0
电池反应为:
3、判断氧化还原反应的方向
用电对的电极电势判断氧化还原反应方向。
4.7 电极电势的应用
例 判断 298.15 K 时,氧化还原反应:
在下列条件下进行的方向。
解:
进行?
时的标准态下能否正向
25℃
在
?
)
g
(
Cl
取
制
HCl
浓
能用
实验室中为
)
2
(
2
什么
)
1
(
试判断下列反应
:
例
该反应在标准态下不能向右进行。
O(1)
2H
)
g
(
Cl
(aq)
MnCl
4HCl(aq)
)
s
(
MnO
2
2
2
2
+
+
+
)
l
(
O
2H
)
aq
(
Mn
2e
)
aq
(
4H
)
s
(
MnO
)
1
(
2
2
2
+
+
+
+
-
+
解:
V
23
.
1
=
V
36
.
1
(aq)
Cl
2
2e
(g)
Cl
2
=
+
-
-
V
30
.
1
12
1
lg
2
V
0592
.
0
1.36V
2
=
+
=
1.36V
12
lg
2
V
0592
.
0
1.2293V
4
=
+
=
)
/Mn
MnO
(
2
2
+
L
12mol
)
Cl
(
)
H
(
HCl
)
2
(
1
=
=
-
-
+
c
c
中,
浓
]
/
)
Cl
(
[
/
)
Cl
(
lg
2
V
0592
.
0
)
/Cl
Cl
(
)
/Cl
Cl
(
2
2
2
2
+
=
-
-
-
c
c
p
p
]
/
)
Mn
(
[
]
/
)
H
(
[
lg
2
V
0592
.
0
)
/Mn
MnO
(
2
4
2
2
+
=
+
+
+
c
c
c
c
)
/Cl
Cl
(
)
/Mn
MnO
(
2
2
2
-
=
-
+
E
0
0.06V
1.30V
1.36V
>
=
-
=
4、确定氧化还原反应进行的限度
氧化还原反应进行的限度可以用反应的标准平衡常数来衡量。氧化还原反应的标准平衡常数与原电池的标准电动势的关系为:
当 T = 298.15 K 时,
原电池的标准电动势越大,氧化还原反应的标准平衡常数就越大,反应进行就越完全。
例题
4.7 电极电势的应用
例 试估计 298.15 K 时氧化还原反应:
进行的限度。
解: 298.15 K 时反应的标准平衡常数为:
很大,说明反应正向进行得很完全。
5、选择氧化剂、还原剂
在实验过程中,经常会遇到同一混合体系中需将
某一组分氧化,而又不要求氧化(或还原)其他
组分,这时,只有选择合适的氧化剂(或还原剂),
才能达到目的。
4.7 电极电势的应用
例
解:查表得:
根据题意,该氧化剂的电极电势必需满足
:
氧化剂。反应方程式为
是符合要求的
)
(
,
由标准电极电势、可知
也可被氧化。
,则
可被氧化,若大于
,则
被氧化。若大于
不能
,则
若小于
。
3
4
2
-
-
-
SO
Fe
Cl
3583V
.
1
Br
066V
.
1
I
0.5355V
3583V
.
1.
5355V
.
0
á
á
q
j
4.8 元素标准电极电势图
把同一种元素组成的各电对的标准电极电势以图的形式表示出来,这种图称为元素标准电势图。
1 元素标准电极电势图的表示方法
按元素的氧化值由高到低的顺序把各种不同氧化值物质从左到右依次排列,将不同氧化值的物质之间用直线连接,在直线上标明两种不同氧化值物质所组成的电对的标准电极电势。例如:
图中所对应的电极反应是在酸性溶液中发生的:
计算电对的标准电极电势
利用元素标准电极电势图,可以从某些已知电对的标准电极电势计算出另一个电对的未知标准电极电势。例如 :
2 元素标准电极电势图的应用
4.8 元素标准电极电势图
例
已知溴元素在碱性介质中的标准电极电势图:
判断歧化反应能否发生:
例如:Cu的电势图:
2 元素标准电极电势图的应用
氧化值的升高和降低发生在同一物质中的
同一种元素上的氧化还原反应称为歧化反应。
+
举例
歧化反应
许多氧化还原反应是在水溶液中进行的,当 H+ 或 OH- 参与电极反应时,溶液 pH 的改变能引起电对的电极电势的变化。在浓度、温度一定时,电对的电极电势仅与溶液 pH 有关。以电对的电极电势为纵坐标,以溶液 pH 为横坐标作图,所得图形称为电势- pH 图。
4.9 电势- pH 图
某些电对的电势-pH 图
水本身又具有氧化还原性
4.9 电势- pH 图
当 H2O 作氧化剂时:
2H+ + 2e- H2
当 p(H2) = 100 kPa 时:
当 H2O 作还原剂时:
O2 + 4H+ + 4e- 2H2O
以上述两个电对的电极电势为纵坐标,以溶液pH 为横坐标作图,得到水的电势-pH 图。
当 p(O2)=100 kPa 时:
某些电对的电势-pH 图
图中 a 线表示在一定 pH 下电对 O2/H2O 的电极电势;b 线表示在一定 pH 下电对 H2O/H2 的电极电势。由于实际放电速率缓慢,致使实际值比理论值升高 0.5 V, 即为 a 线; 而 b 线比理论值降低 0.5 V,即为 b 线。
某些电对的电势-pH 图
某电对的电极电势图高于 a 线,发生什么情况?
某电对的电极电势图低于 b 线,发生什么情况?
在水溶液中,若强氧化剂所在电对的电极电势高于 a 线,它就可以氧化 H2O 放出 O2,所以在 a 线上方区域为 O2 的稳定区。
在水溶液中,若还原剂所在电对的电极电势低于 b 线,它就可以还原 H2O 放出 H2,所以在 b 线下方区域为 H2 的稳定区。
在水溶液中,若氧化剂所在电对的电极电势低于 a 线或还原剂所在电对的电极电势高于 b 线,则水既不能被氧化,也不能被还原。所以 a 线和 b 线之间是 H2O 的稳定区。
4.10 实用电化学
有关电解的几个问题
电解是在外电源作用下被迫发生的氧化还原过程,把电能转变为化学能。而在原电池中正好相反,是自发地把化学能转变为电能。
阳极发生氧化反应,是阴离子移向的极。
习惯上,原电池的电极常称正极、负极;电解池的电极常称阴极、阳极。
第十章 氧化还原反应和电化学
教学基本要求
1.掌握氧化还原反应的概念及方程式配平
2.掌握原电池的原理与符号
3.理解原电池电动势、电极电势、标准电极电势、
标准电极等概念
4.掌握原电池电动势、电极电势的计算及应用;
以及电池电动势与电池反应热力学函数的关系
5.掌握元素的标准电势图
一、基本概念
1、氧化还原反应
1.1从得氧、失氧的角度
氧化反应:
还原反应:
氧化还原反应
氧化剂:
还原剂:
物质得氧的反应
物质失氧的反应
失去氧的物质
得到氧的物质
氧化性
还原性
一、基本概念
1、氧化还原反应
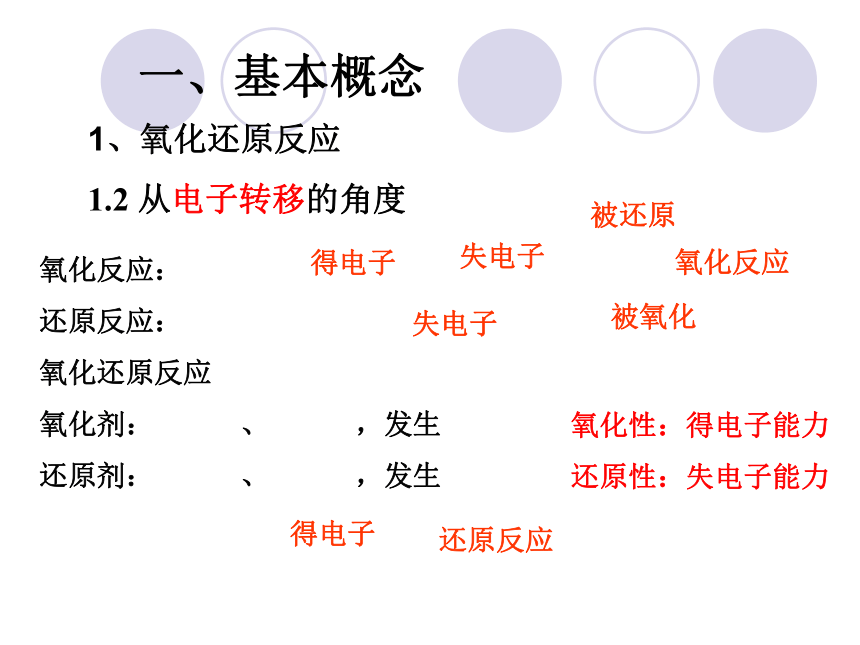
1.2 从电子转移的角度
氧化反应:
还原反应:
氧化还原反应
氧化剂: 、 ,发生
还原剂: 、 ,发生
氧化性:得电子能力
还原性:失电子能力
失电子
得电子
得电子
失电子
被还原
还原反应
被氧化
氧化反应
一、基本概念
1、氧化还原反应
1.3从化合价升降的角度
氧化反应:
还原反应:
氧化还原反应:
氧化剂:
还原剂:
氧化性:处于高价态
还原性:处于低价态
化合价升高
化合价降低
化合价降低
化合价升高
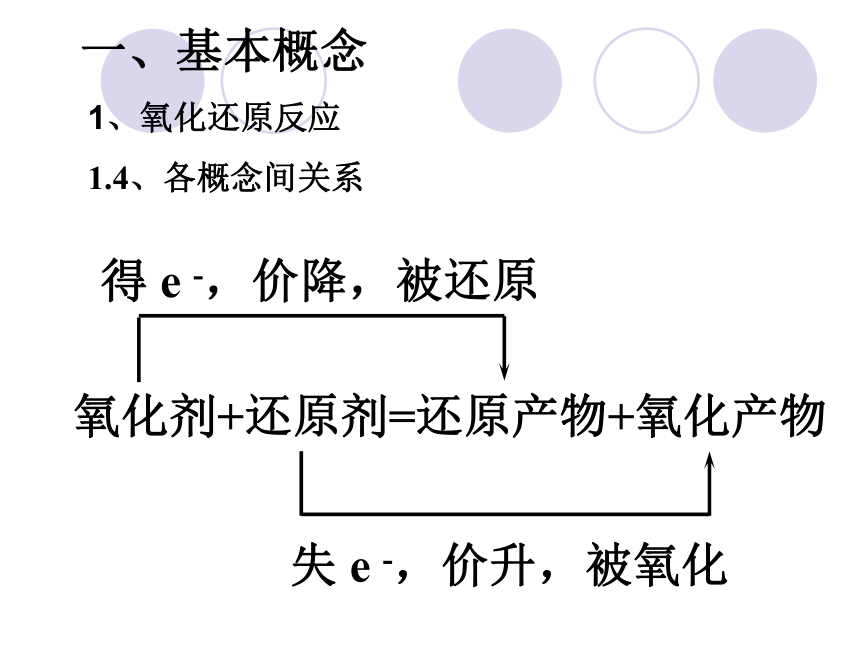
氧化剂+还原剂=还原产物+氧化产物
得 e -,价降,被还原
失 e -,价升,被氧化
1、氧化还原反应
1.4、各概念间关系
一、基本概念
1.5 半反应与氧化还原电对
根据电子转移,氧化还原反应可以拆成两个半反应,或看成由两个半反应构成。
氧化半反应: Zn - 2e- → Zn 2+
还原半反应: Cu2+ + 2e - → Cu
可见:氧化还原反应中,电子有得 必有失,且失得数目相等;氧化半反应和还原半反应同时并存,不能单独存在。
例如: Zn+Cu2+ Cu+Zn 2+
式中:n=5,氧化态为MnO4-和8H+,还原态为Mn2+
(H2O是溶剂,不包括在内)。
n为电子转移的数目,氧化态(oxdidation state,Ox)应包括氧化剂及其相关介质(酸、碱等),
还原态(reduction state,Red)应包括还原剂及其相关介质。
半反应的通式为:氧化态 + ne- 还原态
Ox + ne- Red
MnO4-+8H++5e- Mn2++4H2O
如半反应
如: MnO4-/Mn2+;Cu2+/Cu;Zn2+ /Zn;
还原半反应:
氧化半反应:
Fe3+ + e- → Fe2+
Sn2+ →Sn4+ + 2e-
氧化还原电对为:Fe3+ /Fe2+ ;Sn4+ /Sn2+ ;
又如: 2Fe3+ +Sn2+ 2 Fe2+ +Sn4+
氧化还原反应中,存在氧化还原电对。即氧化态物质(电子受体)及其对应的还原态物质(电子供体) 。
记为:氧化态/还原态;或 (Ox / Red)。
酸碱质子理论中,存在共轭酸碱对。
2、氧化值(Oxidation Number)
2.1电负性(electronegativity)
表示一个原子在分子中吸引成键电子能力的量度。一般用X表示(无单位)。电负性数值越大,原子在形成化学键时对成
键电子的吸引力越强。
元素的电负性随原子序数的增加呈现明显的周期性变化。
同一周期:自左→右,增大
同一主族:自上→下,减小
过渡元素的电负性无明显的规律
一般:X>2.0, 非金属元素
X<2.0, 金属元素
一、基本概念
2.2 氧化数(氧化值)
氧化数:是指某元素的一个原子的表观电荷数。该电荷数是假定把每一化学键中的电子指定给电负性更大的原子而求得的。
一、基本概念
如何理解?
1、氧化数是一种人为规定数值 。用以表征元素在化合状态时所具有的形式电荷(表观电荷)数。
2、它只表示氧化状态的高低,与化合物结构无关,不是真实的电荷数。
3、表示元素平均的、表观的氧化状态。有大小和正负号。
对关键元素的氧化值的规定:
1、在化合物中:氧元素的氧化数一般为-2;
过氧化物(如H2O2、Na2O2等)中为-1;
超氧化合物(如KO2)中为-1/2,
2、在化合物中:氢元素的氧化值一般为+1;
与活泼金属生成的离子型氢化物中为-1。
(如NaH、 CaH2)
3、在卤化物中:卤素的氧化数均为-1;
4、在碱金属、碱土金属在化合物中:
金属的氧化数分别为+1,+2。
确定氧化数的一般规则:
1、单质中元素的氧化数为零。
如:Cu,O2,Ar,S8,P4,
2、中性分子中各元素的正负氧化数代数和为零。
如:Fe2O3, H2S,
+3,-2; +1,-2;
CH4, C2H4,
-4,+1; -2,+1;
3、多原子离子中各元素原子正、负氧化数的代数和
等于离子电荷。
如:MnO4-, BF4-
+7,-2; +3,-1
例: 求NH4+中N的氧化值。
解:已知H的氧化值为+1。设N的氧化值为x。
x +(+1)×4= +1 得: x = -3,所以N的氧化值为-3。
例 :求Fe3O4中Fe的氧化值。
解: 已知O的氧化值为-2。设Fe的氧化值为x,
则: 3x + 4×(- 2)= 0
x = +8/3
所以,Fe的氧化值为+8/3
注意:
在共价化合物中,判断元素原子的氧化值时,不要与共价数(某元素原子形成的共价键的数目,化合价)相混淆。
例如 CH4 CH3Cl CH2Cl2 CHCl3 CCl4
C的共价数 4 4 4 4 4
C的氧化值 -4 -2 0 +2 +4
从氧化值角度定义氧化还原反应:
凡化学反应中,反应前后元素的原子氧化值发生了变化的一类反应。
如: Cu2+ + Zn = Cu + Zn2+
氧化:失去电子,氧化值升高的过程。如:
Zn- 2e=Zn2+
还原:得到电子,氧化值降低的过程。如: Cu2++2e=Cu
还原剂:反应中氧化值升高的物质。发生的反应是氧化反应。如: Zn
氧化剂:反应中氧化值降低的物质。发生的反应是还原反应。如:Cu2+
元素的氧化值发生变化的反应称为
氧化还原反应。
在氧化还原反应中,元素的氧化值升高的过程
称为氧化;元素的氧化值降低的过程称为还原。
氧化过程和还原过程总是 发生的。
在氧化还原反应中,组成元素的氧化值升高的
物质称为还原剂,它的反应产物称为氧化产物。
组成元素的氧化值降低的物质称为氧化剂,它的反应产物称为还原产物。
氧化剂和还原剂
同时
判断一种物质是做氧化剂还是做还原剂,通常可以依据以下原则:
(1) 当元素的氧化值为最高值时,它的氧化
值不能再增大,只能做氧化剂。
(2) 当元素的氧化值为最低值时,它的氧化
值不能再减小,只能做还原剂。
(3) 当元素的氧化值为中间值时,它既可以做氧化剂,也可以做还原剂。
活泼非金属单质:Cl2 、Br2 、I2 、O2等
高价金属离子或不活泼金属离子:
Fe3+ 、Sn4+、 Cu2+ 、Ag+等
高价含氧化合物:H2SO4 、HNO3 、
KMnO4 、MnO2 、KClO3等
常见的强氧化剂
活泼金属单质:Na、Mg、Al、Zn、Fe 等
某些非金属单质:C、H2等
非金属阴离子:S2- 、I- 、Br- 等
低价金属离子:Fe2+ 、Sn2+ 等
低价化合物:H2S、HI、NH3、CO等
常见的还原剂
配平步骤如下:
(1)写出反应物和产物的化学式;
(2)标出氧化值发生变化的元素的氧化值,计算出氧化值升高和降低的数值;
(3)利用最小公倍数确定氧化剂和还原剂的化学计量数。
(4)配平氧化值没有变化的元素原子,并将箭号改成等号。
二、氧化还原反应方程式的配平
1 氧化值法
配平要求:(1)氧化剂的氧化数降低值等于还原剂的氧化数升高值 (氧化数变化守恒)
(2)反应式两边各元素原子数相等(质量守恒)
例 7-2 用氧化值法配平下列氧化还原反应:
解:标出氧化值发生变化的组成元素的氧化值,计算氧化值升高和降低的数值。
2× [+3 - (+6)]=- 6
2× [0 - (-1)]= +2
利用最小公倍数确定氧化剂和还原剂的化学计量数:
配平其他氧化值没有变化的元素的原子:
2、 离子电子法
配平原则:
① 电荷守恒:氧化剂得电子数等于还原剂失电子数。
② 质量守恒:反应前后各元素原子总数相等。
1、将反应物和氧化还原产物,以离子形式写出
2、将方程式分为两个未配平的半反应式
3、将原子数配平,关键在氧原子配平
配平步骤:
例1:配平反应方程式
5、两式乘以系数,使得电子数和失电子数相等,
两式相加,消去两边的“ne”,
6、检查反应式两边各原子数和电荷数是否相等。
4、将电荷数配平,反应式左边或右边加电子
“+ne”
+
-
-
-
+
+
Mn
SO
SO
MnO
①
2
2
4
2
3
4
+
-
+
-
+
=
+
+
O
4H
Mn
5e
8H
MnO
④
2
2
4
①
-
+
-
-
+
+
=
+
2e
2H
SO
O
H
SO
2
4
2
2
3
②
-
-
2 +
-
Mn
MnO
4
①
SO
SO
2
4
2
3
②
②
-
-
+
②
+
+
=
+
2H
SO
O
H
SO
2
4
2
2
3
+
-
+
+
O
4H
Mn
8H
MnO
2
2
4
①
③
+
)
4
2
-
+
-
-
+
+
=
+
10e
10H
5SO
O
5H
5SO
2
2
3
+
-
+
-
+
=
+
+
O
8H
2Mn
10e
16H
2MnO
2
2
4
⑤
①×2+②×5得
O
3H
SO
K
6
MnSO
2
2
4
2
4
+
+
=
3H SO
SO
5K
2KMnO
4
3
2
4
+
+
2
O
3H
5SO
2Mn
6H
5SO
2MnO
2
2
4
2
2
3
4
+
+
=
+
+
-
+
+
-
-
⑥
⑦
2、 离子电子法
例 配平在硫酸介质中高锰酸钾与硫酸亚铁反应的方程式:
解:(1) KMnO4+FeSO4 MnSO4+Fe2(SO4)3+K2SO4
MnO4-+Fe2+ Mn2++Fe3+
(2) 氧化反应: Fe2+ Fe3++e
还原反应:8H++ MnO4-+5e Mn2++4H2O
(3) 5 Fe2+ 5Fe3++5e
+) MnO4-+8H++5e Mn2++4H2O
MnO4-+8H++5 Fe2+ Mn2++4H2O+5Fe3+
得到用分子形式表示的反应式:
(4) 2 KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3 +8H2O+K2SO4
例 用离子-电子法配平下列氧化还原反应:
解:先写成离子方程式:
将离子方程式分成两个半反应:
分别配平两个半反应:
根据得、失电子数相等的原则,将两个半反应合
并,写出配平的离子方程式:
最后写出配平的氧化还原反应方程式:
例:配平
①×5+②得:
①
②
化简得:
二、氧化还原反应方程式的配平
两种方法比较:
离子-电子法 :不需要计算元素的氧化值,仅适用于在水溶液中进行的反应。
氧化值法 :不仅适用于在水溶液中进行的反应,也适用于在非水溶液和高温下进行的反应。
三 原电池
3.1 原电池
/Cu
Cu
,
/Zn
Zn
电对:
2
2
+
+
金属导体,如 Cu、Zn
惰性导体,如 Pt、石墨棒
电极
(aq)
Zn
2e
Zn(s)
:
)
(
极
2
-
+
-
氧化反应
电子流出
负
Cu(s)
2e
(aq)
Cu
:
)
(
极
2
+
-
+
还原反应
电子流入
正
Cu(s)
(aq)
Zn
(aq)
Cu
Zn(s)
电池反应:
2
2
+
+
+
+
还原型
e
氧化型
-
+
Z
电极反应表示的通式:
所以,上式可写为:Zn(s) Zn2-(aq) + 2e
或 Zn2-(aq) + 2e Zn(s)
=
书写原电池符号的规则:
①负极“-”在左边,正极“+”在右边,盐桥用“ ”表示。盐桥两侧是两个电极的电解质溶液。
原电池符号(电池图示):
③如果反应中没有可以作电极的导体,必须外加一惰性电极导体,惰性电极导体通常是不活泼的金属(如铂)或石墨。
②半电池中两相界面用“ ”分开,溶液中存在几种离子时,离 子间用逗号隔开。溶液、气体要注明浓度,压力 。
相界
盐桥
相界
浓度
浓度
④纯液体、固体和气体写在惰性电极一边。
====
====
例:将下列反应设计成原电池并以原电池符号
表示。
解:
-
3
2
====
)
(aq
2Cl
2e
)
g
(
Cl
极
正
2
-
+
)
(aq
Fe
+
e
)
(aq
Fe
极
负
-
+
-
例:将下列反应设计成原电池并以原电池符号表示。
例:将下列反应设计成原电池并以原电池符号表示。
解:
︱Pt(+)
电极电势
还原半反应
氧化半反应
+
-
+
+
+
-
2
3
4
2
)
(
)
(
Fe
e
Fe
-
2
)
(
1
+
Sn
+
-
e
Sn
还原半反应
氧化半反应
2
2
H
e
2
H
2
)
(
Zn
e
2
Zn
)
(
)
2
(
-
+
+
-
+
+
-
-
原电池的正极发生还原反应,负极发生氧化反应。因此组成原电池时,电对 为正极,电对 为负极。原电池符号为:
例 将氧化还原反应:
设计成原电池,写出该原电池的符号。
解:先将氧化还原反应分为两个半反应:
氧化反应:
还原反应:
====
3.2、电极种类:
1. 金属—离子电极:
电极符号: Zn(S) Zn2+(c)
单垂线“∣”表示不同物相间的界面,
电极反应式: Zn2+(aq) + 2e → Zn(s)
2.气体—离子电极:
电极符号:Pt H2(p)H+(c)
电极反应: 2H+(aq) + 2e → H2(g)
3. 氧化—还原电极:
电极反应:Fe3+ (aq)+ e- → Fe2+(aq)
电极符号:Pt Fe3+(c1),Fe2+(c2)
由于这个电极反应是在溶液中进行,不存在界面,所以对于两种不同氧化态的离子可用逗号分开。
电极反应: Hg2Cl2(s)+2e →2Hg(l)+ 2Cl-(aq)
4. 金属—难溶盐电极:
电极符号:Pt Hg(l) Hg2Cl2(s) Cl-(c)
Ag(s) AgCl(s)Cl-(c)
电极符号:
电极反应:
AgCl(s)+ e → Ag(s) + Cl- (aq)
四、电极电势
把金属插入含有该金属离子的溶液中
溶解
沉积
溶解>沉积,金属表面带负电,金属表面附近的溶液带正电;
沉积>溶解,金属表面带正电,金属表面附近的溶液带负电;
即在金属表面上形成“双电层”
产生于金属表面与含有该金属离子的溶液之间的电位差称为金属电对的电极电势, 。
金属电极的电极电势主要取决于金属和金属离子的本性,此外受离子浓度和温度的影响。
4.1 电极电势的产生
以 表示
4.2、标准电极电势的测定
标准电极电势:若组成电极的各物质均处于热力学标准态,此时的电极电势就称为标准电极电势,符号
单个电极的电极电势是无法测定的:
通常选定一个电极作比较标准,规定其标准电极电势为零,确定其它电极对此电极的相对电极电势。
采用标准氢电极作为标准电极。
4.2、标准电极电势的测定
标准氢电极是用镀有一层疏松铂黑的铂片作为电极导体,插入 H+ 活度为 1 mol·L-1的酸溶液中,不断通入 100 kPa H2,使铂片吸附氢气达到饱和。吸附在铂片上的 H2 与溶液中的 H+ 建立了如下平衡:
这种产生在 100 kPa H2 饱和了的铂片与 酸溶液之间的电势差,称为标准氢电极的电极电势。规定标准氢电极的电极电势为零。
标准氢电极的电极电势
电极反应:
(
)
g
H
2e
aq)
(
H
2
2
+
-
+
/H
H
电对:
2
+
标准电极电势,其中“ ” 指标准态
氢电极的标准电极电势等于零。
电极符号为:
H+(1mol.L-1) ︳H2(100kPa) ︳Pt
4.2、标准电极电势的测定
测定某给定电极的标准电极电势时,可将待测标准电极与标准氢电极组成原电池
测定出这个原电池的电动势,就可以得到待测电极的标准电极电势。
4.2、标准电极电势的测定
标准电动势
Galvanometer
例:测锌电极的电极电势
(-)Zn | Zn2+(c )‖H+(c ) | H2( p ) | Pt (+)
根据检流计偏转方向,测得锌电极为
负极,氢电极为正极,并测得E =0.763V
-
+
-
=
j
j
E
Zn
/
Zn
.
.
+
-
=
2
0000
0
763
0
j
V
.
Zn
/
Zn
763
0
2
-
=
+
j
例:测铜电极的电极电势
测得: 铜电极为正极,氢电极为负极
E = 0.340伏
2
.
.
0000
0
340
0
Cu
/
Cu
-
=
+
j
V
.
Cu
/
Cu
340
0
2
=
+
j
Galvanometer
① 采用298K下标准还原电势(即标准电极电势)
4.3 标准电极电势表
电极反应: 氧化型 + ne- 还原型
②
②排列顺序:上→下,
电极类型
小的电对对应的还原型物质 ;
大的电对对应的氧化型物质 。
氧化能力:Ag+>Fe3+>Zn2+
还原能力:Zn>Fe2+>Ag
还原性强
氧化性强
③ 无加和性
④ 一些电对的 与介质的酸碱性有关
⑤ 为水溶液体系标态下的 ,对非水体系不适用。
原则上只适用于热力学标态和常温下的反应。
甘汞电极(参比电极)
表示方法
由于标准氢电极的制作和使用都很困难,平时人们采用相对稳定的甘汞电极作参比电极.
4.4 电池的电动势与Gibbs函数
E — 电动势(V)
F — 法拉第常数 96485≈96500(C·mol-1)
n — 电池反应中转移的电子的物质的量
电功(J)=电量(C)×电势差(V)
电池反应:
标准状态:
nFE
G
-
=
D
当有电子自动从低电势→高电势时,反应的自由能减少转变为电能并做了功。
[例]计算在298K时下列原电池的 和
(-) Zn︱ZnSO4‖CuSO4︱Cu (+)
解:
影响因素
[例]已知下列反应的热力学数据, 试计算
解:
0
0
0
-152.4
0
-106.5
41.63
130.7
= -152.4KJ·mol-1 + 0KJ·mol-1 _ 0KJ·mol-1 - 0KJ·mol-1
= -152.4 KJ·mol-1
有
4.5、电池标准电动势和平衡常数
根据式: △rGm = -nFE
△rGm = -RTlnK
即得: RTlnK = nFE
在298.15K下,将 R= 8.314J·K-1· mol –1, F=96485C · mol –1, 代入上式
得:
该式说明:在一定温度下, 氧化还原反应的平衡常数与标准态下的电池电动势(氧化剂、还原剂本性)和电子转移数有关,而与 无关。
反应物浓度
求298.15K下 Zn+ Cu2+ Cu + Zn2+反应的平衡常数。
解: 将以上反应设计成原电池, 电极反应为:
正极反应: Cu2 ++2e- → Cu
负极反应: Zn →Zn2+ + 2e-
E = (Cu2+ / Cu ) – (Zn2+/Zn)
= 0.34192V – (-0.7618V) =1.1037V
K = 2.503× 1037
查表得 (Cu2+ / Cu ) =0.3419V
(Zn2+/ Zn)= -0.7618V
讨论:电池电动势也可表示反应进行的 。
一般认为: 当n=2时, E ﹥0.2V, 或n=1时, E ﹥0.4V,
均有K﹥106, 反应进行得比较完全了。
由
可知:
K
E
反应程度大
程度
已知:
Ag+ + e- Ag
AgCl + e- Ag + Cl-
=0.7996V
=0.22233V
求AgCl的pKsp。
Ag+ + e- Ag (1)
AgCl + e- Ag + Cl- (2)
把它们组成原电池。根据电极电位的高低, 确定(1)为正极, (2)为负极, 电池反应式为:
Ag+ + Cl- AgCl(s)
该反应的逆反应为 AgCl溶解平衡,电池反应的平衡常数
即为AgCl Ksp的倒数。
解:
pKsp= -lg Ksp = -lg(1/K ) = lg K
pKsp = 9.7578 (与实验值9.75很接近)
4.6 电极电位的Nernst方程式
及影响电极电位的因素
一、Nernst方程式
1.电池电动势的Nernst方程式
得: -nFE = -nFE + RTlnQ
热力学等温方程式:
△rGm =
+ RTlnQ
△rGm
△rGm = -nFE (8.7a)
由式(8.7a)和式(8.7b)代入:
△rGm = -nFE (8.7b)
(8.8a)
R 为气体常数(8.314J·mol-1·K-1),
T 为绝对温度,
n 为电池反应中电子转移的数目。
F 为法拉第常数(96485C·mol-1),
E 为组成电池的电动势。
Q 为反应商。
E 为标准电池电动势( + - - ),
当T =298.15K时, 代入相关常数, 式(8.8a)变为:
(8.8b)
aOx1+bRed2 dRed1+eOx2
反应商可写为:
(8.9)
—— 电池电动势的Nernst方程式。
将式(8.9)代入式(8.8a)和式(8.8b)得:
(8.10a)
(8.10b)
对于任意一个已配平的氧化还原方程式:
可得:
2.电极电位的Nernst方程式
对于任一半反应: pOx + ne- qRed
(8.11a)
(8.11b)
n为电极反应中电子转移数。p 、q 为配平的半反应中氧化态和还原态前的系数。
Q式中包括氧化剂和还原剂及其相关介质(如H+、OH-)
纯液体、纯固体和溶剂不带入Q;
若为气体为p/p ,若为溶液则c/c 。
—— 电极电位的Nernst方程式
(1)电极电位不仅取决于电极的本性, 还取决于反应
时的温度和氧化剂、还原剂及其介质的浓度(或分压)。
(2)一般地,浓度对电极电位的影响并不显著, 影响电极电位的主要因素是标准电极电位, 其次才是浓度。
讨论:
(8.11b)
(8.11a)
例:
例
已知电极反应
室温下的电极电势。
浓度对电极电势的影响
解:
n = 6
电极反应:
若Cr2O72-和Cr3+的浓度均为1mol·L-1, 求298.15K, pH=6时的电极电位。
=1.232V
酸度对电极电势的影响
因为: c(Cr2O72-)= c(Cr3+)=1mol·L-1,
pH=6, c(H+)=1×10-6mol·L-1
讨论:因此pH=6时,电极电位从+1.232V降到+0.404V, 降低了+0.828V, 表明其氧化性较标准态明显降低。
C
r
2
O
7
2
-
+
7
H
+
+
3
e
C
r
3
+
+
7/2
H
2
O
1/2
解: Ag+ + e- Ag n=1
Ag+ + Cl- AgCl
[Ag+ ][Cl-]=Ksp=1.77×10-10
[Ag+ ] = Ksp/[Cl-] =1.77×10-10
= 0.7996V - 0.577V = 0.223V
若在电极溶液中加入NaCl,使其生成AgCl沉淀,并保持Cl-浓度为1mol·L-1 ,求298.15K时的电极电位。
已知Ag+ + e- Ag =0.7996V
讨论:显然由于沉淀生成, [Ag+]急剧降低, 对 (Ag+/ Ag)影响较大。
沉淀的生成对电极电位的影响
1、比较氧化剂和还原剂的相对强弱
电极的电极电势越大,电极反应:
越容易进行,氧化型物质越易得到电子,是越强的氧化剂;而对应的还原型物质越难失去电子,是越弱的还原剂。
电极的电极电势越小,电极中的还原型物质越易失去电子,是越强的还原剂;而对应的氧化型物质越难得到电子,是越弱的氧化剂。
当电对处于非标准状态下,必须计算出各电对的电极电势,然后再进行比较。
例题
4.7 电极电势的应用
pOx + ne- qRed
在 298.15 K、标准状态下,从下列电对中选择出最强的氧化剂和最强的还原剂,并列出各种氧化型物质的氧化能力和还原型物质的还原能力的强弱顺序。
解:查得:
。
在标准状态下,上述电对中氧化型物质的氧化能力由强到弱的顺序为:
还原型物质的还原能力由强到弱的顺序为:
最强的氧化剂
最强的还原剂
2 计算原电池的电动势
把下列反应排成原电池,并计算该原电池的标准电动势E 和
2 Fe3+ + Sn2+ 2 Fe2+ + Sn4+
解:
负极(氧化反应)
Sn2+ Sn4+ + 2e- ;
)
Sn2+
/
(Sn4+
= 0.154V
4.7 电极电势的应用
正极(还原反应)
Fe3+ + e- Fe2+;
(Fe3+/Fe2+) = 0.771V
-
=
E
(Fe3+/Fe2+)
)
Sn2+
/
(Sn4+
= 0.771 – 0.154 = 0.617V
所以,电池符号为:
Pt (+
Fe3+ ,Fe2+
Sn2+,Sn4+
Pt
)
-
‖
计算下列原电池的电动势,写出电池反应式。
解:
电池电动势为: E = 0.213-(-0.433)=0.646>0
电池反应为:
3、判断氧化还原反应的方向
用电对的电极电势判断氧化还原反应方向。
4.7 电极电势的应用
例 判断 298.15 K 时,氧化还原反应:
在下列条件下进行的方向。
解:
进行?
时的标准态下能否正向
25℃
在
?
)
g
(
Cl
取
制
HCl
浓
能用
实验室中为
)
2
(
2
什么
)
1
(
试判断下列反应
:
例
该反应在标准态下不能向右进行。
O(1)
2H
)
g
(
Cl
(aq)
MnCl
4HCl(aq)
)
s
(
MnO
2
2
2
2
+
+
+
)
l
(
O
2H
)
aq
(
Mn
2e
)
aq
(
4H
)
s
(
MnO
)
1
(
2
2
2
+
+
+
+
-
+
解:
V
23
.
1
=
V
36
.
1
(aq)
Cl
2
2e
(g)
Cl
2
=
+
-
-
V
30
.
1
12
1
lg
2
V
0592
.
0
1.36V
2
=
+
=
1.36V
12
lg
2
V
0592
.
0
1.2293V
4
=
+
=
)
/Mn
MnO
(
2
2
+
L
12mol
)
Cl
(
)
H
(
HCl
)
2
(
1
=
=
-
-
+
c
c
中,
浓
]
/
)
Cl
(
[
/
)
Cl
(
lg
2
V
0592
.
0
)
/Cl
Cl
(
)
/Cl
Cl
(
2
2
2
2
+
=
-
-
-
c
c
p
p
]
/
)
Mn
(
[
]
/
)
H
(
[
lg
2
V
0592
.
0
)
/Mn
MnO
(
2
4
2
2
+
=
+
+
+
c
c
c
c
)
/Cl
Cl
(
)
/Mn
MnO
(
2
2
2
-
=
-
+
E
0
0.06V
1.30V
1.36V
>
=
-
=
4、确定氧化还原反应进行的限度
氧化还原反应进行的限度可以用反应的标准平衡常数来衡量。氧化还原反应的标准平衡常数与原电池的标准电动势的关系为:
当 T = 298.15 K 时,
原电池的标准电动势越大,氧化还原反应的标准平衡常数就越大,反应进行就越完全。
例题
4.7 电极电势的应用
例 试估计 298.15 K 时氧化还原反应:
进行的限度。
解: 298.15 K 时反应的标准平衡常数为:
很大,说明反应正向进行得很完全。
5、选择氧化剂、还原剂
在实验过程中,经常会遇到同一混合体系中需将
某一组分氧化,而又不要求氧化(或还原)其他
组分,这时,只有选择合适的氧化剂(或还原剂),
才能达到目的。
4.7 电极电势的应用
例
解:查表得:
根据题意,该氧化剂的电极电势必需满足
:
氧化剂。反应方程式为
是符合要求的
)
(
,
由标准电极电势、可知
也可被氧化。
,则
可被氧化,若大于
,则
被氧化。若大于
不能
,则
若小于
。
3
4
2
-
-
-
SO
Fe
Cl
3583V
.
1
Br
066V
.
1
I
0.5355V
3583V
.
1.
5355V
.
0
á
á
q
j
4.8 元素标准电极电势图
把同一种元素组成的各电对的标准电极电势以图的形式表示出来,这种图称为元素标准电势图。
1 元素标准电极电势图的表示方法
按元素的氧化值由高到低的顺序把各种不同氧化值物质从左到右依次排列,将不同氧化值的物质之间用直线连接,在直线上标明两种不同氧化值物质所组成的电对的标准电极电势。例如:
图中所对应的电极反应是在酸性溶液中发生的:
计算电对的标准电极电势
利用元素标准电极电势图,可以从某些已知电对的标准电极电势计算出另一个电对的未知标准电极电势。例如 :
2 元素标准电极电势图的应用
4.8 元素标准电极电势图
例
已知溴元素在碱性介质中的标准电极电势图:
判断歧化反应能否发生:
例如:Cu的电势图:
2 元素标准电极电势图的应用
氧化值的升高和降低发生在同一物质中的
同一种元素上的氧化还原反应称为歧化反应。
+
举例
歧化反应
许多氧化还原反应是在水溶液中进行的,当 H+ 或 OH- 参与电极反应时,溶液 pH 的改变能引起电对的电极电势的变化。在浓度、温度一定时,电对的电极电势仅与溶液 pH 有关。以电对的电极电势为纵坐标,以溶液 pH 为横坐标作图,所得图形称为电势- pH 图。
4.9 电势- pH 图
某些电对的电势-pH 图
水本身又具有氧化还原性
4.9 电势- pH 图
当 H2O 作氧化剂时:
2H+ + 2e- H2
当 p(H2) = 100 kPa 时:
当 H2O 作还原剂时:
O2 + 4H+ + 4e- 2H2O
以上述两个电对的电极电势为纵坐标,以溶液pH 为横坐标作图,得到水的电势-pH 图。
当 p(O2)=100 kPa 时:
某些电对的电势-pH 图
图中 a 线表示在一定 pH 下电对 O2/H2O 的电极电势;b 线表示在一定 pH 下电对 H2O/H2 的电极电势。由于实际放电速率缓慢,致使实际值比理论值升高 0.5 V, 即为 a 线; 而 b 线比理论值降低 0.5 V,即为 b 线。
某些电对的电势-pH 图
某电对的电极电势图高于 a 线,发生什么情况?
某电对的电极电势图低于 b 线,发生什么情况?
在水溶液中,若强氧化剂所在电对的电极电势高于 a 线,它就可以氧化 H2O 放出 O2,所以在 a 线上方区域为 O2 的稳定区。
在水溶液中,若还原剂所在电对的电极电势低于 b 线,它就可以还原 H2O 放出 H2,所以在 b 线下方区域为 H2 的稳定区。
在水溶液中,若氧化剂所在电对的电极电势低于 a 线或还原剂所在电对的电极电势高于 b 线,则水既不能被氧化,也不能被还原。所以 a 线和 b 线之间是 H2O 的稳定区。
4.10 实用电化学
有关电解的几个问题
电解是在外电源作用下被迫发生的氧化还原过程,把电能转变为化学能。而在原电池中正好相反,是自发地把化学能转变为电能。
阳极发生氧化反应,是阴离子移向的极。
习惯上,原电池的电极常称正极、负极;电解池的电极常称阴极、阳极。
