氮及其化合物(长沙市一中+唐娟)
文档属性
| 名称 | 氮及其化合物(长沙市一中+唐娟) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-27 12:13:35 | ||
图片预览





文档简介
(共21张PPT)
高三二轮复习——
氮及其化合物
长沙市一中高三化学备课组 唐 娟
【考纲分析解读】
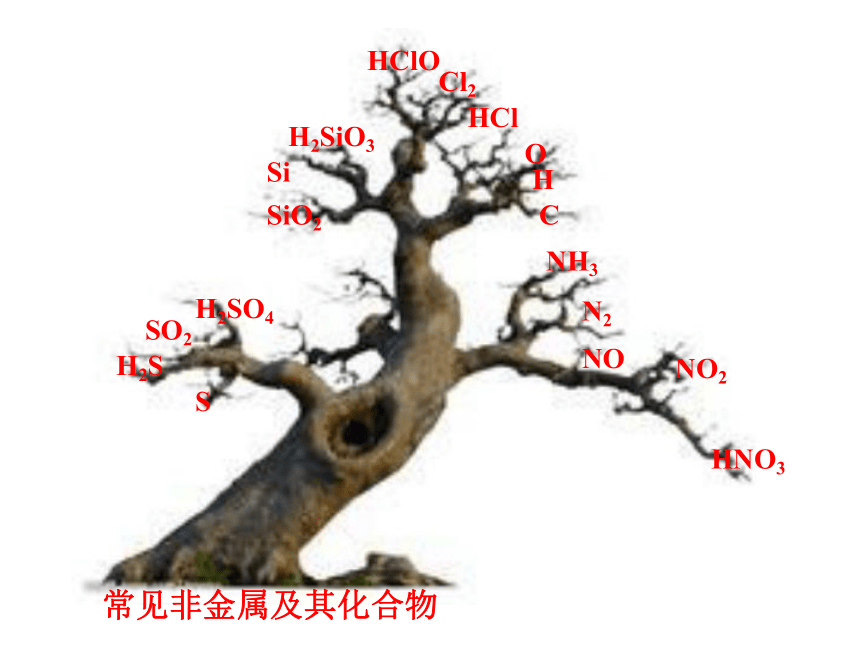
近三年《考试大纲(课标版)》中明确列举了7种非金属元素:
H、C、O、Si、N、Cl、S及其重要化合物的性质和综合应用。
2.元素化合物知识的考查往往以生产生活实际、科技前沿信息、当前社会热点作为切入点;主要以离子方程式正误判断、离子共存判断、化学反应式的书写、氧化还原反应规律的应用、物质的检验和物质的框图推断等题型来考查;将元素化合物的性质与基本概念、化学原理、实验探究、化学计算的考查相融合是新课程高考的命题趋势。
SiO2
Si
C
Cl2
HCl
HClO
H2SiO3
S
H2S
H2SO4
SO2
NH3
N2
NO
NO2
HNO3
常见非金属及其化合物
H
O
NH3
N2
NO
NO2
HNO3
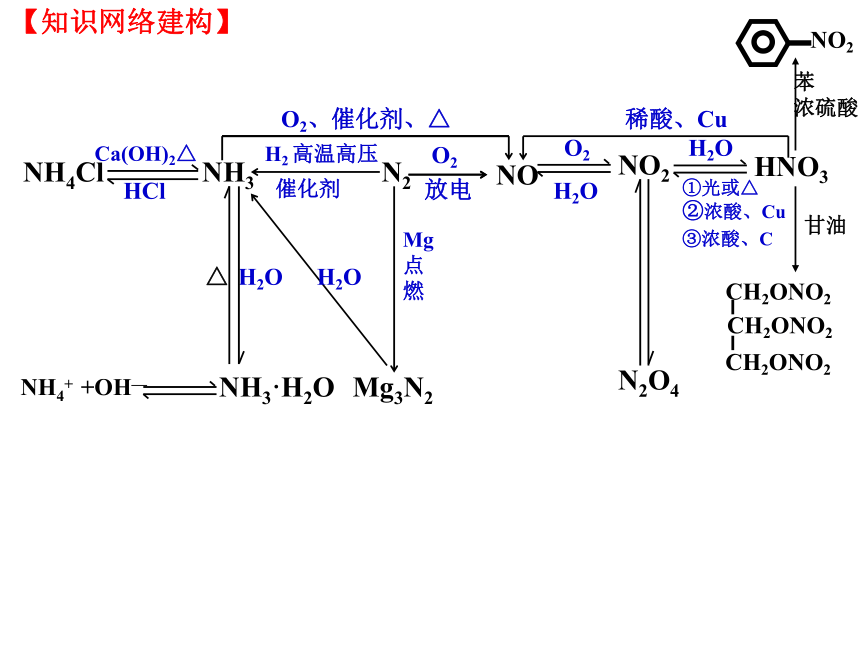
你能写出下列氮及其化合物之间的相互转化关系吗?转化的条件是什么?
【知识网络建构】
H2 高温高压
催化剂
NH3
N2
H2O
放电
O2
NO
HCl
NH4Cl
Ca(OH)2△
△
NH4+ +OH—
H2O
NH3·H2O
O2、催化剂、△
NO2
O2
HNO3
H2O
N2O4
H2O
②浓酸、Cu
①光或△
③浓酸、C
稀酸、Cu
NO2
CH2ONO2
CH2ONO2
CH2ONO2
苯
浓硫酸
甘油
Mg
点
燃
Mg3N2
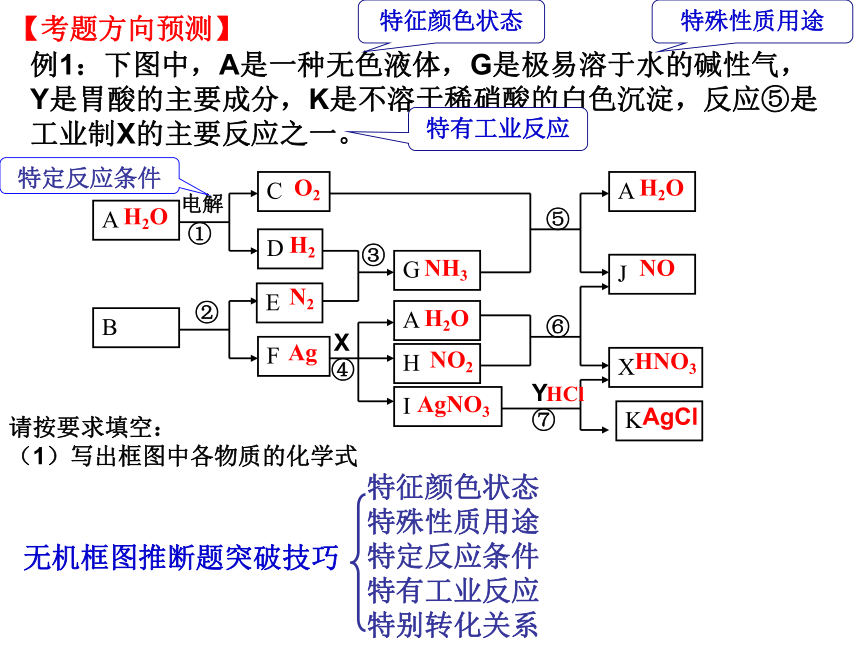
例1:下图中,A是一种无色液体,G是极易溶于水的碱性气,
Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出框图中各物质的化学式
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
【考题方向预测】
HCl
特征颜色状态特殊性质用途特定反应条件
特有工业反应
特别转化关系
无机框图推断题突破技巧
特殊性质用途
特征颜色状态
特定反应条件
特有工业反应
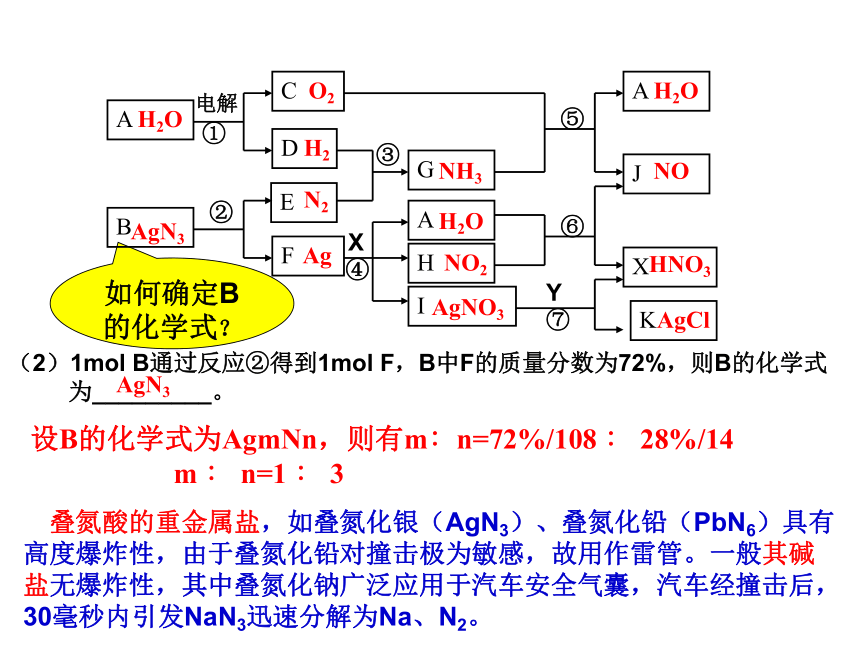
如何确定B的化学式?
设B的化学式为AgmNn,则有m∶n=72%/108 ∶ 28%/14
m ∶ n=1 ∶ 3
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
AgN3
叠氮酸的重金属盐,如叠氮化银(AgN3)、叠氮化铅(PbN6)具有高度爆炸性,由于叠氮化铅对撞击极为敏感,故用作雷管。一般其碱盐无爆炸性,其中叠氮化钠广泛应用于汽车安全气囊,汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2。
(2)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式
为_________。
AgN3
请按要求填空:
(3)写出E和G的电子式 、 。
(4)反应④⑤⑥的化学方程式分别为: 、
、 。
2HNO3 (浓) + Ag === AgNO3+NO2 ↑ +H2O
3NO2+ H2O=2HNO3+ NO
4NH3+5O2 === 4NO+6H2O
催化剂
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
AgN3
(5)一定条件下,向一个2L的密闭容器中充入6mo1D和2molE ,反应达平衡时放出93kJ热量,生成G的浓度为1mol/L,试写出该反应的热化学方程式 。
(6)据报道,G可直接用作车用碱性燃料电池,且产物无污染,写出该电池的负极反应式: 。
N2(g)+3H2(g) 2NH3(g) △H =-93kg ·mol-1
2NH3+6OH- -6e- = N2+6H2O
(8)标准状况下,将干燥纯净的G和H气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是 。
A.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(NO3-)>c(OH-)>c(H+)
C.c(H+)=c(OH-) +c(NH3·H2O)
D.c(NH4+) +c(NH3·H2O)=1.5c(NO3-)
AC
(7) 在一容积不变的密闭容器中分别充入1molH,在恒温条件下发生
反应:2H(g) M(g)△H <0,充分反应达到平衡后再加入一定量的H,
再次达到平衡后,与原平衡相比下列有关说法正确的是 (填序号)
A. H的浓度减小 B. M的物质的量增大
C. H的转化率减小 D. H的体积分数减小
BD
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
AgN3
单一气体标准状态喷泉实验后所得溶液浓度均为
1/22.4mol·L-1
酚酞
石蕊
NH3
NO2
3NO2+ H2O=2HNO3+ NO
22.4
C(NH3.H2O)=
V
V
2
22.4
V
C(HNO3)=
V
3
2/3
氮及其化合物
氮元素及其化合物的推断化学式、电子式、化学方程式、离子方程式的书写
反应热、
化学平衡、
离子浓度大小比较、
原电池
例2: 为了测定足量的铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从下图中选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值。
【考题方向预测】
其中E装置由甲、乙两根玻璃管组成,用橡皮管连通,并装入
适量的水,甲管有刻度,供量气用,乙管可以上下移动,用
来调节液面的高低(假设导气管中气体体积忽略不计,而且
忽略加入硝酸溶液体积)。
(1)装置连接顺序是(填各接口的编号,连接胶管及支持装置均省略): 。
(2)连接好装置并检验气密性后,应进行两步必要的操作:
第一,打开b,从C装置的乙管注水至充满甲、乙两管;
第二 ,打开 通入N2,一段时间后关闭所有活塞;通入N2的原因: 。
(3)要测定m值,需要将c中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
③④⑤⑧
(1)装置连接顺序是(填各接口的编号,连接胶管及支持装置均省略): 。
(2)连接好装置并检验气密性后,应进行两步必要的操作:
第一,打开b,从C装置的乙管注水至充满甲、乙两管;
第二 ,打开 通入N2,一段时间后关闭所有活塞;通入N2的原因: 。
(3)要测定m值,需要将c中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
a
排净装置中的空气
③④⑤⑧
滴定前将C中的溶液加适量水稀释
(5)实验改进后若量气管中气体的体积(换算成标准状况下)为168mL,C中硝酸的物质的量为4×10-3mol.则 NO和NO2的物质
的量之比m = ;
烧瓶中发生反应总的离子方程式为 。
1 ∶ 2
(4)为了准确测量NO和NO2的物质的量之比m的值,上述实验
存在的不足之处: ;
如何改进 .
。
B中生成的NO2不能全部被水吸收
待反应结束后,再通过分液漏斗向B中加入CCl4、苯
等不与NO2 、NO反应的液体至充满整个烧瓶
5Cu + 16H++6NO3-- ===5Cu2+ +2NO ↑ + 4NO2 ↑ + 8H2O
解答实验题的一般思路:
1、准确把握实验目的
2、自我分析实验原理
3、初步确定实验方案
4、结合题设准确答题
氮及其化合物
氮及其化合物转化的推断化学式、电子式、化学方程式、离子方程式的书写
反应热、
化学平衡、
离子浓度大小比较、
原电池
喷泉实验
硝酸的性质实验
氮的氧化物、硝酸的有关计算
元素及其化合物
基本概念
化学原理
实验探究
化学计算
练习:向含4 mol HNO3的稀溶液中,逐渐加入铁粉至过量。假设
生成的气体只有一种,请在坐标系中画出n(Fe2+) 随n(Fe)变化的
示意图,并标出n(Fe2+)的最大值。
1
1.5
1.5
3Fe + 8HNO3 ===3Fe(NO3)2+2NO ↑ +4H2O
Fe + 4HNO3 ===Fe(NO3)3+NO ↑ +2H2O
n(Fe):n(HNO3)≤1:4
n(Fe):n(HNO3) ≥3:8
高三二轮复习——
氮及其化合物
长沙市一中高三化学备课组 唐 娟
【考纲分析解读】
近三年《考试大纲(课标版)》中明确列举了7种非金属元素:
H、C、O、Si、N、Cl、S及其重要化合物的性质和综合应用。
2.元素化合物知识的考查往往以生产生活实际、科技前沿信息、当前社会热点作为切入点;主要以离子方程式正误判断、离子共存判断、化学反应式的书写、氧化还原反应规律的应用、物质的检验和物质的框图推断等题型来考查;将元素化合物的性质与基本概念、化学原理、实验探究、化学计算的考查相融合是新课程高考的命题趋势。
SiO2
Si
C
Cl2
HCl
HClO
H2SiO3
S
H2S
H2SO4
SO2
NH3
N2
NO
NO2
HNO3
常见非金属及其化合物
H
O
NH3
N2
NO
NO2
HNO3
你能写出下列氮及其化合物之间的相互转化关系吗?转化的条件是什么?
【知识网络建构】
H2 高温高压
催化剂
NH3
N2
H2O
放电
O2
NO
HCl
NH4Cl
Ca(OH)2△
△
NH4+ +OH—
H2O
NH3·H2O
O2、催化剂、△
NO2
O2
HNO3
H2O
N2O4
H2O
②浓酸、Cu
①光或△
③浓酸、C
稀酸、Cu
NO2
CH2ONO2
CH2ONO2
CH2ONO2
苯
浓硫酸
甘油
Mg
点
燃
Mg3N2
例1:下图中,A是一种无色液体,G是极易溶于水的碱性气,
Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出框图中各物质的化学式
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
【考题方向预测】
HCl
特征颜色状态特殊性质用途特定反应条件
特有工业反应
特别转化关系
无机框图推断题突破技巧
特殊性质用途
特征颜色状态
特定反应条件
特有工业反应
如何确定B的化学式?
设B的化学式为AgmNn,则有m∶n=72%/108 ∶ 28%/14
m ∶ n=1 ∶ 3
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
AgN3
叠氮酸的重金属盐,如叠氮化银(AgN3)、叠氮化铅(PbN6)具有高度爆炸性,由于叠氮化铅对撞击极为敏感,故用作雷管。一般其碱盐无爆炸性,其中叠氮化钠广泛应用于汽车安全气囊,汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2。
(2)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式
为_________。
AgN3
请按要求填空:
(3)写出E和G的电子式 、 。
(4)反应④⑤⑥的化学方程式分别为: 、
、 。
2HNO3 (浓) + Ag === AgNO3+NO2 ↑ +H2O
3NO2+ H2O=2HNO3+ NO
4NH3+5O2 === 4NO+6H2O
催化剂
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
AgN3
(5)一定条件下,向一个2L的密闭容器中充入6mo1D和2molE ,反应达平衡时放出93kJ热量,生成G的浓度为1mol/L,试写出该反应的热化学方程式 。
(6)据报道,G可直接用作车用碱性燃料电池,且产物无污染,写出该电池的负极反应式: 。
N2(g)+3H2(g) 2NH3(g) △H =-93kg ·mol-1
2NH3+6OH- -6e- = N2+6H2O
(8)标准状况下,将干燥纯净的G和H气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是 。
A.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(NO3-)>c(OH-)>c(H+)
C.c(H+)=c(OH-) +c(NH3·H2O)
D.c(NH4+) +c(NH3·H2O)=1.5c(NO3-)
AC
(7) 在一容积不变的密闭容器中分别充入1molH,在恒温条件下发生
反应:2H(g) M(g)△H <0,充分反应达到平衡后再加入一定量的H,
再次达到平衡后,与原平衡相比下列有关说法正确的是 (填序号)
A. H的浓度减小 B. M的物质的量增大
C. H的转化率减小 D. H的体积分数减小
BD
A
C
D
B
E
F
G
A
H
I
A
J
X
K
电解
①
⑦
Y
⑥
⑤
④
X
③
②
H2O
O2
H2
N2
Ag
NH3
H2O
NO2
AgNO3
H2O
NO
HNO3
AgCl
AgN3
单一气体标准状态喷泉实验后所得溶液浓度均为
1/22.4mol·L-1
酚酞
石蕊
NH3
NO2
3NO2+ H2O=2HNO3+ NO
22.4
C(NH3.H2O)=
V
V
2
22.4
V
C(HNO3)=
V
3
2/3
氮及其化合物
氮元素及其化合物的推断化学式、电子式、化学方程式、离子方程式的书写
反应热、
化学平衡、
离子浓度大小比较、
原电池
例2: 为了测定足量的铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从下图中选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值。
【考题方向预测】
其中E装置由甲、乙两根玻璃管组成,用橡皮管连通,并装入
适量的水,甲管有刻度,供量气用,乙管可以上下移动,用
来调节液面的高低(假设导气管中气体体积忽略不计,而且
忽略加入硝酸溶液体积)。
(1)装置连接顺序是(填各接口的编号,连接胶管及支持装置均省略): 。
(2)连接好装置并检验气密性后,应进行两步必要的操作:
第一,打开b,从C装置的乙管注水至充满甲、乙两管;
第二 ,打开 通入N2,一段时间后关闭所有活塞;通入N2的原因: 。
(3)要测定m值,需要将c中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
③④⑤⑧
(1)装置连接顺序是(填各接口的编号,连接胶管及支持装置均省略): 。
(2)连接好装置并检验气密性后,应进行两步必要的操作:
第一,打开b,从C装置的乙管注水至充满甲、乙两管;
第二 ,打开 通入N2,一段时间后关闭所有活塞;通入N2的原因: 。
(3)要测定m值,需要将c中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
a
排净装置中的空气
③④⑤⑧
滴定前将C中的溶液加适量水稀释
(5)实验改进后若量气管中气体的体积(换算成标准状况下)为168mL,C中硝酸的物质的量为4×10-3mol.则 NO和NO2的物质
的量之比m = ;
烧瓶中发生反应总的离子方程式为 。
1 ∶ 2
(4)为了准确测量NO和NO2的物质的量之比m的值,上述实验
存在的不足之处: ;
如何改进 .
。
B中生成的NO2不能全部被水吸收
待反应结束后,再通过分液漏斗向B中加入CCl4、苯
等不与NO2 、NO反应的液体至充满整个烧瓶
5Cu + 16H++6NO3-- ===5Cu2+ +2NO ↑ + 4NO2 ↑ + 8H2O
解答实验题的一般思路:
1、准确把握实验目的
2、自我分析实验原理
3、初步确定实验方案
4、结合题设准确答题
氮及其化合物
氮及其化合物转化的推断化学式、电子式、化学方程式、离子方程式的书写
反应热、
化学平衡、
离子浓度大小比较、
原电池
喷泉实验
硝酸的性质实验
氮的氧化物、硝酸的有关计算
元素及其化合物
基本概念
化学原理
实验探究
化学计算
练习:向含4 mol HNO3的稀溶液中,逐渐加入铁粉至过量。假设
生成的气体只有一种,请在坐标系中画出n(Fe2+) 随n(Fe)变化的
示意图,并标出n(Fe2+)的最大值。
1
1.5
1.5
3Fe + 8HNO3 ===3Fe(NO3)2+2NO ↑ +4H2O
Fe + 4HNO3 ===Fe(NO3)3+NO ↑ +2H2O
n(Fe):n(HNO3)≤1:4
n(Fe):n(HNO3) ≥3:8
同课章节目录
