第八单元课题3 金属资源的利用和保护课件(共45张PPT)
文档属性
| 名称 | 第八单元课题3 金属资源的利用和保护课件(共45张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-25 20:23:44 | ||
图片预览






文档简介
(共45张PPT)
上节作业:
1、农业上用硫酸铜与熟石灰配制波尔多液,
为什
么波尔多液不能用铁桶装?(用化学方程式表示)
2、写出下列化学方程式:
⑴
在铝的表面形成致密的氧化铝薄膜
⑶铁丝在氧气中燃烧
⑵铜在空气中受热
Fe+CuSO4==FeSO4+Cu
4Al+3O2==2Al2O3
2Cu+O2==2CuO
△
3Fe+2O2==Fe3O4
点燃
3、判断下列反应能否发生,若能发生,写出化学
反应方程式
⑴铜与稀硫酸⑵铜与硝酸银⑶铁与硫酸锌
⑷铁与稀盐酸⑸锌与硫酸铜
⑵
Cu+2AgNO3==Cu(NO3)2+2Ag
⑷
Fe+2HCl==FeCl2+H2↑
⑸
Zn+CuSO4==ZnSO4+Cu
课题3
金属资源的利用和保护
金属矿物
黄铁矿(FeS2
)
磁铁矿(Fe3O4)
菱铁矿(FeCO3
)
赤铁矿(Fe2O3)
孔雀石
铝土矿
黄铜矿
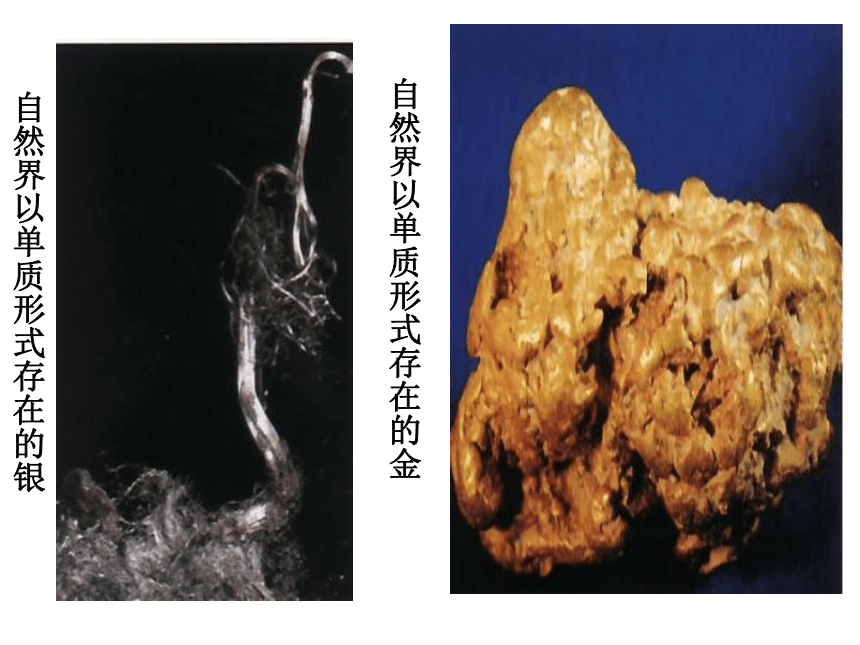
自然界以单质形式存在的银
自然界以单质形式存在的金
变成
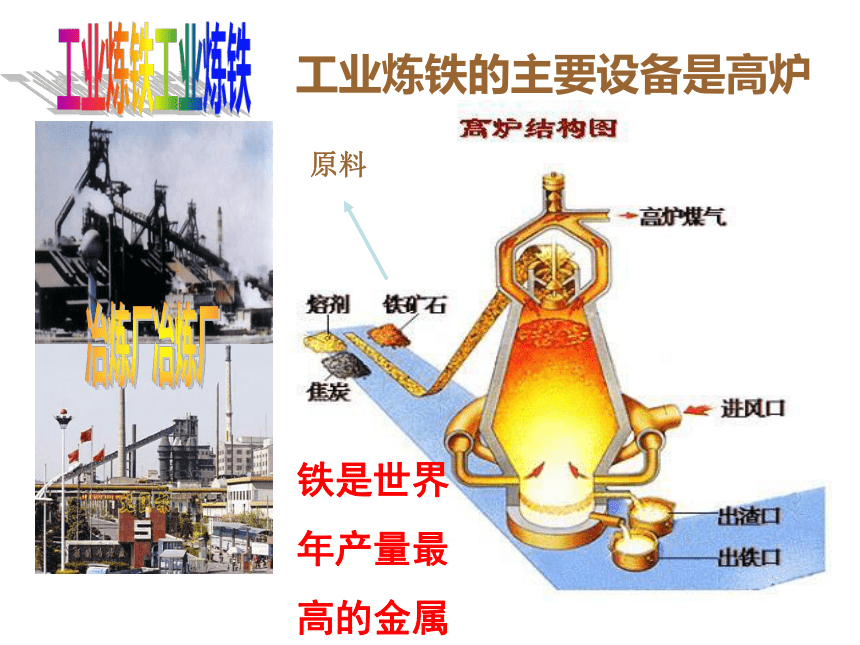
工业炼铁的主要设备是高炉
原料
铁是世界
年产量最
高的金属
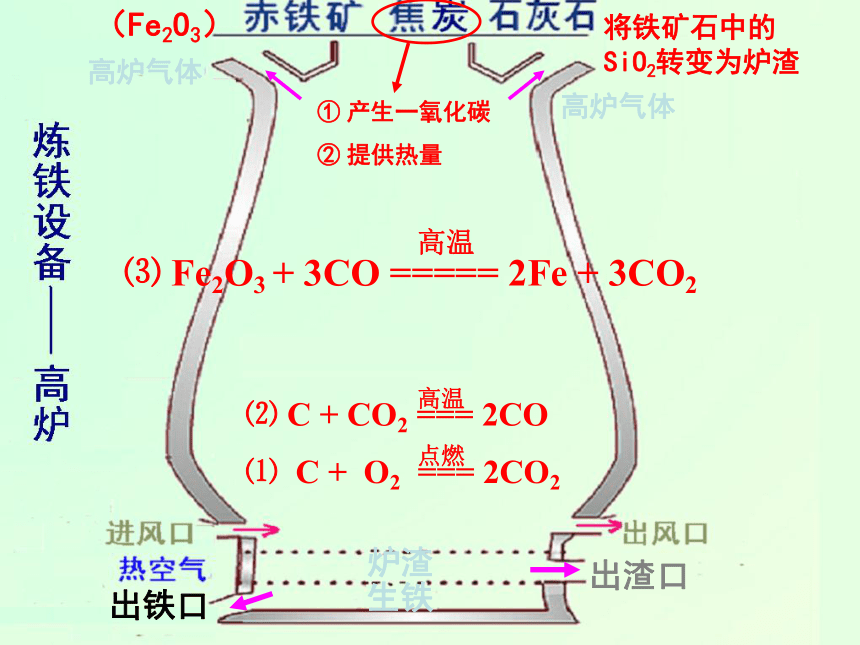
将铁矿石中的
SiO2转变为炉渣
点燃
⑴
C
+
O2
===
2CO2
高温
⑵
C
+
CO2
===
2CO
(Fe2O3)
生铁
出铁口
炉渣
出渣口
⑶
Fe2O3
+
3CO
=====
2Fe
+
3CO2
高温
高炉气体
高炉气体
①
产生一氧化碳
②
提供热量
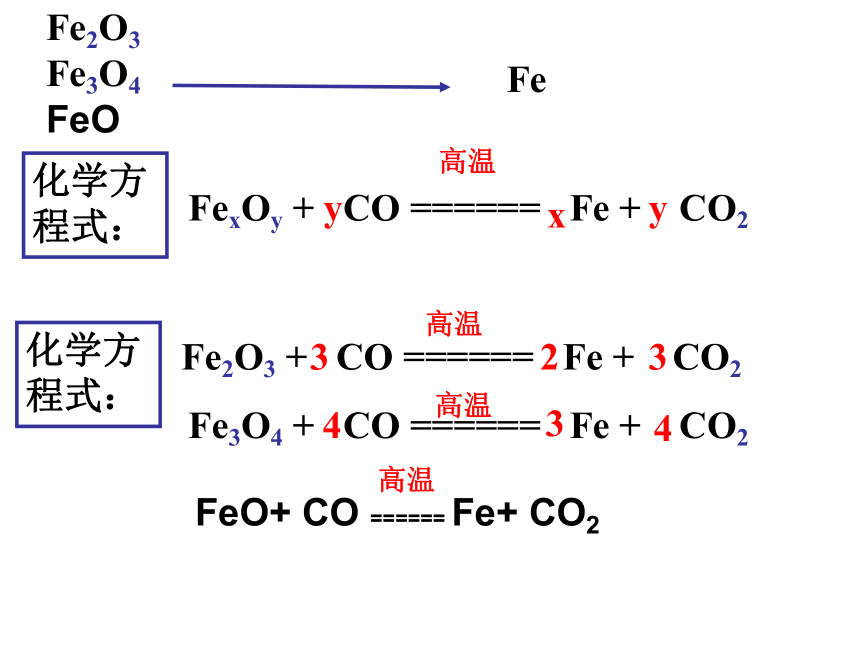
Fe2O3
Fe3O4
FeO
Fe
化学方
程式:
Fe2O3
+
CO
======
Fe
+
CO2
3
3
2
高温
Fe3O4
+
CO
======
Fe
+
CO2
4
4
3
高温
化学方
程式:
FexOy
+
CO
======
Fe
+
CO2
y
x
y
高温
FeO+
CO
======
Fe+
CO2
高温
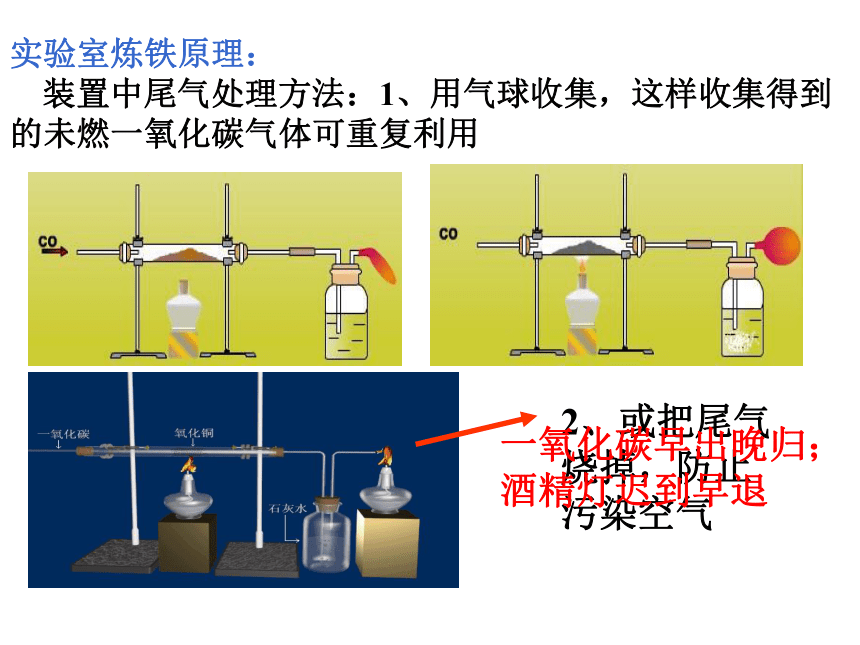
实验室炼铁原理:
???
装置中尾气处理方法:1、用气球收集,这样收集得到的未燃一氧化碳气体可重复利用
2、或把尾气烧掉,防止污染空气
一氧化碳早出晚归;酒精灯迟到早退
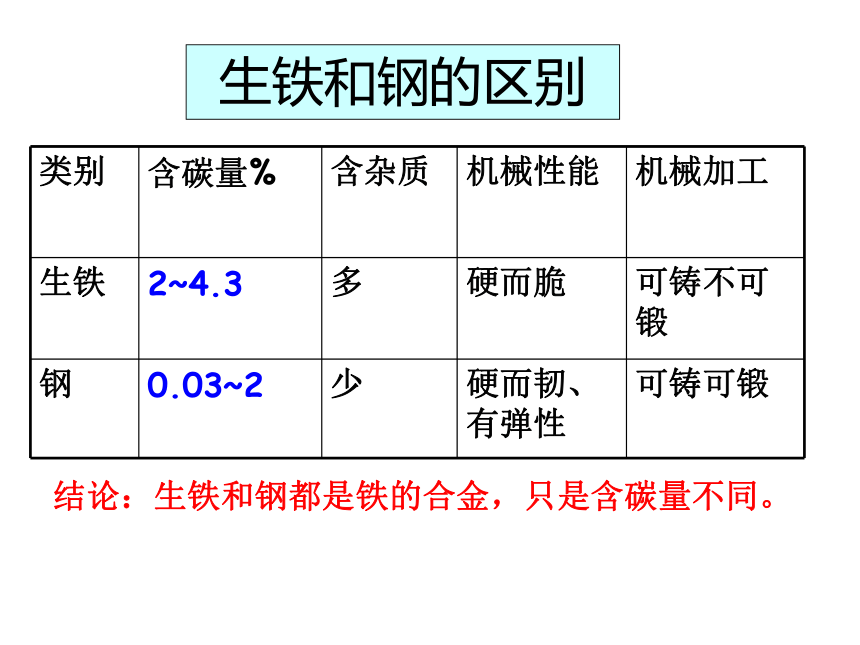
生铁和钢的区别
类别
含碳量%
含杂质
机械性能
机械加工
生铁
2~4.3
多
硬而脆
可铸不可锻
钢
0.03~2
少
硬而韧、有弹性
可铸可锻
结论:生铁和钢都是铁的合金,只是含碳量不同。
1.(1)我国古代将炉甘石[ZnCO3].
赤铜[Cu2O]和木炭混合加强热到8000C左右,得到外观似金子的药金,根据化学方程式,说出反应的基本类型
分解反应
置换反应
ZnCO3=ZnO+CO2
C+
ZnO=
Zn+CO2
C+
Cu2O=
Cu+CO2
高温
高温
高温
2
2
2
4
(2).药金成分是_______合金,是黄金吗?___
原因是____________用什么化学方法证明药金不是黄金:
Zn、Cu
不是
没有金元素
加稀硫酸或稀盐酸看是否有气泡
用火烧,如果变黑
放在火上灼烧——变黑
放入硫酸铜溶液中—使溶液褪色的是假金。
放入硝酸银溶液中——表面出现银白色物质
测密度
生铁1600吨含纯铁为1600吨×(1-2%)=
1568吨
高温
例1:要炼出含2%杂质的生铁1600吨,需要含氧化
铁(Fe2O3)质量分数为80%的赤铁矿石多少吨?
含杂质的运算
解:设需要含为80%的赤铁矿石的质量为x
Fe2O3+3CO
2Fe+3CO2
160
112
x×80%
1568吨
x
=
2800吨
答:需这种赤铁矿石2800吨。
解:1000t赤铁矿石中含氧化铁的质量为:
1000t×75%=750t
X=
525t
Fe2O3+
3CO===
2Fe+
3CO2
高温
含铁95%的生铁质量为:525t/95%=552.6t
答:可炼出含铁95%的生铁质量为552.6t。
160
112
750t
x
设可炼出纯铁Xt
例2、用1000t含氧化铁75%的赤铁矿石,
可以炼出含铁95%的生铁多少t?
作业:P
21
5、某钢铁厂每天需消耗5000tFe2O3
76%的赤铁矿石,该厂理论上可日产
含Fe98%的生铁的质量是多少?
6.冶炼2000t含杂质3%的生铁,需要
Fe3O490%的磁铁矿石的质量是多少?
练习
17页
例题
5、解:设该厂理论上可日产含铁98%的生铁X吨。
Fe2O3+3CO===2Fe+3CO2
高温
160
112
5000t×76%
98%X
X=2714.3t
答:略
第二课时
6、解:需要含四氧化三铁90%的磁铁矿石的质量为X
Fe3O4+4CO===3Fe+4CO2
高温
232t
168
90%X
2000×97%
X=2976.7t
答:略
铁在什么条件下容易生锈呢?
铁钉放在干燥的空气中:
铁不易生锈
铁钉浸没一半的在水中:
铁在空气、水的界面处生锈严重
铁钉完全浸没的在水中:
铁少量生锈
铁钉浸没一半的在食盐水中:
浸没在水中的铁钉几乎全部生锈
在空气中锈蚀,实际上是铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化,使铁转化为铁的化合物的过程
铁锈这种多孔性的物质,能让水分和空气穿过它的空隙,不断向里层渗透,继续跟铁反应,直至铁被完全锈蚀。
铁锈成分复杂,主要Fe2O3·XH2O它是一种疏松多孔的物质
与空气(氧气)接触
与水接触
铁生锈的主要条件:(潮湿的空气)
1.有水;
2.要与氧气接触。
食品包装袋内,放一袋铁粉(又叫双吸剂);铁粉
生锈时会吸收氧气和水,防止食品受潮和变质。
怎么防止钢铁生锈呢?
3、在机械表面涂防锈油
2、在面盆、杯子、等表面烧涂搪瓷
4、此外,还可以在钢铁表面镀上一层能起保护作用的其他金属。如:在钢铁表面镀锡、镀锌、和镀铬
1、在车船的表面喷油漆
思考题:1、
2、自行车的构件如支架、链条、钢圈等,分别采取了什么防锈措施?
刷油漆
涂油
镀铬
铝比铁更容易跟氧气。铝在空气中与氧气反应,生成的氧化铝形成一层致密而结实的膜覆盖在铝的表面,防止铝继续与氧气反应,从而起来“自我保护”的作用
3、铝比铁活泼,为什么铝比铁耐腐蚀?
一、铁锈的主要成分:Fe2O3
二、生锈的条件:在氧气与水作用下
三、防锈原理:隔绝空气和水分
四、防锈的具体方法:涂油、制成不锈钢、刷油
漆、烧制搪瓷、电镀上一层耐腐蚀的金属、保持铁制品表面干燥和洁净
小结
第六章复习:一、 几种重要的金属
金属材料
纯金属
合金
青铜器
冶铁
炼钢
铜和铁
金属光泽
大
高
延展性
导电性
导热性
汞
用途
价格
资源
是否美观
使用是否便利
废料是否易于回收
对环境的影响
二、 金属的化学性质
致密的氧化膜
金在高温下也不与氧气反应
三、 金属的活动性顺序
Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au
K、Ca、Na、Mg、Al、
氢前面
前面
后面
四、 合金
金属
非金属
金属
组成
性质
钢
生铁
含碳量
2%~4.3%
0.03%~2%
熔点高
密度小
可塑性好
易于加工
机械性能好
五、 金属的冶炼
Fe2O3
Fe3O4
铁矿石
焦炭
石灰石
检验CO的纯度
除去CO,防止引起大气污染
通入一会儿CO
排尽装置中的空气,防止发生爆炸
红色固体变成黑色
澄清石灰水变浑浊
Ca(OH)2+CO2===CaCO3↓+H2O
六、 金属的锈蚀与保护
氧气
水
Fe2O3
保持金属表面清洁干燥
涂一层保护膜如涂油、刷漆
改变内部结构
防止金属锈蚀
金属的回收利用
有计划、合理地开采矿物
寻找金属的代用品
1.铁及其合金在生产、生活中应用广泛。下列关于铁及其合金的说法中正确的是
A、铁是地壳中含量最丰富的金属元素
B、不锈钢的抗腐蚀性好,可用于制造医疗器械
C、铁丝能在氧气中剧烈燃烧、火星四射,生成氧化铁
D、铁生锈是铁与空气中的氧气、水发生缓慢氧化的过程
BD
思考与练习
(多选)
2.在下列条件下,铁钉锈蚀最快的是(
)
B
3、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是(
)
A.Mn、Mg、Cu
B.Mg、Mn、Cu
C.Cu、Mg、Mn
D.Cu、Mn、Mg
B
4.(1)以上用品中,主要利用金属导电性的是_____。
(2)铝制品表面的污渍不宜用钢丝球擦洗,以免破坏表面的_________________。
(3)切过蔬菜的菜刀,搁置在砧板上一段时间生锈。铁在空气中锈蚀,实际上是铁跟_________等物质发生化学反应的结果。
(4)锈蚀钢回收重新冶炼是保护金属资源的一条有效途径。写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)的化学方程式_________________。
A
致密的氧化铝的薄膜
氧气和水
Fe2O3
+
3CO
==
2Fe
+
3CO2
高温
5.金属资源是不可再生的资源,保护金属资源是我们刻不容缓的职责。下列有关叙述不正确的是(
)
A.大力开采矿物以保障金属材料的供用
B.提高废旧金属的回收利用率
C.在金属制品上刷漆、涂油等防止金属腐蚀
D.用特种塑料代替金属制造机器的零部件
A
6.
A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是(
)
A.A、B、C、D
B.B、A、C、D
C.D、C、A、B
D.D、C、B、A
C
7、分别用以下三组物质比较锌和铜的金属活动性:
①Zn、Cu、稀硫酸;②Zn、Cu、MgSO4溶液;
③Zn、CuSO4溶液。
仅用组内物质就能够直接达到目的的是(
)
A.仅有①
B.
②③
C.①③
D.①②③
c
8、人们的日常生活离不开金属,高科技新材料的开发和
应用也需要金属。(1)现代社会使用大量的钢铁,钢铁与
接触容易生锈造成损失,在钢铁表面采用
方法可以防止钢铁生锈。
(2)波尔多液是由硫酸铜和熟石灰加水配制而成,不能用铁
制容器配制的原因是(用化学方程式表示)
。
空气和水
表面涂层
9、下图是关于铁化学性质的知识网络(“→”表示一种物
质转化为另一种物质),其中B是密度最小的气体,C为
红色固体单质。请回答下列问题:
(1)A物质的化学式为
。(2)B物质的一种用
途是
。
(3)反应②还需要的一种反应物是
(填化学式)。
(4)写出反应③的方程式,并注明基本反应类型:
(
)。
冶炼金属(作燃料等)
置换反应
Fe3O4
C(或CO或H2)
10.某钢铁厂每天消耗4000t含Fe2O3
80%的赤铁矿石,该钢铁厂理论上可日产含Fe98%的生铁质量是多少?(计算结果保留到0.1)
Fe2O3
+
3CO
==
2Fe
+
3CO2
高温
160
2×56
4000t×80%
98%X
解:设可日产含Fe98%的生铁质量是X。
不利用方程式能否计算?
X≈2281.7t
11、某化学兴趣小组为了测定得到的黄铜样品中铜的含量,
称取20g样品研细后放置于烧杯中,加入50g稀硫酸,恰好
完全反应后,冷却,称得烧杯的总质量为69.8g.请计算
(计算结果精确到0.1%):
(1)生成氢气的质量
(2)此黄铜中铜的质量分数;
解:(1)氢气的质量:20+50-69.8=0.2克
(2)设样品中锌的质量为X
Zn+H2SO4==ZnSO4+H2↑
65
2
X
0.2g
65
X
====
2
0.2g
X=6.5g
13.5g
20g
×100%=67.5%
12.欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,
实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是_________
合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,
经测定产生了0.4g气体。
请你计算该合金中铜的质量分数。
Cu﹣Zn
设合金中Zn的质量为x
Zn+H2SO4
==
ZnSO4+H2↑
65
2
X
0.4g
合金中铜的质量=
32.5g
–
13g
=
19.5g
x
=
13
g
合金中铜的质量分数为:
65
X
====
2
0.4g
19.5g
32.5g
×100%=60%
上节作业:
1、农业上用硫酸铜与熟石灰配制波尔多液,
为什
么波尔多液不能用铁桶装?(用化学方程式表示)
2、写出下列化学方程式:
⑴
在铝的表面形成致密的氧化铝薄膜
⑶铁丝在氧气中燃烧
⑵铜在空气中受热
Fe+CuSO4==FeSO4+Cu
4Al+3O2==2Al2O3
2Cu+O2==2CuO
△
3Fe+2O2==Fe3O4
点燃
3、判断下列反应能否发生,若能发生,写出化学
反应方程式
⑴铜与稀硫酸⑵铜与硝酸银⑶铁与硫酸锌
⑷铁与稀盐酸⑸锌与硫酸铜
⑵
Cu+2AgNO3==Cu(NO3)2+2Ag
⑷
Fe+2HCl==FeCl2+H2↑
⑸
Zn+CuSO4==ZnSO4+Cu
课题3
金属资源的利用和保护
金属矿物
黄铁矿(FeS2
)
磁铁矿(Fe3O4)
菱铁矿(FeCO3
)
赤铁矿(Fe2O3)
孔雀石
铝土矿
黄铜矿
自然界以单质形式存在的银
自然界以单质形式存在的金
变成
工业炼铁的主要设备是高炉
原料
铁是世界
年产量最
高的金属
将铁矿石中的
SiO2转变为炉渣
点燃
⑴
C
+
O2
===
2CO2
高温
⑵
C
+
CO2
===
2CO
(Fe2O3)
生铁
出铁口
炉渣
出渣口
⑶
Fe2O3
+
3CO
=====
2Fe
+
3CO2
高温
高炉气体
高炉气体
①
产生一氧化碳
②
提供热量
Fe2O3
Fe3O4
FeO
Fe
化学方
程式:
Fe2O3
+
CO
======
Fe
+
CO2
3
3
2
高温
Fe3O4
+
CO
======
Fe
+
CO2
4
4
3
高温
化学方
程式:
FexOy
+
CO
======
Fe
+
CO2
y
x
y
高温
FeO+
CO
======
Fe+
CO2
高温
实验室炼铁原理:
???
装置中尾气处理方法:1、用气球收集,这样收集得到的未燃一氧化碳气体可重复利用
2、或把尾气烧掉,防止污染空气
一氧化碳早出晚归;酒精灯迟到早退
生铁和钢的区别
类别
含碳量%
含杂质
机械性能
机械加工
生铁
2~4.3
多
硬而脆
可铸不可锻
钢
0.03~2
少
硬而韧、有弹性
可铸可锻
结论:生铁和钢都是铁的合金,只是含碳量不同。
1.(1)我国古代将炉甘石[ZnCO3].
赤铜[Cu2O]和木炭混合加强热到8000C左右,得到外观似金子的药金,根据化学方程式,说出反应的基本类型
分解反应
置换反应
ZnCO3=ZnO+CO2
C+
ZnO=
Zn+CO2
C+
Cu2O=
Cu+CO2
高温
高温
高温
2
2
2
4
(2).药金成分是_______合金,是黄金吗?___
原因是____________用什么化学方法证明药金不是黄金:
Zn、Cu
不是
没有金元素
加稀硫酸或稀盐酸看是否有气泡
用火烧,如果变黑
放在火上灼烧——变黑
放入硫酸铜溶液中—使溶液褪色的是假金。
放入硝酸银溶液中——表面出现银白色物质
测密度
生铁1600吨含纯铁为1600吨×(1-2%)=
1568吨
高温
例1:要炼出含2%杂质的生铁1600吨,需要含氧化
铁(Fe2O3)质量分数为80%的赤铁矿石多少吨?
含杂质的运算
解:设需要含为80%的赤铁矿石的质量为x
Fe2O3+3CO
2Fe+3CO2
160
112
x×80%
1568吨
x
=
2800吨
答:需这种赤铁矿石2800吨。
解:1000t赤铁矿石中含氧化铁的质量为:
1000t×75%=750t
X=
525t
Fe2O3+
3CO===
2Fe+
3CO2
高温
含铁95%的生铁质量为:525t/95%=552.6t
答:可炼出含铁95%的生铁质量为552.6t。
160
112
750t
x
设可炼出纯铁Xt
例2、用1000t含氧化铁75%的赤铁矿石,
可以炼出含铁95%的生铁多少t?
作业:P
21
5、某钢铁厂每天需消耗5000tFe2O3
76%的赤铁矿石,该厂理论上可日产
含Fe98%的生铁的质量是多少?
6.冶炼2000t含杂质3%的生铁,需要
Fe3O490%的磁铁矿石的质量是多少?
练习
17页
例题
5、解:设该厂理论上可日产含铁98%的生铁X吨。
Fe2O3+3CO===2Fe+3CO2
高温
160
112
5000t×76%
98%X
X=2714.3t
答:略
第二课时
6、解:需要含四氧化三铁90%的磁铁矿石的质量为X
Fe3O4+4CO===3Fe+4CO2
高温
232t
168
90%X
2000×97%
X=2976.7t
答:略
铁在什么条件下容易生锈呢?
铁钉放在干燥的空气中:
铁不易生锈
铁钉浸没一半的在水中:
铁在空气、水的界面处生锈严重
铁钉完全浸没的在水中:
铁少量生锈
铁钉浸没一半的在食盐水中:
浸没在水中的铁钉几乎全部生锈
在空气中锈蚀,实际上是铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化,使铁转化为铁的化合物的过程
铁锈这种多孔性的物质,能让水分和空气穿过它的空隙,不断向里层渗透,继续跟铁反应,直至铁被完全锈蚀。
铁锈成分复杂,主要Fe2O3·XH2O它是一种疏松多孔的物质
与空气(氧气)接触
与水接触
铁生锈的主要条件:(潮湿的空气)
1.有水;
2.要与氧气接触。
食品包装袋内,放一袋铁粉(又叫双吸剂);铁粉
生锈时会吸收氧气和水,防止食品受潮和变质。
怎么防止钢铁生锈呢?
3、在机械表面涂防锈油
2、在面盆、杯子、等表面烧涂搪瓷
4、此外,还可以在钢铁表面镀上一层能起保护作用的其他金属。如:在钢铁表面镀锡、镀锌、和镀铬
1、在车船的表面喷油漆
思考题:1、
2、自行车的构件如支架、链条、钢圈等,分别采取了什么防锈措施?
刷油漆
涂油
镀铬
铝比铁更容易跟氧气。铝在空气中与氧气反应,生成的氧化铝形成一层致密而结实的膜覆盖在铝的表面,防止铝继续与氧气反应,从而起来“自我保护”的作用
3、铝比铁活泼,为什么铝比铁耐腐蚀?
一、铁锈的主要成分:Fe2O3
二、生锈的条件:在氧气与水作用下
三、防锈原理:隔绝空气和水分
四、防锈的具体方法:涂油、制成不锈钢、刷油
漆、烧制搪瓷、电镀上一层耐腐蚀的金属、保持铁制品表面干燥和洁净
小结
第六章复习:一、 几种重要的金属
金属材料
纯金属
合金
青铜器
冶铁
炼钢
铜和铁
金属光泽
大
高
延展性
导电性
导热性
汞
用途
价格
资源
是否美观
使用是否便利
废料是否易于回收
对环境的影响
二、 金属的化学性质
致密的氧化膜
金在高温下也不与氧气反应
三、 金属的活动性顺序
Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au
K、Ca、Na、Mg、Al、
氢前面
前面
后面
四、 合金
金属
非金属
金属
组成
性质
钢
生铁
含碳量
2%~4.3%
0.03%~2%
熔点高
密度小
可塑性好
易于加工
机械性能好
五、 金属的冶炼
Fe2O3
Fe3O4
铁矿石
焦炭
石灰石
检验CO的纯度
除去CO,防止引起大气污染
通入一会儿CO
排尽装置中的空气,防止发生爆炸
红色固体变成黑色
澄清石灰水变浑浊
Ca(OH)2+CO2===CaCO3↓+H2O
六、 金属的锈蚀与保护
氧气
水
Fe2O3
保持金属表面清洁干燥
涂一层保护膜如涂油、刷漆
改变内部结构
防止金属锈蚀
金属的回收利用
有计划、合理地开采矿物
寻找金属的代用品
1.铁及其合金在生产、生活中应用广泛。下列关于铁及其合金的说法中正确的是
A、铁是地壳中含量最丰富的金属元素
B、不锈钢的抗腐蚀性好,可用于制造医疗器械
C、铁丝能在氧气中剧烈燃烧、火星四射,生成氧化铁
D、铁生锈是铁与空气中的氧气、水发生缓慢氧化的过程
BD
思考与练习
(多选)
2.在下列条件下,铁钉锈蚀最快的是(
)
B
3、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是(
)
A.Mn、Mg、Cu
B.Mg、Mn、Cu
C.Cu、Mg、Mn
D.Cu、Mn、Mg
B
4.(1)以上用品中,主要利用金属导电性的是_____。
(2)铝制品表面的污渍不宜用钢丝球擦洗,以免破坏表面的_________________。
(3)切过蔬菜的菜刀,搁置在砧板上一段时间生锈。铁在空气中锈蚀,实际上是铁跟_________等物质发生化学反应的结果。
(4)锈蚀钢回收重新冶炼是保护金属资源的一条有效途径。写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)的化学方程式_________________。
A
致密的氧化铝的薄膜
氧气和水
Fe2O3
+
3CO
==
2Fe
+
3CO2
高温
5.金属资源是不可再生的资源,保护金属资源是我们刻不容缓的职责。下列有关叙述不正确的是(
)
A.大力开采矿物以保障金属材料的供用
B.提高废旧金属的回收利用率
C.在金属制品上刷漆、涂油等防止金属腐蚀
D.用特种塑料代替金属制造机器的零部件
A
6.
A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是(
)
A.A、B、C、D
B.B、A、C、D
C.D、C、A、B
D.D、C、B、A
C
7、分别用以下三组物质比较锌和铜的金属活动性:
①Zn、Cu、稀硫酸;②Zn、Cu、MgSO4溶液;
③Zn、CuSO4溶液。
仅用组内物质就能够直接达到目的的是(
)
A.仅有①
B.
②③
C.①③
D.①②③
c
8、人们的日常生活离不开金属,高科技新材料的开发和
应用也需要金属。(1)现代社会使用大量的钢铁,钢铁与
接触容易生锈造成损失,在钢铁表面采用
方法可以防止钢铁生锈。
(2)波尔多液是由硫酸铜和熟石灰加水配制而成,不能用铁
制容器配制的原因是(用化学方程式表示)
。
空气和水
表面涂层
9、下图是关于铁化学性质的知识网络(“→”表示一种物
质转化为另一种物质),其中B是密度最小的气体,C为
红色固体单质。请回答下列问题:
(1)A物质的化学式为
。(2)B物质的一种用
途是
。
(3)反应②还需要的一种反应物是
(填化学式)。
(4)写出反应③的方程式,并注明基本反应类型:
(
)。
冶炼金属(作燃料等)
置换反应
Fe3O4
C(或CO或H2)
10.某钢铁厂每天消耗4000t含Fe2O3
80%的赤铁矿石,该钢铁厂理论上可日产含Fe98%的生铁质量是多少?(计算结果保留到0.1)
Fe2O3
+
3CO
==
2Fe
+
3CO2
高温
160
2×56
4000t×80%
98%X
解:设可日产含Fe98%的生铁质量是X。
不利用方程式能否计算?
X≈2281.7t
11、某化学兴趣小组为了测定得到的黄铜样品中铜的含量,
称取20g样品研细后放置于烧杯中,加入50g稀硫酸,恰好
完全反应后,冷却,称得烧杯的总质量为69.8g.请计算
(计算结果精确到0.1%):
(1)生成氢气的质量
(2)此黄铜中铜的质量分数;
解:(1)氢气的质量:20+50-69.8=0.2克
(2)设样品中锌的质量为X
Zn+H2SO4==ZnSO4+H2↑
65
2
X
0.2g
65
X
====
2
0.2g
X=6.5g
13.5g
20g
×100%=67.5%
12.欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,
实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是_________
合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,
经测定产生了0.4g气体。
请你计算该合金中铜的质量分数。
Cu﹣Zn
设合金中Zn的质量为x
Zn+H2SO4
==
ZnSO4+H2↑
65
2
X
0.4g
合金中铜的质量=
32.5g
–
13g
=
19.5g
x
=
13
g
合金中铜的质量分数为:
65
X
====
2
0.4g
19.5g
32.5g
×100%=60%
同课章节目录
