课题1 生活中常见的盐 教学课件(31张PPT)
文档属性
| 名称 | 课题1 生活中常见的盐 教学课件(31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-26 00:00:00 | ||
图片预览











文档简介
课题1 生活中常见的盐
第十一单元 盐 化肥
人教版 化学 九年级下
01
氯化钠(食盐)
做饭时,我们都要用到食盐,食盐的主要成分是氯化钠。你对氯化钠了解有多少呢?
情景导入
1、食盐氯化钠的用途、分布
氯化钠(食盐)
一、氯化钠(食盐)
(1)化学中的盐是指一类组成里含有 离子和 离子的化合物。
(2)氯化钠是盐的一种,它的俗名是 ,是一种 色颗粒状的固体,有 味,易溶于水。
金属
酸根
食盐
白
咸
氯化钠(食盐)
(3)氯化钠的用途:
生活方面: ;
医疗方面: ;
工业方面: ;
农业方面: ;
(4)氯化钠的分布:在自然界中分布很广,除海水外, 、 盐井、 、也是氯化钠的来源。
调味品、腌制食物
配制生理盐水
制取碳酸钠、氢氧化钠、氯气和盐酸
用氯化钠溶液来选种
盐湖
盐矿
你知道食盐是怎么来的吗?
海水晒盐原理:氯化钠的溶解度随着温度的升高而增大,受温度影响变化不大。饱和溶液蒸发水分会析出晶体。
海水晒盐
2、海水晒盐
氯化钠(食盐)
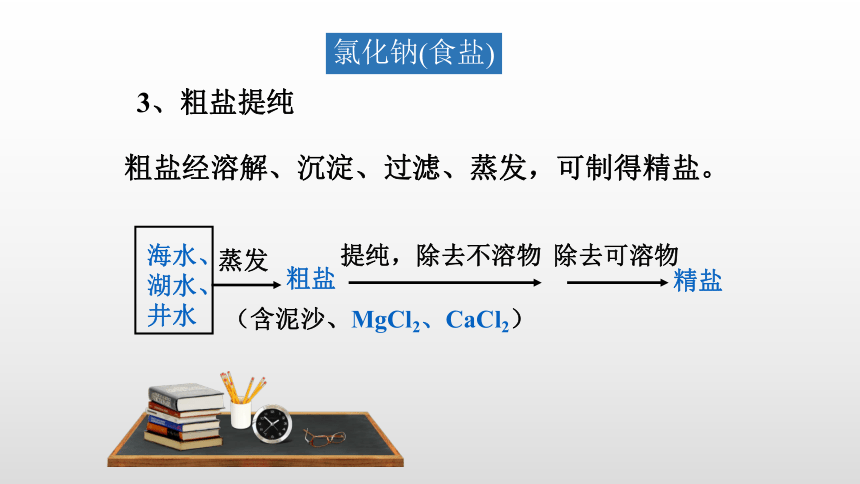
粗盐经溶解、沉淀、过滤、蒸发,可制得精盐。
海水、湖水、井水
提纯,除去不溶物
除去可溶物
精盐
蒸发
粗盐
(含泥沙、MgCl2、CaCl2)
3、粗盐提纯
氯化钠(食盐)
操作步骤
温馨提示:
蒸发时,用玻璃棒不断搅拌。
等蒸发皿中出现较多量固体时,停止加热,利用余热将水分蒸干。
3、粗盐提纯
氯化钠(食盐)
反思交流: 在溶解、过滤、蒸发、转移中都用到了玻璃棒,它的作用分别是什么?
1.溶解时用玻璃棒搅拌,加速固体的溶解。
2.过滤时用玻璃棒引流。
3.蒸发时用玻璃棒搅拌,防止液体受热不均匀,引起液滴飞溅。
4.转移固体,将提纯后的食盐转移到纸上。
3、粗盐提纯
氯化钠(食盐)
几种常见的盐
02
它们的主要成分都是碳酸钙
下列物质的主要成分是什么?
你对碳酸钙都有哪些认识?
你知道吗
(2)性质:
①物理性质:白色固体,难溶于水
(1)用途:
做建筑材料、补钙剂
1、碳酸钙
几种常见的盐
二、几种常见的盐
②化学性质
a.和稀盐酸反应
CaCO3 + 2 HCl === CaCl2 + H2CO3
CO2↑+H2O
b.高温分解
CaCO3 === CaO+ CO2↑
高温
1、碳酸钙
几种常见的盐
碳酸钠 碳酸氢钠
你对碳酸钠、碳酸氢钠的了解有多少呢?
2、碳酸钠和碳酸氢钠
几种常见的盐
二、几种常见的盐
认识碳酸钠和碳酸氢钠的用途
活动与探究
小结:碳酸钠、碳酸氢钠的用途
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
碳酸钠
碳酸氢钠
化学式
俗 名
用 途
生产玻璃、造纸、纺织、洗涤剂、生活中可以用来蒸馒头
Na2CO3
NaHCO3
发酵粉的主要成分之一,治疗胃酸过多症的药剂,干粉灭火器的主要成分
纯碱、苏打
小苏打
碳酸钠+ 盐酸
碳酸氢钠+盐酸
现 象
分 析
结论
固体溶解,产生大量气泡,澄清石灰水变浑浊。
它们都能和盐酸反应生成CO2
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
探究碳酸钠、碳酸氢钠的性质
1.探究碳酸钠和碳酸氢钠是否和盐酸发生反应
活动与探究
CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
交流反思
①分析反应物及生成物各有什么共同点?你能试着总结出什么规律?
②小组内交流归纳含有碳酸根离子(或碳酸氢根离子)的盐的鉴定方法。
操作
现象
结论
向少量样品中加入稀盐酸。
有无色无味气体生成。
该样品是碳酸盐。
将产生的气体通入澄清石灰水。
澄清石灰水变浑浊。
鉴定碳酸根离子的方法
总结提升
练一练: 如何检验水垢中是否含碳酸根离子?
2.探究碳酸钠和碳酸氢钠是否和石灰水发生反应
碳酸钠+ 石灰水
碳酸氢钠+石灰水
现 象
分 析
结论
产生白色沉淀
无现象
可溶性碳酸盐和石灰水反应产生白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
工业制取烧碱的反应
探究碳酸钠、碳酸氢钠的性质
活动与探究
03
复分解反应
三、复分解反应
交流反思:观察下列三个反应有什么共同特点? (注意其构成微粒位置的变化)
(1)HCl+ NaOH== H2O + NaCl
(2)Na2CO3 +2HCl==2NaCl + H2CO3
(3)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
两种化合物互相交换成分,生成另外两种化合物的反应,叫复分解反应。
AB+CD=AD+CB
CO2↑+H2O
复分解反应
探究硫酸铜溶液的性质
氢氧化钠溶液
氯化钡溶液
现象
化学方程式
分别向盛有硫酸铜溶液的试管里滴加氢氧化钠溶液和氯化钡溶液振荡,观察现象。
CuSO4+BaCl2= CuCl2+BaSO4 ↓
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH= Na2SO4 + Cu(OH)2↓
复分解反应通常发生在酸、碱、盐之间,那么酸、碱、盐之间是否一定能发生复分解反应呢?
活动与探究
CuSO4+2NaOH= Na2SO4 + Cu(OH)2↓
CuSO4+BaCl2= CuCl2+BaSO4 ↓
Na2CO3 + Ca(OH)2= 2NaOH + CaCO3↓
Ca(OH)2+H2SO4= CaSO4+2H2O CaCO3 +2HCl=CaCl2 + CO2↑+ H2O
两种化合物相互交换成分,生成物中有沉淀或者气体或者水生成时,复分解反应才能发生。
总结提升:复分解反应发生的条件
这些反应有什么共同特点?
酸、碱、盐之间是否一定能发生复分解反应呢?
请你判断
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
NaOH溶液
NaCl溶液
K2CO3溶液
Ba(NO3)2溶液
稀硫酸
判断依据
能
能
能
不能
生成水
没有水、沉淀或气体生成
生成气体
生成沉淀
结合附录Ⅰ《部分酸、碱和盐的溶解性表》判断下列酸碱盐之间是否发生反应?并设计实验验证。
1.与金属反应
反应条件:金属排在盐中金属前面,盐溶于水。
Fe + CuSO4 = Cu + FeSO4
2Al +3CuSO4 = 3 Cu + Al2(SO4)3
探究盐的化学性质
活动与探究
2.与酸反应
CaCO3 +2HCl=
BaCl2+H2SO4=
反应条件:有水或者沉淀或者气体生成
CaCl2 + CO2↑+ H2O
BaSO4 ↓ +2HCl
盐酸腐蚀大理石
探究盐的化学性质
活动与探究
3.与碱溶液反应
Na2CO3 +Ca(OH)2=
CuSO4+2NaOH=
反应条件:反应物溶于水,生成物中有水或者沉淀或者气体生成。
2NaOH + CaCO3↓
Na2SO4 + Cu(OH)2↓
探究盐的化学性质
活动与探究
4.与盐溶液反应
CuSO4+BaCl2 =
Na2CO3 +CaCl2 =
反应条件:反应物溶于水,生成物中有沉淀生成。
CuCl2+BaSO4 ↓
2NaCl + CaCO3↓
探究盐的化学性质
活动与探究
请将下列物质按照一定的分类标准将它们进行分类。
空气、溶液、氧气、碳、金属、二氧化碳、一氧化碳、水、盐酸、硫酸、氢氧化钠、氢氧化钙、氯化钠、碳酸钠
拓展延伸:物质的分类
物质
混合物(多种物质)
纯净物
(一种物质)
单质(一种元素)
化合物(多种元素)
氧化物(H2O)
酸(HCl)
碱(Ca(OH)2)
盐(NaCl)
金属(铁)
非金属(氧气)
物质种类
元素种类
组成元素
最外层电子数
拓展延伸:物质的分类
第十一单元 盐 化肥
人教版 化学 九年级下
01
氯化钠(食盐)
做饭时,我们都要用到食盐,食盐的主要成分是氯化钠。你对氯化钠了解有多少呢?
情景导入
1、食盐氯化钠的用途、分布
氯化钠(食盐)
一、氯化钠(食盐)
(1)化学中的盐是指一类组成里含有 离子和 离子的化合物。
(2)氯化钠是盐的一种,它的俗名是 ,是一种 色颗粒状的固体,有 味,易溶于水。
金属
酸根
食盐
白
咸
氯化钠(食盐)
(3)氯化钠的用途:
生活方面: ;
医疗方面: ;
工业方面: ;
农业方面: ;
(4)氯化钠的分布:在自然界中分布很广,除海水外, 、 盐井、 、也是氯化钠的来源。
调味品、腌制食物
配制生理盐水
制取碳酸钠、氢氧化钠、氯气和盐酸
用氯化钠溶液来选种
盐湖
盐矿
你知道食盐是怎么来的吗?
海水晒盐原理:氯化钠的溶解度随着温度的升高而增大,受温度影响变化不大。饱和溶液蒸发水分会析出晶体。
海水晒盐
2、海水晒盐
氯化钠(食盐)
粗盐经溶解、沉淀、过滤、蒸发,可制得精盐。
海水、湖水、井水
提纯,除去不溶物
除去可溶物
精盐
蒸发
粗盐
(含泥沙、MgCl2、CaCl2)
3、粗盐提纯
氯化钠(食盐)
操作步骤
温馨提示:
蒸发时,用玻璃棒不断搅拌。
等蒸发皿中出现较多量固体时,停止加热,利用余热将水分蒸干。
3、粗盐提纯
氯化钠(食盐)
反思交流: 在溶解、过滤、蒸发、转移中都用到了玻璃棒,它的作用分别是什么?
1.溶解时用玻璃棒搅拌,加速固体的溶解。
2.过滤时用玻璃棒引流。
3.蒸发时用玻璃棒搅拌,防止液体受热不均匀,引起液滴飞溅。
4.转移固体,将提纯后的食盐转移到纸上。
3、粗盐提纯
氯化钠(食盐)
几种常见的盐
02
它们的主要成分都是碳酸钙
下列物质的主要成分是什么?
你对碳酸钙都有哪些认识?
你知道吗
(2)性质:
①物理性质:白色固体,难溶于水
(1)用途:
做建筑材料、补钙剂
1、碳酸钙
几种常见的盐
二、几种常见的盐
②化学性质
a.和稀盐酸反应
CaCO3 + 2 HCl === CaCl2 + H2CO3
CO2↑+H2O
b.高温分解
CaCO3 === CaO+ CO2↑
高温
1、碳酸钙
几种常见的盐
碳酸钠 碳酸氢钠
你对碳酸钠、碳酸氢钠的了解有多少呢?
2、碳酸钠和碳酸氢钠
几种常见的盐
二、几种常见的盐
认识碳酸钠和碳酸氢钠的用途
活动与探究
小结:碳酸钠、碳酸氢钠的用途
{93296810-A885-4BE3-A3E7-6D5BEEA58F35}
碳酸钠
碳酸氢钠
化学式
俗 名
用 途
生产玻璃、造纸、纺织、洗涤剂、生活中可以用来蒸馒头
Na2CO3
NaHCO3
发酵粉的主要成分之一,治疗胃酸过多症的药剂,干粉灭火器的主要成分
纯碱、苏打
小苏打
碳酸钠+ 盐酸
碳酸氢钠+盐酸
现 象
分 析
结论
固体溶解,产生大量气泡,澄清石灰水变浑浊。
它们都能和盐酸反应生成CO2
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
探究碳酸钠、碳酸氢钠的性质
1.探究碳酸钠和碳酸氢钠是否和盐酸发生反应
活动与探究
CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
交流反思
①分析反应物及生成物各有什么共同点?你能试着总结出什么规律?
②小组内交流归纳含有碳酸根离子(或碳酸氢根离子)的盐的鉴定方法。
操作
现象
结论
向少量样品中加入稀盐酸。
有无色无味气体生成。
该样品是碳酸盐。
将产生的气体通入澄清石灰水。
澄清石灰水变浑浊。
鉴定碳酸根离子的方法
总结提升
练一练: 如何检验水垢中是否含碳酸根离子?
2.探究碳酸钠和碳酸氢钠是否和石灰水发生反应
碳酸钠+ 石灰水
碳酸氢钠+石灰水
现 象
分 析
结论
产生白色沉淀
无现象
可溶性碳酸盐和石灰水反应产生白色沉淀
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
工业制取烧碱的反应
探究碳酸钠、碳酸氢钠的性质
活动与探究
03
复分解反应
三、复分解反应
交流反思:观察下列三个反应有什么共同特点? (注意其构成微粒位置的变化)
(1)HCl+ NaOH== H2O + NaCl
(2)Na2CO3 +2HCl==2NaCl + H2CO3
(3)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
两种化合物互相交换成分,生成另外两种化合物的反应,叫复分解反应。
AB+CD=AD+CB
CO2↑+H2O
复分解反应
探究硫酸铜溶液的性质
氢氧化钠溶液
氯化钡溶液
现象
化学方程式
分别向盛有硫酸铜溶液的试管里滴加氢氧化钠溶液和氯化钡溶液振荡,观察现象。
CuSO4+BaCl2= CuCl2+BaSO4 ↓
产生蓝色沉淀
产生白色沉淀
CuSO4+2NaOH= Na2SO4 + Cu(OH)2↓
复分解反应通常发生在酸、碱、盐之间,那么酸、碱、盐之间是否一定能发生复分解反应呢?
活动与探究
CuSO4+2NaOH= Na2SO4 + Cu(OH)2↓
CuSO4+BaCl2= CuCl2+BaSO4 ↓
Na2CO3 + Ca(OH)2= 2NaOH + CaCO3↓
Ca(OH)2+H2SO4= CaSO4+2H2O CaCO3 +2HCl=CaCl2 + CO2↑+ H2O
两种化合物相互交换成分,生成物中有沉淀或者气体或者水生成时,复分解反应才能发生。
总结提升:复分解反应发生的条件
这些反应有什么共同特点?
酸、碱、盐之间是否一定能发生复分解反应呢?
请你判断
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
NaOH溶液
NaCl溶液
K2CO3溶液
Ba(NO3)2溶液
稀硫酸
判断依据
能
能
能
不能
生成水
没有水、沉淀或气体生成
生成气体
生成沉淀
结合附录Ⅰ《部分酸、碱和盐的溶解性表》判断下列酸碱盐之间是否发生反应?并设计实验验证。
1.与金属反应
反应条件:金属排在盐中金属前面,盐溶于水。
Fe + CuSO4 = Cu + FeSO4
2Al +3CuSO4 = 3 Cu + Al2(SO4)3
探究盐的化学性质
活动与探究
2.与酸反应
CaCO3 +2HCl=
BaCl2+H2SO4=
反应条件:有水或者沉淀或者气体生成
CaCl2 + CO2↑+ H2O
BaSO4 ↓ +2HCl
盐酸腐蚀大理石
探究盐的化学性质
活动与探究
3.与碱溶液反应
Na2CO3 +Ca(OH)2=
CuSO4+2NaOH=
反应条件:反应物溶于水,生成物中有水或者沉淀或者气体生成。
2NaOH + CaCO3↓
Na2SO4 + Cu(OH)2↓
探究盐的化学性质
活动与探究
4.与盐溶液反应
CuSO4+BaCl2 =
Na2CO3 +CaCl2 =
反应条件:反应物溶于水,生成物中有沉淀生成。
CuCl2+BaSO4 ↓
2NaCl + CaCO3↓
探究盐的化学性质
活动与探究
请将下列物质按照一定的分类标准将它们进行分类。
空气、溶液、氧气、碳、金属、二氧化碳、一氧化碳、水、盐酸、硫酸、氢氧化钠、氢氧化钙、氯化钠、碳酸钠
拓展延伸:物质的分类
物质
混合物(多种物质)
纯净物
(一种物质)
单质(一种元素)
化合物(多种元素)
氧化物(H2O)
酸(HCl)
碱(Ca(OH)2)
盐(NaCl)
金属(铁)
非金属(氧气)
物质种类
元素种类
组成元素
最外层电子数
拓展延伸:物质的分类
同课章节目录
