课题3 溶液的浓度 教学课件(34张PPT)
文档属性
| 名称 | 课题3 溶液的浓度 教学课件(34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-26 08:42:31 | ||
图片预览







文档简介
课题3 溶液的浓度
第九单元 溶液
人教版 化学 九年级下
溶质的
质量分数
01
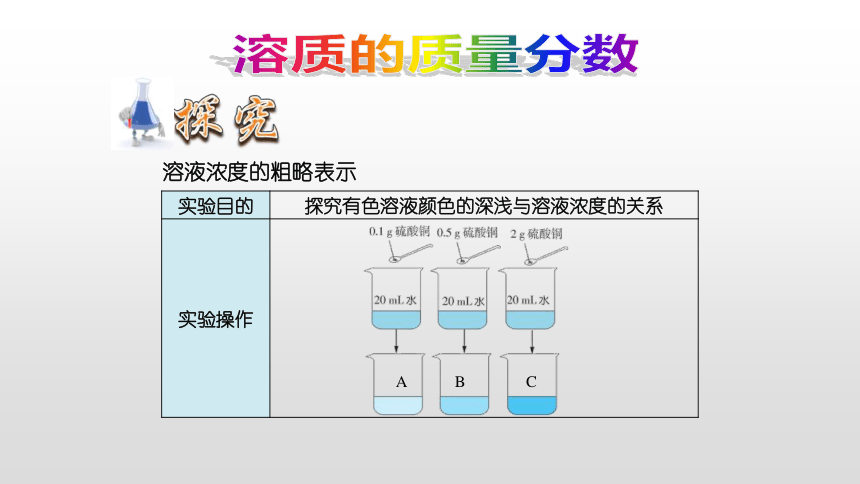
比较三种硫酸铜溶液的颜色,你能判断溶液的浓稀吗?你认为在这三种硫酸铜溶液中,硫酸铜的含量是否相同?
A B C
情景导入
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
A B C
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验目的
探究有色溶液颜色的深浅与溶液浓度的关系
实验操作
A B C
溶液浓度的粗略表示
溶质的质量分数
探究
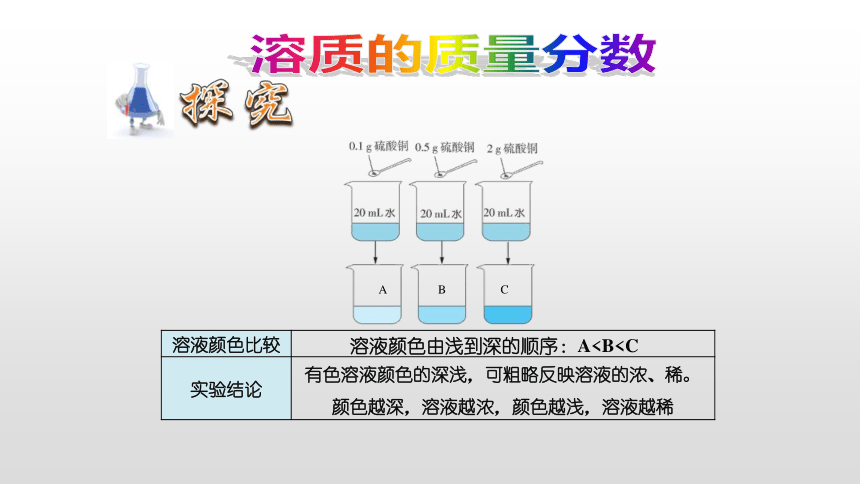
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}溶液颜色比较
实验结论
A B C
溶液颜色由浅到深的顺序:A有色溶液颜色的深浅,可粗略反映溶液的浓、稀。颜色越深,溶液越浓,颜色越浅,溶液越稀
溶质的质量分数
探究
溶质的质量分数
1、定义:
2、计算关系式:
溶质的质量分数
溶质质量
溶液质量
×100%
溶质质量
溶质质量+溶剂质量
×100%
溶质质量与溶液质量之比。
溶质的质量分数
溶质的质量分数
溶质质量
溶液质量
×100%
溶质的质量=
溶液的质量=
溶质的质量
溶质的质量分数
溶液的质量×溶质的质量分数
推导关系式:
溶质的质量分数
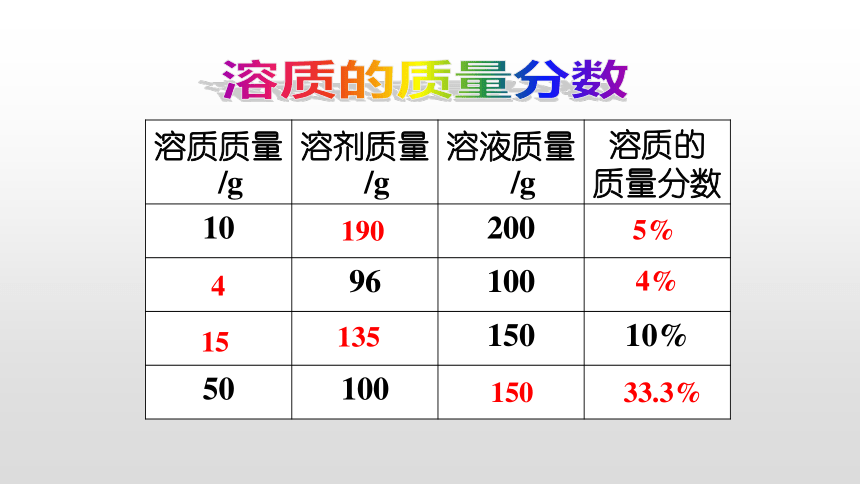
溶质质量/g
溶剂质量/g
溶液质量/g
溶质的
质量分数
10
200
96
100
150
10%
50
100
190
5%
4%
15
135
150
33.3%
4
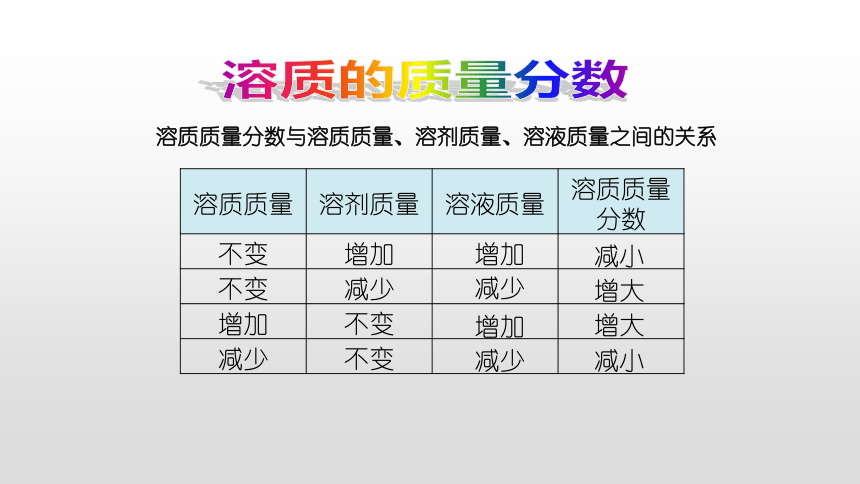
溶质质量分数与溶质质量、溶剂质量、溶液质量之间的关系
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}溶质质量
溶剂质量
溶液质量
溶质质量分数
不变
增加
不变
减少
增加
不变
减少
不变
减小
减小
增大
增大
溶质的质量分数
增加
减少
增加
减少
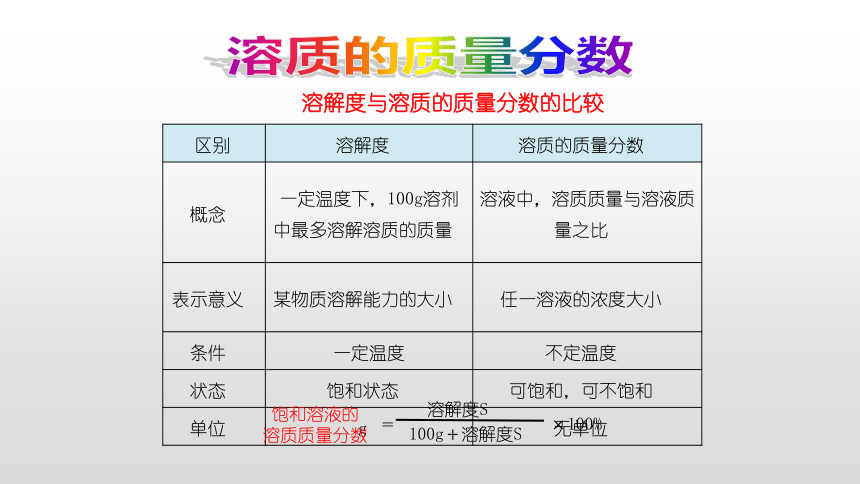
溶解度与溶质的质量分数的比较
{2D5ABB26-0587-4C30-8999-92F81FD0307C}区别?
溶解度 ?
溶质的质量分数 ?
概念 ?
一定温度下,100g溶剂中最多溶解溶质的质量 ?
溶液中,溶质质量与溶液质量之比 ?
表示意义 ?
某物质溶解能力的大小 ?
任一溶液的浓度大小 ?
条件 ?
一定温度
不定温度 ?
状态 ?
饱和状态 ?
可饱和,可不饱和 ?
单位 ?
g ?
无单位 ?
饱和溶液的
溶质质量分数
溶解度S
100g+溶解度S
=
×100%
溶质的质量分数
1.某氯化钠溶液的溶质质量分数为16%,它表示的含义是 ( )
A.溶液中含有氯化钠16g
B.溶液质量为100g
C.每100g溶液中含氯化钠16g
D.每100g水中溶解了16g氯化钠
C
解析:溶质质量分数是溶质质量与溶液质量之比,表示每100g某溶液中所含溶质的质量,某氯化钠溶液的溶质质量分数为16%,它表示的含义是每100g溶液中含氯化钠16g。
课堂练习
2.把10g氯化钠放入40g水中,完全溶解后,溶液中氯化钠的质量分数是多少?
3.在20℃时,将40g氯化钠放入100g水中,结果有4g固体剩余,求溶液中溶质的质量分数。
氯化钠的质量分数= 溶质质量溶质质量+溶剂质量×100%= 10g10g+40g×100%=20%
?
氯化钠的质量分数= 溶质质量溶质质量+溶剂质量×100%= 36g36g+100g×100%≈26.5%
?
课堂练习
有关溶质的
质量分数的计算
02
有关溶质质量分数的计算
例1: 在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?
溶质质量
溶液质量
溶质的质量分数
150kg
16%
24kg
溶剂质量
溶液质量
溶质质量
150kg
24kg
126kg
解:
答;需要24 kg氯化钠,126 kg的水
有关溶液稀释、增浓问题的计算
1
溶液稀释问题
1.稀释方法:加溶剂;
2.稀释依据:稀释前后溶液中溶质的质量不变
3.关系式:A×a%=(A+m溶剂)×b%
有关溶质质量分数的计算
用稀溶液稀释
A×a%+B×b%=(A+B)×c%
有关溶质质量分数的计算
1. 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解题的关键是—溶液稀释前后溶质的质量不变
即:稀释前溶液中溶质质量=稀释后溶液中溶质质量
有关溶质质量分数的计算
1.化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
设稀释后溶液的质量为x。
50g× 98% = x× 20%
x = 245g
答:需要水的质量为195g。
解:
需要水的质量 = 245g-50g = 195g
2
溶液增浓问题
1.增浓方法:
2.关系式:
有关溶质质量分数的计算
加溶质;
A×a%+B=(A+B)×c%
蒸发溶剂;
加浓溶液
A×a%=(A-B)×c%
A×a%+B×b%=(A+B)×c%
2.有40g溶质质量分数为5%的氯化钙溶液,若将其溶质的质量分数增大到10%,求需加入氯化钙的质量。
解:设需加入氯化钙的质量为x
x≈2.22g
答:需加入氯化钙的质量为2.22g。
(40 g+x)
(40 g×5%+x)
×100%=10%
课堂练习
3.有40g溶质质量分数为5%的氯化钙溶液,若将其溶质的质量分数增大到10%,求需蒸发掉水的质量。
解:需蒸发掉水的质量为y
y=20g
答:需蒸发掉水的质量为20g。
(40g-y)
40g×5%
×100%=10%
课堂练习
3.有40g溶质质量分数为5%的氯化钙溶液,若将其溶质的质量分数增大到10%,需加入15%的CaCl2溶液的质量为多少?
解:需加入15%的CaCl2溶液的质量为z
z=40g
答:需加入15%的CaCl2溶液的质量为40g。
(40g+z)
(40g×5%)+(z×15%)
×100%=10%
课堂练习
配制一定溶质
质量分数的溶液
03
欲配制如图所示500mL
0.9%的氯化钠注射液(密
度约为1g/mL),需要氯化
钠和水的质量各是多少?
在实验室欲配制500mL该氯化钠注射液,操作步骤有哪些?需要用到哪些仪器?
用固体物质配制一定溶质质量分数溶液的主要步骤:
1.计算
2.称量
3.量取
4.溶解
5.装瓶存放
配制一定溶质质量分数的溶液
托盘天平、量筒、烧杯、玻璃棒、
用固体物质配制一定溶质质量分数溶液需要用到的实验仪器:
药匙、胶头滴管
配制一定溶质质量分数的溶液
1.计算:所需溶质氯化钠的质量为 g,
水的体积为 mL。
2.称量:用 称取所需的氯化钠。
3.量取:用 量取所需的水。
4.溶解:将称好的氯化钠和量好的水倒入
中,用 搅拌使之完
全溶解。
5.装瓶存放:把配制好的溶液装入 ,
盖好 ,贴上 。
3
47
托盘天平
量筒
烧杯
玻璃棒
试剂瓶
瓶塞
标签
配制50g质量分数为6%的氯化钠溶液
请你与同学合作,配制50g质量分数为6%的氯化钠溶液。
探究
瓶塞倒放
左物右码
烧杯干燥
仰视水多
不能用温度计搅拌
注意
配制一定溶质质量分数的溶液
在配制时,导致所配溶液溶质质量分数偏大或偏小的主要原因可能有哪些?
配制一定溶质质量分数的溶液
在配制时,导致所配溶液溶质质量分数偏大的主要原因:
1.用量筒量取水时,俯视读数。
配制一定溶质质量分数的溶液
2.将量筒中的水倒入烧杯时,有少 量水洒出。
1.称量药品时,药品和砝码放颠倒了。
在配制时,导致所配溶液溶质质量分数偏小的主要原因:
配制一定溶质质量分数的溶液
2.用量筒量取水时,仰视读数。
3.将食盐倒入烧杯时,有少量食盐洒落了。
4.配制所用的烧杯不干燥。
(用到游码时)
1.配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是( )
A.①②③④⑤ B. ④⑤①②③
C.③④①②⑤ D. ②①④③⑤
B
课堂练习
2.要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
D
课堂练习
3.在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的是( )
A.用托盘天平称量氯化钠时,将砝码放在左盘,但未使用游码
B.将量筒中的水倒入烧杯时,有水洒出
C.用量筒量取蒸馏水读数时,仰视凹液面的最低处
D.将配好的氯化钠溶液转移到细口瓶时,不慎撒出部分溶液
C
课堂练习
第九单元 溶液
人教版 化学 九年级下
溶质的
质量分数
01
比较三种硫酸铜溶液的颜色,你能判断溶液的浓稀吗?你认为在这三种硫酸铜溶液中,硫酸铜的含量是否相同?
A B C
情景导入
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
A B C
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验目的
探究有色溶液颜色的深浅与溶液浓度的关系
实验操作
A B C
溶液浓度的粗略表示
溶质的质量分数
探究
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}溶液颜色比较
实验结论
A B C
溶液颜色由浅到深的顺序:A
溶质的质量分数
探究
溶质的质量分数
1、定义:
2、计算关系式:
溶质的质量分数
溶质质量
溶液质量
×100%
溶质质量
溶质质量+溶剂质量
×100%
溶质质量与溶液质量之比。
溶质的质量分数
溶质的质量分数
溶质质量
溶液质量
×100%
溶质的质量=
溶液的质量=
溶质的质量
溶质的质量分数
溶液的质量×溶质的质量分数
推导关系式:
溶质的质量分数
溶质质量/g
溶剂质量/g
溶液质量/g
溶质的
质量分数
10
200
96
100
150
10%
50
100
190
5%
4%
15
135
150
33.3%
4
溶质质量分数与溶质质量、溶剂质量、溶液质量之间的关系
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}溶质质量
溶剂质量
溶液质量
溶质质量分数
不变
增加
不变
减少
增加
不变
减少
不变
减小
减小
增大
增大
溶质的质量分数
增加
减少
增加
减少
溶解度与溶质的质量分数的比较
{2D5ABB26-0587-4C30-8999-92F81FD0307C}区别?
溶解度 ?
溶质的质量分数 ?
概念 ?
一定温度下,100g溶剂中最多溶解溶质的质量 ?
溶液中,溶质质量与溶液质量之比 ?
表示意义 ?
某物质溶解能力的大小 ?
任一溶液的浓度大小 ?
条件 ?
一定温度
不定温度 ?
状态 ?
饱和状态 ?
可饱和,可不饱和 ?
单位 ?
g ?
无单位 ?
饱和溶液的
溶质质量分数
溶解度S
100g+溶解度S
=
×100%
溶质的质量分数
1.某氯化钠溶液的溶质质量分数为16%,它表示的含义是 ( )
A.溶液中含有氯化钠16g
B.溶液质量为100g
C.每100g溶液中含氯化钠16g
D.每100g水中溶解了16g氯化钠
C
解析:溶质质量分数是溶质质量与溶液质量之比,表示每100g某溶液中所含溶质的质量,某氯化钠溶液的溶质质量分数为16%,它表示的含义是每100g溶液中含氯化钠16g。
课堂练习
2.把10g氯化钠放入40g水中,完全溶解后,溶液中氯化钠的质量分数是多少?
3.在20℃时,将40g氯化钠放入100g水中,结果有4g固体剩余,求溶液中溶质的质量分数。
氯化钠的质量分数= 溶质质量溶质质量+溶剂质量×100%= 10g10g+40g×100%=20%
?
氯化钠的质量分数= 溶质质量溶质质量+溶剂质量×100%= 36g36g+100g×100%≈26.5%
?
课堂练习
有关溶质的
质量分数的计算
02
有关溶质质量分数的计算
例1: 在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?
溶质质量
溶液质量
溶质的质量分数
150kg
16%
24kg
溶剂质量
溶液质量
溶质质量
150kg
24kg
126kg
解:
答;需要24 kg氯化钠,126 kg的水
有关溶液稀释、增浓问题的计算
1
溶液稀释问题
1.稀释方法:加溶剂;
2.稀释依据:稀释前后溶液中溶质的质量不变
3.关系式:A×a%=(A+m溶剂)×b%
有关溶质质量分数的计算
用稀溶液稀释
A×a%+B×b%=(A+B)×c%
有关溶质质量分数的计算
1. 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解题的关键是—溶液稀释前后溶质的质量不变
即:稀释前溶液中溶质质量=稀释后溶液中溶质质量
有关溶质质量分数的计算
1.化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
设稀释后溶液的质量为x。
50g× 98% = x× 20%
x = 245g
答:需要水的质量为195g。
解:
需要水的质量 = 245g-50g = 195g
2
溶液增浓问题
1.增浓方法:
2.关系式:
有关溶质质量分数的计算
加溶质;
A×a%+B=(A+B)×c%
蒸发溶剂;
加浓溶液
A×a%=(A-B)×c%
A×a%+B×b%=(A+B)×c%
2.有40g溶质质量分数为5%的氯化钙溶液,若将其溶质的质量分数增大到10%,求需加入氯化钙的质量。
解:设需加入氯化钙的质量为x
x≈2.22g
答:需加入氯化钙的质量为2.22g。
(40 g+x)
(40 g×5%+x)
×100%=10%
课堂练习
3.有40g溶质质量分数为5%的氯化钙溶液,若将其溶质的质量分数增大到10%,求需蒸发掉水的质量。
解:需蒸发掉水的质量为y
y=20g
答:需蒸发掉水的质量为20g。
(40g-y)
40g×5%
×100%=10%
课堂练习
3.有40g溶质质量分数为5%的氯化钙溶液,若将其溶质的质量分数增大到10%,需加入15%的CaCl2溶液的质量为多少?
解:需加入15%的CaCl2溶液的质量为z
z=40g
答:需加入15%的CaCl2溶液的质量为40g。
(40g+z)
(40g×5%)+(z×15%)
×100%=10%
课堂练习
配制一定溶质
质量分数的溶液
03
欲配制如图所示500mL
0.9%的氯化钠注射液(密
度约为1g/mL),需要氯化
钠和水的质量各是多少?
在实验室欲配制500mL该氯化钠注射液,操作步骤有哪些?需要用到哪些仪器?
用固体物质配制一定溶质质量分数溶液的主要步骤:
1.计算
2.称量
3.量取
4.溶解
5.装瓶存放
配制一定溶质质量分数的溶液
托盘天平、量筒、烧杯、玻璃棒、
用固体物质配制一定溶质质量分数溶液需要用到的实验仪器:
药匙、胶头滴管
配制一定溶质质量分数的溶液
1.计算:所需溶质氯化钠的质量为 g,
水的体积为 mL。
2.称量:用 称取所需的氯化钠。
3.量取:用 量取所需的水。
4.溶解:将称好的氯化钠和量好的水倒入
中,用 搅拌使之完
全溶解。
5.装瓶存放:把配制好的溶液装入 ,
盖好 ,贴上 。
3
47
托盘天平
量筒
烧杯
玻璃棒
试剂瓶
瓶塞
标签
配制50g质量分数为6%的氯化钠溶液
请你与同学合作,配制50g质量分数为6%的氯化钠溶液。
探究
瓶塞倒放
左物右码
烧杯干燥
仰视水多
不能用温度计搅拌
注意
配制一定溶质质量分数的溶液
在配制时,导致所配溶液溶质质量分数偏大或偏小的主要原因可能有哪些?
配制一定溶质质量分数的溶液
在配制时,导致所配溶液溶质质量分数偏大的主要原因:
1.用量筒量取水时,俯视读数。
配制一定溶质质量分数的溶液
2.将量筒中的水倒入烧杯时,有少 量水洒出。
1.称量药品时,药品和砝码放颠倒了。
在配制时,导致所配溶液溶质质量分数偏小的主要原因:
配制一定溶质质量分数的溶液
2.用量筒量取水时,仰视读数。
3.将食盐倒入烧杯时,有少量食盐洒落了。
4.配制所用的烧杯不干燥。
(用到游码时)
1.配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是( )
A.①②③④⑤ B. ④⑤①②③
C.③④①②⑤ D. ②①④③⑤
B
课堂练习
2.要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
D
课堂练习
3.在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的是( )
A.用托盘天平称量氯化钠时,将砝码放在左盘,但未使用游码
B.将量筒中的水倒入烧杯时,有水洒出
C.用量筒量取蒸馏水读数时,仰视凹液面的最低处
D.将配好的氯化钠溶液转移到细口瓶时,不慎撒出部分溶液
C
课堂练习
同课章节目录
