四川省内江市威远县高中2020-2021学年高一下学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 四川省内江市威远县高中2020-2021学年高一下学期期中考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 737.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-26 20:38:03 | ||
图片预览




文档简介
威远中学高2020级高一下学期半期考试
化学试题
本试卷分为第Ⅰ卷和第Ⅱ卷两部分,共100分。考试时间为80分钟。
注意事项:
1.考生务必将自己的“班级”、“考号”和“姓名”写在答题卡相应的位置上,只交答题卡。
3.可能用到的相对原子质量:H—1 C—12 N—14 O—16 F—19 Na—23 Mg—24 S—32 Cl—35.5 K—39 Ca—40 Mn—55 Fe—56 Cu—64 Br—80 Ag—108 Ba—137
第Ⅰ卷(选择题 共48分)
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
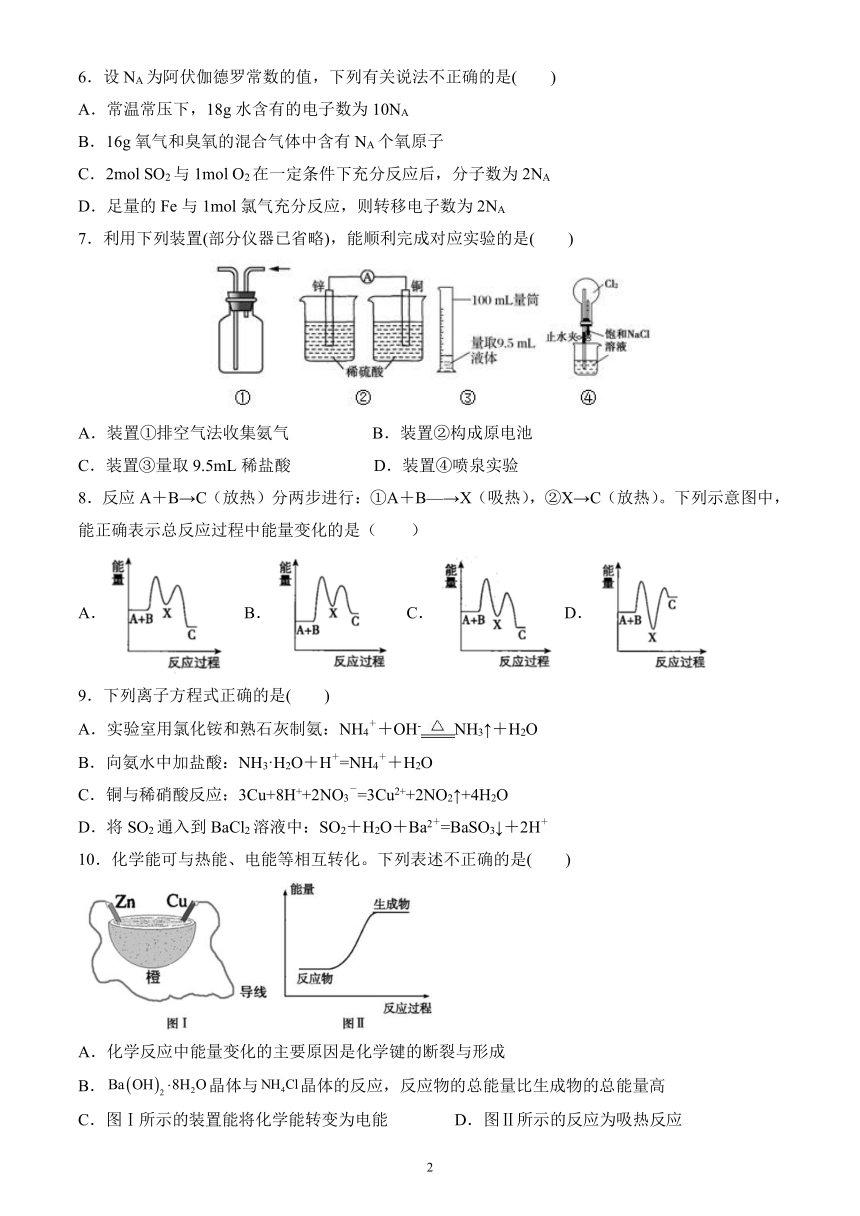
1.中国女科学家吴健雄使用,证明了李政道和杨振宁提出的弱相互作用,关于下列说法正确的是( )
A.核电荷数为33 B.中子数与质子数之差为6
C.中子数为27 D.相对原子量为60
2.下列关于元素周期表说法错误的是( )
A.现行元素周期表中一共有18列,16个族
B.现行元素周期表一共有七行,七个周期
C.已发现的100多种元素中,绝大多数是金属元素
D.在元素周期表的右上角寻找制半导体材料的元素
3.在2A(s)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.7mol·L-1·s-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.8mol·L-1·s-1 D.v(D)=60mol·L-1·min-1
4.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 ① ② ③ ④
装置
部分实验现象 a极质量减小;
b极质量增加 b极有气体产生;
c极无变化 d极溶解;
c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
5.化学用语是学习化学的基础工具,下列化学用语描述正确的是( )
A.中子数为10的氧原子可表示为 B.CO2 的电子式为:
C.用电子式表示 HCl 的形成过程为:H·+ D.HClO分子的结构式H—Cl—O
6.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A.常温常压下,18g水含有的电子数为10NA
B.16g氧气和臭氧的混合气体中含有NA个氧原子
C.2mol SO2与1mol O2在一定条件下充分反应后,分子数为2NA
D.足量的Fe与1mol氯气充分反应,则转移电子数为2NA
7.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
A.装置①排空气法收集氨气 B.装置②构成原电池
C.装置③量取9.5mL稀盐酸 D.装置④喷泉实验
8.反应A+B→C(放热)分两步进行:①A+B—→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A. B. C.D.
9.下列离子方程式正确的是( )
A.实验室用氯化铵和熟石灰制氨:NH4++OH-NH3↑+H2O
B.向氨水中加盐酸:NH3·H2O+H+=NH4++H2O
C.铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O
D.将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+
10.化学能可与热能、电能等相互转化。下列表述不正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.晶体与晶体的反应,反应物的总能量比生成物的总能量高
C.图Ⅰ所示的装置能将化学能转变为电能 D.图Ⅱ所示的反应为吸热反应
11.当2SO2+O22SO3 达到平衡后,通入18O2一定时间后,18O存在于( )
A.三氧化硫、氧气 B.二氧化硫、三氧化硫、氧气
C.二氧化硫、氧气 D.二氧化硫、三氧化硫
12.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At2)为有色固体;HAt 不稳定;AgAt 不溶于水也不溶于稀硝酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒、比 H2S 稳定的气体
13.一定量的锌粉和6mol·L-1 的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
A.①②④ B.①③⑤ C.③④⑤ D.①③④
14.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的( )
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X15.下列叙述正确的是( )
A.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
B.化学反应中的能量变化都是以热量的形式体现
C.CCl4和PCl3分子中所有原子的最外层都达到了8电子稳定结构
D.凡吸热反应均需在加热条件下才能发生
16.某同学设计了如图所示的原电池,发现一开始电流计指针偏向铝,随后又转而偏向镁。下列说法不正确的是( )
A.镁比铝活泼,始终作负极,发生氧化反应
B.最终铝电极逐渐溶解,镁电极表面出现大量气泡
C.电流计指针偏转方向改变后,溶液中OH-流向铝电极
D.铝电极的电极反应式:
17.下列说法正确的是( )
①化学键可以存在于原子之间也可以存在于分子之间; ②化学键断裂,不一定发生化学变化;
③物质中一定存在化学键; ④两种非金属元素形成的化合物可能含离子键;
⑤离子化合物可能含有共价键; ⑥共价化合物中可能有离子键
A.①②③ B.②④⑤ C. ②⑤ D.①②⑤
18.下列关于四种装置的叙述不正确的是( )
A.电池Ⅰ:铜表面产生气泡 B.电池Ⅱ:锌筒作负极,被氧化
C.电池Ⅲ:是充电电池,属于二次电池 D.电池Ⅳ:外电路中电流由电极a通过导线流向电极b
19.在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是( )
A.t1时,Y的浓度是X的浓度的2倍
B.反应的化学方程式为X2Y
C.t2时,反应的正、逆反应速率相等,达到平衡状态
D.t3时,X、Y的量不再变化,化学反应停止了,正、逆反应速率为零
20.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个。下列说法错误的是( )
A.原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y
C.ZX3的水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
21.下列实验操作、实验现象、解释或结论不对应的是( )
选项 实验操作 实验现象 解释或结论
A 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 产生大量白烟 氨与氯化氢反应生成固体物质
B 常温下,将洁净的铁片放入浓硫酸或浓硝酸中 无明显变化 常温下,浓硫酸、浓硝酸使铁片钝化
C 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 产生苍白色火焰 物质燃烧不一定需要氧气
D 向某无色溶液中滴加盐酸 产生能使澄清石灰水变浑浊的气体 说明溶液中一定含有CO
22.下列说法中不正确的是( )
A.X+Y=M+N为放热反应,可推知X和Y的总能量一定高于M和N的总能量
B.1molSO2的键能总和大于1mol硫和1mol氧气的键能之和
C.因为石墨变成金刚石吸热,所以金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
23.有600mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验
①向第一份中加入AgNO3溶液,有沉淀产生;
②向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol(能使湿润的红色石蕊试纸变蓝);
③向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测错误的是( )
A.K+一定存在 B.Ba2+、Mg2+一定不存
C.Cl- 一定存在 D.混合溶液中的浓度为0.1 mol/L
24.CuS、Cu2S用于处理酸性废水中的Cr2O反应如下:
反应I: CuS+Cr2O+H+ →Cu2++SO+Cr3++H2O(未配平)
反应II:Cu2S+ Cr2O+H+→Cu2++SO+Cr3++H2O(未配平)
下列说法正确的是( )
A.反应I和II中各有2种元素的化合价发生变化
B.反应II中还原剂与氧化剂的物质的量之比为3:5
C.处理1molCr2O72-时反应I、II中消耗H+的物质的量相等
D.质量相同时,Cu2S能去除更多的Cr2O72-
第Ⅱ卷(非选择题 共52分)
本卷共5个小题,第25题11分,第26题10分,第27题12分,第28题9分,第29题10分,共52分。
25.(11分)完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①O、O、O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥K、Ca、Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)H2O的摩尔质量为____________,相同质量的H2O与H2O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的H2O和H2O时产生的氢气在同温同压下体积之比为______,质量之比为_______。
26.(10分)根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化的曲线如图所示:
(1)该反应的化学方程式为__________________________________。
(2)反应开始至4 min时,A的平均反应速率为______________。
(3)4 min时,反应是否达平衡状态?_______(填“是”或“否”),8 min时,
v正_______(填“>”“<”或“=”)v逆。
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为________________________。
(2)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________。
②反应达到平衡时,放出的热量_______(填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(3)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为_______。
A.压强不变 B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2 D.混合气体的质量不变
27.(12分)(1)已知:2H2+O22H2O。该反应1g氢气完全燃烧放出热量121.6kJ,其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH-O键放出热量_____________。
燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_________________________________________。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(3)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。请回答:
①a极电极反应式为___________________________________;
②工作时,O2-由电极________向电极________移动(填“a”或“b”);
③电子由电极________通过传感器流向电极________(填“a”或“b”)。
28.(9分)A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是_______________,E2D2的电子式为_______________。
(2)AFD的结构式为____________。
(3)元素D、E、F形成的简单离子的半径由大到小为_________________(用离子符号表示)。
(4)B、D的最简单气态氢化物的稳定性:____________(用化学式表示)。
(5)设计一个简单的实验证明F和B的非金属性强弱:___________________________________
____________(用化学方程式表示)。
29.(10分)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 10 mL 5% H2O2溶液 无
③ 10 mL 5% H2O2溶液+1 mL H2O 1 mL 0.1 mol·L-1FeCl3溶液
④ 10 mL 5% H2O2溶液+1 mL HCl溶液 1 mL 0.1 mol·L-1FeCl3溶液
⑤ 10 mL 5% H2O2溶液+1 mL NaOH溶液 1 mL 0.1 mol·L-1FeCl3溶液
(1)实验①和②的目的是______________________________________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________________________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是_________________________________________________________。
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2状态 触摸试管情况 观察结果 反应完成所需时间
粉末状 很烫 剧烈反应,带火星的木条复燃 4 min
块状 微热 反应较慢,火星红亮但木条未复燃 30 min
(1)写出大试管中发生反应的化学方程式:_______________________________________________,该反应是______反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与___________________有关。
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:_______________________________________________________________________,计算H2O2的初始物质的量浓度为___________。(保留两位有效数字)
威远中学高2020级高一下学期半期考试
化学试题答案解析
选择题
题号 1 2 3 4 5 6 7 8
答案 B D B C C C A A
题号 9 10 11 12 13 14 15 16
答案 B B B D B B C A
题号 17 18 19 20 21 22 23 24
答案 B D A D D C C B
25.(11分)
(1)cd(1分)
(2)①⑤(1分) ③(1分) 18(1分) 7(1分) T218O或218O(1分)
(3)20 g·mol-1(1分) 11∶10(1分) 11∶12(1分)
(4)10∶9(1分) 5∶9 (1分)
【详解】(1)10Be和9Be互为同位素,它们的质子数相同,中子数和质量数不同,不是同一种原子;但是他们都是Be元素的原子,化学性质相同,具有相同的核外电子排布,故选cd;
(2)①O、O、O这三种原子质子数都是8,中子数不同,它们都是氧元素的同位素;②H2O、D2O,它们不是原子,也不是单质,不是同位素或同素异形体的研究范畴;③石墨、金刚石都是碳元素的单质,互为同素异形体;④H2、D2、T2分别是、、形成的氢气单质,它们不是原子,却是同一种物质,所以它们不是同位素或同素异形体的研究范畴;⑤H、D、T分别是、、,它们的质子数都是1,中子数不同,它们都是氢元素的同位素;⑥K、Ca、Ar,它们的质子数不同,故彼此不是同位素;故a、互为同位素的是①⑤,b、互为同素异形体的是③;c、由①(O、O、O)和⑤(H、D、T)中的微粒能结合成水,由于水分子中有两个氢原子和一个氧原子,且这两个氢原子可以是不同种类的,则氢原子的“搭配”有6种,故可形成水分子的种数为18(=6×3)种;可得相对分子质量不同的水分子种数为7种,相对分子质量分别是18(H216O)、19(HD16O、H217O)、20(D216O、HT16O、HD17O、H218O)、21(DT16O、D217O、HT17O、HD18O)、22(T216O、DT17O、D218O、HT18O)、23(T217O、DT18O)、24(T218O);相对分子质量最大的是T218O;
(3)H2O的摩尔质量为[(2×2)+16]g·mol-1=20g·mol-1;M(H2O)=22g·mol-1,1个H216O分子含10个质子和10个中子,1个H218O分子含10个质子和12个中子,假设H216O与H218O各有1g,则1g的H216O与1g的H218O的质子数比为():()=11:10,中子数比为():()=11:12;
(4)假设H2O和H2O各有1g,M(H2O)=18g·mol-1,M(H2O)=20g·mol-1,则n(H2O)=mol,n(H2O)=mol,则产生氢气,n(H2)=mol,n(H2)=mol,根据阿伏加德罗定律可知,两种氢气在同温同压下的体积为:=10:9,质量比为(×2):(×4)=5:9。
26.(10分)
I.(1)2AB(1分) (2)0.05mol/(L?min) (1分) (3)否(1分) = (1分)
II. t2-t3 、 t4-t5(1分) (2)50%(2分) B(1分)
(3)AB(2分)(选对1个给1分,错选不给分)
【详解】Ⅰ.(1)从图像可以看出,在反应过程中,A的物质的量减小,为反应物,B的物质的量增加,为生成物。从开始到4min时,A的物质的量从0.8mol减小到0.4mol,减小了0.4mol,B的物质的量从0.2mol增加到0.4mol,增加了0.2mol。A和B变化的物质的量之比为0.4mol:0.2mol=2:1,变化的物质的量之比等于方程式的系数比,同时可以从图像中看出,8min后,A和B的物质的量不再变化,说明该反应是可逆反应,8min后,反应达到了平衡状态,则反应的化学方程式为:2A B。
(2)从开始到4min时,消耗的A的物质的量为0.4mol,容器体积为2L,则消耗的A的物质的量浓度为0.2mol/L,用A表示的反应速率为=0.05mol/(L?min)。
(3)4min时,A和B的物质的量仍在变化,所以没有达到平衡状态。8min时,A和B的物质的量不再变化,达到了平衡状态,则v正=v逆。
Ⅱ.(1)正逆反应速率相等时,反应达到平衡状态,所以处于化学平衡状态的时间段为t2-t3和t4-t5。
(2)①起始时容器中共有气体10mol,平衡时压强为开始时的80%,在恒温恒容的容器中,压强之比等于物质的量之比,则平衡时混合气的总的物质的量为10mol×80%=8mol,比起始时减小了2mol,根据合成氨反应的方程式可知,反应中变化的物质的量即为生成氨气的物质的量,所以生成氨气2mol,则消耗了1mol氮气,所以氮气的转化率为=50%。②已知每生成2 mol NH3,放出92.4 kJ的热量。该反应中生成了2 mol NH3,所以放出92.4 kJ的热量,故选B。
(3)A.该反应前后气体系数之和不相等,即反应前后气体物质的量有变化,所以反应前后压强会发生变化,当压强不变时,反应达到了化学平衡,故A选;B.该反应在绝热条件下进行,当体系温度不变时,反应达到了化学平衡,故B选;C.N2、H2、NH3的分子数之比为1:3:2,和反应是否平衡无关,故C不选;
D.反应物和生成物均为气体,混合气的总质量一直不变,所以混合气体质量不变不能证明反应达到了化学平衡,故D不选;故选AB。
27.(12分)
(1)463.6kJ (2分)
(2)①正(1分) ②O2+4H++4e-=2H2O(1分) ③负(1分) 正(1分) ④22.4 L(1分)
(3)①CO+O2--2e-=CO2(1分) ②b(1分) a(1分) ③a(1分) b(1分)
【详解】(1)1g氢气完全燃烧放出热量121.6kJ,则2mol氢气即4g氢气完全燃烧放出热量为4×121.6kJ=486.4kJ;其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,因此有2×436+496-2×2×x=-486.4,解得x=463.6,即形成1molH-O键放出热量为463.6kJ;
(2)由图可知A为燃料电池的正极,电极反应为O2+4H++4e-=2H2O;B为燃料电池的负极,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+;放电过程中,H+由负极区向正极区移动;葡萄糖燃料电池的总反应为C6H12O6+6O2=6CO2+6H2O,即1 mol O2~1 mol CO2,每消耗1 mol O2,理论上生成标准状况下CO2气体22.4 L;故答案为:正;O2+4H++4e-=2H2O;负;正;22.4L;
(3)①由元素价态变化可知,a电极为负极,电极反应式为CO+O2--2e-=CO2;
②b电极为正极,电极反应式为O2+4e-=2O2-,总反应为2CO+O2=2CO2,O2-由电极b向电极a移动;
③工作时电子由负极向正极移动,电子由电极a通过传感器流向电极b;
故答案为:CO+O2--2e-=CO2;b;a;a;b。
28.(9分)(1)第三周期ⅦA族(1分) (2分)
(2)H-O-Cl(1分) (3)Cl->O2->Na+(2分)
(4)H2O>CH4(1分) (5)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O(2分)
【分析】A、B、C、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,E处于IA族,D处于ⅥA族,则E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为C元素;C的原子序数介于碳、氧之间,则C为N元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl,以此解答该题。
【详解】(1)F为Cl,位于第三周期ⅦA族;E2D2为过氧化钠,属于离子化合物,其电子式为;
(2)AFD为HClO,其结构式为H-O-Cl;
(3)元素D、E、F形成的简单离子分别为O2-、Na+、Cl-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->O2->Na+;
(4)氧元素非金属性强于碳元素,则B、D的最简单气态氢化物的稳定性为H2O>CH4;
(5)高氯酸可以制备二氧化碳,可证明F和B的非金属性强弱,方程式为Na2CO3+2HClO4=2NaClO4+CO2↑+H2O。
29.(10分)I.(1)探究反应物浓度对反应速率的影响(1分)
向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(1分)
(2)碱性环境能增大H2O2的分解速率,酸性环境能减小H2O2的分解速率(2分)
(答对1点给1分)
II.(1)2H2O22H2O+O2↑(1分) 放热(1分)
(2)催化剂的接触面积(1分)
(3)随着反应的进行,反应物浓度减小,反应速率减慢(1分) 0.11 mol·L-1 (2分)
【解析】Ⅰ.(1)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;(2)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答;
Ⅱ. (1)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;由实验现象可知,反应放热还是吸热;(2)由实验现象可知催化剂作用大小的影响因素;(3)随着反应的进行,反应物的浓度不断减小,据此分析原因;根据图象可以看出H2O2完全反应放出60 mL O2,根据化学方程式进行计算。
【详解】Ⅰ. (1)实验①和②的浓度不同,则该实验的目的为探究反应物浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中);
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,在酸性环境能减小H2O2分解的速率;
Ⅱ. (1)H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O22H2O+O2↑;根据触摸试管的感觉可知,该反应为放热反应;
(2)因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明催化剂的接触面积对反应速率有影响,故答案为:催化剂的接触面积;
(3)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O22H2O+O2↑,则:n(H2O2)=≈0.00536 mol,所以H2O2的初始物质的量浓度为:c(H2O2)=≈0.11 mol/L,
故答案为:随着反应的进行,反应物浓度减小,反应速率减慢;0.11 mol·L-1。
12
化学试题
本试卷分为第Ⅰ卷和第Ⅱ卷两部分,共100分。考试时间为80分钟。
注意事项:
1.考生务必将自己的“班级”、“考号”和“姓名”写在答题卡相应的位置上,只交答题卡。
3.可能用到的相对原子质量:H—1 C—12 N—14 O—16 F—19 Na—23 Mg—24 S—32 Cl—35.5 K—39 Ca—40 Mn—55 Fe—56 Cu—64 Br—80 Ag—108 Ba—137
第Ⅰ卷(选择题 共48分)
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
1.中国女科学家吴健雄使用,证明了李政道和杨振宁提出的弱相互作用,关于下列说法正确的是( )
A.核电荷数为33 B.中子数与质子数之差为6
C.中子数为27 D.相对原子量为60
2.下列关于元素周期表说法错误的是( )
A.现行元素周期表中一共有18列,16个族
B.现行元素周期表一共有七行,七个周期
C.已发现的100多种元素中,绝大多数是金属元素
D.在元素周期表的右上角寻找制半导体材料的元素
3.在2A(s)+B(g)?3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.7mol·L-1·s-1 B.v(B)=0.3mol·L-1·s-1
C.v(C)=0.8mol·L-1·s-1 D.v(D)=60mol·L-1·min-1
4.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验 ① ② ③ ④
装置
部分实验现象 a极质量减小;
b极质量增加 b极有气体产生;
c极无变化 d极溶解;
c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
5.化学用语是学习化学的基础工具,下列化学用语描述正确的是( )
A.中子数为10的氧原子可表示为 B.CO2 的电子式为:
C.用电子式表示 HCl 的形成过程为:H·+ D.HClO分子的结构式H—Cl—O
6.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A.常温常压下,18g水含有的电子数为10NA
B.16g氧气和臭氧的混合气体中含有NA个氧原子
C.2mol SO2与1mol O2在一定条件下充分反应后,分子数为2NA
D.足量的Fe与1mol氯气充分反应,则转移电子数为2NA
7.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
A.装置①排空气法收集氨气 B.装置②构成原电池
C.装置③量取9.5mL稀盐酸 D.装置④喷泉实验
8.反应A+B→C(放热)分两步进行:①A+B—→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A. B. C.D.
9.下列离子方程式正确的是( )
A.实验室用氯化铵和熟石灰制氨:NH4++OH-NH3↑+H2O
B.向氨水中加盐酸:NH3·H2O+H+=NH4++H2O
C.铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O
D.将SO2通入到BaCl2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+
10.化学能可与热能、电能等相互转化。下列表述不正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与形成
B.晶体与晶体的反应,反应物的总能量比生成物的总能量高
C.图Ⅰ所示的装置能将化学能转变为电能 D.图Ⅱ所示的反应为吸热反应
11.当2SO2+O22SO3 达到平衡后,通入18O2一定时间后,18O存在于( )
A.三氧化硫、氧气 B.二氧化硫、三氧化硫、氧气
C.二氧化硫、氧气 D.二氧化硫、三氧化硫
12.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At2)为有色固体;HAt 不稳定;AgAt 不溶于水也不溶于稀硝酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒、比 H2S 稳定的气体
13.一定量的锌粉和6mol·L-1 的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓硫酸
A.①②④ B.①③⑤ C.③④⑤ D.①③④
14.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的( )
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X
A.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
B.化学反应中的能量变化都是以热量的形式体现
C.CCl4和PCl3分子中所有原子的最外层都达到了8电子稳定结构
D.凡吸热反应均需在加热条件下才能发生
16.某同学设计了如图所示的原电池,发现一开始电流计指针偏向铝,随后又转而偏向镁。下列说法不正确的是( )
A.镁比铝活泼,始终作负极,发生氧化反应
B.最终铝电极逐渐溶解,镁电极表面出现大量气泡
C.电流计指针偏转方向改变后,溶液中OH-流向铝电极
D.铝电极的电极反应式:
17.下列说法正确的是( )
①化学键可以存在于原子之间也可以存在于分子之间; ②化学键断裂,不一定发生化学变化;
③物质中一定存在化学键; ④两种非金属元素形成的化合物可能含离子键;
⑤离子化合物可能含有共价键; ⑥共价化合物中可能有离子键
A.①②③ B.②④⑤ C. ②⑤ D.①②⑤
18.下列关于四种装置的叙述不正确的是( )
A.电池Ⅰ:铜表面产生气泡 B.电池Ⅱ:锌筒作负极,被氧化
C.电池Ⅲ:是充电电池,属于二次电池 D.电池Ⅳ:外电路中电流由电极a通过导线流向电极b
19.在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是( )
A.t1时,Y的浓度是X的浓度的2倍
B.反应的化学方程式为X2Y
C.t2时,反应的正、逆反应速率相等,达到平衡状态
D.t3时,X、Y的量不再变化,化学反应停止了,正、逆反应速率为零
20.X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个。下列说法错误的是( )
A.原子半径:Z<Y<M
B.最高价氧化物对应水化物的酸性:Z>Y
C.ZX3的水溶液呈碱性
D.X、Z和Q三种元素形成的化合物一定是共价化合物
21.下列实验操作、实验现象、解释或结论不对应的是( )
选项 实验操作 实验现象 解释或结论
A 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 产生大量白烟 氨与氯化氢反应生成固体物质
B 常温下,将洁净的铁片放入浓硫酸或浓硝酸中 无明显变化 常温下,浓硫酸、浓硝酸使铁片钝化
C 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 产生苍白色火焰 物质燃烧不一定需要氧气
D 向某无色溶液中滴加盐酸 产生能使澄清石灰水变浑浊的气体 说明溶液中一定含有CO
22.下列说法中不正确的是( )
A.X+Y=M+N为放热反应,可推知X和Y的总能量一定高于M和N的总能量
B.1molSO2的键能总和大于1mol硫和1mol氧气的键能之和
C.因为石墨变成金刚石吸热,所以金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
23.有600mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验
①向第一份中加入AgNO3溶液,有沉淀产生;
②向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol(能使湿润的红色石蕊试纸变蓝);
③向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测错误的是( )
A.K+一定存在 B.Ba2+、Mg2+一定不存
C.Cl- 一定存在 D.混合溶液中的浓度为0.1 mol/L
24.CuS、Cu2S用于处理酸性废水中的Cr2O反应如下:
反应I: CuS+Cr2O+H+ →Cu2++SO+Cr3++H2O(未配平)
反应II:Cu2S+ Cr2O+H+→Cu2++SO+Cr3++H2O(未配平)
下列说法正确的是( )
A.反应I和II中各有2种元素的化合价发生变化
B.反应II中还原剂与氧化剂的物质的量之比为3:5
C.处理1molCr2O72-时反应I、II中消耗H+的物质的量相等
D.质量相同时,Cu2S能去除更多的Cr2O72-
第Ⅱ卷(非选择题 共52分)
本卷共5个小题,第25题11分,第26题10分,第27题12分,第28题9分,第29题10分,共52分。
25.(11分)完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①O、O、O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥K、Ca、Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)H2O的摩尔质量为____________,相同质量的H2O与H2O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的H2O和H2O时产生的氢气在同温同压下体积之比为______,质量之比为_______。
26.(10分)根据化学反应速率和化学反应限度的知识回答下列问题:
Ⅰ.某温度时,在2 L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化的曲线如图所示:
(1)该反应的化学方程式为__________________________________。
(2)反应开始至4 min时,A的平均反应速率为______________。
(3)4 min时,反应是否达平衡状态?_______(填“是”或“否”),8 min时,
v正_______(填“>”“<”或“=”)v逆。
Ⅱ.氢气是合成氨的重要原料,合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g),该反应为放热反应,且每生成2 mol NH3,放出92.4 kJ的热量。当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为________________________。
(2)在一定温度下,向一个容积为1 L的容器中通入2 mol氮气和8 mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%。
①N2的转化率为___________。
②反应达到平衡时,放出的热量_______(填字母,下同)。
A.小于92.4 kJ B.等于92.4 kJ C.大于92.4 kJ D.可能大于、小于或等于92.4 kJ
(3)若该反应在绝热条件下进行,下列能证明反应已达化学平衡的为_______。
A.压强不变 B.体系的温度不变
C.N2、H2、NH3的分子数之比为1:3:2 D.混合气体的质量不变
27.(12分)(1)已知:2H2+O22H2O。该反应1g氢气完全燃烧放出热量121.6kJ,其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH-O键放出热量_____________。
燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_________________________________________。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(3)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。请回答:
①a极电极反应式为___________________________________;
②工作时,O2-由电极________向电极________移动(填“a”或“b”);
③电子由电极________通过传感器流向电极________(填“a”或“b”)。
28.(9分)A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是_______________,E2D2的电子式为_______________。
(2)AFD的结构式为____________。
(3)元素D、E、F形成的简单离子的半径由大到小为_________________(用离子符号表示)。
(4)B、D的最简单气态氢化物的稳定性:____________(用化学式表示)。
(5)设计一个简单的实验证明F和B的非金属性强弱:___________________________________
____________(用化学方程式表示)。
29.(10分)氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ. 某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 10 mL 5% H2O2溶液 无
③ 10 mL 5% H2O2溶液+1 mL H2O 1 mL 0.1 mol·L-1FeCl3溶液
④ 10 mL 5% H2O2溶液+1 mL HCl溶液 1 mL 0.1 mol·L-1FeCl3溶液
⑤ 10 mL 5% H2O2溶液+1 mL NaOH溶液 1 mL 0.1 mol·L-1FeCl3溶液
(1)实验①和②的目的是______________________________________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是__________________________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如图1所示。分析该图能够得出的实验结论是_________________________________________________________。
Ⅱ. MnO2对H2O2的分解有催化作用,某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将状态不同的0.1 g MnO2分别加入盛有50 mL等浓度的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2状态 触摸试管情况 观察结果 反应完成所需时间
粉末状 很烫 剧烈反应,带火星的木条复燃 4 min
块状 微热 反应较慢,火星红亮但木条未复燃 30 min
(1)写出大试管中发生反应的化学方程式:_______________________________________________,该反应是______反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与___________________有关。
(3)实验过程中放出气体的体积(标准状况)和时间的关系如图3所示。解释反应速率变化的原因:_______________________________________________________________________,计算H2O2的初始物质的量浓度为___________。(保留两位有效数字)
威远中学高2020级高一下学期半期考试
化学试题答案解析
选择题
题号 1 2 3 4 5 6 7 8
答案 B D B C C C A A
题号 9 10 11 12 13 14 15 16
答案 B B B D B B C A
题号 17 18 19 20 21 22 23 24
答案 B D A D D C C B
25.(11分)
(1)cd(1分)
(2)①⑤(1分) ③(1分) 18(1分) 7(1分) T218O或218O(1分)
(3)20 g·mol-1(1分) 11∶10(1分) 11∶12(1分)
(4)10∶9(1分) 5∶9 (1分)
【详解】(1)10Be和9Be互为同位素,它们的质子数相同,中子数和质量数不同,不是同一种原子;但是他们都是Be元素的原子,化学性质相同,具有相同的核外电子排布,故选cd;
(2)①O、O、O这三种原子质子数都是8,中子数不同,它们都是氧元素的同位素;②H2O、D2O,它们不是原子,也不是单质,不是同位素或同素异形体的研究范畴;③石墨、金刚石都是碳元素的单质,互为同素异形体;④H2、D2、T2分别是、、形成的氢气单质,它们不是原子,却是同一种物质,所以它们不是同位素或同素异形体的研究范畴;⑤H、D、T分别是、、,它们的质子数都是1,中子数不同,它们都是氢元素的同位素;⑥K、Ca、Ar,它们的质子数不同,故彼此不是同位素;故a、互为同位素的是①⑤,b、互为同素异形体的是③;c、由①(O、O、O)和⑤(H、D、T)中的微粒能结合成水,由于水分子中有两个氢原子和一个氧原子,且这两个氢原子可以是不同种类的,则氢原子的“搭配”有6种,故可形成水分子的种数为18(=6×3)种;可得相对分子质量不同的水分子种数为7种,相对分子质量分别是18(H216O)、19(HD16O、H217O)、20(D216O、HT16O、HD17O、H218O)、21(DT16O、D217O、HT17O、HD18O)、22(T216O、DT17O、D218O、HT18O)、23(T217O、DT18O)、24(T218O);相对分子质量最大的是T218O;
(3)H2O的摩尔质量为[(2×2)+16]g·mol-1=20g·mol-1;M(H2O)=22g·mol-1,1个H216O分子含10个质子和10个中子,1个H218O分子含10个质子和12个中子,假设H216O与H218O各有1g,则1g的H216O与1g的H218O的质子数比为():()=11:10,中子数比为():()=11:12;
(4)假设H2O和H2O各有1g,M(H2O)=18g·mol-1,M(H2O)=20g·mol-1,则n(H2O)=mol,n(H2O)=mol,则产生氢气,n(H2)=mol,n(H2)=mol,根据阿伏加德罗定律可知,两种氢气在同温同压下的体积为:=10:9,质量比为(×2):(×4)=5:9。
26.(10分)
I.(1)2AB(1分) (2)0.05mol/(L?min) (1分) (3)否(1分) = (1分)
II. t2-t3 、 t4-t5(1分) (2)50%(2分) B(1分)
(3)AB(2分)(选对1个给1分,错选不给分)
【详解】Ⅰ.(1)从图像可以看出,在反应过程中,A的物质的量减小,为反应物,B的物质的量增加,为生成物。从开始到4min时,A的物质的量从0.8mol减小到0.4mol,减小了0.4mol,B的物质的量从0.2mol增加到0.4mol,增加了0.2mol。A和B变化的物质的量之比为0.4mol:0.2mol=2:1,变化的物质的量之比等于方程式的系数比,同时可以从图像中看出,8min后,A和B的物质的量不再变化,说明该反应是可逆反应,8min后,反应达到了平衡状态,则反应的化学方程式为:2A B。
(2)从开始到4min时,消耗的A的物质的量为0.4mol,容器体积为2L,则消耗的A的物质的量浓度为0.2mol/L,用A表示的反应速率为=0.05mol/(L?min)。
(3)4min时,A和B的物质的量仍在变化,所以没有达到平衡状态。8min时,A和B的物质的量不再变化,达到了平衡状态,则v正=v逆。
Ⅱ.(1)正逆反应速率相等时,反应达到平衡状态,所以处于化学平衡状态的时间段为t2-t3和t4-t5。
(2)①起始时容器中共有气体10mol,平衡时压强为开始时的80%,在恒温恒容的容器中,压强之比等于物质的量之比,则平衡时混合气的总的物质的量为10mol×80%=8mol,比起始时减小了2mol,根据合成氨反应的方程式可知,反应中变化的物质的量即为生成氨气的物质的量,所以生成氨气2mol,则消耗了1mol氮气,所以氮气的转化率为=50%。②已知每生成2 mol NH3,放出92.4 kJ的热量。该反应中生成了2 mol NH3,所以放出92.4 kJ的热量,故选B。
(3)A.该反应前后气体系数之和不相等,即反应前后气体物质的量有变化,所以反应前后压强会发生变化,当压强不变时,反应达到了化学平衡,故A选;B.该反应在绝热条件下进行,当体系温度不变时,反应达到了化学平衡,故B选;C.N2、H2、NH3的分子数之比为1:3:2,和反应是否平衡无关,故C不选;
D.反应物和生成物均为气体,混合气的总质量一直不变,所以混合气体质量不变不能证明反应达到了化学平衡,故D不选;故选AB。
27.(12分)
(1)463.6kJ (2分)
(2)①正(1分) ②O2+4H++4e-=2H2O(1分) ③负(1分) 正(1分) ④22.4 L(1分)
(3)①CO+O2--2e-=CO2(1分) ②b(1分) a(1分) ③a(1分) b(1分)
【详解】(1)1g氢气完全燃烧放出热量121.6kJ,则2mol氢气即4g氢气完全燃烧放出热量为4×121.6kJ=486.4kJ;其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,因此有2×436+496-2×2×x=-486.4,解得x=463.6,即形成1molH-O键放出热量为463.6kJ;
(2)由图可知A为燃料电池的正极,电极反应为O2+4H++4e-=2H2O;B为燃料电池的负极,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+;放电过程中,H+由负极区向正极区移动;葡萄糖燃料电池的总反应为C6H12O6+6O2=6CO2+6H2O,即1 mol O2~1 mol CO2,每消耗1 mol O2,理论上生成标准状况下CO2气体22.4 L;故答案为:正;O2+4H++4e-=2H2O;负;正;22.4L;
(3)①由元素价态变化可知,a电极为负极,电极反应式为CO+O2--2e-=CO2;
②b电极为正极,电极反应式为O2+4e-=2O2-,总反应为2CO+O2=2CO2,O2-由电极b向电极a移动;
③工作时电子由负极向正极移动,电子由电极a通过传感器流向电极b;
故答案为:CO+O2--2e-=CO2;b;a;a;b。
28.(9分)(1)第三周期ⅦA族(1分) (2分)
(2)H-O-Cl(1分) (3)Cl->O2->Na+(2分)
(4)H2O>CH4(1分) (5)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O(2分)
【分析】A、B、C、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,E处于IA族,D处于ⅥA族,则E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为C元素;C的原子序数介于碳、氧之间,则C为N元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl,以此解答该题。
【详解】(1)F为Cl,位于第三周期ⅦA族;E2D2为过氧化钠,属于离子化合物,其电子式为;
(2)AFD为HClO,其结构式为H-O-Cl;
(3)元素D、E、F形成的简单离子分别为O2-、Na+、Cl-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:Cl->O2->Na+;
(4)氧元素非金属性强于碳元素,则B、D的最简单气态氢化物的稳定性为H2O>CH4;
(5)高氯酸可以制备二氧化碳,可证明F和B的非金属性强弱,方程式为Na2CO3+2HClO4=2NaClO4+CO2↑+H2O。
29.(10分)I.(1)探究反应物浓度对反应速率的影响(1分)
向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(1分)
(2)碱性环境能增大H2O2的分解速率,酸性环境能减小H2O2的分解速率(2分)
(答对1点给1分)
II.(1)2H2O22H2O+O2↑(1分) 放热(1分)
(2)催化剂的接触面积(1分)
(3)随着反应的进行,反应物浓度减小,反应速率减慢(1分) 0.11 mol·L-1 (2分)
【解析】Ⅰ.(1)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;(2)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答;
Ⅱ. (1)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;由实验现象可知,反应放热还是吸热;(2)由实验现象可知催化剂作用大小的影响因素;(3)随着反应的进行,反应物的浓度不断减小,据此分析原因;根据图象可以看出H2O2完全反应放出60 mL O2,根据化学方程式进行计算。
【详解】Ⅰ. (1)实验①和②的浓度不同,则该实验的目的为探究反应物浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中);
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,在酸性环境能减小H2O2分解的速率;
Ⅱ. (1)H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O22H2O+O2↑;根据触摸试管的感觉可知,该反应为放热反应;
(2)因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明催化剂的接触面积对反应速率有影响,故答案为:催化剂的接触面积;
(3)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O22H2O+O2↑,则:n(H2O2)=≈0.00536 mol,所以H2O2的初始物质的量浓度为:c(H2O2)=≈0.11 mol/L,
故答案为:随着反应的进行,反应物浓度减小,反应速率减慢;0.11 mol·L-1。
12
同课章节目录
