课题1 生活中常见的盐 盐的通性课件(共28张PPT)
文档属性
| 名称 | 课题1 生活中常见的盐 盐的通性课件(共28张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-26 22:01:35 | ||
图片预览





文档简介
(共28张PPT)
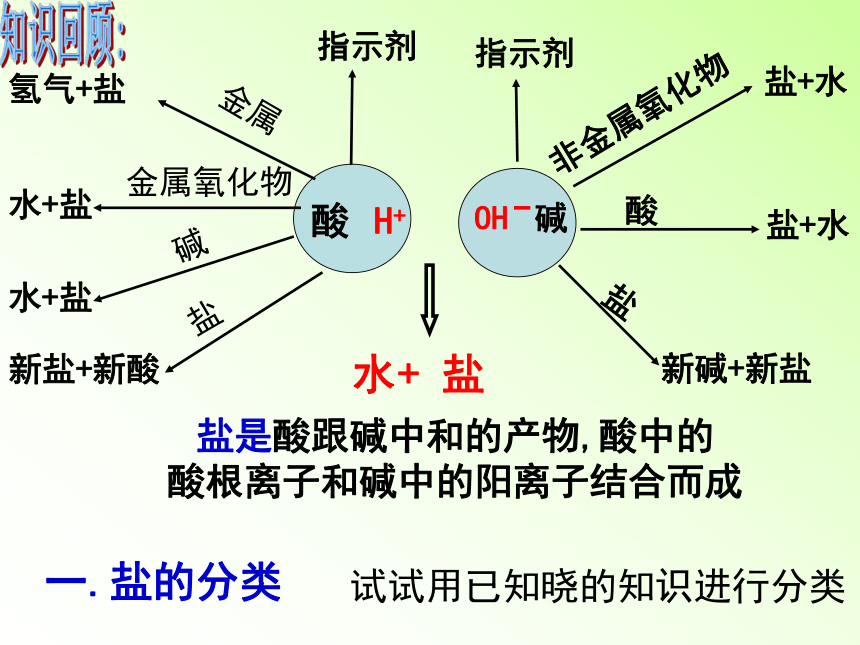
盐的通性
11.1生活中常见的盐
指示剂
金属
氢气+盐
金属氧化物
水+盐
水+盐
盐
新盐+新酸
H+
指示剂
盐+水
酸
碱
非金属氧化物
酸
盐
盐+水
新碱+新盐
OH
水
+
盐
盐是酸跟碱中和的产物,酸中的
酸根离子和碱中的阳离子结合而成
一.盐的分类
试试用已知晓的知识进行分类
碱
1.根据组成中是否含有H+或OH-氢氧根
酸与碱完全中和的产物,组成中不含H+或OH-盐,如NaCl、KNO3等。
酸中氢离子被碱部分中和的产物,组成中含H+的盐,如NaHCO3、KHSO4、Ca(H2PO4)2等。
碱中氢氧根离子被酸部分中和的产物,组成中含OH-的盐,如Mg(OH)Cl、Cu2(OH)2CO3等。
正盐
酸式盐
碱式盐
在酸名称的后面加个“氢”字,然后再读金属的名称。
“某化某”
、“某酸某”
在正盐的名称前边加“碱式”二字
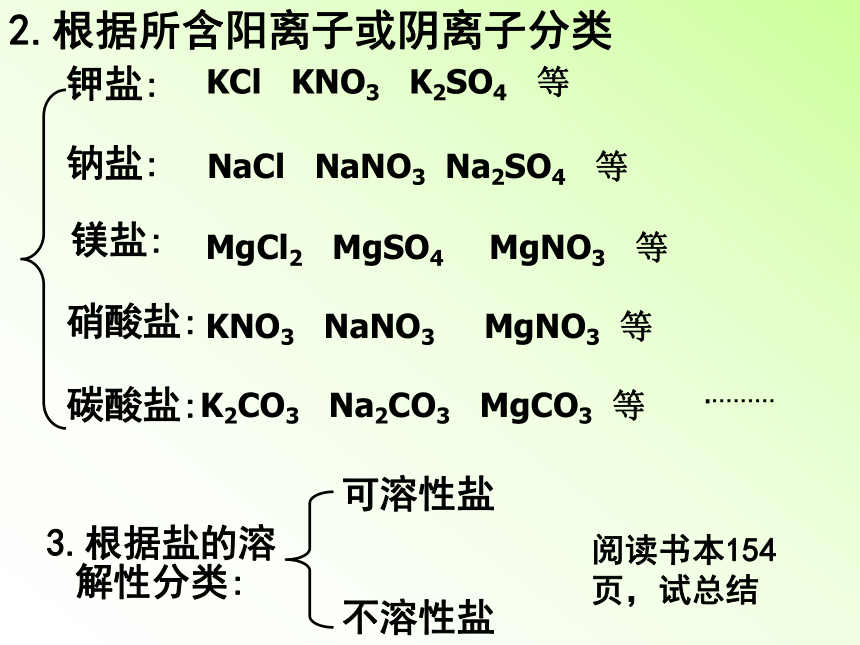
可溶性盐
不溶性盐
2.根据所含阳离子或阴离子分类
钾盐:
KCl
KNO3
K2SO4
等
钠盐:
镁盐:
硝酸盐:
碳酸盐:
……….
NaCl
NaNO3
Na2SO4
等
MgCl2
MgSO4
MgNO3
等
KNO3
NaNO3
MgNO3
等
K2CO3
Na2CO3
MgCO3
等
3.根据盐的溶解性分类:
阅读书本154页,试总结
溶碱钾钠钡钙铵
大多酸溶于水中间
钾钠铵盐均易溶
硝酸盐遇水无影踪
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
硫酸盐微溶是银钙
二、盐的溶解性
(1)钾盐(含K+)、钠盐(含Na+)、铵盐(含NH4+)硝酸盐(含NO3-)都溶于水
(2)盐酸盐(除AgCl不溶)其余都溶于水
(3)硫酸盐(除BaSO4不溶);(CaSO4
、Ag2SO4
微溶)其余都溶于水
(4)碳酸盐(除K2CO3
、Na2CO3
、
(NH4)2CO3可溶),其余都不溶于水
根据溶解性口诀,判断下列物质的溶解性?
1.ZnSO4:
2.AgCl:________
3.NaNO3:________
4.K2CO3:________
5.BaSO4:________
6.BaCl2:________
7.CaCO3:________
8.Na2CO3:_______
9.CuCl2:________
10.AgNO3:_______
11.BaCO3:_____
12.Ba(OH)2:______
三:盐的化学性质
盐
+
酸
→新盐+新酸(制酸方法)
回顾实验:
AgNO3
溶液中加HCl溶液
现象:_____________
化学方程式:____________
产生不溶于酸的白色沉淀
AgNO3+HCl=AgCl↓+HNO3
1
①可以不溶,除AgCl
BaSO4
②必须是强酸
③沉淀
气体或水
AgCl+H2SO4
BaCO3+
HCl
2
=
BaCl2↓+
+H2O+CO2↑
CaCl2+H2O+CO2
HCl+MgSO4
回顾实验:
FeCl3溶液中加NaOH溶液,
现象:___________
化学方程式:____________
产生红褐色絮状沉淀
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
盐+碱→新盐+新碱(制碱的方法)
2
Na2CO3
+
Ca(OH)2
均可溶
沉淀、气体、水
Na2CO3+
Cu(OH)2
=
CaCO3↓
+
2NaOH
Na2CO3+KOH
3
Ba(NO3)2+Na2CO3
Na2CO3+
AgNO3
CaCO3+FeCl3
≠
盐
+
盐→
新盐
+
新盐
均可溶
=
2NaNO3+BaCO3↓
KNO3+NaCl
≠
白色沉淀
白色沉淀
2
=2NaNO3+Ag2CO3↓
沉淀
碳酸钠与氯化钙反应原理分析:
Na2CO3溶液中含有离子
2Na+
CO32-
CaCl2溶液中含有离子
Ca2+
2Cl—
Na2CO3+CaCl2
=
CaCO3↓+
2NaCl
2Na++CO32-+Ca2++2Cl-=CaCO3↓+2Na++2Cl-
KNO3溶液中含有离子
K+
NO3-
NaCl溶液中含有离子
Na+
Cl-
K+
+
NO3-
+
Na+
+
Cl-
=
Na++
NO3-
+
K+
+
Cl-
KNO3
NaCl
=
+
KCl
NaNO3
+
为什么KNO3和Nacl不发生复分解反应
反应
反应物条件
生成物条件
酸+金氧→盐+水
酸+碱→盐+水
酸+盐→酸+盐
碱+盐→碱+盐
盐+盐→盐+盐
复分解反应及发生条件
AB
+
CD
=
AD
+
CB
(1)发生范围:酸碱、盐、金属氧化物四大类物质之间
(2)反应进行的环境:大多数在水溶液中进行
生成沉
淀或气
体或水
盐可以不溶
酸应是强酸
碱可以不溶
金氧可以不溶
两者均可溶
两者均可溶
判断下列物质间能否发生化学反应并写出有关反应的化学方程式:
(1)ZnCO3
+
HCl
不
(2)BaCl2
+
HNO3不
(3)BaSO4
+
HCl
不
(4)CaCl2+H2CO3行
(5)Na2SO4
+
Ba(OH)2
行
(6)K2SO4
+
NaOH不
(7)Na2CO3+
Cu(OH)2
不
(8)BaCO3+Ca(OH)2不
(9)CuSO4
+
BaCl2
行
(10)Na2SO4+BaCO3
不
(11)NaNO3
+
KCl
不
(12)Mg(NO3)2+CaSO4行
(13)CuSO4+Mg(NO3)2
行
(14)SO2+
HNO3不
回顾:是否所有金属都能被酸腐蚀?
铜银金等不能被腐蚀;
而且能被腐蚀的金属反应速度也不同.
Zn+HNO3=
★金属
+
酸
→
盐
+
氢气
排在H前面
除浓稀硝酸.浓硫酸
单质铁跟酸反应,生成亚铁盐
讨论:1.此类反应的类型?
2.金属活动性顺序还有应用吗?
实验:
CuSO4溶液中加入铁钉,
现象:____________.
化学方程式:____________
CuSO4+Fe=FeSO4+Cu
4
铁钉表面逐渐出现红色的固体
溶液由蓝色变成浅绿色
金属
盐溶液
现象
Cu
AgCl
Fe
Na2CO3
没有变化
Na
CuSO4
2Na+2H2O=2NaOH+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
没有变化
金属+盐
新金属+新盐
注意:
?金属要比盐中金属活泼,即前金置后金
2Na
+
2H2O
=
2NaOH
+
H2↑
2NaOH
+
CuSO4
=
Na2SO4
+
Cu(OH)2↓
4
?参加反应的盐必须可溶
?参加反应的金属若为钾、钙、钠、钡,则反应的规律不是如此,而是如:
(可溶)
(可溶)
(可溶)
(可溶)
(可溶)
(沉淀.气体.水)
(沉淀)
1.盐
+
金属
=
新盐+新金属
2.盐
+
酸
=
新盐
+
新酸
3.盐
+
碱
=
新盐
+
新碱
4.盐
+
盐
=
新盐
+
新盐
(新金属前面,除KCaNaBa)
(可以不溶)
(沉淀.气体.水)
(强酸)
你能否说说盐有哪些通性?
2KClO3
====
2KCl
+
3O2↑
2KMnO4
====
K2MnO4+MnO2+O2↑
(NH4)2CO3===2NH3↑+CO2↑+H2O
碳酸铵
氨气
如:CaCO3
====
CaO
+
CO2↑
高温
注:某些盐加热能分解
1.在Cu(NO3)2、AgNO3的混合溶液中,加入一定量的锌粉,充分反应后可能有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质是
.
(2)若将反应后的物质过滤,向所得固体物质中滴加稀盐酸,没有气体产生,则固体物质一定有
,可能有
.
(3)若将反应后的物质过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则滤液中含有的溶质是
.
例题分析
Zn(NO3)2
Ag
Cu
AgNO3、Cu(NO3)2、
Zn(NO3)2
练.在AgNO3溶液中加入一定量的铁粉和铜粉,使之充分反应后,有下列情况:(1)若反应后过滤,在滤渣中加稀HCl,冒气泡,则析出的金属是
,滤液中的溶质是
.
(2)若在滤液中加稀HCl,产生白色沉淀,则此时滤液中溶质是
,析出晶体是
.
Fe.Cu.Ag
Fe(NO3)2
AgNO3.Cu(NO3)2.Fe(NO3)2
Ag
金属活动性顺序主要应用
反应的先后顺序是:在金属活动顺序表中,排在越后边的金属越容易从它的盐溶液中被置换出来;
或者说:金属活动性相差越大,置换反应越易发生.
反应的先后顺序是:在金属活动顺序表中,排在越前边的金属越容易与盐(或酸)溶液反应而被溶解;
或者说:金属活动性相差越大,置换反应越易发生.
二:判断金属与混合盐溶液的反应顺序
三:判断混合金属与盐(或酸)溶液反应顺序
一:判断金属跟酸能否发生置换反应及其反应的快慢
1.现有X、Y、Z三中金属(镁、锌、铜),把Y投入到X的硫酸盐溶液中,Y溶解而且溶液的质量减小;把Z投入到X的硫酸盐溶液中;Z溶解而且溶液质量增加。则XYZ依是
。
Cu、Mg、Zn
例题分析
练.为研究锰、铜、镍的金属活动性,进行如下实验:将镍丝分别插入硫酸锰和硫酸铜的溶液中,前者镍丝表面无变化,后者镍丝表面有红色的固体析出,由此可知,锰铜镍三种金属的活动顺序由强到弱的顺序为(
)
A.铜.锰.镍
B.锰.镍.铜
C.镍.铜.锰
D.镍.锰.铜
B
1.将锌片投入下列盐溶液中,溶液质量减轻的是(
)
A.MgCl2
B.CuCl2
C.AgNO3
D.HCl
C
例题分析
2.将质量为100g的铁棒插入硫酸铜溶液中,过一会儿取出,烘干,称量,棒的质量变为100.8g。求有多少克铁参加了反应。
练:用含杂质(杂质不与酸作用,也不溶于水)的铁10g与50g稀硫酸完全反应后,滤去杂质,所得液体质量为55.4g,求此铁的纯度。
1.下列各组在溶液中能大量共存的是(
)
A.KOH
CuSO4
NaCl
B.NaCl
Na2CO3
Ba(OH)2
C.Ca(0H)2
KCl
H2SO4
D.Na2CO3
KOH
NaCl
D
2.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______
。
K2CO3
MgCl2.CuSO4.
AgCl.BaSO4
巩固练习
3.已知可溶性钡盐有毒,而在医院里做胃镜透视时,要用BaSO4造影,俗称“钡餐”,吃下BaSO4无毒原因是因为:
但如果无意中误服了BaCO3则会引起中毒,这是因为(用化学方程式表示,下同)是
,误服后,应立即用泻盐MgSO4解毒,这是因为:
BaSO4不溶于水,也不与酸反应式
BaCO3+2HCl=BaCl2+H2O+CO2↑
BaCl2
+
MgSO4
=BaSO4↓
+
MgCl2
4.有一包固体粉末,可能由CaCO3.Na2SO4.KNO3.CuSO4.
BaCl2中的一种或几种组成,做实验得以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色.
(2)该白色沉淀不溶于稀硝酸.
从实验可判断出,该粉末中一定含有______,一定不含有______。
Na2SO4
BaCl2
CaCO3.CuSO4
5.在一条鱼虾绝迹的小河边,有四座工厂:甲.乙.丙.丁,他们排放的废液里,每厂只有碳酸钠.氯化铁.氢氧化钙.盐酸的一种,某中学环保小组对实现调查的情况如图,甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生,请推测这四座工厂废液里的污染物.
Ca(OH)2
FeCl3
HCl
Na2CO3
6.某工厂排出的废液中主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,他们设计以下步骤,试回答问题(步骤在下图)
(1)写出加入的X.Y物质的化学式:X
Y
.
(2)写出固体A及滤液B.C中主要成分的化学式:
A
B
C
.
(3)Z处进行的操作是
.
废液
加入过量X过滤
固体混合物A
滤液B
金属银
加入适量的Y过滤
滤液C
硝酸锌固体
加入适量E
蒸发结晶
固体D
Z
Zn
H2SO4
Zn.Ag
Zn(NO3)2
ZnSO4
过滤
金属活动性顺序
3.排在前面的金属(除KCaNaBa)能把排在后面的金属从它的盐溶液中置换出来,而且越活泼的金属越先反应溶解形成阳离子,越不活泼的金属越先被置换析出.
1.越排在前面的金属,在酸或盐溶液中越容易失去电子变成阳离子,活动性越强.
2.排在氢前面金属可以把酸里的氢置换出来,而且越活泼金属与酸反应越快,且越先反应.
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
盐的通性
11.1生活中常见的盐
指示剂
金属
氢气+盐
金属氧化物
水+盐
水+盐
盐
新盐+新酸
H+
指示剂
盐+水
酸
碱
非金属氧化物
酸
盐
盐+水
新碱+新盐
OH
水
+
盐
盐是酸跟碱中和的产物,酸中的
酸根离子和碱中的阳离子结合而成
一.盐的分类
试试用已知晓的知识进行分类
碱
1.根据组成中是否含有H+或OH-氢氧根
酸与碱完全中和的产物,组成中不含H+或OH-盐,如NaCl、KNO3等。
酸中氢离子被碱部分中和的产物,组成中含H+的盐,如NaHCO3、KHSO4、Ca(H2PO4)2等。
碱中氢氧根离子被酸部分中和的产物,组成中含OH-的盐,如Mg(OH)Cl、Cu2(OH)2CO3等。
正盐
酸式盐
碱式盐
在酸名称的后面加个“氢”字,然后再读金属的名称。
“某化某”
、“某酸某”
在正盐的名称前边加“碱式”二字
可溶性盐
不溶性盐
2.根据所含阳离子或阴离子分类
钾盐:
KCl
KNO3
K2SO4
等
钠盐:
镁盐:
硝酸盐:
碳酸盐:
……….
NaCl
NaNO3
Na2SO4
等
MgCl2
MgSO4
MgNO3
等
KNO3
NaNO3
MgNO3
等
K2CO3
Na2CO3
MgCO3
等
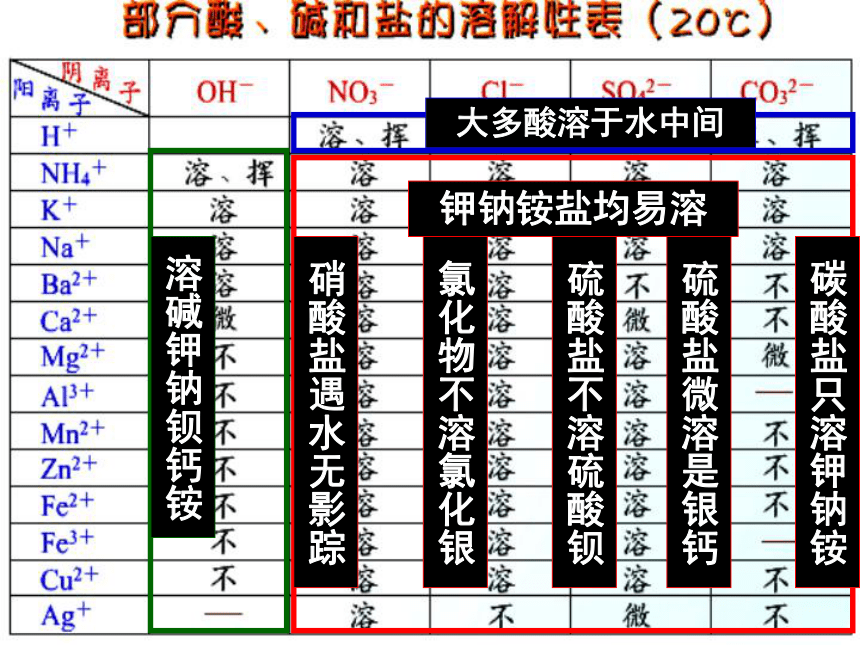
3.根据盐的溶解性分类:
阅读书本154页,试总结
溶碱钾钠钡钙铵
大多酸溶于水中间
钾钠铵盐均易溶
硝酸盐遇水无影踪
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾钠铵
硫酸盐微溶是银钙
二、盐的溶解性
(1)钾盐(含K+)、钠盐(含Na+)、铵盐(含NH4+)硝酸盐(含NO3-)都溶于水
(2)盐酸盐(除AgCl不溶)其余都溶于水
(3)硫酸盐(除BaSO4不溶);(CaSO4
、Ag2SO4
微溶)其余都溶于水
(4)碳酸盐(除K2CO3
、Na2CO3
、
(NH4)2CO3可溶),其余都不溶于水
根据溶解性口诀,判断下列物质的溶解性?
1.ZnSO4:
2.AgCl:________
3.NaNO3:________
4.K2CO3:________
5.BaSO4:________
6.BaCl2:________
7.CaCO3:________
8.Na2CO3:_______
9.CuCl2:________
10.AgNO3:_______
11.BaCO3:_____
12.Ba(OH)2:______
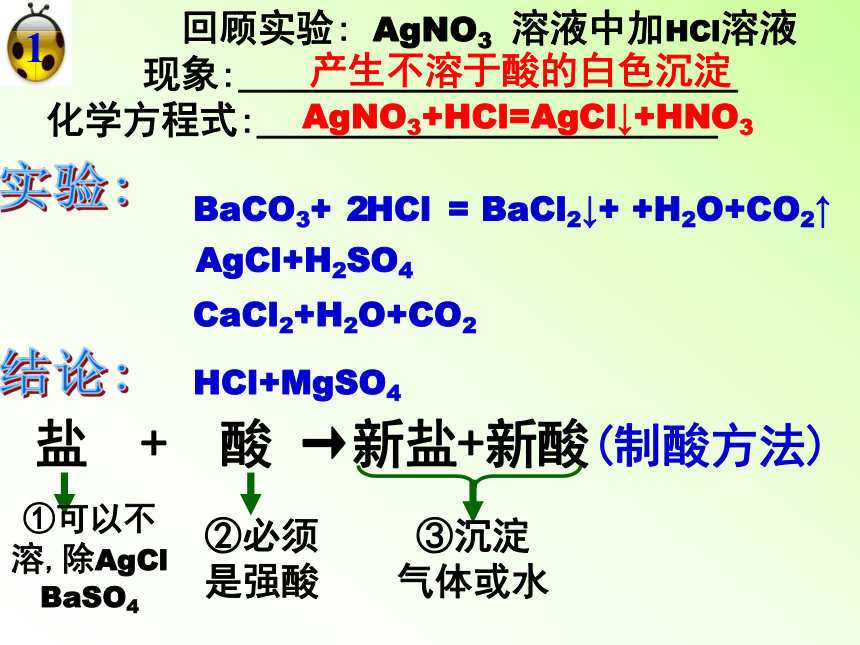
三:盐的化学性质
盐
+
酸
→新盐+新酸(制酸方法)
回顾实验:
AgNO3
溶液中加HCl溶液
现象:_____________
化学方程式:____________
产生不溶于酸的白色沉淀
AgNO3+HCl=AgCl↓+HNO3
1
①可以不溶,除AgCl
BaSO4
②必须是强酸
③沉淀
气体或水
AgCl+H2SO4
BaCO3+
HCl
2
=
BaCl2↓+
+H2O+CO2↑
CaCl2+H2O+CO2
HCl+MgSO4
回顾实验:
FeCl3溶液中加NaOH溶液,
现象:___________
化学方程式:____________
产生红褐色絮状沉淀
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
盐+碱→新盐+新碱(制碱的方法)
2
Na2CO3
+
Ca(OH)2
均可溶
沉淀、气体、水
Na2CO3+
Cu(OH)2
=
CaCO3↓
+
2NaOH
Na2CO3+KOH
3
Ba(NO3)2+Na2CO3
Na2CO3+
AgNO3
CaCO3+FeCl3
≠
盐
+
盐→
新盐
+
新盐
均可溶
=
2NaNO3+BaCO3↓
KNO3+NaCl
≠
白色沉淀
白色沉淀
2
=2NaNO3+Ag2CO3↓
沉淀
碳酸钠与氯化钙反应原理分析:
Na2CO3溶液中含有离子
2Na+
CO32-
CaCl2溶液中含有离子
Ca2+
2Cl—
Na2CO3+CaCl2
=
CaCO3↓+
2NaCl
2Na++CO32-+Ca2++2Cl-=CaCO3↓+2Na++2Cl-
KNO3溶液中含有离子
K+
NO3-
NaCl溶液中含有离子
Na+
Cl-
K+
+
NO3-
+
Na+
+
Cl-
=
Na++
NO3-
+
K+
+
Cl-
KNO3
NaCl
=
+
KCl
NaNO3
+
为什么KNO3和Nacl不发生复分解反应
反应
反应物条件
生成物条件
酸+金氧→盐+水
酸+碱→盐+水
酸+盐→酸+盐
碱+盐→碱+盐
盐+盐→盐+盐
复分解反应及发生条件
AB
+
CD
=
AD
+
CB
(1)发生范围:酸碱、盐、金属氧化物四大类物质之间
(2)反应进行的环境:大多数在水溶液中进行
生成沉
淀或气
体或水
盐可以不溶
酸应是强酸
碱可以不溶
金氧可以不溶
两者均可溶
两者均可溶
判断下列物质间能否发生化学反应并写出有关反应的化学方程式:
(1)ZnCO3
+
HCl
不
(2)BaCl2
+
HNO3不
(3)BaSO4
+
HCl
不
(4)CaCl2+H2CO3行
(5)Na2SO4
+
Ba(OH)2
行
(6)K2SO4
+
NaOH不
(7)Na2CO3+
Cu(OH)2
不
(8)BaCO3+Ca(OH)2不
(9)CuSO4
+
BaCl2
行
(10)Na2SO4+BaCO3
不
(11)NaNO3
+
KCl
不
(12)Mg(NO3)2+CaSO4行
(13)CuSO4+Mg(NO3)2
行
(14)SO2+
HNO3不
回顾:是否所有金属都能被酸腐蚀?
铜银金等不能被腐蚀;
而且能被腐蚀的金属反应速度也不同.
Zn+HNO3=
★金属
+
酸
→
盐
+
氢气
排在H前面
除浓稀硝酸.浓硫酸
单质铁跟酸反应,生成亚铁盐
讨论:1.此类反应的类型?
2.金属活动性顺序还有应用吗?
实验:
CuSO4溶液中加入铁钉,
现象:____________.
化学方程式:____________
CuSO4+Fe=FeSO4+Cu
4
铁钉表面逐渐出现红色的固体
溶液由蓝色变成浅绿色
金属
盐溶液
现象
Cu
AgCl
Fe
Na2CO3
没有变化
Na
CuSO4
2Na+2H2O=2NaOH+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
没有变化
金属+盐
新金属+新盐
注意:
?金属要比盐中金属活泼,即前金置后金
2Na
+
2H2O
=
2NaOH
+
H2↑
2NaOH
+
CuSO4
=
Na2SO4
+
Cu(OH)2↓
4
?参加反应的盐必须可溶
?参加反应的金属若为钾、钙、钠、钡,则反应的规律不是如此,而是如:
(可溶)
(可溶)
(可溶)
(可溶)
(可溶)
(沉淀.气体.水)
(沉淀)
1.盐
+
金属
=
新盐+新金属
2.盐
+
酸
=
新盐
+
新酸
3.盐
+
碱
=
新盐
+
新碱
4.盐
+
盐
=
新盐
+
新盐
(新金属前面,除KCaNaBa)
(可以不溶)
(沉淀.气体.水)
(强酸)
你能否说说盐有哪些通性?
2KClO3
====
2KCl
+
3O2↑
2KMnO4
====
K2MnO4+MnO2+O2↑
(NH4)2CO3===2NH3↑+CO2↑+H2O
碳酸铵
氨气
如:CaCO3
====
CaO
+
CO2↑
高温
注:某些盐加热能分解
1.在Cu(NO3)2、AgNO3的混合溶液中,加入一定量的锌粉,充分反应后可能有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质是
.
(2)若将反应后的物质过滤,向所得固体物质中滴加稀盐酸,没有气体产生,则固体物质一定有
,可能有
.
(3)若将反应后的物质过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则滤液中含有的溶质是
.
例题分析
Zn(NO3)2
Ag
Cu
AgNO3、Cu(NO3)2、
Zn(NO3)2
练.在AgNO3溶液中加入一定量的铁粉和铜粉,使之充分反应后,有下列情况:(1)若反应后过滤,在滤渣中加稀HCl,冒气泡,则析出的金属是
,滤液中的溶质是
.
(2)若在滤液中加稀HCl,产生白色沉淀,则此时滤液中溶质是
,析出晶体是
.
Fe.Cu.Ag
Fe(NO3)2
AgNO3.Cu(NO3)2.Fe(NO3)2
Ag
金属活动性顺序主要应用
反应的先后顺序是:在金属活动顺序表中,排在越后边的金属越容易从它的盐溶液中被置换出来;
或者说:金属活动性相差越大,置换反应越易发生.
反应的先后顺序是:在金属活动顺序表中,排在越前边的金属越容易与盐(或酸)溶液反应而被溶解;
或者说:金属活动性相差越大,置换反应越易发生.
二:判断金属与混合盐溶液的反应顺序
三:判断混合金属与盐(或酸)溶液反应顺序
一:判断金属跟酸能否发生置换反应及其反应的快慢
1.现有X、Y、Z三中金属(镁、锌、铜),把Y投入到X的硫酸盐溶液中,Y溶解而且溶液的质量减小;把Z投入到X的硫酸盐溶液中;Z溶解而且溶液质量增加。则XYZ依是
。
Cu、Mg、Zn
例题分析
练.为研究锰、铜、镍的金属活动性,进行如下实验:将镍丝分别插入硫酸锰和硫酸铜的溶液中,前者镍丝表面无变化,后者镍丝表面有红色的固体析出,由此可知,锰铜镍三种金属的活动顺序由强到弱的顺序为(
)
A.铜.锰.镍
B.锰.镍.铜
C.镍.铜.锰
D.镍.锰.铜
B
1.将锌片投入下列盐溶液中,溶液质量减轻的是(
)
A.MgCl2
B.CuCl2
C.AgNO3
D.HCl
C
例题分析
2.将质量为100g的铁棒插入硫酸铜溶液中,过一会儿取出,烘干,称量,棒的质量变为100.8g。求有多少克铁参加了反应。
练:用含杂质(杂质不与酸作用,也不溶于水)的铁10g与50g稀硫酸完全反应后,滤去杂质,所得液体质量为55.4g,求此铁的纯度。
1.下列各组在溶液中能大量共存的是(
)
A.KOH
CuSO4
NaCl
B.NaCl
Na2CO3
Ba(OH)2
C.Ca(0H)2
KCl
H2SO4
D.Na2CO3
KOH
NaCl
D
2.白色粉末,可能含MgCl2.CuSO4.AgCl.BaSO4.K2CO3中的一种或几种,将粉末溶于水为无色溶液,当加入BaCl2溶液后有白色沉淀产生,再加入过量盐酸,白色沉淀溶解,有气泡放出。
原混合物中一定含有______,一定不含有_______
。
K2CO3
MgCl2.CuSO4.
AgCl.BaSO4
巩固练习
3.已知可溶性钡盐有毒,而在医院里做胃镜透视时,要用BaSO4造影,俗称“钡餐”,吃下BaSO4无毒原因是因为:
但如果无意中误服了BaCO3则会引起中毒,这是因为(用化学方程式表示,下同)是
,误服后,应立即用泻盐MgSO4解毒,这是因为:
BaSO4不溶于水,也不与酸反应式
BaCO3+2HCl=BaCl2+H2O+CO2↑
BaCl2
+
MgSO4
=BaSO4↓
+
MgCl2
4.有一包固体粉末,可能由CaCO3.Na2SO4.KNO3.CuSO4.
BaCl2中的一种或几种组成,做实验得以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色.
(2)该白色沉淀不溶于稀硝酸.
从实验可判断出,该粉末中一定含有______,一定不含有______。
Na2SO4
BaCl2
CaCO3.CuSO4
5.在一条鱼虾绝迹的小河边,有四座工厂:甲.乙.丙.丁,他们排放的废液里,每厂只有碳酸钠.氯化铁.氢氧化钙.盐酸的一种,某中学环保小组对实现调查的情况如图,甲处的河水是乳白色的,乙处的河水是红褐色的,丙处的河水变清了,丁处的河水是清的,但有气泡产生,请推测这四座工厂废液里的污染物.
Ca(OH)2
FeCl3
HCl
Na2CO3
6.某工厂排出的废液中主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,他们设计以下步骤,试回答问题(步骤在下图)
(1)写出加入的X.Y物质的化学式:X
Y
.
(2)写出固体A及滤液B.C中主要成分的化学式:
A
B
C
.
(3)Z处进行的操作是
.
废液
加入过量X过滤
固体混合物A
滤液B
金属银
加入适量的Y过滤
滤液C
硝酸锌固体
加入适量E
蒸发结晶
固体D
Z
Zn
H2SO4
Zn.Ag
Zn(NO3)2
ZnSO4
过滤
金属活动性顺序
3.排在前面的金属(除KCaNaBa)能把排在后面的金属从它的盐溶液中置换出来,而且越活泼的金属越先反应溶解形成阳离子,越不活泼的金属越先被置换析出.
1.越排在前面的金属,在酸或盐溶液中越容易失去电子变成阳离子,活动性越强.
2.排在氢前面金属可以把酸里的氢置换出来,而且越活泼金属与酸反应越快,且越先反应.
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
同课章节目录
