高中化学人教版必修二第二章第二节原电池与化学电源课件(共41张ppt)
文档属性
| 名称 | 高中化学人教版必修二第二章第二节原电池与化学电源课件(共41张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-31 00:00:00 | ||
图片预览











文档简介
(共41张PPT)
原电池是意大利科学家伏打于1799年捕捉到原电池的实验现象,并加以研究,发明了世界上第一个电池——伏打电池
你知道吗
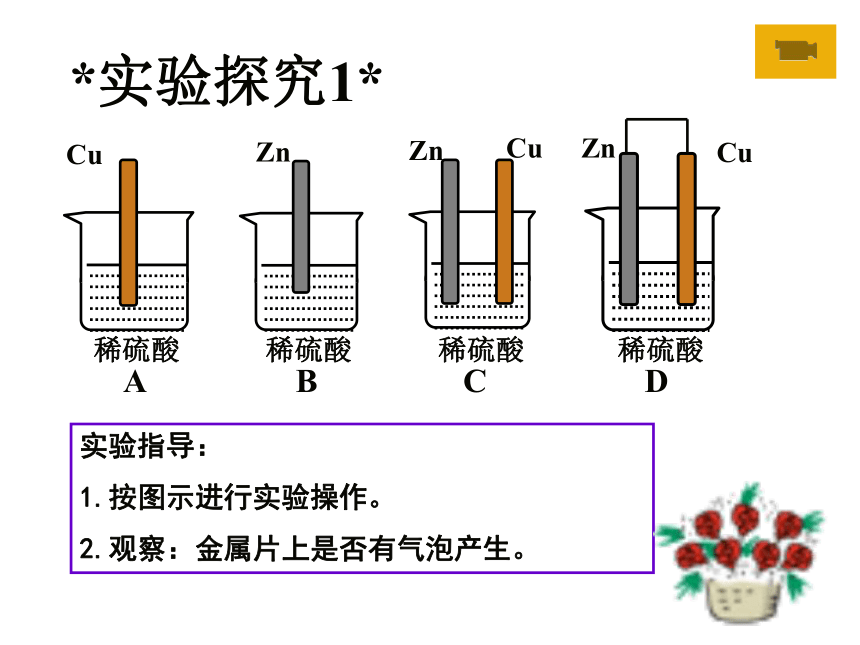
Cu
Zn
Zn
Zn
C
B
A
*实验探究1*
实验指导:
1.按图示进行实验操作。
2.观察:金属片上是否有气泡产生。
D
Cu
Cu
稀硫酸 稀硫酸 稀硫酸 稀硫酸
Cu
Zn
-
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
静电引力
一、原电池工作原理
1.概念:把化学能转化成电能的装置叫做原电池
一、原电池的工作原理
电子流出的一极
电子流入的一极
负极:
正极:
氧化反应
还原反应
锌片(负极):
铜片(正极):
原电池总反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
电极反应:
Zn + 2H+ = Zn2+ + H2↑
原电池的原理:
自发进行的氧化还原反应
随着反应的不断进行,电解质溶液中的PH有何变化???
电解质溶液
失e-,沿导线传递,有电流产生
阳离子
负极
正极
阳离子
原电池工作原理:
条件一 原电池的电极材料
结论一
H2SO4溶液
Cu
Zn
G
H2SO4溶液
C
Zn
G
H2SO4溶液
Zn
Zn
G
两电极活性不同(两种金属或一种金属一种非金属C或一种金属一种金属氧化物),较活泼的一极为负极,较不活泼的一极为正极.
A
B
C
条件二 溶液的性质
结论二
两个电极插入电解质溶液中。
(可以)
(不可以)
(不可以)
(可以)
条件三 闭合回路
*二、形成原电池的条件* :
前提:必须是一个自发进行的氧化还原反应。
1.两电极活性不同(两种金属或一种金属一种非金属或一种金属一种金属氧化物),较活泼的一极为负极,较不活泼的一极为正极.
2.两个电极插入电解质溶液中。
3.构成闭合回路。
三、 原电池原理的应用
(1) 比较金属性的强弱
活泼的金属作负极
(3) 改变反应速率
(2) 金属的腐蚀及防护
能构成原电池的反应比普通化学反应快
电化学腐蚀比普通化学腐蚀来得快
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A X>Y>Z B X>Z>Y
C Y>X>Z D Y>Z>X
C
应用1
负极(Fe):2Fe - 4e = 2Fe2+
正极(C): 2H2O+O2+4e = 4OH
Fe2+与OH-形成Fe(OH)2,又被氧化成Fe(OH)3,分解后形成铁锈Fe2O3.
电化学腐蚀是造成钢铁腐蚀的主要原因。
在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,这层水膜里含有少量H+和OH-,还溶解了氧气,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳恰好形成无数微小的原电池。在这些原电池里,铁是负极,碳是正极。铁失去电子而被氧化:
2Fe+O2+2H2O=2Fe(OH)2
总式:
1、实验室用锌与稀硫酸反应制取氢气,为了提高氢气生成的速率,可以使用含杂质的粗锌或者在硫酸溶液中加入少量硫酸铜溶液。分析上述方法能加速氢气生成的原因。
2、为什么在铜锌原电池的实验中,本不应该产生气体的锌片上会有大量气泡产生呢?
应用2
1 原电池的基本原理
2 原电池的构成条件
3 原电池原理的应用
你知道了吗
1、下列各种情况是否形成了原电池?
Ag
Fe
G
盐酸溶液
含杂质C
的Fe片
盐酸溶液
Al
Mg
G
CCl4溶液
Cu
Zn
G
A
F
E
D
C
B
盐酸溶液
Cu
Zn
CuSO4溶液
H2SO4溶液
Cu
C
G
练一练
2.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不变 B.先变大后变小
C.逐渐变大 D.逐渐变小
C
把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此4种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
②
A>B
C>D
A>C
D>B
5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
普通锌锰电池
碱性电池
镍
镉
电
池
锂离子电池
镍氢电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
燃料电池
神舟六号燃料电池发电系统
化学电池
利用原电池原理制造的供电装置
分类
①一次电池——不可充电电池——如:干电池
②二次电池——充电电池——如:蓄电池
③燃料电池
燃料电池是利用氢气、天然气、甲醇等燃料与氧气或空气进行电化学反应时释放出来的化学能直接转化成电能的一类原电池。
目前燃料电池的能量转化率近80%,约为火力发电的2倍。这是因为火力发电中放出的废热太多。燃料电池没有噪声及硫、氮氧化物等废气污染
燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时不断从外界输入氧化剂和还原剂,同时将电极反应产物不断排出电池。它是把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”。
氢氧燃料电池
Na2SO4溶液
氢氧燃料电池
负极:2H2-4e- = 4H+
正极:O2+2H2O+4e- = 4OH-
总反应:2H2+O2 = 2H2O
中
性
燃料电池书写一般步骤
1、先明确燃料做负极(H2、CH4、CH3OH、N2H4等可燃物),氧化剂(O2等氧化剂)做正极
2、写出正极反应式
判断正极产物能否与电解质溶液共存(溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-)
3、写出负极反应式
4、若已知总反应式,也可相减得到负极反应式
氢氧燃料电池
负极:2H2-4e- = 4H+
正极:O2+2H2O+4e- = 4OH-
总反应:2H2+O2 = 2H2O
中
性
负极:2H2+4OH--4e- = 4H2O
正极:O2+2H2O+4e- = 4OH-
总反应:2H2+O2 = 2H2O
碱
性
负极: 2H2-4e- = 4H+
正极:O2+4H++4e- = 2H2O
总反应: 2H2+O2 = 2H2O
酸
性
甲烷燃料电池
负极材料:
正极材料:
电解质溶液:
CH4
O2
KOH
1.燃料电池总反应:CH4+2OH-+2O2 = CO32-+3H2O
2.正极: 2O2+4H2O+8e- = 8OH-
3.负极:CH4+10OH--8e- = CO32-+7H2O
书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-
Zn-Mn干电池
负极材料:
正极材料:
电解质溶液:
总:Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2+MnO(OH)
负极: Zn-2e-== Zn2+
正极:2MnO2+2NH4++2e-==MnO(OH)+2NH3
Zn
C
MnO2和NH4Cl的
混合糊状物
干电池
1、最早使用的化学电池是锌锰电池,也是最普通的干电池。
2、缺点:电池在使用的过程中,锌会逐渐融解,最后内部糊状电解质会泄漏出来,使得电器被腐蚀。为了防止泄漏电解质,外壳用塑料筒。
注意:使用完毕要及时从用电器中取出、不可久置、应保存在阴凉干燥处.
铅蓄电池
负极材料:
正极材料:
电解质溶液:
负极:Pb+SO42--2e-=PbSO4
正极:PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
放电过程
(原电池)
阴极: PbSO4 +2e- =Pb+SO42-
阳极: PbSO4+ 2H2O -2e-=PbO2+SO42-+4H+
充电过程
(电解池)
Pb
PbO2
H2SO4
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
Ag-Zn碱性纽扣电池
负极:Zn-2e-+ 2OH-==Zn(OH)2
正极:Ag2O + H2O +2e-==2Ag + 2OH-
放电过程
(原电池)
负极材料:
正极材料:
电解质溶液:
阴极:Zn(OH)2 +2e- == Zn + 2OH-
阳极:2Ag + 2OH- -2e-== Ag2O + H2O
充电过程
(电解池)
Zn
Ag2O
KOH
总反应:Zn +Ag2O + H2O 2Ag + Zn(OH)2
1.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li + MnO2=LiMnO2,下列说法正确的是
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+
B
2、银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表为 ,
在此电池放电时,负极上发生反应的物质是
A、Ag B、Zn(OH)2
C、Ag2O D、Zn
2Ag+Zn(OH)2 Ag2O +Zn+H2O
充电
放电
D
3、1991年我国首创以铝、空气、海水电池为能源的新型海水标志灯已经研制成功。该灯以海水为电解质溶液,靠空气中氧使铝不断氧化产生电流。只要把灯放入海水中数分钟就发出耀眼的闪光,其能量比干电池高20到50倍。运用所学的化学知识,推测该新型电池两极上可能发生的电极反应。
负极 正极
Al-3e-=Al3+
3O2+6H2O+12e-=12OH-
4、在实验室欲加速制取氢气,最好的方 法是采用
(A)纯锌跟稀硫酸溶液
(B)纯锌+稀盐酸
(C)粗锌(含少量铜)跟稀硫酸溶液
(D)粗锌(含少量铜)跟醋酸溶液
C
原电池是意大利科学家伏打于1799年捕捉到原电池的实验现象,并加以研究,发明了世界上第一个电池——伏打电池
你知道吗
Cu
Zn
Zn
Zn
C
B
A
*实验探究1*
实验指导:
1.按图示进行实验操作。
2.观察:金属片上是否有气泡产生。
D
Cu
Cu
稀硫酸 稀硫酸 稀硫酸 稀硫酸
Cu
Zn
-
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
静电引力
一、原电池工作原理
1.概念:把化学能转化成电能的装置叫做原电池
一、原电池的工作原理
电子流出的一极
电子流入的一极
负极:
正极:
氧化反应
还原反应
锌片(负极):
铜片(正极):
原电池总反应:
Zn-2e-=Zn2+
2H++2e-=H2↑
电极反应:
Zn + 2H+ = Zn2+ + H2↑
原电池的原理:
自发进行的氧化还原反应
随着反应的不断进行,电解质溶液中的PH有何变化???
电解质溶液
失e-,沿导线传递,有电流产生
阳离子
负极
正极
阳离子
原电池工作原理:
条件一 原电池的电极材料
结论一
H2SO4溶液
Cu
Zn
G
H2SO4溶液
C
Zn
G
H2SO4溶液
Zn
Zn
G
两电极活性不同(两种金属或一种金属一种非金属C或一种金属一种金属氧化物),较活泼的一极为负极,较不活泼的一极为正极.
A
B
C
条件二 溶液的性质
结论二
两个电极插入电解质溶液中。
(可以)
(不可以)
(不可以)
(可以)
条件三 闭合回路
*二、形成原电池的条件* :
前提:必须是一个自发进行的氧化还原反应。
1.两电极活性不同(两种金属或一种金属一种非金属或一种金属一种金属氧化物),较活泼的一极为负极,较不活泼的一极为正极.
2.两个电极插入电解质溶液中。
3.构成闭合回路。
三、 原电池原理的应用
(1) 比较金属性的强弱
活泼的金属作负极
(3) 改变反应速率
(2) 金属的腐蚀及防护
能构成原电池的反应比普通化学反应快
电化学腐蚀比普通化学腐蚀来得快
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A X>Y>Z B X>Z>Y
C Y>X>Z D Y>Z>X
C
应用1
负极(Fe):2Fe - 4e = 2Fe2+
正极(C): 2H2O+O2+4e = 4OH
Fe2+与OH-形成Fe(OH)2,又被氧化成Fe(OH)3,分解后形成铁锈Fe2O3.
电化学腐蚀是造成钢铁腐蚀的主要原因。
在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,这层水膜里含有少量H+和OH-,还溶解了氧气,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳恰好形成无数微小的原电池。在这些原电池里,铁是负极,碳是正极。铁失去电子而被氧化:
2Fe+O2+2H2O=2Fe(OH)2
总式:
1、实验室用锌与稀硫酸反应制取氢气,为了提高氢气生成的速率,可以使用含杂质的粗锌或者在硫酸溶液中加入少量硫酸铜溶液。分析上述方法能加速氢气生成的原因。
2、为什么在铜锌原电池的实验中,本不应该产生气体的锌片上会有大量气泡产生呢?
应用2
1 原电池的基本原理
2 原电池的构成条件
3 原电池原理的应用
你知道了吗
1、下列各种情况是否形成了原电池?
Ag
Fe
G
盐酸溶液
含杂质C
的Fe片
盐酸溶液
Al
Mg
G
CCl4溶液
Cu
Zn
G
A
F
E
D
C
B
盐酸溶液
Cu
Zn
CuSO4溶液
H2SO4溶液
Cu
C
G
练一练
2.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
B
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不变 B.先变大后变小
C.逐渐变大 D.逐渐变小
C
把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此4种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D
②
A>B
C>D
A>C
D>B
5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )
C
A B C D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 HCl
普通锌锰电池
碱性电池
镍
镉
电
池
锂离子电池
镍氢电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
燃料电池
神舟六号燃料电池发电系统
化学电池
利用原电池原理制造的供电装置
分类
①一次电池——不可充电电池——如:干电池
②二次电池——充电电池——如:蓄电池
③燃料电池
燃料电池是利用氢气、天然气、甲醇等燃料与氧气或空气进行电化学反应时释放出来的化学能直接转化成电能的一类原电池。
目前燃料电池的能量转化率近80%,约为火力发电的2倍。这是因为火力发电中放出的废热太多。燃料电池没有噪声及硫、氮氧化物等废气污染
燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时不断从外界输入氧化剂和还原剂,同时将电极反应产物不断排出电池。它是把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”。
氢氧燃料电池
Na2SO4溶液
氢氧燃料电池
负极:2H2-4e- = 4H+
正极:O2+2H2O+4e- = 4OH-
总反应:2H2+O2 = 2H2O
中
性
燃料电池书写一般步骤
1、先明确燃料做负极(H2、CH4、CH3OH、N2H4等可燃物),氧化剂(O2等氧化剂)做正极
2、写出正极反应式
判断正极产物能否与电解质溶液共存(溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-)
3、写出负极反应式
4、若已知总反应式,也可相减得到负极反应式
氢氧燃料电池
负极:2H2-4e- = 4H+
正极:O2+2H2O+4e- = 4OH-
总反应:2H2+O2 = 2H2O
中
性
负极:2H2+4OH--4e- = 4H2O
正极:O2+2H2O+4e- = 4OH-
总反应:2H2+O2 = 2H2O
碱
性
负极: 2H2-4e- = 4H+
正极:O2+4H++4e- = 2H2O
总反应: 2H2+O2 = 2H2O
酸
性
甲烷燃料电池
负极材料:
正极材料:
电解质溶液:
CH4
O2
KOH
1.燃料电池总反应:CH4+2OH-+2O2 = CO32-+3H2O
2.正极: 2O2+4H2O+8e- = 8OH-
3.负极:CH4+10OH--8e- = CO32-+7H2O
书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-
Zn-Mn干电池
负极材料:
正极材料:
电解质溶液:
总:Zn+2MnO2+2NH4Cl==Zn(NH3)2Cl2+MnO(OH)
负极: Zn-2e-== Zn2+
正极:2MnO2+2NH4++2e-==MnO(OH)+2NH3
Zn
C
MnO2和NH4Cl的
混合糊状物
干电池
1、最早使用的化学电池是锌锰电池,也是最普通的干电池。
2、缺点:电池在使用的过程中,锌会逐渐融解,最后内部糊状电解质会泄漏出来,使得电器被腐蚀。为了防止泄漏电解质,外壳用塑料筒。
注意:使用完毕要及时从用电器中取出、不可久置、应保存在阴凉干燥处.
铅蓄电池
负极材料:
正极材料:
电解质溶液:
负极:Pb+SO42--2e-=PbSO4
正极:PbO2+SO42-+4H++2e- =PbSO4+ 2H2O
放电过程
(原电池)
阴极: PbSO4 +2e- =Pb+SO42-
阳极: PbSO4+ 2H2O -2e-=PbO2+SO42-+4H+
充电过程
(电解池)
Pb
PbO2
H2SO4
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
Ag-Zn碱性纽扣电池
负极:Zn-2e-+ 2OH-==Zn(OH)2
正极:Ag2O + H2O +2e-==2Ag + 2OH-
放电过程
(原电池)
负极材料:
正极材料:
电解质溶液:
阴极:Zn(OH)2 +2e- == Zn + 2OH-
阳极:2Ag + 2OH- -2e-== Ag2O + H2O
充电过程
(电解池)
Zn
Ag2O
KOH
总反应:Zn +Ag2O + H2O 2Ag + Zn(OH)2
1.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li + MnO2=LiMnO2,下列说法正确的是
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+
B
2、银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表为 ,
在此电池放电时,负极上发生反应的物质是
A、Ag B、Zn(OH)2
C、Ag2O D、Zn
2Ag+Zn(OH)2 Ag2O +Zn+H2O
充电
放电
D
3、1991年我国首创以铝、空气、海水电池为能源的新型海水标志灯已经研制成功。该灯以海水为电解质溶液,靠空气中氧使铝不断氧化产生电流。只要把灯放入海水中数分钟就发出耀眼的闪光,其能量比干电池高20到50倍。运用所学的化学知识,推测该新型电池两极上可能发生的电极反应。
负极 正极
Al-3e-=Al3+
3O2+6H2O+12e-=12OH-
4、在实验室欲加速制取氢气,最好的方 法是采用
(A)纯锌跟稀硫酸溶液
(B)纯锌+稀盐酸
(C)粗锌(含少量铜)跟稀硫酸溶液
(D)粗锌(含少量铜)跟醋酸溶液
C
