2021年浙江省中考科学复习课件第29讲 构成物质的粒子 元素(课件 49张PPT)
文档属性
| 名称 | 2021年浙江省中考科学复习课件第29讲 构成物质的粒子 元素(课件 49张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-06-01 18:46:42 | ||
图片预览











文档简介
第29讲 构成物质的粒子 元素
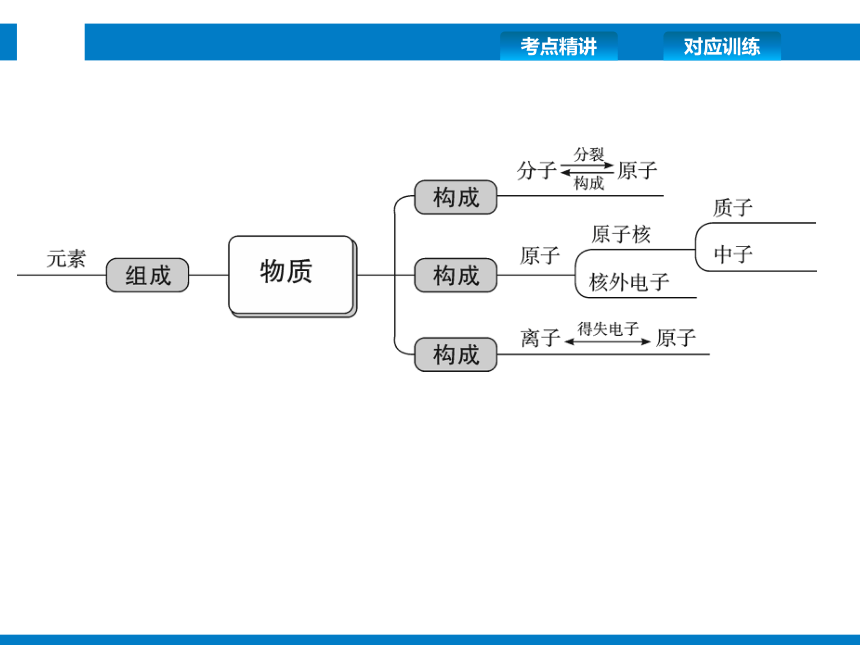
思维导图
考点扫描
1.构成物质的微粒有分子、原子和离子。 是保持物质化学性质的一种微粒; 是化学变化中的最小微粒; 是得失电子的原子或原子团。
2.构成物质的分子都在不停地做无规则运动,____越高,分子无规则运动越剧烈,如扩散现象。
3.构成物质的分子之间虽然彼此相互隔开,却存在着相互作用的引力。但固体和液体的体积很难被压缩,因为分子间存在着斥力。
考点一 构成物质的微粒(八下教材P39)
分子
原子
离子
温度
1.(2020,聊城)分子、原子和离子都是构成物质的基本粒子。下列说法正确的是( )
A.分子由原子构成,分子比原子大
B.水遇冷凝结成冰,水分子停止了运动
C.原子是最小的粒子,不可再分
D.氯化钠是由钠离子和氯离子构成的
D
在原子结构中,需要注意:
(1)质子数(核电荷数)= ,
因而原子 。
考点二 原子的构成(八下教材P44)
核外电子数
不显电性
(2)原子核中质子数不一定等于中子数,如氢原子的原子核内 。
(3)原子核在整个原子中所占体积很小,但原子的质量主要集中在 上。
(4)原子核内 决定了元素种类,同种元素的原子和离子具有相同的 。
无中子
原子核
质子数
质子数
2.(2020,抚顺)下列有关微观粒子的说法正确的是
( )
A.氯化钠是由氯化钠分子构成的
B.分子可以分成原子而原子不能再分
C.分子是保持物质性质的最小粒子
D.原子是由原子核和核外电子构成的
D
1.道尔顿——实心球模型——首先提出原子论;
2.汤姆生——枣糕模型(西瓜模型)——发现电子;
3.卢瑟福—— 结构模型—α粒子散射实验,原子核;
4.玻尔—— 模型;
考点三 原子结构模型的发展过程(八下教材P43)
核式
分层
5.现代——电子云模型。
从原子结构模型建立的过程中,我们可以发现建立模型往往需要有一个不断完善、不断修正的过程,使模型更接近事物的本质。
3.英国科学家卢瑟福用带正电的α粒子轰击金属箔,这就是著名的α粒子散射实验。该实验不能证明的是
( )
A.原子核体积很小
B.原子不是实心球体,大部分空间是空的
C.原子核是由质子和中子组成
D.原子核质量比较大
C
1.元素是具有相同 (质子数)的同一类原子的总称。
2.元素和原子的区别与联系
考点四 物质由元素组成(八下教材P49)
?
原子
元素
区别
①粒子(成员)
②既讲____,又讲____
③从____角度描述分子的构成或物质的构成
①粒子的总称(集体)
②只讲____,不讲____
③从____角度描述物质的组成
联系
化学反应前后元素和原子的种类都不会改变?
核电荷数
种类
数目
微观
种类
数目
宏观
3.植物生长过程中需要量较多的是含 元素的无机盐。植物生长缺乏氮元素时,植株矮小,叶色发黄;缺乏磷元素时,植株暗绿带红;缺乏钾元素时,植株矮小,叶片上带许多褐斑。
N、P、K
4.元素在地壳中的分布是不均匀的,地壳主要由氧(48.6%)、硅(26.3%)、铝(7.73%)、铁(4.75%)、钙(3.45%)等元素组成。人体中所含各种元素的质量分数主要为氧(65%)、碳(18%)、氢(10%)和其他(7%)。海水中,除了水由氢(10.7%)、氧(85.5%)组成外,其他还有氯、钠、镁和贵金属元素等。
4.(2020,吉林)在原子中,能决定元素种类的是( )
A.电子层数 B.质子数
C.中子数 D.核外电子数
B
5.(2020,荆州)下列说法正确的是( )
A.热胀冷缩说明温度能改变分子大小
B.原子是不可再分的最小的粒子
C.分子、原子、离子都是构成物质的粒子
D.不同元素的本质区别是中子数不同
C
6.(2020,常州)地壳中的元素分布如图,其中区域②代表的元素是( )
A.氧
B.硅
C.铝
D.铁
B
1.元素符号的表示方法
用该元素的拉丁文的第一个大写字母来表示,若有重复则取前面两个字母,第二个字母小写。
2.元素符号表示的意义
宏观:表示一种 ; 微观:表示这种元素的一个 。
注意:当元素符号前面加上 时,就只具有微观意义。如“2H”只表示两个氢原子。
考点五 元素符号(八下教材P53)
物质
原子
数字
3.元素周期表共有7个横行,18个纵列。每个横行叫做一个 ,每个纵列叫做一个族(8、9、10三个纵列共同组成一个族)。元素周期表每一个周期(除第一周期外)开头都是 元素,结尾都是 元素。元素周期表中每一格所包含的信息有元素名称、元素符号和原子序数等
周期
金属
非金属
7.(2020,连云港)如图摘自元素周期表,据此判断下列叙述错误的是( )
B.硫原子的核外电子数为16
C.氧和硫都属于非金属元素
D.氧和硫位于元素周期表同一周期
【备考补充】
同一周期,核外电子层数相同,从左往右,最外层电子数逐渐增大;同一族,最外层电子数相同,化学性质相似。
D
1.一些常见元素的化合价
氢钾钠银 ;镁锌钡钙 ;氟氯溴碘
;通常氧显 ;铜 铝 ;铁有 和 ;单质元素为 。
2.常见原子团化合价口诀: 硝酸氢氧根, 硫酸碳酸根, 记住磷酸根, 价的是铵根。
考点六 元素的化合价(八下教材P61)
正一价
正二价
负一价
负二价
正二
正三
正二
正三
零价
负一
负二
负三
正一
3.化合价的一般规律
(1)在化合物里氢元素通常显 价,
氧元素 价。
(2)金属元素在化合物中通常显 。
(3)单质里元素的化合价为 。
(4)在化合物里,元素正负化合价的代数和为 。
正一
负二
正价
零
零
4.根据化合价写出化学式
根据元素的化合价正确写出化合物化学式的步骤:①按一定顺序写出元素符号;②在元素符号的上方标出化合价;③再根据元素化合价代数和为 的原则写出分子中各元素的原子个数。
5.根据化学式推断元素的化合价
标出已知元素化合价,根据 列式求解。
零
正负化合价的代数和为0
8.(2020,柳州)“84消毒液”的有效成分是次氯酸钠(NaClO),其中氯元素的化合价是( )
A.-1 B.0 C.+1 D.+2
9.(2020,南充)电动汽车使用的锂离子电池中含有LiFePO4,其中锂元素和磷元素的化合价分别为+1和+5,则铁元素的化合价为( )
A.0 B.+2 C.+3 D.+6
C
B
精讲释疑
物质的微粒性是指:(1)所有物质都是由肉眼看不见的、极小的微粒构成的;(2)微粒是在不断运动的,并且温度越高,运动越剧烈;(3)微粒之间存在间隔,在固体、液体中,微粒之间的距离较小,在气体物质中,微粒之间的距离较大。
题型一 物质的微粒性
【例1】 下列对宏观事实的微观解释错误的是( )
选项
宏观事实
微观解释
A
塑料带很难被拉断
分子之间有引力
B
水结冰后不再流动
分子停止了运动
C
切洋葱时眼睛被熏得直流泪
分子在不停运动
D
水很难被压缩
分子之间有斥力
B
1.宏观辨识与微观探析是化学学科的核心素养之一。用分子、原子的观点解释下列现象,其中不合理的是( )
A.氯化钠溶液是混合物——该溶液由氯化钠分子和水分子构成
B.电解水生成氢气和氧气——分子本身发生变化
C.气体可以压缩储存在钢瓶中——分子间有间隔
D.1滴水中大约有1.67×1021个水分子——分子很小
A
分子、原子和离子是构成物质的基本微粒,在化学变化中分子可分而原子不可分,在由分子构成的物质中,分子是保持物质化学性质的最小微粒,原子是化学变化中的最小微粒,分子不一定比原子大,但比构成该分子的原子大。原子得失电子后变成离子,因此离子是带电的微粒。
题型二 分子、原子、离子的基本概念
【例2】 (2020,常德)元素观和微粒观是化学核心观念。下列说法不正确的是( )
A.构成物质的微粒有分子、原子和离子
B.质子数相同的微粒一定是由同种元素形成的
C.化学变化前后原子的种类和个数一定不变
D.原子序数与元素原子核电荷数在数值上相等
B
2.下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
原子核在整个原子中所占的体积很小,但原子的质量主要集中在原子核上。在原子内,核电荷数=质子数=核外电子数。
题型三 原子的结构
【例3】 卢瑟福的α离子轰击金箔实验为建立现代原子理论打下了基础,如图中a、b、c、d四条线,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A.abcd B.bcd
C.abc D.ad
B
3.(2020,枣庄)1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。根据实验,不能获得的结论是( )
A.金原子核带正电
B.金原子核外电子带负电
C.金原子核体积很小
D.金原子核的质量比α粒子大得多
B
元素是具有相同核电荷数(即质子数)的一类原子的总称。质子数决定元素的种类。元素用元素符号表示,元素是宏观概念,讲“种”数,不讲“个”数。元素符号要熟记,会正确规范书写。
化合价是正确书写化学式的工具,因此要熟记常见元素和原子团的化合价。熟练应用“化合物中各元素化合价代数和为零”求未知元素的化合价和书写化学式。
题型四 元素符号与化合价
【例4】 (2019,眉山)铝是生活中用途很广的金属材料。根据如图回答问题:
(1)铝原子核内的质子数为 。
(2)铝的相对原子质量为 。
(3)地壳中含量最多的元素与铝元素组成的化合物的化学式为 ,该化合物中铝元素的化合价为 。
13
26.98
Al2O3
+3_
4.某些元素的相关信息如图所示,请认真分析并回答问题。
(1)原子序数为7的元素位于元素周期表中第____周期,它属于 (填“金属”或“非金属”)元素;
二
非金属
(2)在化学反应中,原子序数为11的元素的原子容易
(填“得”或“失”)电子,形成离子的符号是
;
(3)根据上表中原子结构示意图分析,氧元素与____ (填元素符号)的化学性质相似。
失
Na+
S
诊断自测
1.(2020,潍坊)下列有关粒子的说法中正确的是( )
A.分子可分,原子不可分
B.原子得到电子后带正电荷
C.分子、原子和离子都可以直接构成物质
D.原子的原子核都是由质子和中子构成的
C
2.(2019,温州)联合国把今年定为“元素周期表年”。俄国科学家门捷列夫对元素周期表的编制做出巨大贡献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的质子数为( )
A.101 B.157 C.258 D.359
A
3.(2019,金丽)思维导图有助于建构知识,如图是小金建立的有关物质宏观组成和微观构成的思维导图,其中“▲”应填入的是( )
A.原子 B.中子 C.电子 D.质子
A
4.(2020,衡阳)古人用雌黄(化学式为As2S3)加水混合后涂在纸上来修改文字,成语“信口雌黄”就源出于此。雌黄中S的化合价是-2,则As的化合价为( )
A.+1 B.+2 C.+3 D.+4
C
5.(2020,大连)我国的5G通信芯片主要由氮化镓材料制成,如图是镓元素在元素周期表中的相关信息。下列说法错误的是( )
A.镓属于金属元素
B.镓原子的质子数是31
C.镓原子质量是69.72g
D.镓原子核外有31个电子
C
6.下列说法错误的是( )
A.H2O2属于氧化物
B.碳元素与氧元素位于同一周期
C.NaNO2中氮元素的化合价为+5价
D.1个钠原子失去1个电子变成钠离子
C
7.(2019,绍兴)元素周期表是学习科学的重要工具,下表是元素周期表的一部分,请回答下列问题。
(1)不同种元素之间最本质的区别是____不同。
A.相对原子质量 B.质子数
C.中子数
(2)第3号元素属于 (选填“金属”或“非金属”)元素。
(3)第12号元素和第17号元素组成化合物的化学式是
。
B
金属
MgCl2
思维导图
考点扫描
1.构成物质的微粒有分子、原子和离子。 是保持物质化学性质的一种微粒; 是化学变化中的最小微粒; 是得失电子的原子或原子团。
2.构成物质的分子都在不停地做无规则运动,____越高,分子无规则运动越剧烈,如扩散现象。
3.构成物质的分子之间虽然彼此相互隔开,却存在着相互作用的引力。但固体和液体的体积很难被压缩,因为分子间存在着斥力。
考点一 构成物质的微粒(八下教材P39)
分子
原子
离子
温度
1.(2020,聊城)分子、原子和离子都是构成物质的基本粒子。下列说法正确的是( )
A.分子由原子构成,分子比原子大
B.水遇冷凝结成冰,水分子停止了运动
C.原子是最小的粒子,不可再分
D.氯化钠是由钠离子和氯离子构成的
D
在原子结构中,需要注意:
(1)质子数(核电荷数)= ,
因而原子 。
考点二 原子的构成(八下教材P44)
核外电子数
不显电性
(2)原子核中质子数不一定等于中子数,如氢原子的原子核内 。
(3)原子核在整个原子中所占体积很小,但原子的质量主要集中在 上。
(4)原子核内 决定了元素种类,同种元素的原子和离子具有相同的 。
无中子
原子核
质子数
质子数
2.(2020,抚顺)下列有关微观粒子的说法正确的是
( )
A.氯化钠是由氯化钠分子构成的
B.分子可以分成原子而原子不能再分
C.分子是保持物质性质的最小粒子
D.原子是由原子核和核外电子构成的
D
1.道尔顿——实心球模型——首先提出原子论;
2.汤姆生——枣糕模型(西瓜模型)——发现电子;
3.卢瑟福—— 结构模型—α粒子散射实验,原子核;
4.玻尔—— 模型;
考点三 原子结构模型的发展过程(八下教材P43)
核式
分层
5.现代——电子云模型。
从原子结构模型建立的过程中,我们可以发现建立模型往往需要有一个不断完善、不断修正的过程,使模型更接近事物的本质。
3.英国科学家卢瑟福用带正电的α粒子轰击金属箔,这就是著名的α粒子散射实验。该实验不能证明的是
( )
A.原子核体积很小
B.原子不是实心球体,大部分空间是空的
C.原子核是由质子和中子组成
D.原子核质量比较大
C
1.元素是具有相同 (质子数)的同一类原子的总称。
2.元素和原子的区别与联系
考点四 物质由元素组成(八下教材P49)
?
原子
元素
区别
①粒子(成员)
②既讲____,又讲____
③从____角度描述分子的构成或物质的构成
①粒子的总称(集体)
②只讲____,不讲____
③从____角度描述物质的组成
联系
化学反应前后元素和原子的种类都不会改变?
核电荷数
种类
数目
微观
种类
数目
宏观
3.植物生长过程中需要量较多的是含 元素的无机盐。植物生长缺乏氮元素时,植株矮小,叶色发黄;缺乏磷元素时,植株暗绿带红;缺乏钾元素时,植株矮小,叶片上带许多褐斑。
N、P、K
4.元素在地壳中的分布是不均匀的,地壳主要由氧(48.6%)、硅(26.3%)、铝(7.73%)、铁(4.75%)、钙(3.45%)等元素组成。人体中所含各种元素的质量分数主要为氧(65%)、碳(18%)、氢(10%)和其他(7%)。海水中,除了水由氢(10.7%)、氧(85.5%)组成外,其他还有氯、钠、镁和贵金属元素等。
4.(2020,吉林)在原子中,能决定元素种类的是( )
A.电子层数 B.质子数
C.中子数 D.核外电子数
B
5.(2020,荆州)下列说法正确的是( )
A.热胀冷缩说明温度能改变分子大小
B.原子是不可再分的最小的粒子
C.分子、原子、离子都是构成物质的粒子
D.不同元素的本质区别是中子数不同
C
6.(2020,常州)地壳中的元素分布如图,其中区域②代表的元素是( )
A.氧
B.硅
C.铝
D.铁
B
1.元素符号的表示方法
用该元素的拉丁文的第一个大写字母来表示,若有重复则取前面两个字母,第二个字母小写。
2.元素符号表示的意义
宏观:表示一种 ; 微观:表示这种元素的一个 。
注意:当元素符号前面加上 时,就只具有微观意义。如“2H”只表示两个氢原子。
考点五 元素符号(八下教材P53)
物质
原子
数字
3.元素周期表共有7个横行,18个纵列。每个横行叫做一个 ,每个纵列叫做一个族(8、9、10三个纵列共同组成一个族)。元素周期表每一个周期(除第一周期外)开头都是 元素,结尾都是 元素。元素周期表中每一格所包含的信息有元素名称、元素符号和原子序数等
周期
金属
非金属
7.(2020,连云港)如图摘自元素周期表,据此判断下列叙述错误的是( )
B.硫原子的核外电子数为16
C.氧和硫都属于非金属元素
D.氧和硫位于元素周期表同一周期
【备考补充】
同一周期,核外电子层数相同,从左往右,最外层电子数逐渐增大;同一族,最外层电子数相同,化学性质相似。
D
1.一些常见元素的化合价
氢钾钠银 ;镁锌钡钙 ;氟氯溴碘
;通常氧显 ;铜 铝 ;铁有 和 ;单质元素为 。
2.常见原子团化合价口诀: 硝酸氢氧根, 硫酸碳酸根, 记住磷酸根, 价的是铵根。
考点六 元素的化合价(八下教材P61)
正一价
正二价
负一价
负二价
正二
正三
正二
正三
零价
负一
负二
负三
正一
3.化合价的一般规律
(1)在化合物里氢元素通常显 价,
氧元素 价。
(2)金属元素在化合物中通常显 。
(3)单质里元素的化合价为 。
(4)在化合物里,元素正负化合价的代数和为 。
正一
负二
正价
零
零
4.根据化合价写出化学式
根据元素的化合价正确写出化合物化学式的步骤:①按一定顺序写出元素符号;②在元素符号的上方标出化合价;③再根据元素化合价代数和为 的原则写出分子中各元素的原子个数。
5.根据化学式推断元素的化合价
标出已知元素化合价,根据 列式求解。
零
正负化合价的代数和为0
8.(2020,柳州)“84消毒液”的有效成分是次氯酸钠(NaClO),其中氯元素的化合价是( )
A.-1 B.0 C.+1 D.+2
9.(2020,南充)电动汽车使用的锂离子电池中含有LiFePO4,其中锂元素和磷元素的化合价分别为+1和+5,则铁元素的化合价为( )
A.0 B.+2 C.+3 D.+6
C
B
精讲释疑
物质的微粒性是指:(1)所有物质都是由肉眼看不见的、极小的微粒构成的;(2)微粒是在不断运动的,并且温度越高,运动越剧烈;(3)微粒之间存在间隔,在固体、液体中,微粒之间的距离较小,在气体物质中,微粒之间的距离较大。
题型一 物质的微粒性
【例1】 下列对宏观事实的微观解释错误的是( )
选项
宏观事实
微观解释
A
塑料带很难被拉断
分子之间有引力
B
水结冰后不再流动
分子停止了运动
C
切洋葱时眼睛被熏得直流泪
分子在不停运动
D
水很难被压缩
分子之间有斥力
B
1.宏观辨识与微观探析是化学学科的核心素养之一。用分子、原子的观点解释下列现象,其中不合理的是( )
A.氯化钠溶液是混合物——该溶液由氯化钠分子和水分子构成
B.电解水生成氢气和氧气——分子本身发生变化
C.气体可以压缩储存在钢瓶中——分子间有间隔
D.1滴水中大约有1.67×1021个水分子——分子很小
A
分子、原子和离子是构成物质的基本微粒,在化学变化中分子可分而原子不可分,在由分子构成的物质中,分子是保持物质化学性质的最小微粒,原子是化学变化中的最小微粒,分子不一定比原子大,但比构成该分子的原子大。原子得失电子后变成离子,因此离子是带电的微粒。
题型二 分子、原子、离子的基本概念
【例2】 (2020,常德)元素观和微粒观是化学核心观念。下列说法不正确的是( )
A.构成物质的微粒有分子、原子和离子
B.质子数相同的微粒一定是由同种元素形成的
C.化学变化前后原子的种类和个数一定不变
D.原子序数与元素原子核电荷数在数值上相等
B
2.下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
原子核在整个原子中所占的体积很小,但原子的质量主要集中在原子核上。在原子内,核电荷数=质子数=核外电子数。
题型三 原子的结构
【例3】 卢瑟福的α离子轰击金箔实验为建立现代原子理论打下了基础,如图中a、b、c、d四条线,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
A.abcd B.bcd
C.abc D.ad
B
3.(2020,枣庄)1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。根据实验,不能获得的结论是( )
A.金原子核带正电
B.金原子核外电子带负电
C.金原子核体积很小
D.金原子核的质量比α粒子大得多
B
元素是具有相同核电荷数(即质子数)的一类原子的总称。质子数决定元素的种类。元素用元素符号表示,元素是宏观概念,讲“种”数,不讲“个”数。元素符号要熟记,会正确规范书写。
化合价是正确书写化学式的工具,因此要熟记常见元素和原子团的化合价。熟练应用“化合物中各元素化合价代数和为零”求未知元素的化合价和书写化学式。
题型四 元素符号与化合价
【例4】 (2019,眉山)铝是生活中用途很广的金属材料。根据如图回答问题:
(1)铝原子核内的质子数为 。
(2)铝的相对原子质量为 。
(3)地壳中含量最多的元素与铝元素组成的化合物的化学式为 ,该化合物中铝元素的化合价为 。
13
26.98
Al2O3
+3_
4.某些元素的相关信息如图所示,请认真分析并回答问题。
(1)原子序数为7的元素位于元素周期表中第____周期,它属于 (填“金属”或“非金属”)元素;
二
非金属
(2)在化学反应中,原子序数为11的元素的原子容易
(填“得”或“失”)电子,形成离子的符号是
;
(3)根据上表中原子结构示意图分析,氧元素与____ (填元素符号)的化学性质相似。
失
Na+
S
诊断自测
1.(2020,潍坊)下列有关粒子的说法中正确的是( )
A.分子可分,原子不可分
B.原子得到电子后带正电荷
C.分子、原子和离子都可以直接构成物质
D.原子的原子核都是由质子和中子构成的
C
2.(2019,温州)联合国把今年定为“元素周期表年”。俄国科学家门捷列夫对元素周期表的编制做出巨大贡献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的质子数为( )
A.101 B.157 C.258 D.359
A
3.(2019,金丽)思维导图有助于建构知识,如图是小金建立的有关物质宏观组成和微观构成的思维导图,其中“▲”应填入的是( )
A.原子 B.中子 C.电子 D.质子
A
4.(2020,衡阳)古人用雌黄(化学式为As2S3)加水混合后涂在纸上来修改文字,成语“信口雌黄”就源出于此。雌黄中S的化合价是-2,则As的化合价为( )
A.+1 B.+2 C.+3 D.+4
C
5.(2020,大连)我国的5G通信芯片主要由氮化镓材料制成,如图是镓元素在元素周期表中的相关信息。下列说法错误的是( )
A.镓属于金属元素
B.镓原子的质子数是31
C.镓原子质量是69.72g
D.镓原子核外有31个电子
C
6.下列说法错误的是( )
A.H2O2属于氧化物
B.碳元素与氧元素位于同一周期
C.NaNO2中氮元素的化合价为+5价
D.1个钠原子失去1个电子变成钠离子
C
7.(2019,绍兴)元素周期表是学习科学的重要工具,下表是元素周期表的一部分,请回答下列问题。
(1)不同种元素之间最本质的区别是____不同。
A.相对原子质量 B.质子数
C.中子数
(2)第3号元素属于 (选填“金属”或“非金属”)元素。
(3)第12号元素和第17号元素组成化合物的化学式是
。
B
金属
MgCl2
同课章节目录
