2021年浙江省中考科学复习课件第31讲 质量守恒定律及化学方程式(课件 43张PPT)
文档属性
| 名称 | 2021年浙江省中考科学复习课件第31讲 质量守恒定律及化学方程式(课件 43张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1002.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-06-01 00:00:00 | ||
图片预览











文档简介
第31讲 质量守恒定律及化学方程式
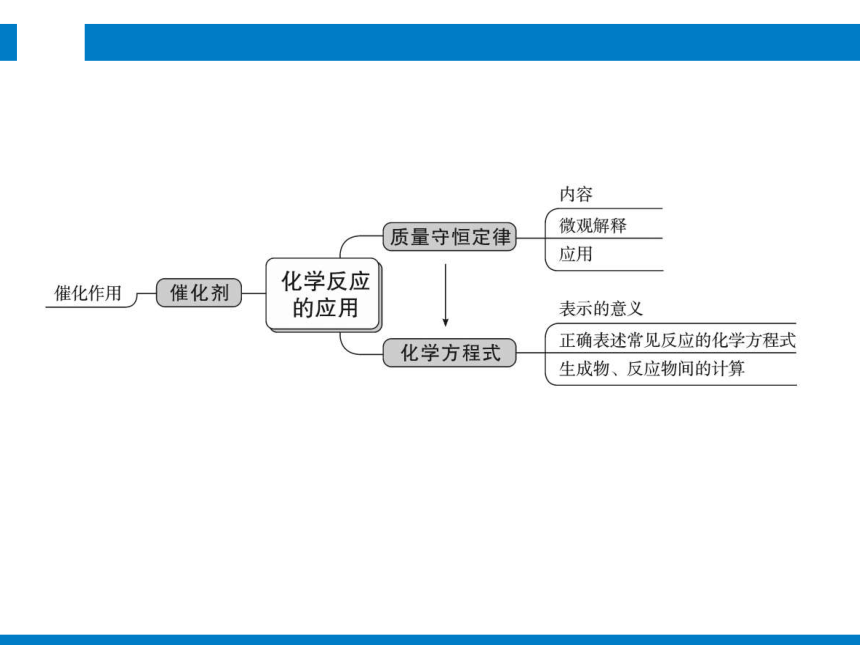
思维导图
考点扫描
考点一 质量守恒定律(八下教材P87)
1.内容:化学反应中,参加化学反应的各物质的
等于反应后生成的各物质的
2.实质:化学反应前后,原子的种类没有改变,原子的数量也没有增减,每个原子的质量也没有变化,所以化学反应前后各物质的质量总和相等
3.质量守恒定律的验证(详见实验突破)
质量总和
质量总和
1.(2020,常州)石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的化学方程式为CaCN2+3H2O===CaCO3+2X,则X化学式为( )
A.NO B.N2 C.CO2 D.NH3
【备考补充】
化学方程式的配平——奇数配偶法
出现最多寻奇数,再将奇数变为偶。
观察配平道理简,二四不行再求六。
D
1.定义:用化学式来表示化学反应的式子。
2.表述:反应物在一定条件,反应生成某物质,如
“ ”的表述为“碳和氧气在点燃的条件下,反应生成二氧化碳”。
3.意义:
(1)宏观意义:表示什么物质参加了反应,结果生成了什么物质;反应在什么条件下进行;
考点二 化学方程式(八下教材P89)
(2)质量意义:表示各物质之间的质量关系,即反应物和生成物之间的质量比,如12份质量的碳与32份质量的氧气完全反应生成44份质量的二氧化碳;
(3)微观意义:表示各物质间原子和分子的个数比,1个碳原子和1个氧分子反应得到1个二氧化碳分子。
4.依据化学方程式进行计算:
(1)一般步骤:设未知数→写出配平的化学方程式→写出有关物质的质量比和已知量→列方程、求解→写出简明的答案;
(2)注意点:①方程式必须配平;②计算有关物质的质量比时式量要乘以前面的系数;③单位必须统一;④如果是不纯物必须换算成纯物质的质量代入计算。
考点一 质量守恒定律(八下教材P87)
D
【特别提醒】
依据化学方程式进行计算时,不是相关量不用标出,设未知量x时,x不带单位,一定要带入纯净物的量进行计算
考点三 催化剂(八下教材P76)
1.概念:在化学反应中,能改变其他物质的化学反应 ,而本身的 和 在化学反应前后都 的物质叫做催化剂。在工业上,催化剂也叫触媒。
2.催化剂有“一变二不变”:一变(改变化学反应速率,不一定加快);二不变(自身的 和 不变)。
速率
质量
化学性质
没有改变
质量
化学性质
3.我们不能说某一种物质是催化剂,应该说某一种物质在某个反应中是催化剂。
3.(2020,抚顺)下列有关催化剂的说法正确的是( )
A.在化学反应后其质量减小
B.催化剂只能加快化学反应速率
C.在化学反应后其化学性质不变
D.过氧化氢分解反应中,只能用二氧化锰作催化剂
C
实验突破
验证质量守恒定律
实验
方案
方案一
方案二
实验
装置
注意
事项
有气体参加或气体生成的反应,必须在密闭系统中进行
无气体参加或生成的反应,可以在开放系统中进行
实验
现象
白磷燃烧,产生大量白烟,放出热量,气球先膨胀后缩小
铁钉表面有一层红色物质析出,溶液由蓝色逐渐变为浅绿色
反应前
总质量
m1
m1
反应后
总质量
m2
m2
分析
结论
反应前后
?
物质的总质量相等
【知识拓展】
1.实验误差分析
任何化学反应都遵守质量守恒定律,如果在探究质量守恒定律时,反应前后质量发生了改变,可能原因有:
(1)有气体物质参加了反应;
(2)有气体(或固体)生成物逸散到空气中去了;
(3)反应后,气球胀大,造成气球所受空气的浮力增大等。
2.实验评价:
探究质量守恒定律时,评价实验设计是否合理,主要看以下几点:
(1)所选物质是否发生化学反应;
(2)所用装置是否密闭;
(3)如果有物质燃烧,是否有气体缓冲装置;
(4)产物是否污染空气等。
精讲释疑
设计实验验证质量守恒定律时,要选择合适的实验装置、药品,实验现象明显,有气体生成的反应要注意实验误差分析。
【例1】 利用如图所示装置进行如下实验探究。
在锥形瓶中放入一小粒白磷,
塞好瓶塞后玻璃管下端刚好能与白磷接触,
将整套装置放在托盘天平上调节至平衡,取下橡皮塞,将玻璃管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
题型一 质量守恒定律的验证
(1)实验时,气球的变化是 。
(2)根据白磷引燃前后的变化,可知燃烧的条件是
;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是 。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针 (填“向左偏”“向右偏”或“指向中间”)。
(4)白磷(P)燃烧生成P2O5,写出该反应的化学方程式: 。
先膨胀后缩小
与氧气接触,温度达到可燃物着火点
可燃物
向左偏
1.以下是俄国化学家罗蒙诺索夫曾开展的实验:①先用天平称取质量为m1的金属锡粉;②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2;③打开容器,听到了空气进入容器发出的“嘶嘶”的声响,称量所得白色物质的质量为m3;④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4。
(1)根据所学知识判断,锡的燃烧是 变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量m3= ,于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)后经多位科学家的共同努力,最终确立了质量守恒定律,请从微观角度解释该定律:____。
化学
m4-m2+m1
因为化学反应的过程是原子的重新组合过程,反应前后原子的种类不变,总个数不变,原子质量不变,所以化学反应前后物质的总质量相等
质量守恒定律是中考的重要考点。理解质量守恒定律要抓住五个“不变”即反应物和生成物总质量不变、元素种类不变、原子种类不变、原子数目不变、原子质量不变;两个“一定改变”即物质种类一定改变、构成物质的分子种类一定改变;一个“可能改变”指分子总数可能改变。
题型二 质量守恒定律的应用
【例2】 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0表示物质质量不变),下列说法正确的是( )
A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48∶23
D.该反应中甲、丁的相对分子质量之比一定为44∶27
C
2.(2020,宜昌)某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12∶5
D
书写化学方程式要注意“四查”:一查是否符合客观事实;二查物质化学式是否正确;三查是否配平;四查是否注明反应条件和箭头。应用化学方程式计算时注意步骤的完整和物质的相对分子质量无误。
题型三 化学方程式及其相关计算
【例3】 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据如下:
已知实验中发生的化学反应:
NaOH+HCl===NaCl+H2O
Na2CO3+2HCl===2NaCl+H2O+CO2↑
?
实验一
实验二
实验三
反应前稀盐酸+
烧杯质量(克)
150
150
150
反应前固体样品
质量(克)
4
8
12
反应后烧杯内物质
+烧杯质量(克)
m
155.8
158.7
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:____。
(2)表中的m值为 。
实验三产生的气体的质量为150g+12g-158.7g=3.3g,实验二产生的气体的质量为150g+8g-155.8g=2.2g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8g样品已完全反应
152.9
(3)根据实验二中的数据计算样品中Na2CO3的质量分数。
(3)解:根据质量守恒定律可得,生成的二氧化碳的质量为150 g+8 g-155.8 g=2.2 g
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 2.2 g
3.(2020,滨州)某校化学兴趣小组同学,将一定量的稀硫酸滴入9.3g氢氧化钠和碳酸钠的固体混合物中,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
(1)产生二氧化碳气体的质量为 ;
(2)混合物与稀硫酸恰好完全反应时所得溶液中溶质的质量是多少?
2.2g
诊断自测
B
2.(2020,鄂州)在一个密闭容器中放入甲、乙、丙、丁四种物质,使其在一定条件下发生化学反应,一段时间后测得反应数据如下表所示:
下列说法正确的是( )
A.丙一定是该反应的催化剂
B.该反应可能是分解反应
C.该反应生成的乙与丁的质量比为1∶1
D.待测值为2
物质
甲
乙
丙
丁
反应前的质量/g
36
2
3
4
反应后的质量/g
待测
20
3
20
D
3.(2019,绍兴)我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图。下列说法正确的是( )
A.甲的相对分子质量为6
B.一个丙分子中含有4个氢原子
C.参加反应的甲与乙的质量比为3∶1
D.氢元素的化合价在反应前后没有发生改变
B
C
5.(2020,无锡)元素钴(Co)有多种化合价,将9.3g Co(OH)2在空气中加热至290℃时完全脱水,得到8.3g钴的氧化物,该氧化物的化学式是( )
A.CoO B.CoO3
C.Co2O3 D.Co3O4
C
6.(2019,嘉舟)质量守恒定律的发现,对科学的发展作出了重要贡献。
(1)为了验证质量守恒定律,实验小组分别选取以下四组药品,通过称量比较各组物质在密闭容器内混合前后的总质量,能达到目的的有____。
A.氯化铁溶液和氢氧化钠溶液
B.生石灰和水
C.氯化钙溶液和硝酸钾溶液
D.碘和酒精
AB
(2)在一定条件下,A和B反应生成C,微粒种类变化如图所示(“ ”“ ”表示不同原子)。则参加反应的A、B物质的分子数之比为 。
2∶1
思维导图
考点扫描
考点一 质量守恒定律(八下教材P87)
1.内容:化学反应中,参加化学反应的各物质的
等于反应后生成的各物质的
2.实质:化学反应前后,原子的种类没有改变,原子的数量也没有增减,每个原子的质量也没有变化,所以化学反应前后各物质的质量总和相等
3.质量守恒定律的验证(详见实验突破)
质量总和
质量总和
1.(2020,常州)石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的化学方程式为CaCN2+3H2O===CaCO3+2X,则X化学式为( )
A.NO B.N2 C.CO2 D.NH3
【备考补充】
化学方程式的配平——奇数配偶法
出现最多寻奇数,再将奇数变为偶。
观察配平道理简,二四不行再求六。
D
1.定义:用化学式来表示化学反应的式子。
2.表述:反应物在一定条件,反应生成某物质,如
“ ”的表述为“碳和氧气在点燃的条件下,反应生成二氧化碳”。
3.意义:
(1)宏观意义:表示什么物质参加了反应,结果生成了什么物质;反应在什么条件下进行;
考点二 化学方程式(八下教材P89)
(2)质量意义:表示各物质之间的质量关系,即反应物和生成物之间的质量比,如12份质量的碳与32份质量的氧气完全反应生成44份质量的二氧化碳;
(3)微观意义:表示各物质间原子和分子的个数比,1个碳原子和1个氧分子反应得到1个二氧化碳分子。
4.依据化学方程式进行计算:
(1)一般步骤:设未知数→写出配平的化学方程式→写出有关物质的质量比和已知量→列方程、求解→写出简明的答案;
(2)注意点:①方程式必须配平;②计算有关物质的质量比时式量要乘以前面的系数;③单位必须统一;④如果是不纯物必须换算成纯物质的质量代入计算。
考点一 质量守恒定律(八下教材P87)
D
【特别提醒】
依据化学方程式进行计算时,不是相关量不用标出,设未知量x时,x不带单位,一定要带入纯净物的量进行计算
考点三 催化剂(八下教材P76)
1.概念:在化学反应中,能改变其他物质的化学反应 ,而本身的 和 在化学反应前后都 的物质叫做催化剂。在工业上,催化剂也叫触媒。
2.催化剂有“一变二不变”:一变(改变化学反应速率,不一定加快);二不变(自身的 和 不变)。
速率
质量
化学性质
没有改变
质量
化学性质
3.我们不能说某一种物质是催化剂,应该说某一种物质在某个反应中是催化剂。
3.(2020,抚顺)下列有关催化剂的说法正确的是( )
A.在化学反应后其质量减小
B.催化剂只能加快化学反应速率
C.在化学反应后其化学性质不变
D.过氧化氢分解反应中,只能用二氧化锰作催化剂
C
实验突破
验证质量守恒定律
实验
方案
方案一
方案二
实验
装置
注意
事项
有气体参加或气体生成的反应,必须在密闭系统中进行
无气体参加或生成的反应,可以在开放系统中进行
实验
现象
白磷燃烧,产生大量白烟,放出热量,气球先膨胀后缩小
铁钉表面有一层红色物质析出,溶液由蓝色逐渐变为浅绿色
反应前
总质量
m1
m1
反应后
总质量
m2
m2
分析
结论
反应前后
?
物质的总质量相等
【知识拓展】
1.实验误差分析
任何化学反应都遵守质量守恒定律,如果在探究质量守恒定律时,反应前后质量发生了改变,可能原因有:
(1)有气体物质参加了反应;
(2)有气体(或固体)生成物逸散到空气中去了;
(3)反应后,气球胀大,造成气球所受空气的浮力增大等。
2.实验评价:
探究质量守恒定律时,评价实验设计是否合理,主要看以下几点:
(1)所选物质是否发生化学反应;
(2)所用装置是否密闭;
(3)如果有物质燃烧,是否有气体缓冲装置;
(4)产物是否污染空气等。
精讲释疑
设计实验验证质量守恒定律时,要选择合适的实验装置、药品,实验现象明显,有气体生成的反应要注意实验误差分析。
【例1】 利用如图所示装置进行如下实验探究。
在锥形瓶中放入一小粒白磷,
塞好瓶塞后玻璃管下端刚好能与白磷接触,
将整套装置放在托盘天平上调节至平衡,取下橡皮塞,将玻璃管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
题型一 质量守恒定律的验证
(1)实验时,气球的变化是 。
(2)根据白磷引燃前后的变化,可知燃烧的条件是
;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是 。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针 (填“向左偏”“向右偏”或“指向中间”)。
(4)白磷(P)燃烧生成P2O5,写出该反应的化学方程式: 。
先膨胀后缩小
与氧气接触,温度达到可燃物着火点
可燃物
向左偏
1.以下是俄国化学家罗蒙诺索夫曾开展的实验:①先用天平称取质量为m1的金属锡粉;②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2;③打开容器,听到了空气进入容器发出的“嘶嘶”的声响,称量所得白色物质的质量为m3;④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4。
(1)根据所学知识判断,锡的燃烧是 变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量m3= ,于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)后经多位科学家的共同努力,最终确立了质量守恒定律,请从微观角度解释该定律:____。
化学
m4-m2+m1
因为化学反应的过程是原子的重新组合过程,反应前后原子的种类不变,总个数不变,原子质量不变,所以化学反应前后物质的总质量相等
质量守恒定律是中考的重要考点。理解质量守恒定律要抓住五个“不变”即反应物和生成物总质量不变、元素种类不变、原子种类不变、原子数目不变、原子质量不变;两个“一定改变”即物质种类一定改变、构成物质的分子种类一定改变;一个“可能改变”指分子总数可能改变。
题型二 质量守恒定律的应用
【例2】 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0表示物质质量不变),下列说法正确的是( )
A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48∶23
D.该反应中甲、丁的相对分子质量之比一定为44∶27
C
2.(2020,宜昌)某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12∶5
D
书写化学方程式要注意“四查”:一查是否符合客观事实;二查物质化学式是否正确;三查是否配平;四查是否注明反应条件和箭头。应用化学方程式计算时注意步骤的完整和物质的相对分子质量无误。
题型三 化学方程式及其相关计算
【例3】 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据如下:
已知实验中发生的化学反应:
NaOH+HCl===NaCl+H2O
Na2CO3+2HCl===2NaCl+H2O+CO2↑
?
实验一
实验二
实验三
反应前稀盐酸+
烧杯质量(克)
150
150
150
反应前固体样品
质量(克)
4
8
12
反应后烧杯内物质
+烧杯质量(克)
m
155.8
158.7
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:____。
(2)表中的m值为 。
实验三产生的气体的质量为150g+12g-158.7g=3.3g,实验二产生的气体的质量为150g+8g-155.8g=2.2g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8g样品已完全反应
152.9
(3)根据实验二中的数据计算样品中Na2CO3的质量分数。
(3)解:根据质量守恒定律可得,生成的二氧化碳的质量为150 g+8 g-155.8 g=2.2 g
设参加反应的碳酸钠的质量为x
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 2.2 g
3.(2020,滨州)某校化学兴趣小组同学,将一定量的稀硫酸滴入9.3g氢氧化钠和碳酸钠的固体混合物中,产生气体质量与滴入稀硫酸的质量关系如图所示。试计算:
(1)产生二氧化碳气体的质量为 ;
(2)混合物与稀硫酸恰好完全反应时所得溶液中溶质的质量是多少?
2.2g
诊断自测
B
2.(2020,鄂州)在一个密闭容器中放入甲、乙、丙、丁四种物质,使其在一定条件下发生化学反应,一段时间后测得反应数据如下表所示:
下列说法正确的是( )
A.丙一定是该反应的催化剂
B.该反应可能是分解反应
C.该反应生成的乙与丁的质量比为1∶1
D.待测值为2
物质
甲
乙
丙
丁
反应前的质量/g
36
2
3
4
反应后的质量/g
待测
20
3
20
D
3.(2019,绍兴)我国科研人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图。下列说法正确的是( )
A.甲的相对分子质量为6
B.一个丙分子中含有4个氢原子
C.参加反应的甲与乙的质量比为3∶1
D.氢元素的化合价在反应前后没有发生改变
B
C
5.(2020,无锡)元素钴(Co)有多种化合价,将9.3g Co(OH)2在空气中加热至290℃时完全脱水,得到8.3g钴的氧化物,该氧化物的化学式是( )
A.CoO B.CoO3
C.Co2O3 D.Co3O4
C
6.(2019,嘉舟)质量守恒定律的发现,对科学的发展作出了重要贡献。
(1)为了验证质量守恒定律,实验小组分别选取以下四组药品,通过称量比较各组物质在密闭容器内混合前后的总质量,能达到目的的有____。
A.氯化铁溶液和氢氧化钠溶液
B.生石灰和水
C.氯化钙溶液和硝酸钾溶液
D.碘和酒精
AB
(2)在一定条件下,A和B反应生成C,微粒种类变化如图所示(“ ”“ ”表示不同原子)。则参加反应的A、B物质的分子数之比为 。
2∶1
同课章节目录
