2021年浙江省中考科学复习课件第35讲 水和溶液(课件 49张PPT)
文档属性
| 名称 | 2021年浙江省中考科学复习课件第35讲 水和溶液(课件 49张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-06-01 18:40:57 | ||
图片预览









文档简介
第35讲 水和溶液
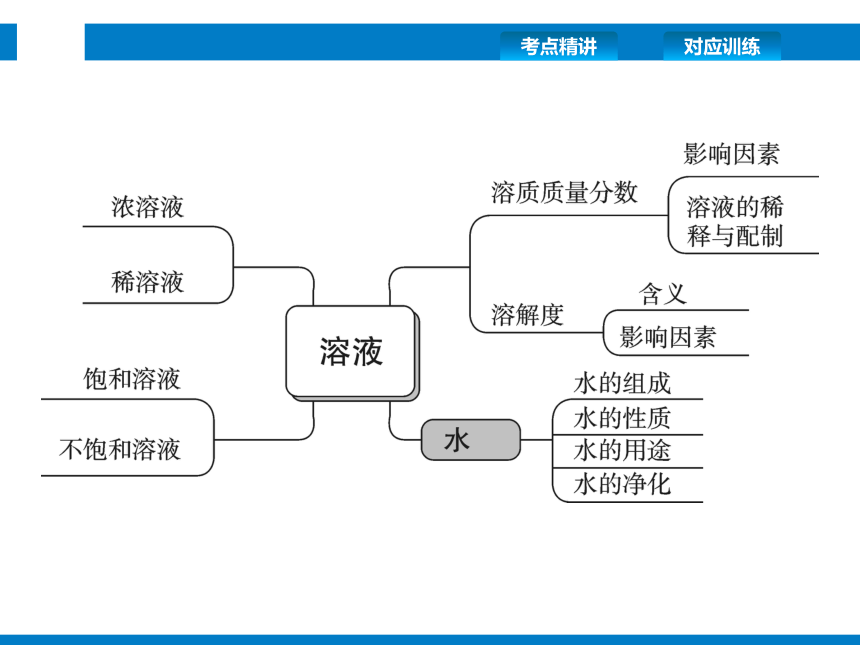
思维导图
考点扫描
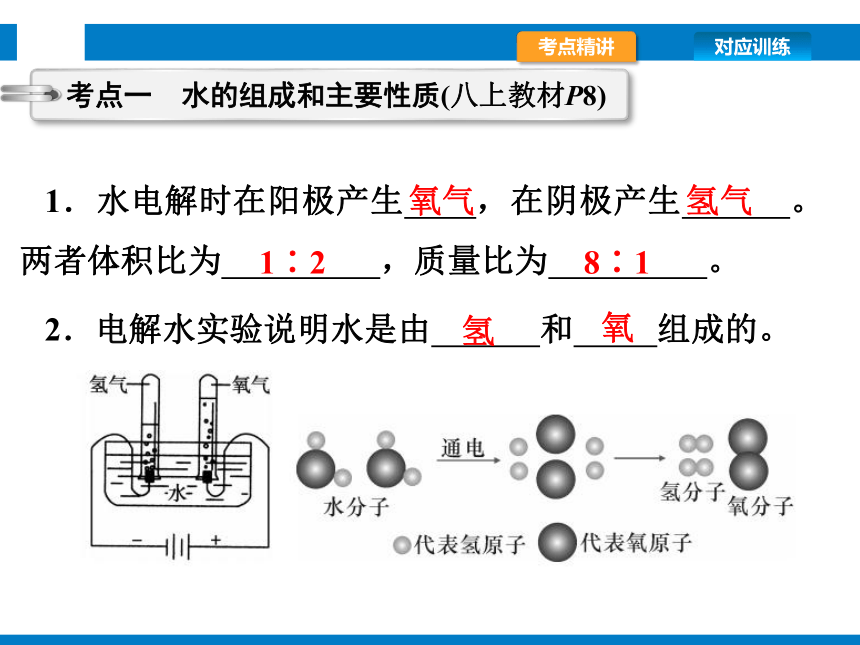
1.水电解时在阳极产生 ,在阴极产生 。两者体积比为 ,质量比为 。
2.电解水实验说明水是由 和 组成的。
考点一 水的组成和主要性质(八上教材P8)
氧气
氢气
1∶2
8∶1
氢
氧
3.水的性质
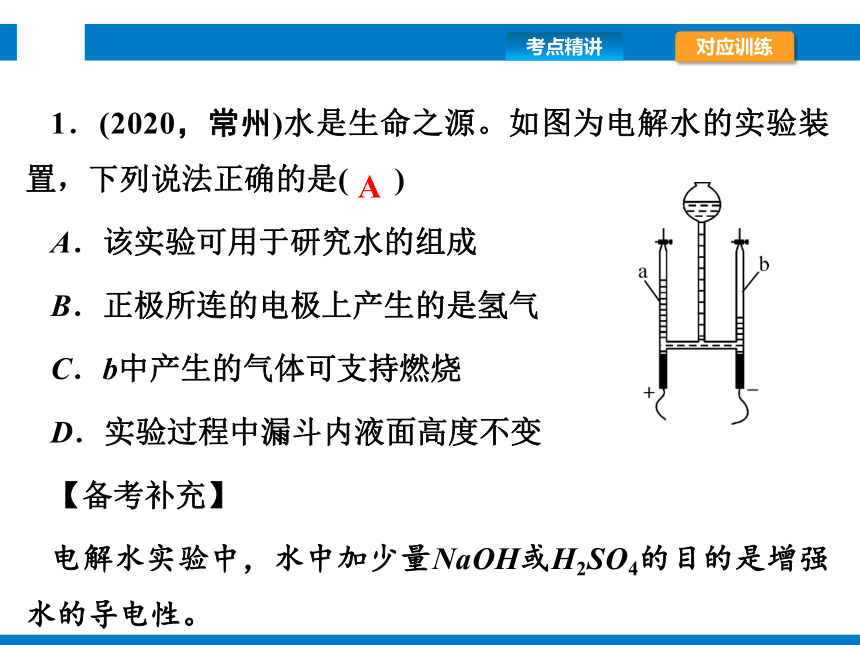
1.(2020,常州)水是生命之源。如图为电解水的实验装置,下列说法正确的是( )
A.该实验可用于研究水的组成
B.正极所连的电极上产生的是氢气
C.b中产生的气体可支持燃烧
D.实验过程中漏斗内液面高度不变
【备考补充】
电解水实验中,水中加少量NaOH或H2SO4的目的是增强水的导电性。
A
1.溶液的组成
溶液由 和 组成。被溶解的物质称为溶质,能溶解其他物质的物质称为溶剂,如碘酒中碘是溶质,酒精是溶剂。
2.水是最常用的 ,除水外常用的溶剂还有
等。
考点二 溶液、悬浊液和乳浊液(八上教材P20)
溶质
溶剂
溶剂
汽油、酒精
3.溶液、浊液的比较
2.(2020,长沙)在“停课不停学”期间,小兰同学通过网课学习了溶液的形成后,将少量下列物质分别放入水中并充分搅拌,其中不能形成溶液的是( )
A.白砂糖
B.食盐
C.纯碱
D.植物油
D
1.在一定温度下,在一定量的溶剂里, 某种溶质的溶液称为这种溶质的 ,还能继续溶解某种溶质的溶液称为这种溶质的 。
2.饱和溶液和不饱和溶液一般情况下可相互转化:
不饱和溶液 饱和溶液
考点三 饱和溶液与不饱和溶液、溶解度(八上教材P27)
不能继续溶解
饱和溶液
不饱和溶液
3.影响溶解性的因素:①溶质、溶剂自身的性质;② ;③气体的溶解度还受 的影响。
4.溶解度的含义:在一定温度下,溶质在 水中达到 状态时所溶解的克数,就称作该温度下某物质的 。
温度
压强
100g
饱和
溶解度
3.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
D
1.溶液中溶质质量分数:溶质质量与溶液质量之比。
2.意义:能定量表示溶液的组成,可用小数或百分数表示。
3.溶液中溶质的质量分数=
4.配制一定溶质质量分数的溶液(详见实验突破)
考点四 溶质的质量分数(八上教材P29)
1.水污染的主要来源:工业生产中的“三废”;生活污水的任意排放;农业生产中的农药、化肥的流失。
2.水净化的方法:吸附、沉淀[KAl(SO4)2·12H2O(明矾)]、 、蒸馏。
3.水污染的防治:加强对水质的监测;工业“三废”经过处理后再排放;农业生产中要合理使用化肥和农药等。
考点五 水污染(八上教材P42)
过滤
4.(2020,滨州)下列有关溶液的说法错误的是( )
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
D
实验突破
一定溶质质量分数的氯化钠溶液的配制
一、用氯化钠固体配制溶液
1.所需仪器及作用
(1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。
(2)仪器的作用:
a.玻璃棒的作用是 ,目的是加快固体或液体溶质的溶解速率;
b.量筒的作用是 液体的体积。
搅拌
量取
2.操作步骤
计算:计算所需溶质的 和水的 。
称量:用 称取一定质量的固体。
量取:用 量取一定体积的水。
质量
体积
托盘天平
量筒
溶解:将固体倒入烧杯中,再将量取的水倒入烧杯中,用 不断搅拌直至固体完全溶解。
装瓶:将配制好的溶液转移到 中,并贴上标签。
玻璃棒
试剂瓶
【知识拓展】 实验误差分析
操作
误差分析
所配溶液的
溶质质量分数
用天平称量固体药品质量时,固体药品和砝码放反了(在使用游码的情况下)
称量的固体药品的实际质量 _
____
偏小
偏小
量取水的体积时仰视读数
配制的溶液中水的实际体积
量取水的体积时俯视读数
配制的溶液中水的实际体积
烧杯内原来有少量的水
配制的溶液中水的质量
将固体药品倒入烧杯中时撒在外面
配制的溶液中溶质的质量
固体药品中含有不溶性杂质
配制的溶液中溶质的质量
配制完成后,转移过程中有少量溶液洒出
配制的溶液中溶质的质量
偏大
偏小
偏小
偏大
偏大
偏小
偏小
偏小
偏小
偏小
偏小
不变
二、用浓溶液配制稀溶液
1.所需仪器:量筒、胶头滴管、烧杯、玻璃棒。
3.操作步骤:
(1)计算:计算所需 的体积和所需水的体积。
浓溶液
(2)量取:用 量取溶液(接近所需体积时改用
)和水。
(3)混匀:将量取的浓溶液和水倒入烧杯中并用
不断搅拌。
量筒
胶头滴管
玻璃棒
精讲释疑
要熟练判断常见的溶液和浊液(悬浊液和乳浊液)。溶液和浊液的区别是前者均一、稳定,静置后不分层,后者不稳定,静置后会分层。浊液分为悬浊液和乳浊液,两者的区别是前者是固体小颗粒悬浮于液体中,后者是小液滴分散在另一种液体中。
题型一 溶液和浊液
【例1】 (2019,衡阳)溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是( )
A.碘酒 B.食醋
C.生理盐水 D.牛奶
D
1.溶液的知识广泛用于生产、生活中。下列有关溶液说法正确的是( )
A.碘溶于水得到碘酒
B.溶液是均一的、稳定的混合物
C.洗涤剂去油污的原理是溶解
D.植物油加入水中可得溶液
B
饱和溶液和不饱和溶液的区别是前者不可再溶解某种溶质,后者还可以溶解该种溶质。同种溶液两者是可以相互转化的,要熟练掌握两者转化的条件。另外要清楚饱和溶液与浓溶液、不饱和溶液与稀溶液的关系。
题型二 饱和溶液和不饱和溶液途
【例2】 硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示。则下列说法正确的是( )
A.硫酸镁的溶解度随温度升高而增大
B.10℃时,27.7 g硫酸镁和72.3 g水可配制成质量分数为27.7%的硫酸镁溶液
温度/℃
10
30
50
70
90
溶解度/g
27.7
39.3
49.0
54.1
51.1
C
C.50℃时,100 g的硫酸镁饱和溶液中溶质和溶剂的质量比为49∶100
D.70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大
2.(2020,武汉)将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是____(填字母编号)。
(2)0℃时,物质X的溶解度是 。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是 (填字母编号)。
B
20g
AB
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
【例3】 (2019,台州)某同学进行硫酸铜晶体(化学式为CuSO4·5H2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
题型三 溶质质量分数的计算
(1)能判断原硫酸铜溶液已饱和的方法是____。
A.观察颜色,溶液蓝色较深
B.溶液冷却,有蓝色晶体析出
C.蒸发少量水,有蓝色晶体析出
D.加入硫酸铜晶体,晶体质量不变
D
(2)现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。
3.“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶75 g溶质质量分数为10%的氯化钠溶液,需氯化钠的质量 g。
(2)请用图中的序号表示配制溶液的正确操作顺序
。
7.5
④②③⑤①
(3)认真观察,图中某步骤错误,写出该步骤的正确操作为 。若不进行改正,其他操作步骤正确,则所配制溶液的溶质的质量分数 (填“大于”“小于”或“等于”)10%。
(4)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,问需要15%的氯化钠溶液 克,向其中加入 克水可配得120克5%的氯化钠溶液。
称量时应该把药品放在左盘,把砝码放在右盘
小于
40
80
诊断自测
1.(2019,杭州)如图是教材中用来表示电解水过程的示意图(其中“ ”“ ”分别表示H原子和O原子)。分析示意图,可作出的正确判断是( )
A.常温常压下水可以发生分解反应
B.电解水的最终产物是H、O原子
C.H原子是图示微粒中的最小微粒
D.O原子只有在通电条件下才能转化为O2分子
C
2.(2020,安徽)理论上电解水得到氧气和氢气的体积比为1∶2,某同学用碳棒作电极进行电解水实验,得到氧气和氢气的体积比小于1∶2,对产生此现象原因的猜想不合理的是( )
A.部分氧气溶于水
B.部分氧气与碳棒反应
C.部分氧气被碳棒吸附
D.部分氧气与氢气反应重新生成了水
D
3.(2020,郴州)医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是( )
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
C
4.(2020,呼和浩特)下表是甲和乙在不同温度时水中的溶解度,根据此表回答:
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是____。
(2)在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为 g。
温度/℃
10
20
30
40
50
溶解度/g
甲
30
33
35
38
41
乙
21
31
45
65
88
乙
135
(3)由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度x g。则x取值范围是 。
33<x<35
(4)某同学取甲、乙中的一种物质,按如图所示进行实验,下列有关说法不正确的是 (填序号)。
①烧杯中加入的是乙
②W取值为50
③40℃时,甲、乙的饱和溶液中溶质的质量乙>甲
④将等质量的甲、乙分别加入等质量的水中,所得溶液的溶质质量分数甲=乙
②③④
5.(2019,衡阳)某同学配制25g 3%的NaCl溶液,整个操作过程如图所示。
回答下列问题:
(1)配制溶液的正确操作顺序为 (填序号),其中操作错误的是 。(填序号)
②①⑤③④
①
(2)用量筒量取液体时,读数时视线要与量筒内
保持水平。
(3)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 。
凹液面的最低处
用量筒量取水时,仰视液面读数
思维导图
考点扫描
1.水电解时在阳极产生 ,在阴极产生 。两者体积比为 ,质量比为 。
2.电解水实验说明水是由 和 组成的。
考点一 水的组成和主要性质(八上教材P8)
氧气
氢气
1∶2
8∶1
氢
氧
3.水的性质
1.(2020,常州)水是生命之源。如图为电解水的实验装置,下列说法正确的是( )
A.该实验可用于研究水的组成
B.正极所连的电极上产生的是氢气
C.b中产生的气体可支持燃烧
D.实验过程中漏斗内液面高度不变
【备考补充】
电解水实验中,水中加少量NaOH或H2SO4的目的是增强水的导电性。
A
1.溶液的组成
溶液由 和 组成。被溶解的物质称为溶质,能溶解其他物质的物质称为溶剂,如碘酒中碘是溶质,酒精是溶剂。
2.水是最常用的 ,除水外常用的溶剂还有
等。
考点二 溶液、悬浊液和乳浊液(八上教材P20)
溶质
溶剂
溶剂
汽油、酒精
3.溶液、浊液的比较
2.(2020,长沙)在“停课不停学”期间,小兰同学通过网课学习了溶液的形成后,将少量下列物质分别放入水中并充分搅拌,其中不能形成溶液的是( )
A.白砂糖
B.食盐
C.纯碱
D.植物油
D
1.在一定温度下,在一定量的溶剂里, 某种溶质的溶液称为这种溶质的 ,还能继续溶解某种溶质的溶液称为这种溶质的 。
2.饱和溶液和不饱和溶液一般情况下可相互转化:
不饱和溶液 饱和溶液
考点三 饱和溶液与不饱和溶液、溶解度(八上教材P27)
不能继续溶解
饱和溶液
不饱和溶液
3.影响溶解性的因素:①溶质、溶剂自身的性质;② ;③气体的溶解度还受 的影响。
4.溶解度的含义:在一定温度下,溶质在 水中达到 状态时所溶解的克数,就称作该温度下某物质的 。
温度
压强
100g
饱和
溶解度
3.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深
B.砂糖水味道很甜
C.砂糖溶解得很快
D.砂糖固体有剩余
D
1.溶液中溶质质量分数:溶质质量与溶液质量之比。
2.意义:能定量表示溶液的组成,可用小数或百分数表示。
3.溶液中溶质的质量分数=
4.配制一定溶质质量分数的溶液(详见实验突破)
考点四 溶质的质量分数(八上教材P29)
1.水污染的主要来源:工业生产中的“三废”;生活污水的任意排放;农业生产中的农药、化肥的流失。
2.水净化的方法:吸附、沉淀[KAl(SO4)2·12H2O(明矾)]、 、蒸馏。
3.水污染的防治:加强对水质的监测;工业“三废”经过处理后再排放;农业生产中要合理使用化肥和农药等。
考点五 水污染(八上教材P42)
过滤
4.(2020,滨州)下列有关溶液的说法错误的是( )
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
D
实验突破
一定溶质质量分数的氯化钠溶液的配制
一、用氯化钠固体配制溶液
1.所需仪器及作用
(1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。
(2)仪器的作用:
a.玻璃棒的作用是 ,目的是加快固体或液体溶质的溶解速率;
b.量筒的作用是 液体的体积。
搅拌
量取
2.操作步骤
计算:计算所需溶质的 和水的 。
称量:用 称取一定质量的固体。
量取:用 量取一定体积的水。
质量
体积
托盘天平
量筒
溶解:将固体倒入烧杯中,再将量取的水倒入烧杯中,用 不断搅拌直至固体完全溶解。
装瓶:将配制好的溶液转移到 中,并贴上标签。
玻璃棒
试剂瓶
【知识拓展】 实验误差分析
操作
误差分析
所配溶液的
溶质质量分数
用天平称量固体药品质量时,固体药品和砝码放反了(在使用游码的情况下)
称量的固体药品的实际质量 _
____
偏小
偏小
量取水的体积时仰视读数
配制的溶液中水的实际体积
量取水的体积时俯视读数
配制的溶液中水的实际体积
烧杯内原来有少量的水
配制的溶液中水的质量
将固体药品倒入烧杯中时撒在外面
配制的溶液中溶质的质量
固体药品中含有不溶性杂质
配制的溶液中溶质的质量
配制完成后,转移过程中有少量溶液洒出
配制的溶液中溶质的质量
偏大
偏小
偏小
偏大
偏大
偏小
偏小
偏小
偏小
偏小
偏小
不变
二、用浓溶液配制稀溶液
1.所需仪器:量筒、胶头滴管、烧杯、玻璃棒。
3.操作步骤:
(1)计算:计算所需 的体积和所需水的体积。
浓溶液
(2)量取:用 量取溶液(接近所需体积时改用
)和水。
(3)混匀:将量取的浓溶液和水倒入烧杯中并用
不断搅拌。
量筒
胶头滴管
玻璃棒
精讲释疑
要熟练判断常见的溶液和浊液(悬浊液和乳浊液)。溶液和浊液的区别是前者均一、稳定,静置后不分层,后者不稳定,静置后会分层。浊液分为悬浊液和乳浊液,两者的区别是前者是固体小颗粒悬浮于液体中,后者是小液滴分散在另一种液体中。
题型一 溶液和浊液
【例1】 (2019,衡阳)溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是( )
A.碘酒 B.食醋
C.生理盐水 D.牛奶
D
1.溶液的知识广泛用于生产、生活中。下列有关溶液说法正确的是( )
A.碘溶于水得到碘酒
B.溶液是均一的、稳定的混合物
C.洗涤剂去油污的原理是溶解
D.植物油加入水中可得溶液
B
饱和溶液和不饱和溶液的区别是前者不可再溶解某种溶质,后者还可以溶解该种溶质。同种溶液两者是可以相互转化的,要熟练掌握两者转化的条件。另外要清楚饱和溶液与浓溶液、不饱和溶液与稀溶液的关系。
题型二 饱和溶液和不饱和溶液途
【例2】 硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示。则下列说法正确的是( )
A.硫酸镁的溶解度随温度升高而增大
B.10℃时,27.7 g硫酸镁和72.3 g水可配制成质量分数为27.7%的硫酸镁溶液
温度/℃
10
30
50
70
90
溶解度/g
27.7
39.3
49.0
54.1
51.1
C
C.50℃时,100 g的硫酸镁饱和溶液中溶质和溶剂的质量比为49∶100
D.70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大
2.(2020,武汉)将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是____(填字母编号)。
(2)0℃时,物质X的溶解度是 。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是 (填字母编号)。
B
20g
AB
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
【例3】 (2019,台州)某同学进行硫酸铜晶体(化学式为CuSO4·5H2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
题型三 溶质质量分数的计算
(1)能判断原硫酸铜溶液已饱和的方法是____。
A.观察颜色,溶液蓝色较深
B.溶液冷却,有蓝色晶体析出
C.蒸发少量水,有蓝色晶体析出
D.加入硫酸铜晶体,晶体质量不变
D
(2)现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。
3.“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶75 g溶质质量分数为10%的氯化钠溶液,需氯化钠的质量 g。
(2)请用图中的序号表示配制溶液的正确操作顺序
。
7.5
④②③⑤①
(3)认真观察,图中某步骤错误,写出该步骤的正确操作为 。若不进行改正,其他操作步骤正确,则所配制溶液的溶质的质量分数 (填“大于”“小于”或“等于”)10%。
(4)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,问需要15%的氯化钠溶液 克,向其中加入 克水可配得120克5%的氯化钠溶液。
称量时应该把药品放在左盘,把砝码放在右盘
小于
40
80
诊断自测
1.(2019,杭州)如图是教材中用来表示电解水过程的示意图(其中“ ”“ ”分别表示H原子和O原子)。分析示意图,可作出的正确判断是( )
A.常温常压下水可以发生分解反应
B.电解水的最终产物是H、O原子
C.H原子是图示微粒中的最小微粒
D.O原子只有在通电条件下才能转化为O2分子
C
2.(2020,安徽)理论上电解水得到氧气和氢气的体积比为1∶2,某同学用碳棒作电极进行电解水实验,得到氧气和氢气的体积比小于1∶2,对产生此现象原因的猜想不合理的是( )
A.部分氧气溶于水
B.部分氧气与碳棒反应
C.部分氧气被碳棒吸附
D.部分氧气与氢气反应重新生成了水
D
3.(2020,郴州)医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是( )
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
C
4.(2020,呼和浩特)下表是甲和乙在不同温度时水中的溶解度,根据此表回答:
(1)从表中数据可以看出,两种物质的溶解度受温度影响变化较大的是____。
(2)在30℃时,100g水中加入50g甲,充分搅拌后得到的溶液质量为 g。
温度/℃
10
20
30
40
50
溶解度/g
甲
30
33
35
38
41
乙
21
31
45
65
88
乙
135
(3)由表中的数据分析可知,甲和乙在某一温度时具有相同的溶解度x g。则x取值范围是 。
33<x<35
(4)某同学取甲、乙中的一种物质,按如图所示进行实验,下列有关说法不正确的是 (填序号)。
①烧杯中加入的是乙
②W取值为50
③40℃时,甲、乙的饱和溶液中溶质的质量乙>甲
④将等质量的甲、乙分别加入等质量的水中,所得溶液的溶质质量分数甲=乙
②③④
5.(2019,衡阳)某同学配制25g 3%的NaCl溶液,整个操作过程如图所示。
回答下列问题:
(1)配制溶液的正确操作顺序为 (填序号),其中操作错误的是 。(填序号)
②①⑤③④
①
(2)用量筒量取液体时,读数时视线要与量筒内
保持水平。
(3)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 。
凹液面的最低处
用量筒量取水时,仰视液面读数
同课章节目录
