第二节 离子反应 课件(23张PPT)
文档属性
| 名称 | 第二节 离子反应 课件(23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-05-31 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
人教版高中化学必修第一册第一章
第二节 离子反应
电解质的电离
问题:
夏天天热,出了很多汗(主要成分NaCl)的手不能去接触电器或擦拭电器,否则容易发生触电事故。小组讨论,结合所学,解释原因。
电解质的电离
【任务】观察氯化钠固体、蒸馏水、氯化钠溶液、熔融氯化钠的导电实验,描述现象,得出结论。
实验结果:
导电性实验表明,干燥的氯化钠固体,蒸馏水均不能使小灯泡发亮,而氯化钠溶液和熔融氯化钠可导电。
电解质的电离
思考:为什么氯化钠在干燥时不导电,而溶于水或熔融状态时会导电呢?
电解质的电离
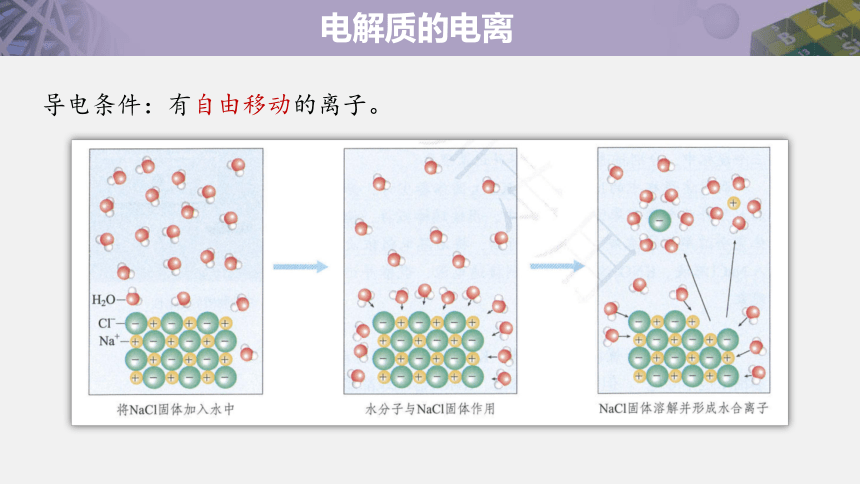
导电条件:有自由移动的离子。
电解质的电离
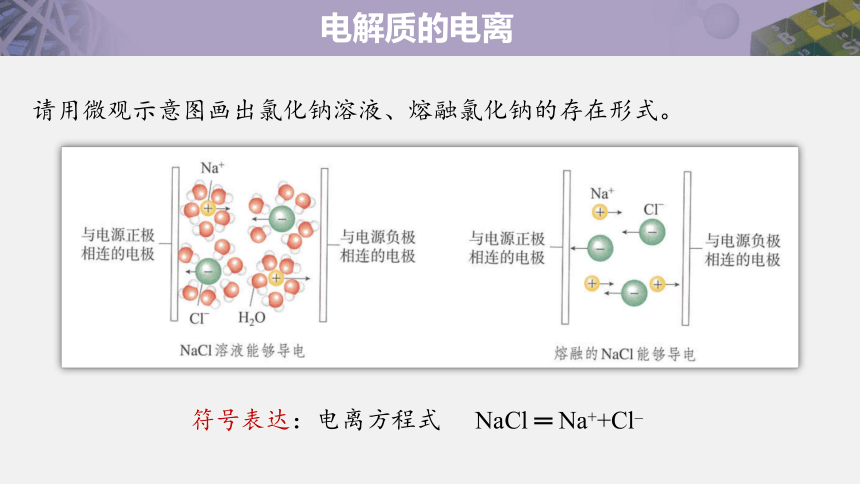
请用微观示意图画出氯化钠溶液、熔融氯化钠的存在形式。
符号表达:电离方程式
NaCl ═ Na++Cl
【讨论】形成离子的过程必须要通电吗?
【化学史】十九世纪后期,瑞典化学家阿伦尼乌斯在前人研究的基础上,通过研究电解质稀溶液的导电性等,提出了电离模型,即电解质溶于水会自动地解离成离子,而不是当时流行的说法——离子是通电后才产生的,并对电解质的电离进行了定量计算,后发展成为近代电离理论,阿伦尼乌斯也因此获得1903年诺贝尔化学奖。
电解质的电离过程本质
【结论】电解质溶于水或受热熔化时,会自动解离形成自由移动的离子,这一过程叫做电离。
电解质的电离
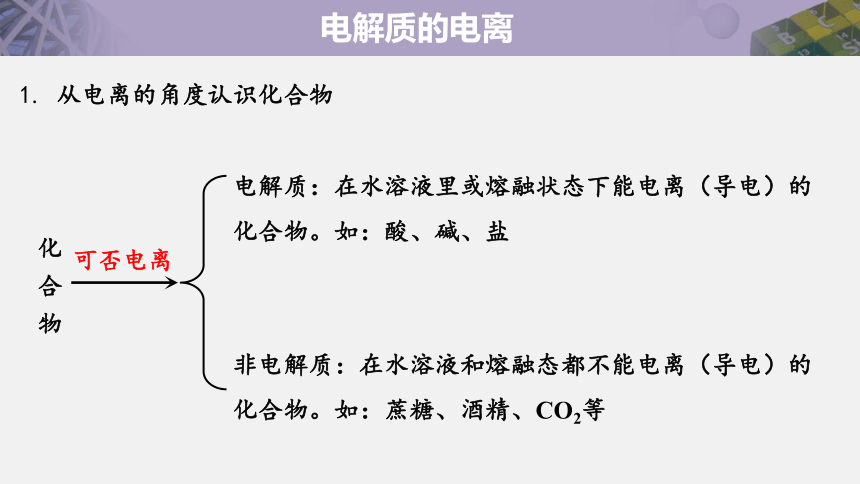
电解质:在水溶液里或熔融状态下能电离(导电)的化合物。如:酸、碱、盐
非电解质:在水溶液和熔融态都不能电离(导电)的化合物。如:蔗糖、酒精、CO2等
化 合 物
可否电离
1. 从电离的角度认识化合物
请从电离的角度归纳出酸、碱、盐的本质。
【练习】请书写下列物质的电离方程式
HCl、H2SO4、HNO3、
NaOH、Ca(OH)2、 Ba(OH)2、
Na2CO3、MgCl2
电解质的电离
电解质的电离
2. 从电离的角度定义酸、碱、盐(本质)
酸:凡电离时生成的阳离子全部是H+的化合物。
碱:凡电离时生成的阴离子全部是OH-的化合物。
盐:凡电离时生成金属阳离子(或NH4+)和酸根阴离子
的化合物。
【任务】通过实验观察氢氧化钡与硫酸滴定反应中小灯泡亮度的变化,分析水溶液中电解质的行为。
实验 宏观现象
1.将氢氧化钡固体加入水中 灯泡变亮
2.向其中滴入硫酸溶液 产生白色沉淀,灯泡变暗直至熄灭
3.继续向其中滴入硫酸溶液 灯泡又变亮
离子反应
【思考】请解释电导率图像变化趋势和拐点意义(电导率:溶液导电能力,与溶液中离子浓度有关)。
参考文献:刘春锋,离子反应【J】
离子反应
用化学用语表达上述过程:
离子反应
1. 灯泡变亮
Ba(OH)2 ═ Ba2+ + 2OH
2. 灯泡逐渐熄灭
3. 灯泡又变亮
H2SO4 ═ 2H+ + SO42-
Ba(OH)2 + H2SO4 ═ BaSO4↓+ 2H2O
微观本质:
Ba2+ + 2OH +2H+ + SO42- ═ BaSO4↓+ 2H2O
离子反应基本概念
离子反应:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
离子方程式:用实际参加反应的离子符号来表示反应的式子叫做离子方程式。
离子方程式书写:
(1)写:写出化学方程式
(2)拆:
(3)删:删去方程式两边不参加反应的离子,并化为最简
(4)查:检查方程式两边各元素的原子个数和电荷总数
体系中完全以离子形式存在的物质
离子反应基本概念
【拓展思考】若将硫酸换成硫酸氢钠,电导率又会如何变化?该过程的离子反应方程式如何书写?
离子反应基本概念
Ba2+ + 2OH +2H+ + SO42- ═ BaSO4↓+ 2H2O
Ba2+ + OH + H+ + SO42- ═ BaSO4↓+ H2O
NaHSO4少量:
NaHSO4过量:
1.盐酸与氢氧化钠溶液中和
H+ + OH = H2O
2.硫酸中加入氢氧化钾溶液
3.澄清石灰水中滴入硝酸
离子方程式的意义
【练习】请书写下列反应的离子方程式
1.表示真正参与反应的粒子——反应的实质
2.一个离子反应可代表一类化学反应
离子反应
【小结】复分解型离子反应发生的条件
(1)生成沉淀(难溶物质)
(2)生成气体(挥发性物质)
(3)生成水(难电离物质)
离子反应
【任务】设计实验方案,完成粗盐(主要成分:Na+、Cl-、Ca2+ 、Mg2+ 、SO42-、泥沙)精制过程,并书写该过程中涉及的离子方程式。
应用离子反应解决实际问题
离子反应应用
具体要求:
离子反应应用
(1)从离子角度认识粗盐的成分。
(2)依据微粒间相互作用及离子反应发生条件选择合适的试剂完成实验设计。
(3)从定量层面分析试剂的用量,并调整设计方案。
(4)书写该过程中的离子方程式。
Na+
Cl
Ca2+
Mg2+
SO42-
泥沙
过滤
过量BaCl2
过量NaOH
过量Na2CO3
Na+ Cl
CaCO3 ↓
Mg(OH)2 ↓
BaSO4 ↓
OH
溶解
过滤
过量
稀HCl
Na+ Cl H+
蒸发结晶
NaCl晶体
一贴、二低、三靠
Na+
Cl
Ca2+
Mg2+
SO42-
试剂选择、用量、顺序
离子反应应用
粗盐精制:
【小结】分析电解质在水溶液中行为的基本思路
离子反应应用
谢
谢
看
观
谢
谢
看
观
谢
谢
看
观
人教版高中化学必修第一册第一章
第二节 离子反应
电解质的电离
问题:
夏天天热,出了很多汗(主要成分NaCl)的手不能去接触电器或擦拭电器,否则容易发生触电事故。小组讨论,结合所学,解释原因。
电解质的电离
【任务】观察氯化钠固体、蒸馏水、氯化钠溶液、熔融氯化钠的导电实验,描述现象,得出结论。
实验结果:
导电性实验表明,干燥的氯化钠固体,蒸馏水均不能使小灯泡发亮,而氯化钠溶液和熔融氯化钠可导电。
电解质的电离
思考:为什么氯化钠在干燥时不导电,而溶于水或熔融状态时会导电呢?
电解质的电离
导电条件:有自由移动的离子。
电解质的电离
请用微观示意图画出氯化钠溶液、熔融氯化钠的存在形式。
符号表达:电离方程式
NaCl ═ Na++Cl
【讨论】形成离子的过程必须要通电吗?
【化学史】十九世纪后期,瑞典化学家阿伦尼乌斯在前人研究的基础上,通过研究电解质稀溶液的导电性等,提出了电离模型,即电解质溶于水会自动地解离成离子,而不是当时流行的说法——离子是通电后才产生的,并对电解质的电离进行了定量计算,后发展成为近代电离理论,阿伦尼乌斯也因此获得1903年诺贝尔化学奖。
电解质的电离过程本质
【结论】电解质溶于水或受热熔化时,会自动解离形成自由移动的离子,这一过程叫做电离。
电解质的电离
电解质:在水溶液里或熔融状态下能电离(导电)的化合物。如:酸、碱、盐
非电解质:在水溶液和熔融态都不能电离(导电)的化合物。如:蔗糖、酒精、CO2等
化 合 物
可否电离
1. 从电离的角度认识化合物
请从电离的角度归纳出酸、碱、盐的本质。
【练习】请书写下列物质的电离方程式
HCl、H2SO4、HNO3、
NaOH、Ca(OH)2、 Ba(OH)2、
Na2CO3、MgCl2
电解质的电离
电解质的电离
2. 从电离的角度定义酸、碱、盐(本质)
酸:凡电离时生成的阳离子全部是H+的化合物。
碱:凡电离时生成的阴离子全部是OH-的化合物。
盐:凡电离时生成金属阳离子(或NH4+)和酸根阴离子
的化合物。
【任务】通过实验观察氢氧化钡与硫酸滴定反应中小灯泡亮度的变化,分析水溶液中电解质的行为。
实验 宏观现象
1.将氢氧化钡固体加入水中 灯泡变亮
2.向其中滴入硫酸溶液 产生白色沉淀,灯泡变暗直至熄灭
3.继续向其中滴入硫酸溶液 灯泡又变亮
离子反应
【思考】请解释电导率图像变化趋势和拐点意义(电导率:溶液导电能力,与溶液中离子浓度有关)。
参考文献:刘春锋,离子反应【J】
离子反应
用化学用语表达上述过程:
离子反应
1. 灯泡变亮
Ba(OH)2 ═ Ba2+ + 2OH
2. 灯泡逐渐熄灭
3. 灯泡又变亮
H2SO4 ═ 2H+ + SO42-
Ba(OH)2 + H2SO4 ═ BaSO4↓+ 2H2O
微观本质:
Ba2+ + 2OH +2H+ + SO42- ═ BaSO4↓+ 2H2O
离子反应基本概念
离子反应:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
离子方程式:用实际参加反应的离子符号来表示反应的式子叫做离子方程式。
离子方程式书写:
(1)写:写出化学方程式
(2)拆:
(3)删:删去方程式两边不参加反应的离子,并化为最简
(4)查:检查方程式两边各元素的原子个数和电荷总数
体系中完全以离子形式存在的物质
离子反应基本概念
【拓展思考】若将硫酸换成硫酸氢钠,电导率又会如何变化?该过程的离子反应方程式如何书写?
离子反应基本概念
Ba2+ + 2OH +2H+ + SO42- ═ BaSO4↓+ 2H2O
Ba2+ + OH + H+ + SO42- ═ BaSO4↓+ H2O
NaHSO4少量:
NaHSO4过量:
1.盐酸与氢氧化钠溶液中和
H+ + OH = H2O
2.硫酸中加入氢氧化钾溶液
3.澄清石灰水中滴入硝酸
离子方程式的意义
【练习】请书写下列反应的离子方程式
1.表示真正参与反应的粒子——反应的实质
2.一个离子反应可代表一类化学反应
离子反应
【小结】复分解型离子反应发生的条件
(1)生成沉淀(难溶物质)
(2)生成气体(挥发性物质)
(3)生成水(难电离物质)
离子反应
【任务】设计实验方案,完成粗盐(主要成分:Na+、Cl-、Ca2+ 、Mg2+ 、SO42-、泥沙)精制过程,并书写该过程中涉及的离子方程式。
应用离子反应解决实际问题
离子反应应用
具体要求:
离子反应应用
(1)从离子角度认识粗盐的成分。
(2)依据微粒间相互作用及离子反应发生条件选择合适的试剂完成实验设计。
(3)从定量层面分析试剂的用量,并调整设计方案。
(4)书写该过程中的离子方程式。
Na+
Cl
Ca2+
Mg2+
SO42-
泥沙
过滤
过量BaCl2
过量NaOH
过量Na2CO3
Na+ Cl
CaCO3 ↓
Mg(OH)2 ↓
BaSO4 ↓
OH
溶解
过滤
过量
稀HCl
Na+ Cl H+
蒸发结晶
NaCl晶体
一贴、二低、三靠
Na+
Cl
Ca2+
Mg2+
SO42-
试剂选择、用量、顺序
离子反应应用
粗盐精制:
【小结】分析电解质在水溶液中行为的基本思路
离子反应应用
谢
谢
看
观
谢
谢
看
观
谢
谢
看
观
