人教新课标版高中必修二第二章 化学反应与能量单元测试
文档属性
| 名称 | 人教新课标版高中必修二第二章 化学反应与能量单元测试 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-03-31 21:17:09 | ||
图片预览



文档简介
人教新课标版高中必修二第二章 化学反应与能量单元测试
[知能分级 拓展训练]
一、选择题(共51分)
1.21世纪人类正由“化石能源时代逐步向多能源时代”过渡,下列不属于新能源的是( )
A.电力 B.核能
C.太阳能 D.氢能
2.关于锌一铜合金和稀H2SO4构成的原电池的下列说法中正确的是( )
A.锌是正极,铜是负极
B.电子从铜片经导线流向锌片
C.负极的反应式为2H++2e-====H2↑
D.反应一段时间后溶液pH升高
3.下列各组溶液,同时开始反应,出现浑浊最早的是( )
A.10 ℃时5 mL 0.1 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
B.10 ℃时5 mL 0.5 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
C.20 ℃时5 mL 0.1 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
D.20 ℃时5 mL 0.5 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
4.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图2-31所示:
图2-31
下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)Z(g)
5.将a、b、c、d四块金属浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,d上有气体逸出,a、c相连时,a极减轻;b、d相连时,b为正极。则四种金属活动性顺序为( )
A.a>b>c>d B.a>c>b>d
C.a>c>d>b D.d>b>c>a
6.如图2-32所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
图2-32
A.②①③ B.①②③
C.③①② D.③②①
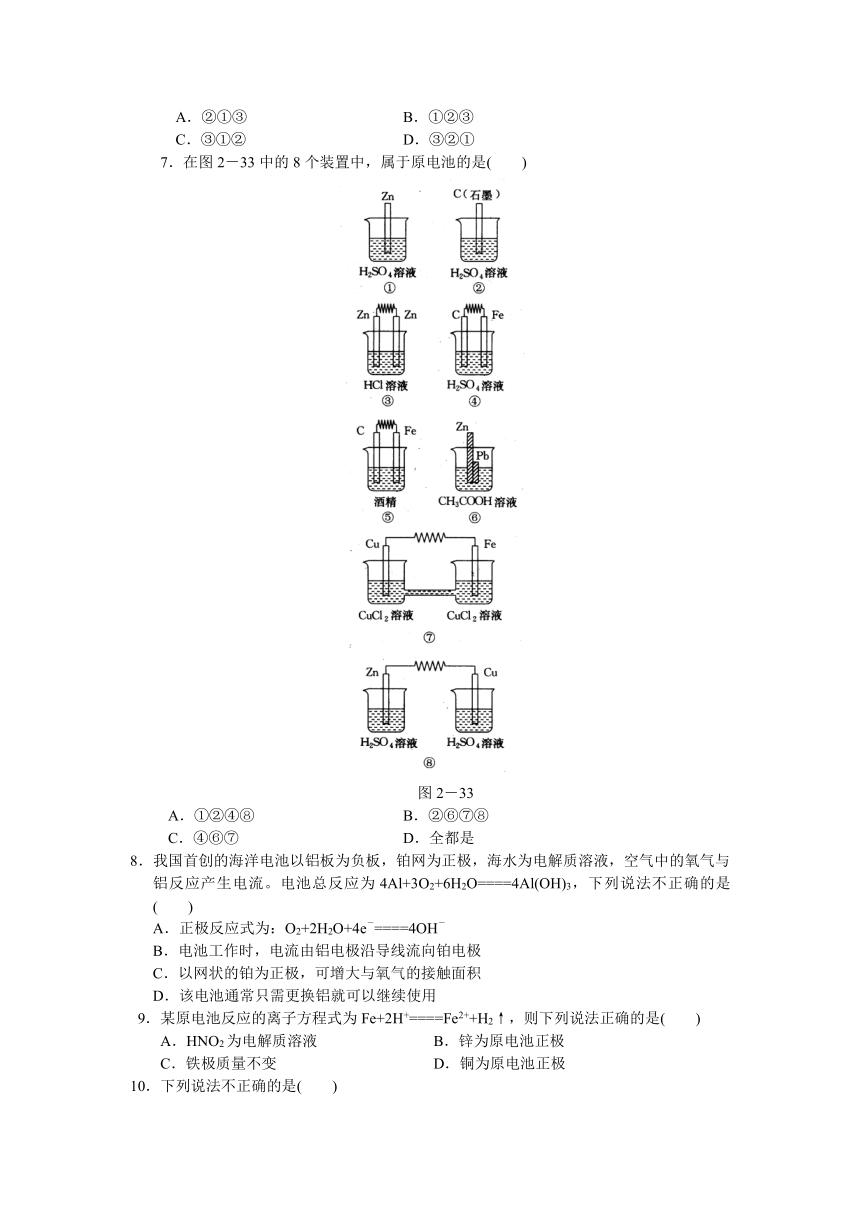
7.在图2-33中的8个装置中,属于原电池的是( )
图2-33
A.①②④⑧ B.②⑥⑦⑧
C.④⑥⑦ D.全都是
8.我国首创的海洋电池以铝板为负板,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O====4Al(OH)3,下列说法不正确的是( )
A.正极反应式为:O2+2H2O+4e-====4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝就可以继续使用
9.某原电池反应的离子方程式为Fe+2H+====Fe2++H2↑,则下列说法正确的是( )
A.HNO2为电解质溶液 B.锌为原电池正极
C.铁极质量不变 D.铜为原电池正极
10.下列说法不正确的是( )
A.当今社会人们所需要能量的绝大部分是由化学反应产生的
B.人类对于能源的利用处于化石能源时代
C.人体的生命活动所需要的能源是由氧化还原反应提供的
D.凡是放出热量的化学反应均可利用来造福人类
11.一种新型燃料电池,它以多孔的镍片为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其中总反应方程式为2C2H6+8KOH+7O2====4K2CO3+10H2O,下列有关该电池的叙述正确的是( )
A.负极反应7O2+14H2O+28e-====28OH-
B.电池放电一段时间溶液的pH会减小
C.每消耗1 mol C2H6,则电路中有14 mol电子通过
D.放电过程中KOH的物质的量浓度不变
12.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( )
A.HI的生成速率等于其分解速率
B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率
D.无法判断HI的生成速率和分解速率的相对大小
13.在一定温度下,向a L,密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)2Z(g)此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度比为1∶2∶2
D.单位时间内消耗0.1 mol X同时生成0.2 mol Z
14.t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+b(B)(g)cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体浓度为0.4 mol·L-1,下列叙述正确的是( )
A.重新达到平衡时,D的体积分数减小
B.a+bC.平衡向右移动
D.重新达到平衡时,A气体浓度增大
15.把稀硫酸倒在亚硫酸钠粉末上,能使反应的最初速率加快的是( )
A.增大亚硫酸钠粉末的量
B.硫酸浓度增大一倍,用量减少到原来的1/2
C.硫酸浓度不变,用量增大一倍
D.使反应在较高温度下进行
16.如图2-34所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧一杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
A.杠杆为导体和绝缘体时,均为A端高、B端低
B.杠杆为导体和绝缘体时,均为A端低、B端高
C.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低
D.当杠杆为绝缘体时,A端高、B端低;为导体时,A端低、B端高
17.100 mL浓度为2 mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成H2
的总量,可采用的方法是( )
A.加入适量的6 mol/L的盐酸
B.加入数滴CuCl2溶液
C.加入适量的蒸馏水
D.加入适量的NaCl溶液
二、非选择题(共49分)
18.(2007·广东化学)“碘钟”实验中,3I-++2的反应速率可以用I2-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c(S2)/mol·L-1 0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是__________________。
(2)显色时间t1=__________________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是
_____________________________________________________。
19.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为2H2+O2====2H2O,酸式氢氧燃料电池的电解质是酸,其负极反应可表示为2H2-4e-====4H+,其正极反应可表示为______________;碱式氢氧燃料电池的电解质是碱,其正极反应可表示为O2+2H2O+
4e-====4OH-;则其负极反应式可表示为___________________。
20.设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造出了一种燃料电池,一个电极通空气,另一个电极通入汽油蒸气。电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以丁烷代表汽油,这个电池放电时发生反应的化学方程式是___________________
(已知丁烷的分子式:C4H10)。
(2)这个电池的正极发生的反应是____________________________________,负极发生的反应是________________________;固体电解质里的O2-的移动方向是________________;向外电路释放电子的电极是____________。
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是__________________________________________。
(4)你认为ZrO2晶体里掺杂Y2O3用Y3+代替晶体里部分Zr2+对提高固体电解质的导电能力起什么作用 其可能的原因是什么
21.某温度时,在2 L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图2-35所示,由图中数据分析,该可逆反应的化学方程式为__________________;该反应开始至2 min,Z的平均反应速率为___________。
图2-35
22.利用Fe+Cu2+====Fe2++Cu反应,设计原电池。指出电极名称,写出电极反应式。
23.在一定条件下,在2 L密闭容器中发生反应3A(g)+B(g)====2C(g),开始时加入4 mol A、6 mol B、2 mol C,在2 min末时测得C的物质的量是3 mol。
(1)用A的浓度变化表示反应的平均速率为v(A)=___________;
(2)2 min末时,B的浓度为c(B)=__________;
(3)假定反应前后容器内的温度不变,求反应开始时和2 min末时容器内气体的压强之比为______________。
参考答案
1.A 解析:核能、太阳能、氢能均属于新能源,有广泛的开发潜能,而电力需要化石燃料的燃烧、水力等,属于常规能源。
2.D 解析:Zn比Cu活泼,在形成的原电池中,Zn是负极,铜是正极;电子从Zn片经导线流向Cu片;负极反应为Zn-2e-====Zn2+,正极反应为2H++2e-====H2↑;反应一段时间后,因c(H+)减小,故溶液的pH升高。答案为D。
3.D 解析:根据温度、浓度对反应速率的影响判断。A、C浓度相同,C温度高,所以C出现浑浊早;B、D浓度相同,D温度高,所以D出现浑浊早,C、D温度相同,但D浓度大,所以D出现浑浊最早。
4.C 解析:反应到10 s时,X减少1.20 mol-0.41 mol=0.79 mol,Y减少1.00 mol-0.21 mol=0.79 mol,Z增加1.58 mol,所以X、Y、Z的化学反应方程式为X(g)+Y(g)2Z(g),D错;用Z表示的反应速率应为=0.079 mol/(L·s),A错,X的物质的量浓度减少了=0.395 mol/L,B错;故正确答案为C。
5.C 解析:金属组成原电池,相对活泼的金属失去电子作负极,相对不活泼的金属作正极。负极被氧化质量减轻,正极上发生还原反应,有物质析出,由题意得活泼性a>b、c>d、a>c、d>b,则金属活动性顺序为a>c>d>b。
6.A 解析:本题考查金属腐蚀问题。金属腐蚀,从本质上讲也是组成化学电池发生氧化还原反应的结果。在原电池中,活泼金属为负极,该金属被氧化,不活泼金属便被保护起来,其被腐蚀的速率大大减小,所以装置③中的铁被腐蚀的速率比①中的慢;反之,当铁与比它不活泼的金属,如Sn、Cu等连接起来,则其被腐蚀的速率增大,所以在容器②中的铁比容器①中的铁腐蚀得快。
7.C 解析:①中只有Zn,②中只有石墨,③中两个都是Zn片,⑤中的酒精是非电解质溶液,⑧中没有形成闭合回路,所以这5种装置都不能构成原电池。而④、⑥、⑦三个装置可以构成原电池。答案为C。
8.B 解析:根据原电池的原理综合各选项判断。从电池的总反应式可知,Al为负极,铂网为正极,负极:Al-3e-====Al3+,正极:O2+2H2O+4e-====4OH-,电子从Al经外电路流向铂,电流的方向与电子的流向相反,从铂到铝,铂网面积大,反应速率加快。反应只消耗铝,故只需更换铝就可以继续使用。
9.D 解析:由电池反应的离子方程式可知,电池的负极应为铁,则正极应是活泼性比铁弱的金属,B错。在反应中负极不断被消耗,质量减小,C错。反应中放出了氢气并生成了Fe2+,电解质溶液不能是HNO3,A错。由上分析可知正确选项为D。
10.D 解析:不论是吸热反应还是放热反应,只有在人类的控制下才能造福人类。例如我们通过煤气的燃烧来烧水做饭,但森林发生火灾时的燃烧却给人类带来了灾难。
11.BC 解析:原电池中,失去电子的一极为负极,因此,A项错误。从总反应方程式上看,反应消耗KOH,所以溶液的pH会减小,KOH浓度发生改变。从关系式:2C2H6→7O2→28e-,所以1 mol C2H6反应时,电路中有14 mol e-通过。
12.B 解析:反应从HI分解开始到建立平衡的过程中,HI的分解速率一定大于HI的生成速率。只有这样,HI的分解速率越来越小,HI的生成速率越来越大,到达某一时刻才能建立化学平衡。答案为B。
13.AB 解析:正反应是气体体积缩小的反应,容器内压强不随时间变化时,即气体总物质的量不再变化,各物质的浓度也不再变化,表明该反应达到了平衡状态。
14.A 解析:恒温下,容器容积扩大1倍时,假定平衡不移动,则B的浓度将变为原来的一半,即由0.6 mol·L-1变为0.3 mol·L-1,现B气体多浓度为0.4 mol·L-1,说明平衡向生成B的方向移动了,即减压平衡逆向移动,故a+b>c+d,B、C项错,A项正确。重新达到平衡时尽管A、B物质的量均增大了,但因体积扩大,实际上容器A、B、C、D各物质浓度均减小了,D项错。
15.BD 解析:A固体物质和纯液体物质(不是溶的浓度是不变的。所以增加亚硫酸钠粉末并不改变其浓度,对反应速率无影响。B由于硫酸浓度增大一倍,所以反应的初始速率加快。至于硫酸用量的多少,只影响参加反应的物质的量的多少,而不影响反应速率,故B正确。C中硫酸的浓度没变,故对反应速率无影响。因提高温度反应速率加快,故D也是正确答案。
16.D 解析:若杠杆为导体则构成原电池,铁作负极失电子而溶解:Fe-2e-====Fe2+,溶液中Cu2+在正极(铜极)得电子生成铜,质量增大而下降,A端低,B端高;若杠杆为绝缘体,则铁球和CuSO4溶液发生置换反应生成Cu覆于表面质量增加,B端下降,即A端高,B端低。
17.B 解析:向溶液中再加入盐酸,增加了H+的物质的量,也就增加了放出H2的量,故A错误。因Zn是过量的。放出H2的量取决于盐酸的量,加入CuCl2后,有少量的Cu析出,附在锌片上,构成原电池,反应速率加快,故B正确。向原溶液中分别加水或NaCl溶液均引起溶液中c(H+)的减小,反应速率变慢,故C、D错误。
18.(1)研究反应物I-与S2的浓度对反应速率的影响
(2)29.3 s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度成反比)
解析:(1)从题干信息和实验数据可知该实验的目的是为了研究反应物I-与S2的浓度对反应速率的影响。
(2)根据①、②组数据可知t与c(I-)成反比,根据②、③组数据可知t与c(S2)成反比,可得出t=Kc(I-)c(S2)-1。将第一组数据代入得K=0.1408,将第⑤组代入得t1=0.1408×0.120-1×0.040-1=29.3 s。
(3)因升高温度反应速率增大,则显色时间t2应小于22.0 s。
(4)综合分析上述数据可推出化学反应速率与反应物起始浓度乘积成正比。
19.O2+4H++4e-====2H2O
2H2+4OH――4e-====4H2O
解析:此题有一个简便的解法,就是拿总反应去已知电极的电极反应式,便可求得另一未知的反应式。
20.(1)2C4H10+13O28CO2+10H2O
(2)13O2+52e-====26O2- 2C4H10+26O2--52e-====8CO2+10H2O 由正极流向负极 负极
(3)燃料具有较高的能量转化率
(4)为维持电荷平衡,晶体中O2-将减少,从而使O2-得以在电场作用下向负极移动。
解析:第(1)问要求写出汽油燃料电池放电时的反应化学方程式,燃料电池的制作原理就是燃料气体被氧化剂氧化而发生了氧化还原反应,所以该反应的化学方程式为2C4H10+13O2====8CO2+10H2O。第(2)问要求写出电池正负极的反应式。因为放电时,电池正极发生还原反应(元素化合价降低),负极发生氧化反应。所以正极反应式是13O2+52e-====26O2-,负极反应式是2C4H10+26O2--52e-====8CO2+10H2O。由上述电池正、负极反应可以看出,正极反应源源不断地产生O2-,负极反应要持续进行,则需要持续不断的供应O2-,故电池内O2-的移动方向是由正极流向负极。电池的负极发生氧化反应,失电子,因此外电路电子从负极流出。第(3)问考查了燃料电池的优点。燃料电池是将燃料燃烧所产生的化学能直接转化为电能的“能量转化器”,其能量转化率很高,可达70%以上,而内燃机的能量转化率较低。因此,该问答案应为燃料电池具有较高的能量转化率。第(4)问依据电荷守恒原理,得出掺有Y2O3的ZrO2晶体中
O2-减少了,致使晶体中O2-缺陷,从而使其在电场作用下向负极移动。
21.3X+Y2Z 0.05 mol/(L·min)
解析:从本题的图像分析可知,X、Y是随着反应的进行(时间的增加)物质的量逐渐减少,与此相反,Z的物质的量是随着反应的进行(时间的增加)而逐渐增大,所以X、Y在反应式的左边,为反应物;而Z在反应式的右边,为生成物。X、Y、Z在化学方程式中的化学计量数应通过其相应的速率之比确定。从图中的数据分析可知,用X、Y、Z表示的反应速率分别为:
v(Y)==0.025 mol/(L·min)
v(X)==0.075 mol/(L·min)
v(Z)= =0.05 mol/(L·min)
则v(X)∶v(Y)∶v(Z)=0.075∶0.025∶0.05=3∶1∶2
反应的化学方程式为:3X+Y2Z。
22.方案一 负极:Fe,电极反应式:Fe-2e-====Fe2+,正极:C,电极反应式:Cu2++2e-====Cu,电解质溶液是CuCl2溶液。
方案二 负极:Fe,电极反应式:Fe-2e-====Fe2+,正极;Cu,电极反应式:Cu2++2e-====Cu,电解质溶液是CuSO4溶液(其他合理答案也可以)
解析:因Fe失电子,故Fe必须作负极;Cu2+得电子,电解质溶液必须是含Cu2+的可溶性盐溶液,正极材料比Fe不活泼。以氧化还原反应为依托,设计原电池的正极、负极,以及电解质溶液和电极反应的题型,一般思路是氧化还原反应中的还原剂作负极;比它不活泼的金属材料(有时也可以是氧化剂)作正极;合适的电解质溶液。原电池设计好以后,两个电极反应式相加应得到原来的氧化还原反应。
23.(1)0.375 mol/(L·min)
(2)2.75 mol·L-1
(3)12∶11
解析:(1)v(A)=3/2v(C)=3/2×(3 mol-2 mol)÷2 L÷2 min=0.375 mol/(L·min);
(2)根据反应计量关系,生成1 mol C消耗0.5 mol的B,故2 min末时B为5.5 mol;
(3)反应开始时气体共有12 mol;2 min末时分别为A是2.5 mol、B是5.5 mol、C为3 mol,共11 mol。根据阿伏加德罗定律的推论(在同温同体积下气体的物质的量之比等于气体的压强之比)可解得答案。
[知能分级 拓展训练]
一、选择题(共51分)
1.21世纪人类正由“化石能源时代逐步向多能源时代”过渡,下列不属于新能源的是( )
A.电力 B.核能
C.太阳能 D.氢能
2.关于锌一铜合金和稀H2SO4构成的原电池的下列说法中正确的是( )
A.锌是正极,铜是负极
B.电子从铜片经导线流向锌片
C.负极的反应式为2H++2e-====H2↑
D.反应一段时间后溶液pH升高
3.下列各组溶液,同时开始反应,出现浑浊最早的是( )
A.10 ℃时5 mL 0.1 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
B.10 ℃时5 mL 0.5 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
C.20 ℃时5 mL 0.1 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
D.20 ℃时5 mL 0.5 mol·L-1 Na2S2O3与5 mL 0.1 mol·L-1 H2SO4溶液混合
4.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图2-31所示:
图2-31
下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)Z(g)
5.将a、b、c、d四块金属浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,d上有气体逸出,a、c相连时,a极减轻;b、d相连时,b为正极。则四种金属活动性顺序为( )
A.a>b>c>d B.a>c>b>d
C.a>c>d>b D.d>b>c>a
6.如图2-32所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
图2-32
A.②①③ B.①②③
C.③①② D.③②①
7.在图2-33中的8个装置中,属于原电池的是( )
图2-33
A.①②④⑧ B.②⑥⑦⑧
C.④⑥⑦ D.全都是
8.我国首创的海洋电池以铝板为负板,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O====4Al(OH)3,下列说法不正确的是( )
A.正极反应式为:O2+2H2O+4e-====4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝就可以继续使用
9.某原电池反应的离子方程式为Fe+2H+====Fe2++H2↑,则下列说法正确的是( )
A.HNO2为电解质溶液 B.锌为原电池正极
C.铁极质量不变 D.铜为原电池正极
10.下列说法不正确的是( )
A.当今社会人们所需要能量的绝大部分是由化学反应产生的
B.人类对于能源的利用处于化石能源时代
C.人体的生命活动所需要的能源是由氧化还原反应提供的
D.凡是放出热量的化学反应均可利用来造福人类
11.一种新型燃料电池,它以多孔的镍片为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其中总反应方程式为2C2H6+8KOH+7O2====4K2CO3+10H2O,下列有关该电池的叙述正确的是( )
A.负极反应7O2+14H2O+28e-====28OH-
B.电池放电一段时间溶液的pH会减小
C.每消耗1 mol C2H6,则电路中有14 mol电子通过
D.放电过程中KOH的物质的量浓度不变
12.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( )
A.HI的生成速率等于其分解速率
B.HI的生成速率小于其分解速率
C.HI的生成速率大于其分解速率
D.无法判断HI的生成速率和分解速率的相对大小
13.在一定温度下,向a L,密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)2Z(g)此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度比为1∶2∶2
D.单位时间内消耗0.1 mol X同时生成0.2 mol Z
14.t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+b(B)(g)cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体浓度为0.4 mol·L-1,下列叙述正确的是( )
A.重新达到平衡时,D的体积分数减小
B.a+b
D.重新达到平衡时,A气体浓度增大
15.把稀硫酸倒在亚硫酸钠粉末上,能使反应的最初速率加快的是( )
A.增大亚硫酸钠粉末的量
B.硫酸浓度增大一倍,用量减少到原来的1/2
C.硫酸浓度不变,用量增大一倍
D.使反应在较高温度下进行
16.如图2-34所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧一杯中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
A.杠杆为导体和绝缘体时,均为A端高、B端低
B.杠杆为导体和绝缘体时,均为A端低、B端高
C.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低
D.当杠杆为绝缘体时,A端高、B端低;为导体时,A端低、B端高
17.100 mL浓度为2 mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成H2
的总量,可采用的方法是( )
A.加入适量的6 mol/L的盐酸
B.加入数滴CuCl2溶液
C.加入适量的蒸馏水
D.加入适量的NaCl溶液
二、非选择题(共49分)
18.(2007·广东化学)“碘钟”实验中,3I-++2的反应速率可以用I2-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol·L-1 0.040 0.080 0.080 0.160 0.120
c(S2)/mol·L-1 0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是__________________。
(2)显色时间t1=__________________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是
_____________________________________________________。
19.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为2H2+O2====2H2O,酸式氢氧燃料电池的电解质是酸,其负极反应可表示为2H2-4e-====4H+,其正极反应可表示为______________;碱式氢氧燃料电池的电解质是碱,其正极反应可表示为O2+2H2O+
4e-====4OH-;则其负极反应式可表示为___________________。
20.设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造出了一种燃料电池,一个电极通空气,另一个电极通入汽油蒸气。电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以丁烷代表汽油,这个电池放电时发生反应的化学方程式是___________________
(已知丁烷的分子式:C4H10)。
(2)这个电池的正极发生的反应是____________________________________,负极发生的反应是________________________;固体电解质里的O2-的移动方向是________________;向外电路释放电子的电极是____________。
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是__________________________________________。
(4)你认为ZrO2晶体里掺杂Y2O3用Y3+代替晶体里部分Zr2+对提高固体电解质的导电能力起什么作用 其可能的原因是什么
21.某温度时,在2 L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图2-35所示,由图中数据分析,该可逆反应的化学方程式为__________________;该反应开始至2 min,Z的平均反应速率为___________。
图2-35
22.利用Fe+Cu2+====Fe2++Cu反应,设计原电池。指出电极名称,写出电极反应式。
23.在一定条件下,在2 L密闭容器中发生反应3A(g)+B(g)====2C(g),开始时加入4 mol A、6 mol B、2 mol C,在2 min末时测得C的物质的量是3 mol。
(1)用A的浓度变化表示反应的平均速率为v(A)=___________;
(2)2 min末时,B的浓度为c(B)=__________;
(3)假定反应前后容器内的温度不变,求反应开始时和2 min末时容器内气体的压强之比为______________。
参考答案
1.A 解析:核能、太阳能、氢能均属于新能源,有广泛的开发潜能,而电力需要化石燃料的燃烧、水力等,属于常规能源。
2.D 解析:Zn比Cu活泼,在形成的原电池中,Zn是负极,铜是正极;电子从Zn片经导线流向Cu片;负极反应为Zn-2e-====Zn2+,正极反应为2H++2e-====H2↑;反应一段时间后,因c(H+)减小,故溶液的pH升高。答案为D。
3.D 解析:根据温度、浓度对反应速率的影响判断。A、C浓度相同,C温度高,所以C出现浑浊早;B、D浓度相同,D温度高,所以D出现浑浊早,C、D温度相同,但D浓度大,所以D出现浑浊最早。
4.C 解析:反应到10 s时,X减少1.20 mol-0.41 mol=0.79 mol,Y减少1.00 mol-0.21 mol=0.79 mol,Z增加1.58 mol,所以X、Y、Z的化学反应方程式为X(g)+Y(g)2Z(g),D错;用Z表示的反应速率应为=0.079 mol/(L·s),A错,X的物质的量浓度减少了=0.395 mol/L,B错;故正确答案为C。
5.C 解析:金属组成原电池,相对活泼的金属失去电子作负极,相对不活泼的金属作正极。负极被氧化质量减轻,正极上发生还原反应,有物质析出,由题意得活泼性a>b、c>d、a>c、d>b,则金属活动性顺序为a>c>d>b。
6.A 解析:本题考查金属腐蚀问题。金属腐蚀,从本质上讲也是组成化学电池发生氧化还原反应的结果。在原电池中,活泼金属为负极,该金属被氧化,不活泼金属便被保护起来,其被腐蚀的速率大大减小,所以装置③中的铁被腐蚀的速率比①中的慢;反之,当铁与比它不活泼的金属,如Sn、Cu等连接起来,则其被腐蚀的速率增大,所以在容器②中的铁比容器①中的铁腐蚀得快。
7.C 解析:①中只有Zn,②中只有石墨,③中两个都是Zn片,⑤中的酒精是非电解质溶液,⑧中没有形成闭合回路,所以这5种装置都不能构成原电池。而④、⑥、⑦三个装置可以构成原电池。答案为C。
8.B 解析:根据原电池的原理综合各选项判断。从电池的总反应式可知,Al为负极,铂网为正极,负极:Al-3e-====Al3+,正极:O2+2H2O+4e-====4OH-,电子从Al经外电路流向铂,电流的方向与电子的流向相反,从铂到铝,铂网面积大,反应速率加快。反应只消耗铝,故只需更换铝就可以继续使用。
9.D 解析:由电池反应的离子方程式可知,电池的负极应为铁,则正极应是活泼性比铁弱的金属,B错。在反应中负极不断被消耗,质量减小,C错。反应中放出了氢气并生成了Fe2+,电解质溶液不能是HNO3,A错。由上分析可知正确选项为D。
10.D 解析:不论是吸热反应还是放热反应,只有在人类的控制下才能造福人类。例如我们通过煤气的燃烧来烧水做饭,但森林发生火灾时的燃烧却给人类带来了灾难。
11.BC 解析:原电池中,失去电子的一极为负极,因此,A项错误。从总反应方程式上看,反应消耗KOH,所以溶液的pH会减小,KOH浓度发生改变。从关系式:2C2H6→7O2→28e-,所以1 mol C2H6反应时,电路中有14 mol e-通过。
12.B 解析:反应从HI分解开始到建立平衡的过程中,HI的分解速率一定大于HI的生成速率。只有这样,HI的分解速率越来越小,HI的生成速率越来越大,到达某一时刻才能建立化学平衡。答案为B。
13.AB 解析:正反应是气体体积缩小的反应,容器内压强不随时间变化时,即气体总物质的量不再变化,各物质的浓度也不再变化,表明该反应达到了平衡状态。
14.A 解析:恒温下,容器容积扩大1倍时,假定平衡不移动,则B的浓度将变为原来的一半,即由0.6 mol·L-1变为0.3 mol·L-1,现B气体多浓度为0.4 mol·L-1,说明平衡向生成B的方向移动了,即减压平衡逆向移动,故a+b>c+d,B、C项错,A项正确。重新达到平衡时尽管A、B物质的量均增大了,但因体积扩大,实际上容器A、B、C、D各物质浓度均减小了,D项错。
15.BD 解析:A固体物质和纯液体物质(不是溶的浓度是不变的。所以增加亚硫酸钠粉末并不改变其浓度,对反应速率无影响。B由于硫酸浓度增大一倍,所以反应的初始速率加快。至于硫酸用量的多少,只影响参加反应的物质的量的多少,而不影响反应速率,故B正确。C中硫酸的浓度没变,故对反应速率无影响。因提高温度反应速率加快,故D也是正确答案。
16.D 解析:若杠杆为导体则构成原电池,铁作负极失电子而溶解:Fe-2e-====Fe2+,溶液中Cu2+在正极(铜极)得电子生成铜,质量增大而下降,A端低,B端高;若杠杆为绝缘体,则铁球和CuSO4溶液发生置换反应生成Cu覆于表面质量增加,B端下降,即A端高,B端低。
17.B 解析:向溶液中再加入盐酸,增加了H+的物质的量,也就增加了放出H2的量,故A错误。因Zn是过量的。放出H2的量取决于盐酸的量,加入CuCl2后,有少量的Cu析出,附在锌片上,构成原电池,反应速率加快,故B正确。向原溶液中分别加水或NaCl溶液均引起溶液中c(H+)的减小,反应速率变慢,故C、D错误。
18.(1)研究反应物I-与S2的浓度对反应速率的影响
(2)29.3 s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度成反比)
解析:(1)从题干信息和实验数据可知该实验的目的是为了研究反应物I-与S2的浓度对反应速率的影响。
(2)根据①、②组数据可知t与c(I-)成反比,根据②、③组数据可知t与c(S2)成反比,可得出t=Kc(I-)c(S2)-1。将第一组数据代入得K=0.1408,将第⑤组代入得t1=0.1408×0.120-1×0.040-1=29.3 s。
(3)因升高温度反应速率增大,则显色时间t2应小于22.0 s。
(4)综合分析上述数据可推出化学反应速率与反应物起始浓度乘积成正比。
19.O2+4H++4e-====2H2O
2H2+4OH――4e-====4H2O
解析:此题有一个简便的解法,就是拿总反应去已知电极的电极反应式,便可求得另一未知的反应式。
20.(1)2C4H10+13O28CO2+10H2O
(2)13O2+52e-====26O2- 2C4H10+26O2--52e-====8CO2+10H2O 由正极流向负极 负极
(3)燃料具有较高的能量转化率
(4)为维持电荷平衡,晶体中O2-将减少,从而使O2-得以在电场作用下向负极移动。
解析:第(1)问要求写出汽油燃料电池放电时的反应化学方程式,燃料电池的制作原理就是燃料气体被氧化剂氧化而发生了氧化还原反应,所以该反应的化学方程式为2C4H10+13O2====8CO2+10H2O。第(2)问要求写出电池正负极的反应式。因为放电时,电池正极发生还原反应(元素化合价降低),负极发生氧化反应。所以正极反应式是13O2+52e-====26O2-,负极反应式是2C4H10+26O2--52e-====8CO2+10H2O。由上述电池正、负极反应可以看出,正极反应源源不断地产生O2-,负极反应要持续进行,则需要持续不断的供应O2-,故电池内O2-的移动方向是由正极流向负极。电池的负极发生氧化反应,失电子,因此外电路电子从负极流出。第(3)问考查了燃料电池的优点。燃料电池是将燃料燃烧所产生的化学能直接转化为电能的“能量转化器”,其能量转化率很高,可达70%以上,而内燃机的能量转化率较低。因此,该问答案应为燃料电池具有较高的能量转化率。第(4)问依据电荷守恒原理,得出掺有Y2O3的ZrO2晶体中
O2-减少了,致使晶体中O2-缺陷,从而使其在电场作用下向负极移动。
21.3X+Y2Z 0.05 mol/(L·min)
解析:从本题的图像分析可知,X、Y是随着反应的进行(时间的增加)物质的量逐渐减少,与此相反,Z的物质的量是随着反应的进行(时间的增加)而逐渐增大,所以X、Y在反应式的左边,为反应物;而Z在反应式的右边,为生成物。X、Y、Z在化学方程式中的化学计量数应通过其相应的速率之比确定。从图中的数据分析可知,用X、Y、Z表示的反应速率分别为:
v(Y)==0.025 mol/(L·min)
v(X)==0.075 mol/(L·min)
v(Z)= =0.05 mol/(L·min)
则v(X)∶v(Y)∶v(Z)=0.075∶0.025∶0.05=3∶1∶2
反应的化学方程式为:3X+Y2Z。
22.方案一 负极:Fe,电极反应式:Fe-2e-====Fe2+,正极:C,电极反应式:Cu2++2e-====Cu,电解质溶液是CuCl2溶液。
方案二 负极:Fe,电极反应式:Fe-2e-====Fe2+,正极;Cu,电极反应式:Cu2++2e-====Cu,电解质溶液是CuSO4溶液(其他合理答案也可以)
解析:因Fe失电子,故Fe必须作负极;Cu2+得电子,电解质溶液必须是含Cu2+的可溶性盐溶液,正极材料比Fe不活泼。以氧化还原反应为依托,设计原电池的正极、负极,以及电解质溶液和电极反应的题型,一般思路是氧化还原反应中的还原剂作负极;比它不活泼的金属材料(有时也可以是氧化剂)作正极;合适的电解质溶液。原电池设计好以后,两个电极反应式相加应得到原来的氧化还原反应。
23.(1)0.375 mol/(L·min)
(2)2.75 mol·L-1
(3)12∶11
解析:(1)v(A)=3/2v(C)=3/2×(3 mol-2 mol)÷2 L÷2 min=0.375 mol/(L·min);
(2)根据反应计量关系,生成1 mol C消耗0.5 mol的B,故2 min末时B为5.5 mol;
(3)反应开始时气体共有12 mol;2 min末时分别为A是2.5 mol、B是5.5 mol、C为3 mol,共11 mol。根据阿伏加德罗定律的推论(在同温同体积下气体的物质的量之比等于气体的压强之比)可解得答案。
