河北省唐县一高2020-2021学年高一下学期期中考试化学试卷 Word版含答案
文档属性
| 名称 | 河北省唐县一高2020-2021学年高一下学期期中考试化学试卷 Word版含答案 |
|
|
| 格式 | doc | ||
| 文件大小 | 475.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-02 00:00:00 | ||
图片预览





文档简介
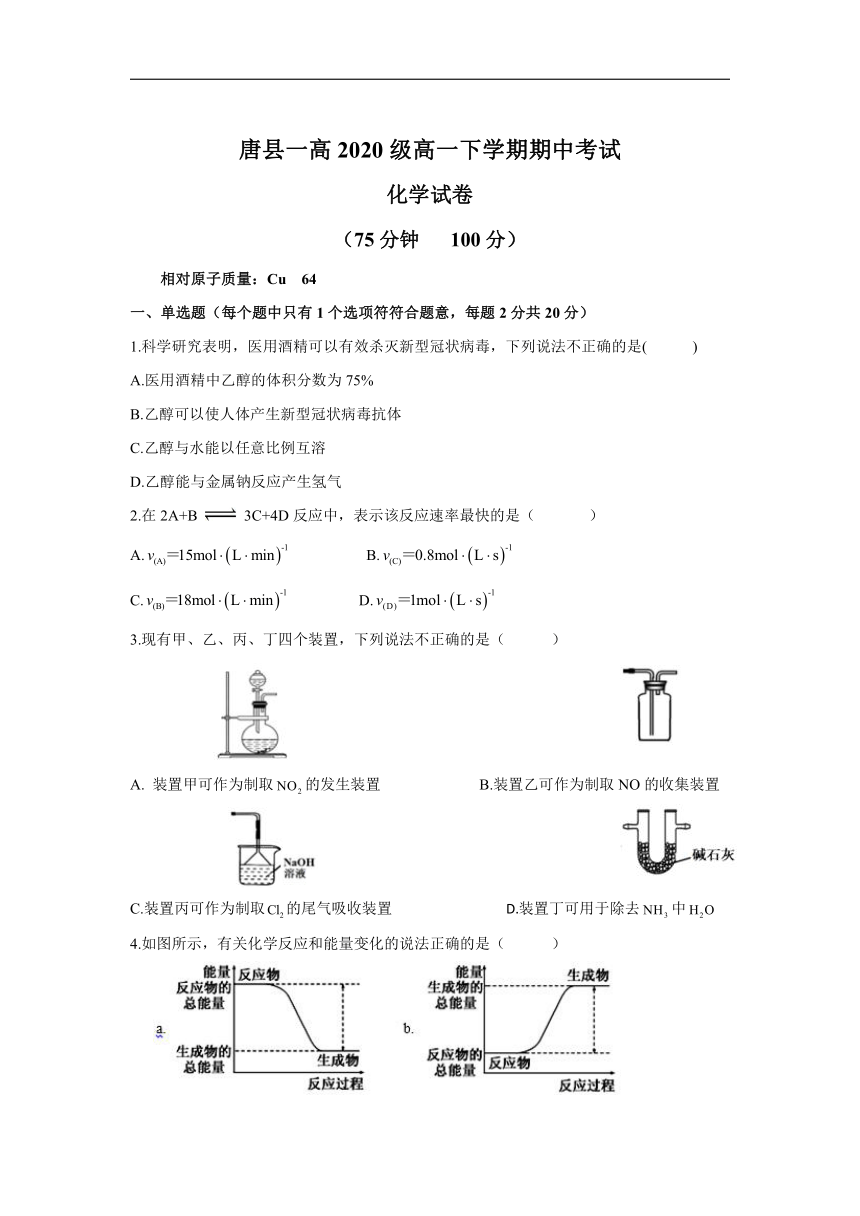
唐县一高2020级高一下学期期中考试
化学试卷
(75分钟 100分)
相对原子质量:Cu 64
一、单选题(每个题中只有1个选项符符合题意,每题2分共20分)
1.科学研究表明,医用酒精可以有效杀灭新型冠状病毒,下列说法不正确的是( )
A.医用酒精中乙醇的体积分数为75%
B.乙醇可以使人体产生新型冠状病毒抗体
C.乙醇与水能以任意比例互溶
D.乙醇能与金属钠反应产生氢气
2.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A. B.
C. D.
3.现有甲、乙、丙、丁四个装置,下列说法不正确的是( )
装置甲可作为制取的发生装置 B.装置乙可作为制取NO的收集装置
C.装置丙可作为制取的尾气吸收装置 D.装置丁可用于除去中
4.如图所示,有关化学反应和能量变化的说法正确的是( )
A.图a表示的是吸热反应的能量变化
B.图a不需要加热就能发生,图b一定需要加热才能发生
C.图a可以表示C与反应生成CO的能量变化
D.图b中反应物比生成物稳定
5.用纯净的与100mL稀盐酸反应制取,实验过程记录如右图所示(的体积已折算为标准状况 下的体积),下列分析不正确的是( )
A.段表示的平均速率最快
B.段,用盐酸表示该反应的平均反应速率为
C.三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D.G点收集到的的量最多
6.氢氧燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,硫酸作电解质。下列对该燃料电池的描述中正确的是( )
A.电池工作时,可产生蓝色的火焰 B. 电池工作时,电流通过外电路由负极流向正极
C.电池工作时,负极反应: D. 氢氧燃料电池不产生污染
7.下列关于苯的叙述不正确的是( ?? )
A.反应④能发生,从而证明苯中是单、双键交替结构
B.反应②不发生,但是仍有分层现象,紫色层在下层
C.反应③为取代反应,产物是一种烃的衍生物
D.反应①常温下能进行,不需要加热
8.下列除杂方法正确的是(?? )
A.除去乙烷中混有的少量乙烯:先通入酸性高锰酸钾溶液中再干燥
B.除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液
C.除去96%的乙醇中的少量水制无水乙醇:蒸馏
D.除去乙醇中混有的少量苯,可通过分液的方法实现
9.等体积等浓度的两份稀硫酸a、b 中分别加入过量的锌粉,同时向a 中加入少量的CuSO4溶液, 下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是(? ?)
A. B.
C. D.
10.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
气体 溶液
A
稀盐酸
B
稀氨水
C
稀
D
饱和溶液
二、不定项选择(每个小题有一个或二个选项符合题意,每小题4分共20分,多选错选不得分,漏选一个得2分)
11.下列说法正确的是( )
A.烷烃的通式为,随的增大,碳元素的质量分数逐渐减小
B. 和互为同系物
C. 烷烃分子中一定含有碳碳单键
D. 分子式为和的烷烃的一氯代物的数目可能相同
12.把a、b、c、d四种金属片浸泡在稀中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.b>d>c>a B. a>b>c>d
C.c>a>b>d D.a>c>d>b
13. 化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:向Cu电极方向移动,Cu电极附近溶液中浓度增加
B.乙:正极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
14.抗击新冠肺炎的战疫中,N95口罩发挥了重要作用,丙烯是制造N95口罩的原料。下列有关丙烯的说法错误的是( )
A.丙烯和乙烯互为同系物
B.丙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理相同
C.丙烯分子中所有的原子可能在同一个平面上
D.由丙烯制备丙烷的化学方程式:
15.某化学兴趣小组进行有关探究Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是( )
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为
B.③中反应的化学方程式:
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
三、非选择题 (本题有4个小题,共60分)
16.(13分)某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中反应①②③属于同种反应类型。根据图示回答下列问题:
(1)写出A、B、C、D的结构简式:
A______________、B ______________、C______________、D______________。
(2)写出②、④两步反应的化学方程式,并注明②反应类型。
②_____________ _,反应类型:______________。
④_____________ _ ,
17.实验题(16分)
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4 - + 5H2C2O4 + 6H+ ==2Mn2+ +10CO2 + 8H2O 。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20mL 0.1mol·L-1 H2C2O4溶液 30mL 0.01mol·L-1 KMnO4溶液
② 20mL 0.2mol·L-1 H2C2O4溶液 30mL 0.01mol·L-1 KMnO4溶液
该实验探究的是__________因素对化学反应速率的影响。如图一,相同时间内针筒中所得CO2的体积大小关系是__________>__________(填实验序号)。
若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,
c(MnO4 -)=_________mol·L-1。(假设混合后溶液体积不变)
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定__________来比较化学反应速率。
(4).小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是
①该反应放热 ②________________。
某小组同学欲探究 NH3的催化氧化实验,按如图装置进行实验。
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH 固体、MnO2
(1)制取 NH3 是在哪一装置中__________________。(填 A 或 B)
(2)装置D中盛放的试剂可以是__________________(填序号)。
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.硫酸铜
(3)装置E中发生反应的化学方程式为__________________。
18.(15分)电池是人类生产和生活中重要的能量来源,电池的发明是化学对人类的一项重大贡献,电能是现代社会应用最广泛的能源之一。
(1)依据NaOH与HCl的反应原理设计原电池,你认为________(填“是”或“否”)可行,理由是________。
(2)理论上讲,任何能自发进行的氧化还原反应都可以设计成原电池。请利用反应
设计一个化学电池(正极材料用碳棒),回答下列问题:
①电池的负极材料是________,发生________反应(填“氧化”或“还原”),电解质溶液是________;
②正极上出现的现象是________;
③若导线上转移电子1mol,则生成铜________g。
(3)设计一个实验方案,使如图装置中的铁棒上析出铜,而铁不溶解。
19.(16分)能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是__________(填序号)。
a. 与混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是__________(填“吸热”或“放热”)反应,其离子方程式是__________。
(2)卫星发射可用肼(N2H4)作燃料,2 mol N2H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(液态)放出1 244 kJ的热量。则该反应的热化学方程式为:
_________________________
(3)某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
.该反应第_____分钟到达平衡状态。
②.该反应的化学方程式为_______________。
③.2min时,Y的浓度为_____。
④.反应开始至2min,气体X的平均反应速率为_____。
唐县一高2020级高一下学期期中考试
化学答案
单选(每题2分共20分))
1.B 2.C 3.B 4.D 5.C 6.D 7. A 8.B 9.D 10.B
二、不定项选择(每小题4分共20分,多选错选不得分,漏选一个得2分)
11.BD 12.D 13.A 14.BC 15.B
三、每空2分,指明的每空1分,共60分
16.(13分)(1);;;
(2); 加成反应 (1分);
(16分) I.(1)浓度; ②; ①; (2)0.0052;
.KMnO4溶液完全退色所需时间(或产生相同体积气体所需时间)
(4)产物Mn2+(或MnSO4)是反应的催化剂.
18.(15分)II.(1)B (2)B (3)
(1)否;(1分)NaOH与HCl的反应不是氧化还原反应
(2)①Fe;氧化;溶液(合理即可);②碳棒上出现红色物质;③32
(3)(合理即可)
19.(16分) (1)①c ② 放热; H+ + OH-?= H2O
(2)
(3) ① 2; ②. 3X+Y2Z; ③.0.45mol/L;
④. 0.075mol/(L·min)
化学试卷
(75分钟 100分)
相对原子质量:Cu 64
一、单选题(每个题中只有1个选项符符合题意,每题2分共20分)
1.科学研究表明,医用酒精可以有效杀灭新型冠状病毒,下列说法不正确的是( )
A.医用酒精中乙醇的体积分数为75%
B.乙醇可以使人体产生新型冠状病毒抗体
C.乙醇与水能以任意比例互溶
D.乙醇能与金属钠反应产生氢气
2.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A. B.
C. D.
3.现有甲、乙、丙、丁四个装置,下列说法不正确的是( )
装置甲可作为制取的发生装置 B.装置乙可作为制取NO的收集装置
C.装置丙可作为制取的尾气吸收装置 D.装置丁可用于除去中
4.如图所示,有关化学反应和能量变化的说法正确的是( )
A.图a表示的是吸热反应的能量变化
B.图a不需要加热就能发生,图b一定需要加热才能发生
C.图a可以表示C与反应生成CO的能量变化
D.图b中反应物比生成物稳定
5.用纯净的与100mL稀盐酸反应制取,实验过程记录如右图所示(的体积已折算为标准状况 下的体积),下列分析不正确的是( )
A.段表示的平均速率最快
B.段,用盐酸表示该反应的平均反应速率为
C.三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D.G点收集到的的量最多
6.氢氧燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,硫酸作电解质。下列对该燃料电池的描述中正确的是( )
A.电池工作时,可产生蓝色的火焰 B. 电池工作时,电流通过外电路由负极流向正极
C.电池工作时,负极反应: D. 氢氧燃料电池不产生污染
7.下列关于苯的叙述不正确的是( ?? )
A.反应④能发生,从而证明苯中是单、双键交替结构
B.反应②不发生,但是仍有分层现象,紫色层在下层
C.反应③为取代反应,产物是一种烃的衍生物
D.反应①常温下能进行,不需要加热
8.下列除杂方法正确的是(?? )
A.除去乙烷中混有的少量乙烯:先通入酸性高锰酸钾溶液中再干燥
B.除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液
C.除去96%的乙醇中的少量水制无水乙醇:蒸馏
D.除去乙醇中混有的少量苯,可通过分液的方法实现
9.等体积等浓度的两份稀硫酸a、b 中分别加入过量的锌粉,同时向a 中加入少量的CuSO4溶液, 下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是(? ?)
A. B.
C. D.
10.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
气体 溶液
A
稀盐酸
B
稀氨水
C
稀
D
饱和溶液
二、不定项选择(每个小题有一个或二个选项符合题意,每小题4分共20分,多选错选不得分,漏选一个得2分)
11.下列说法正确的是( )
A.烷烃的通式为,随的增大,碳元素的质量分数逐渐减小
B. 和互为同系物
C. 烷烃分子中一定含有碳碳单键
D. 分子式为和的烷烃的一氯代物的数目可能相同
12.把a、b、c、d四种金属片浸泡在稀中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.b>d>c>a B. a>b>c>d
C.c>a>b>d D.a>c>d>b
13. 化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A.甲:向Cu电极方向移动,Cu电极附近溶液中浓度增加
B.乙:正极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
14.抗击新冠肺炎的战疫中,N95口罩发挥了重要作用,丙烯是制造N95口罩的原料。下列有关丙烯的说法错误的是( )
A.丙烯和乙烯互为同系物
B.丙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理相同
C.丙烯分子中所有的原子可能在同一个平面上
D.由丙烯制备丙烷的化学方程式:
15.某化学兴趣小组进行有关探究Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是( )
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为
B.③中反应的化学方程式:
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
三、非选择题 (本题有4个小题,共60分)
16.(13分)某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中反应①②③属于同种反应类型。根据图示回答下列问题:
(1)写出A、B、C、D的结构简式:
A______________、B ______________、C______________、D______________。
(2)写出②、④两步反应的化学方程式,并注明②反应类型。
②_____________ _,反应类型:______________。
④_____________ _ ,
17.实验题(16分)
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4 - + 5H2C2O4 + 6H+ ==2Mn2+ +10CO2 + 8H2O 。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 A溶液 B溶液
① 20mL 0.1mol·L-1 H2C2O4溶液 30mL 0.01mol·L-1 KMnO4溶液
② 20mL 0.2mol·L-1 H2C2O4溶液 30mL 0.01mol·L-1 KMnO4溶液
该实验探究的是__________因素对化学反应速率的影响。如图一,相同时间内针筒中所得CO2的体积大小关系是__________>__________(填实验序号)。
若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,
c(MnO4 -)=_________mol·L-1。(假设混合后溶液体积不变)
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定__________来比较化学反应速率。
(4).小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是
①该反应放热 ②________________。
某小组同学欲探究 NH3的催化氧化实验,按如图装置进行实验。
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH 固体、MnO2
(1)制取 NH3 是在哪一装置中__________________。(填 A 或 B)
(2)装置D中盛放的试剂可以是__________________(填序号)。
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.硫酸铜
(3)装置E中发生反应的化学方程式为__________________。
18.(15分)电池是人类生产和生活中重要的能量来源,电池的发明是化学对人类的一项重大贡献,电能是现代社会应用最广泛的能源之一。
(1)依据NaOH与HCl的反应原理设计原电池,你认为________(填“是”或“否”)可行,理由是________。
(2)理论上讲,任何能自发进行的氧化还原反应都可以设计成原电池。请利用反应
设计一个化学电池(正极材料用碳棒),回答下列问题:
①电池的负极材料是________,发生________反应(填“氧化”或“还原”),电解质溶液是________;
②正极上出现的现象是________;
③若导线上转移电子1mol,则生成铜________g。
(3)设计一个实验方案,使如图装置中的铁棒上析出铜,而铁不溶解。
19.(16分)能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是__________(填序号)。
a. 与混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是__________(填“吸热”或“放热”)反应,其离子方程式是__________。
(2)卫星发射可用肼(N2H4)作燃料,2 mol N2H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(液态)放出1 244 kJ的热量。则该反应的热化学方程式为:
_________________________
(3)某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
.该反应第_____分钟到达平衡状态。
②.该反应的化学方程式为_______________。
③.2min时,Y的浓度为_____。
④.反应开始至2min,气体X的平均反应速率为_____。
唐县一高2020级高一下学期期中考试
化学答案
单选(每题2分共20分))
1.B 2.C 3.B 4.D 5.C 6.D 7. A 8.B 9.D 10.B
二、不定项选择(每小题4分共20分,多选错选不得分,漏选一个得2分)
11.BD 12.D 13.A 14.BC 15.B
三、每空2分,指明的每空1分,共60分
16.(13分)(1);;;
(2); 加成反应 (1分);
(16分) I.(1)浓度; ②; ①; (2)0.0052;
.KMnO4溶液完全退色所需时间(或产生相同体积气体所需时间)
(4)产物Mn2+(或MnSO4)是反应的催化剂.
18.(15分)II.(1)B (2)B (3)
(1)否;(1分)NaOH与HCl的反应不是氧化还原反应
(2)①Fe;氧化;溶液(合理即可);②碳棒上出现红色物质;③32
(3)(合理即可)
19.(16分) (1)①c ② 放热; H+ + OH-?= H2O
(2)
(3) ① 2; ②. 3X+Y2Z; ③.0.45mol/L;
④. 0.075mol/(L·min)
同课章节目录
