鲁科版高中化学必修一2.2-电解质说课课件(27张ppt)
文档属性
| 名称 | 鲁科版高中化学必修一2.2-电解质说课课件(27张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-03 10:49:41 | ||
图片预览








文档简介
(共27张PPT)
第二章
第二节
(第一课时)
教材分析
教法和学法
教学过程
板书设计
教材分析
◆教材的地位和作用
学生认识离子反应和离子方程式的起始
电解质
教材体系
研究方法
初中学习溶液导电性实验、酸碱盐电离知识的延续和深化
进一步学习电解质溶液理论知识的基础
中学生现在及至以后学习化学、从事化学专业研究的重点
研究化学反应分类方法的补充以及从本质分析化学反应的必备技能
教材分析
◆教学目标
根据教学大纲的要求、教材的编写意图、学生的实际情况,确定本节课的教学目标。
①知道酸、碱、盐在溶液中能发生电离;②掌握电离、电解质的含义;③学会电离方程式的书写。
①通过实验思考猜测电解质溶于水发生的变化;
②将化合物按照新的标准重新进行分类。
激发研究物质和理论的兴趣,在探究过程中培养一丝不苟、实事求是的科学态度和分类观。
知识与技能
过程与方法
情感态度价值观
教材分析
◆重点和难点
重点:电解质、非电解质的判断;强电解质和弱电
解质的判断;实验现象的分析。
难点:电解质溶液导电的本质
难点的突破:充分运用实验和多媒体教学手段,尽
可能增加实验可见度,加强感性认识,引导
学生进行全面观察,理解微观本质。
教法和学法
◆学情分析
学生好奇心较强,逻辑思维正在日趋发展中,在知识学习上仍需借助感性材料的支持。
他们对化学现象、化学实验兴趣浓厚,有探求欲、表现欲和成就欲。学生具备了一定的实验操作能力和观察分析能力。
学习此内容之前学生已学习了酸、碱、盐的相关知识,并且已经知道了物质分类的相关知识。这些内容对电离的学习起到了铺垫和支持的作用。
教法和学法
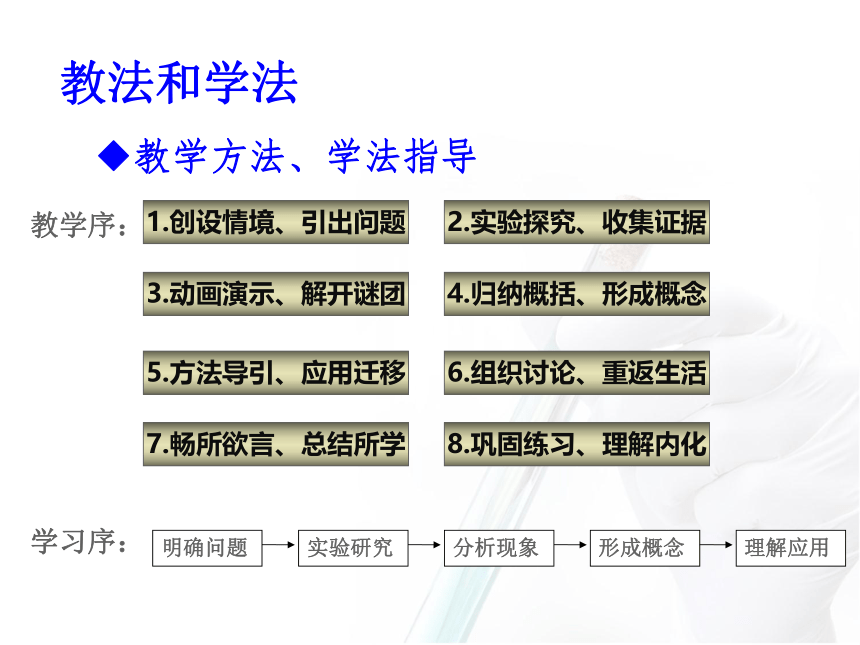
◆教学方法、学法指导
明确问题
实验研究
分析现象
形成概念
理解应用
7.畅所欲言、总结所学
1.创设情境、引出问题
3.动画演示、解开谜团
5.方法导引、应用迁移
8.巩固练习、理解内化
2.实验探究、收集证据
4.归纳概括、形成概念
6.组织讨论、重返生活
教学序:
学习序:
出汗后人体更容易触电
教学过程
1.创设情境、引出问题
2.实验探究、收集证据
教学过程
溶液浓度相同
实验2:
NaOH
溶液
、氨水、酒精溶液
实验3:
HCl溶液
、醋酸溶液、蔗糖溶液
实验1:
KNO3晶体、
KNO3溶液、熔融KNO3
学生分组实验
2.实验探究、收集证据
教学过程
NaOH溶液
KNO3晶体
KNO3溶液
熔融的KNO3
不导电
导
电
实验3
实验2
实验1
亮
暗
氨水
酒精溶液
HCl溶液
蔗糖溶液
醋酸溶液
食盐溶于水
3.动画演示、解开谜团
教学过程
3.动画演示、解开谜团
教学过程
蔗糖溶解
食盐熔融
导电的原因
熔融状态:受热熔化后,
NaCl晶体中的Na+和Cl-成为自由移动的离子,可以导电。
溶液:原来在晶体中被束缚的离子在水分子的作用下解离为可自由移动的Na+和Cl-离子,从而能够导电。
晶体:晶体中含有Na+和Cl-
,但不能自由移动,故不能导电。
3.动画演示、解开谜团
教学过程
教学过程
NaOH溶液
KNO3晶体
KNO3溶液
熔融的KNO3
不导电
导
电
实验3
实验2
实验1
亮
暗
氨水
酒精溶液
HCl溶液
蔗糖溶液
醋酸溶液
4.归纳概括,形成概念
教学过程
4.归纳概括,形成概念
电解质:在水溶液或熔融状态下能够导电的
化合物。
非电解质:在水溶液和熔融状态下都不导电
的化合物。
强电解质:水溶液中完全电离成离子的电解质.
弱电解质:水溶液中部分电离成离子的电解质.
电离:溶于水或受热熔化时解离出自由移动
的离子的过程。
电解质
非电解质
定义
在水溶液里或熔融状态下能够导电的化合物
在水溶液里或熔融状态下都不能导电的化合物
导电实质
电解质电离产生的自由运动的带电离子
非电解质不电离,不导电
实例
酸、碱、盐、水、Al2O3
乙醇、蔗糖等多数有机物及CO2、SO2等一些无机化合物
电离过程表示方法
用电离方程式表示:
HCl===H++Cl-
NaOH===Na++OH-
教学过程
4.归纳概括,形成概念
用分子式
可溶:用离子;难溶:用分子式
离子方程式表示
分子(多)、离子(少)
离子
溶液中溶质微粒
用“
”,存在电离
用“
”
电离表示方式
部分(可逆)
完全(不可逆)
电离程度
弱
强
导电能力
小
大
离子浓度
弱酸、弱碱、水
强酸、强碱、盐
物质类别
极性共价化合物
离子化合物、极性共价化合物
化合物类型
弱电解质
强电解质
类
型
比
较
教学过程
4.归纳概括,形成概念
电离可以用电离方程式表示
①
HCl
=
H+
+
Cl-
②
NaOH
=
Na+
+
OH-
③
NaCl
=
Na+
+
Cl-
教学过程
5.方法导引,应用迁移
电荷守恒、元素守恒
⑴
硝酸、硫酸
:
⑵
氢氧化钾、氢氧化钡:
⑶
硫酸铜、氯化钡:
P42迁移·应用
请分别书写下列各组物质的电离方程式,并进一步从电离方程式的角度认识酸、碱、盐。
教学过程
5.方法导引,应用迁移
HCl
=
H+
+
Cl-
H2SO4
=
HNO3
=
2
H
+
+
SO42
-
H
+
+NO3-
NaOH
=
OH-
+Na+
KOH
=
Ba(OH)2
=
OH-
+K
+
2
OH-
+
Ba
2
+
NaCl
=
Na+
+
Cl-
CuSO4=
Cu2+
+
SO42
-
BaCl2
=
Ba2+
+
2
Cl-
金属离子
电离时,生成的阳
离子全部是H+的
化合物。
酸
碱
电离时,生成的阴
离子全部是OH-
的化合物。
盐
电离时,能生成金
属阳离子和酸根
阴离子的化合物。
酸根离子
运动员餐厅一天“喝”饮料17吨
北京日报(11月22日)
本报广州21日电(记者王洋)自亚运开幕以来,运动员村主餐厅的日平均食材、饮料消耗量惊人。
今天,记者从运动员村餐饮服务部获悉,截至目前,运动员村主餐厅共接待各地运动员逾25万人次,平均每天接待1.65万人次,消耗食材包括牛肉1.2万余公斤、鸡肉1.6万余公斤、羊肉6600多公斤、猪肉5000多公斤,另有大量蔬菜、水果、奶制品和饮料。据统计,消耗峰值出现在本月18日,主餐厅当天接待了2.75万人次。而水果、蔬菜消耗量最多的一天超过10.2吨。而本月15日的饮料消耗量最大,逾17吨。
6.组织讨论、重返生活
教学过程
P41身边的化学
——《电解质与细胞活动》
【运动饮料适合的人群】
上海胸科医院心内科专家兼急诊科主任蒋锦琪教授认为,运动饮料主要是针对运动员或是经常参加健身的人群,普通人如果每天的运动时间不超过1小时,就没有必要喝这种饮料。如果运动量大、时间长,且出汗量大(在超过一升时),才推荐饮用运动饮料。从不良反应角度来说,不适宜人群盲目喝运动饮料,其中的各种电解质会加重血液、血管、肾脏的负担,引起心脏负荷加大、血压升高,造成血管硬化、中风等,肾脏功能不好者应禁用。
6.组织讨论、重返生活
教学过程
一个本质(电解质导电的本质):电解质发生电离(溶于水或熔融状态)形成自由移动的离子,通电后自由移动,形成电流。
两种电离:
A强电解质电离一步
=
B弱电解质电离分步
三组概念
酸、碱、盐
电解质、非电解质
强电解质、弱电解质
教学过程
7.畅所欲言、总结所学
板书设计
第二章
元素与物质世界
第2节
电解质
一、电解质的电离
电解质
(酸、碱、盐)
非电解质
(蔗糖、乙醇等)
化合物
在水溶液里
或熔融状态
下能否导电
电离
自由移动的离子
电离方程式
二、酸碱盐是电解质
重新认识
酸、碱、盐
电解质
溶解于水
或受热熔化
第二章
元素与物质世界
一、电解质的电离
电解质
(酸、碱、盐)
非电解质
(蔗糖、乙醇等)
化合物
在水溶液里
或熔融状态
下能否导电
电离
自由移动的离子
电离方程式
二、酸碱盐是电解质
重新认识
酸、碱、盐
电解质
溶解于水
或受热熔化
第2节
电解质
“盐水导电”情景引入,激起疑问
结合探究实验、动画演示
讨论食盐水导电的原理
学生分析实验现象
得出五个基本概念
介绍电解质饮料的知识,引导学生学以致用
介绍电离方程式的书写规则,并加以练习
观察对比所写电离方程式,引出酸碱盐的概念
通过学生畅所欲言
对所学内容进行整合
电池中电解液选择
电解质与
身体健康
电解质饮料
安全用电
教学反思
社会线索
电解质
知识线索
电解质
导电原理
电解质
非电解质
酸、碱、盐
电离方程式
引导学生主动参与探究
根据学生现状设计教学
教学反思
谢
谢
第二章
第二节
(第一课时)
教材分析
教法和学法
教学过程
板书设计
教材分析
◆教材的地位和作用
学生认识离子反应和离子方程式的起始
电解质
教材体系
研究方法
初中学习溶液导电性实验、酸碱盐电离知识的延续和深化
进一步学习电解质溶液理论知识的基础
中学生现在及至以后学习化学、从事化学专业研究的重点
研究化学反应分类方法的补充以及从本质分析化学反应的必备技能
教材分析
◆教学目标
根据教学大纲的要求、教材的编写意图、学生的实际情况,确定本节课的教学目标。
①知道酸、碱、盐在溶液中能发生电离;②掌握电离、电解质的含义;③学会电离方程式的书写。
①通过实验思考猜测电解质溶于水发生的变化;
②将化合物按照新的标准重新进行分类。
激发研究物质和理论的兴趣,在探究过程中培养一丝不苟、实事求是的科学态度和分类观。
知识与技能
过程与方法
情感态度价值观
教材分析
◆重点和难点
重点:电解质、非电解质的判断;强电解质和弱电
解质的判断;实验现象的分析。
难点:电解质溶液导电的本质
难点的突破:充分运用实验和多媒体教学手段,尽
可能增加实验可见度,加强感性认识,引导
学生进行全面观察,理解微观本质。
教法和学法
◆学情分析
学生好奇心较强,逻辑思维正在日趋发展中,在知识学习上仍需借助感性材料的支持。
他们对化学现象、化学实验兴趣浓厚,有探求欲、表现欲和成就欲。学生具备了一定的实验操作能力和观察分析能力。
学习此内容之前学生已学习了酸、碱、盐的相关知识,并且已经知道了物质分类的相关知识。这些内容对电离的学习起到了铺垫和支持的作用。
教法和学法
◆教学方法、学法指导
明确问题
实验研究
分析现象
形成概念
理解应用
7.畅所欲言、总结所学
1.创设情境、引出问题
3.动画演示、解开谜团
5.方法导引、应用迁移
8.巩固练习、理解内化
2.实验探究、收集证据
4.归纳概括、形成概念
6.组织讨论、重返生活
教学序:
学习序:
出汗后人体更容易触电
教学过程
1.创设情境、引出问题
2.实验探究、收集证据
教学过程
溶液浓度相同
实验2:
NaOH
溶液
、氨水、酒精溶液
实验3:
HCl溶液
、醋酸溶液、蔗糖溶液
实验1:
KNO3晶体、
KNO3溶液、熔融KNO3
学生分组实验
2.实验探究、收集证据
教学过程
NaOH溶液
KNO3晶体
KNO3溶液
熔融的KNO3
不导电
导
电
实验3
实验2
实验1
亮
暗
氨水
酒精溶液
HCl溶液
蔗糖溶液
醋酸溶液
食盐溶于水
3.动画演示、解开谜团
教学过程
3.动画演示、解开谜团
教学过程
蔗糖溶解
食盐熔融
导电的原因
熔融状态:受热熔化后,
NaCl晶体中的Na+和Cl-成为自由移动的离子,可以导电。
溶液:原来在晶体中被束缚的离子在水分子的作用下解离为可自由移动的Na+和Cl-离子,从而能够导电。
晶体:晶体中含有Na+和Cl-
,但不能自由移动,故不能导电。
3.动画演示、解开谜团
教学过程
教学过程
NaOH溶液
KNO3晶体
KNO3溶液
熔融的KNO3
不导电
导
电
实验3
实验2
实验1
亮
暗
氨水
酒精溶液
HCl溶液
蔗糖溶液
醋酸溶液
4.归纳概括,形成概念
教学过程
4.归纳概括,形成概念
电解质:在水溶液或熔融状态下能够导电的
化合物。
非电解质:在水溶液和熔融状态下都不导电
的化合物。
强电解质:水溶液中完全电离成离子的电解质.
弱电解质:水溶液中部分电离成离子的电解质.
电离:溶于水或受热熔化时解离出自由移动
的离子的过程。
电解质
非电解质
定义
在水溶液里或熔融状态下能够导电的化合物
在水溶液里或熔融状态下都不能导电的化合物
导电实质
电解质电离产生的自由运动的带电离子
非电解质不电离,不导电
实例
酸、碱、盐、水、Al2O3
乙醇、蔗糖等多数有机物及CO2、SO2等一些无机化合物
电离过程表示方法
用电离方程式表示:
HCl===H++Cl-
NaOH===Na++OH-
教学过程
4.归纳概括,形成概念
用分子式
可溶:用离子;难溶:用分子式
离子方程式表示
分子(多)、离子(少)
离子
溶液中溶质微粒
用“
”,存在电离
用“
”
电离表示方式
部分(可逆)
完全(不可逆)
电离程度
弱
强
导电能力
小
大
离子浓度
弱酸、弱碱、水
强酸、强碱、盐
物质类别
极性共价化合物
离子化合物、极性共价化合物
化合物类型
弱电解质
强电解质
类
型
比
较
教学过程
4.归纳概括,形成概念
电离可以用电离方程式表示
①
HCl
=
H+
+
Cl-
②
NaOH
=
Na+
+
OH-
③
NaCl
=
Na+
+
Cl-
教学过程
5.方法导引,应用迁移
电荷守恒、元素守恒
⑴
硝酸、硫酸
:
⑵
氢氧化钾、氢氧化钡:
⑶
硫酸铜、氯化钡:
P42迁移·应用
请分别书写下列各组物质的电离方程式,并进一步从电离方程式的角度认识酸、碱、盐。
教学过程
5.方法导引,应用迁移
HCl
=
H+
+
Cl-
H2SO4
=
HNO3
=
2
H
+
+
SO42
-
H
+
+NO3-
NaOH
=
OH-
+Na+
KOH
=
Ba(OH)2
=
OH-
+K
+
2
OH-
+
Ba
2
+
NaCl
=
Na+
+
Cl-
CuSO4=
Cu2+
+
SO42
-
BaCl2
=
Ba2+
+
2
Cl-
金属离子
电离时,生成的阳
离子全部是H+的
化合物。
酸
碱
电离时,生成的阴
离子全部是OH-
的化合物。
盐
电离时,能生成金
属阳离子和酸根
阴离子的化合物。
酸根离子
运动员餐厅一天“喝”饮料17吨
北京日报(11月22日)
本报广州21日电(记者王洋)自亚运开幕以来,运动员村主餐厅的日平均食材、饮料消耗量惊人。
今天,记者从运动员村餐饮服务部获悉,截至目前,运动员村主餐厅共接待各地运动员逾25万人次,平均每天接待1.65万人次,消耗食材包括牛肉1.2万余公斤、鸡肉1.6万余公斤、羊肉6600多公斤、猪肉5000多公斤,另有大量蔬菜、水果、奶制品和饮料。据统计,消耗峰值出现在本月18日,主餐厅当天接待了2.75万人次。而水果、蔬菜消耗量最多的一天超过10.2吨。而本月15日的饮料消耗量最大,逾17吨。
6.组织讨论、重返生活
教学过程
P41身边的化学
——《电解质与细胞活动》
【运动饮料适合的人群】
上海胸科医院心内科专家兼急诊科主任蒋锦琪教授认为,运动饮料主要是针对运动员或是经常参加健身的人群,普通人如果每天的运动时间不超过1小时,就没有必要喝这种饮料。如果运动量大、时间长,且出汗量大(在超过一升时),才推荐饮用运动饮料。从不良反应角度来说,不适宜人群盲目喝运动饮料,其中的各种电解质会加重血液、血管、肾脏的负担,引起心脏负荷加大、血压升高,造成血管硬化、中风等,肾脏功能不好者应禁用。
6.组织讨论、重返生活
教学过程
一个本质(电解质导电的本质):电解质发生电离(溶于水或熔融状态)形成自由移动的离子,通电后自由移动,形成电流。
两种电离:
A强电解质电离一步
=
B弱电解质电离分步
三组概念
酸、碱、盐
电解质、非电解质
强电解质、弱电解质
教学过程
7.畅所欲言、总结所学
板书设计
第二章
元素与物质世界
第2节
电解质
一、电解质的电离
电解质
(酸、碱、盐)
非电解质
(蔗糖、乙醇等)
化合物
在水溶液里
或熔融状态
下能否导电
电离
自由移动的离子
电离方程式
二、酸碱盐是电解质
重新认识
酸、碱、盐
电解质
溶解于水
或受热熔化
第二章
元素与物质世界
一、电解质的电离
电解质
(酸、碱、盐)
非电解质
(蔗糖、乙醇等)
化合物
在水溶液里
或熔融状态
下能否导电
电离
自由移动的离子
电离方程式
二、酸碱盐是电解质
重新认识
酸、碱、盐
电解质
溶解于水
或受热熔化
第2节
电解质
“盐水导电”情景引入,激起疑问
结合探究实验、动画演示
讨论食盐水导电的原理
学生分析实验现象
得出五个基本概念
介绍电解质饮料的知识,引导学生学以致用
介绍电离方程式的书写规则,并加以练习
观察对比所写电离方程式,引出酸碱盐的概念
通过学生畅所欲言
对所学内容进行整合
电池中电解液选择
电解质与
身体健康
电解质饮料
安全用电
教学反思
社会线索
电解质
知识线索
电解质
导电原理
电解质
非电解质
酸、碱、盐
电离方程式
引导学生主动参与探究
根据学生现状设计教学
教学反思
谢
谢
