河北省廊坊市三河一高2020-2021学年高一下学期5月第二次阶段考化学试卷 Word版含答案
文档属性
| 名称 | 河北省廊坊市三河一高2020-2021学年高一下学期5月第二次阶段考化学试卷 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 1000.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-04 14:52:01 | ||
图片预览




文档简介
高一年级第二次阶段考
化学试题
(满分:100分 时间:75分钟)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cu 64 Fe 56 S 32 Si 28
第I卷 选择题 (共45分)
一、选择题:(每小题只有一个正确选项,每小题 2 分,共30分)
1. 下列我国科研成果所涉及材料中,主要成分是有机物的是( )
A.C919发动机的新型材料氮化硅陶瓷 B.中国天眼用到传输信息用的光纤材料 C.“人造太阳”核聚变实验装置的钨合金 D.高铁轨道与地基之间填隙减震材料聚氨酯
2.某烯烃与H2加成后的产物如下,则烯烃可能的结构有( )
A.4种 B.5种 C.6种 D.7种
3.如图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是( )
溶液 现象 结论
A 品红溶液 红色溶液褪色 SO2有漂白性
B H2S溶液 产生黄色沉淀 SO2有还原性
C 酸性KMnO4溶液 紫色溶液褪色 SO2有还原性
D 滴有酚酞的NaOH溶液 红色溶液褪色 SO2的水溶液呈酸性
4. 中华民族为人类文明进步做出了巨大贡献,下列分析不正确的是( )
A. 中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2
B. 东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的黄芽是指硫
C.《本草纲目》拾遗中对“强水”的记载“……性最猛烈,能蚀五金……其水至强……惟玻璃可盛……”,“强水”为氢氟酸
D. “白墙黑瓦青石板,烟雨小巷油纸伞”中纸伞的主要成分为有机高分子材料
5.下图为番茄电池(已知番茄汁显酸性),下列说法正确的是( )
A.锌片是该电池的正极
B.铜电极附近会出现蓝色
C.一段时间后,锌片质量会变小
D.电子由铜通过导线流向锌
6. 医用外科口罩的结构示意图如下图所示,其中,过滤层所用的材料是熔喷聚丙烯,具有阻隔部分病毒和细菌的作用。下列关于医用外科口罩的说法不正确的是( )
A.防水层具有阻隔飞沫进入口鼻内的作用
B.熔喷聚丙烯属于合成高分子材料
C.熔喷聚丙烯材料难溶于水
D.用完后应投入的垃圾箱的标志为 (可回收物)
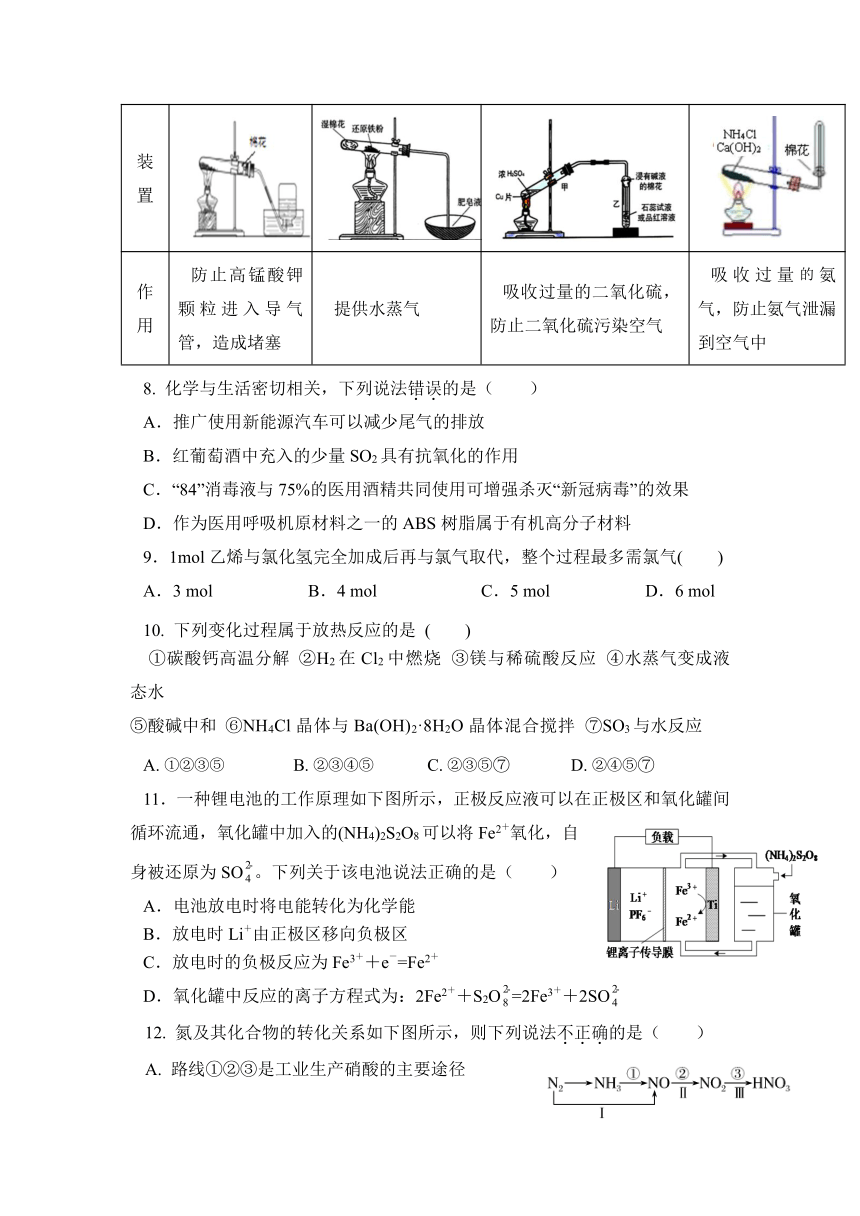
7.下列制取或收集气体装置中棉花作用不正确的是( )
A B C D
名 称 加热高锰酸钾制取氧气 铁粉与高温下的水蒸气反应 铜与浓硫酸反应制取SO2 制取并收集氨气
装 置
作 用 防止高锰酸钾颗粒进入导气管,造成堵塞 提供水蒸气 吸收过量的二氧化硫,防止二氧化硫污染空气 吸收过量氨气,防止氨气泄漏到空气中
8. 化学与生活密切相关,下列说法错误的是( )
A.推广使用新能源汽车可以减少尾气的排放
B.红葡萄酒中充入的少量SO2具有抗氧化的作用
C.“84”消毒液与75%的医用酒精共同使用可增强杀灭“新冠病毒”的效果
D.作为医用呼吸机原材料之一的ABS树脂属于有机高分子材料
9.1mol乙烯与氯化氢完全加成后再与氯气取代,整个过程最多需氯气( )
A.3 mol B.4 mol C.5 mol D.6 mol
10. 下列变化过程属于放热反应的是 ( )
①碳酸钙高温分解 ②H2在Cl2中燃烧 ③镁与稀硫酸反应 ④水蒸气变成液态水
⑤酸碱中和 ⑥NH4Cl晶体与Ba(OH)2·8H2O晶体混合搅拌 ⑦SO3与水反应
A. ①②③⑤ B. ②③④⑤ C. ②③⑤⑦ D. ②④⑤⑦
11.一种锂电池的工作原理如下图所示,正极反应液可以在正极区和氧化罐间循环流通,氧化罐中加入的(NH4)2S2O8可以将Fe2+氧化,自身被还原为SO。下列关于该电池说法正确的是( )
A.电池放电时将电能转化为化学能
B.放电时Li+由正极区移向负极区
C.放电时的负极反应为Fe3++e-=Fe2+
D.氧化罐中反应的离子方程式为:2Fe2++S2O=2Fe3++2SO
12. 氮及其化合物的转化关系如下图所示,则下列说法不正确的是( )
A. 路线①②③是工业生产硝酸的主要途径
B. 路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C. 路线③必须再加入氧化剂才能实现
D. 路线②变化过程中气体颜色会加深
13. 某华人科学家和他的团队研发出“纸电池”(如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,厚度仅为0.5毫米。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为Zn+2MnO2+H2O===ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生氧化反应
C.电池的正极反应式为MnO2+H2O+e-===MnO(OH)+OH-
D.当有0.1 mol锌溶解时,流经电解液的电子数为1.204×1023
14.2020年我国取得让世界瞩目的科技成果,化学功不可没。下列说法错误的是( )
A.“嫦娥五号”运载火箭用液氧液氢推进剂,产物对环境无污染
B.“硅-石墨烯-锗晶体管”为我国首创,石墨烯属于新型无机非金属材料
C.“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
D.“奋斗者”号潜水器外壳材料为钛合金,钛合金耐高压、耐腐蚀
15. 用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2,其部分工艺流程如下, 下列说法不正确的是( )
A. 吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O
B. 将石灰乳改为澄清石灰水吸收效率将会增大
C. 采用气液逆流接触有利于尾气中NO、NO2的充分吸收
D. 若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高
二、选择题(每小题有1~2个选项符合题意,每小题3分,共15分)
16. 美国加州Miramar海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2。则下列推断中正确的是( )
A. 正极反应:4OH--4e-=2H2O+O2↑
B. 放电时CO32-向负极移动
C. 当电池中有4g H2发生反应时,另一极发生反应的CO2分子数目为1.204╳1024
D. 当电池生成1molH2O时,转移4mol电子
17.已知NH4CuSO3与足量的3 mol·L-1硫酸混合微热,产生下列现象:①有红色金属生成;②产生有刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是( )
A. 反应中硫酸作氧化剂
B. 1 mol NH4CuSO3完全反应转移0.5 mol电子
C. NH4CuSO3中硫元素被氧化
D. 有刺激性气味的气体是氨气
18.X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化能一步实现的是( )
序号 X Y Z W
A N2 NH3 NO NO2
B Al Al2O3 NaAlO2 Al(OH) 3
C Cl2 Ca(ClO)2 HClO HCl
D H2S S SO3 H2SO4
19.乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如下图所示,则下列说法正确的是( )
A. 反应①、②均是取代反应
B. 反应②、③的原子利用率均为100%
C. 反应④中该有机反应物只有一种结构
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
20. 稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多溶解铜粉19.2g(同时生成NO气体,下同)。向另一份中逐渐加入铁粉,产生气体的量与铁粉的质量变化如图所示,下列结论错误的是( )
A. ab段发生反应为:Fe+2Fe3+=3Fe2+
B. 原混合酸中c(HNO3)=2 mol/L
C. 原混合酸中c (H2SO4) =4 mol/L
D. c点时,溶液中的溶质只有Fe2(SO4)3
第Ⅱ卷 非选择题 (共55分)
21.(14分) ?.根据下列物质回答:
① CH2=CH2 ② CH3CH2CH2CH2CH3 ③ 石墨 ④ 乙醇 ⑤ CH2=CH—CH2—CH3
⑥ 金刚石 ⑦ CH3—O—CH3 ⑧ CH3—CH—CH2—CH3
(1) 互为同素异形体的是_________________(填序号,下同)。
(2) 互为同分异构体的是____________________。
(3) 互为同系物的是_______________________。
??. 已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味D,其合成路线如图所示。请回答下列问题:
(1)A的结构式为___________,B、C分子中官能团名称是___________、___________。
(2)E是一种常见的塑料,其结构简式为___________。
(3)写出下列反应的化学方程式,并注明反应类型:
①___________________________________,____________反应;
②___________________________________,____________反应。
22.(13分)?.工业合成氨的反应N2+3H2===2NH3的能量变化如图所示,请回答有关问题:
(1)合成1 mol NH3(l)________(填“吸收”或“放出”)__________ (用“a、b、c”表示)kJ的热量。?
(2)已知:拆开 1 mol H—H键、1 mol N—H键、1 mol N≡N 键分别需要的能量是436 kJ、391 kJ、946 kJ。则图中的a=___________ kJ;若有1 mol N2(g)发生反应生成NH3(g)产生的能量变化为_________ kJ。?
(3)推测反应 2NH3(g)=== N2 (g)+3H2(g) 比反应2NH3(l)=== N2 (g)+3H2(g) _________(填“吸收”或“放出”)的热量__________(填“多”或“少”)。
??. 根据原电池的工作原理,可设计电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
⑴此反应消耗的NH3与O2的物质的量之比为___________;
⑵a电极作为该原电池的_______(填“正极”或“负极”), 其电极反应式为______________;
⑶b电极上发生________(填“氧化”或“还原”)反应,溶液中OH-向________(填“a”或“b”)电极移动。
23.(14分)?.乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取乙酸乙酯用醋酸、乙醇、浓硫酸、饱和碳酸钠溶液以及极易与乙醇结合的氯化钙溶液。主要装置如图所示:
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率,使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物用分液漏斗分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1) 该制备反应的化学方程式为:______________________________________;若用示踪原子(18O)标注乙醇中的氧原子,则该原子还将存在于_____________(写结构简式)中。
(2) 实验中浓硫酸的主要作用是______________________。用饱和Na2CO3溶液洗涤粗酯的目的是___________________________________________________________。
(3)用饱和CaCl2溶液洗涤粗酯的目的是___________________。
(4)在步骤⑧所得的粗酯里可能还含有的少量杂质是_____________________。
??. 已知5.8克某烃在氧气中完全燃烧,其产物(110℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加9.0克,干燥管的质量增加17.6克。
(1)经计算该有机物的实验式为________________;
(2)相同条件下,该烃蒸汽相对氢气的密度为29,则该有机物的分子式为:____________;
写出该烃所有同分异构体的结构简式:__________________________________________。
24.(14分) 用如图所示实验装置探究铜丝与过量浓硫酸的反应。
(1)写出A中发生反应的化学方程式________________________________________。
(2)装置D通入产生的气体后(未加热)的现象是 ,点燃酒精灯加热后的现象是 。
(3)为验证SO2和Cl2发生了反应,小组同学进行如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl—,只要检验到生成的Cl—即可,甲取适量B中样品于试管中,向其中滴加少量 (写化学式)溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理, 理由是 。他认为若验证SO2和Cl2反应,需要检验到生成的 (写化学式)。
③一段时间后,观察到B中溶液黄绿色褪去,B中反应的离子方程式为_____________。
(4) C中反应的化学方程式为__________________________________。
(5) 装置E的作用是___________________________,发生反应的离子方程式是___________________________________________________________。
《高 一 化 学 试 题》参考答案
一、单项选择题(每题2分,共30分)
1-5 D C B C C 6-10 D D C C C 11-15 D C C C B
二、不定项选择题(每题3分,共15分,每题1-2个正确答案,少选1分,多选0分)
16-20 BC B AC BD D
21、(除标注外,每空1分,共14分)
?. (1) ③⑥ (2) ②⑧、④⑦ (2分) (3) ①⑤
??. (1) H–C=C–H , 羟基、羧基。(2) [CH2—CH2 ] n。
(3) ① CH2=CH2+H2OCH3CH2OH (2分); 加成反应;
② 2CH3CH2OH+O2),\s\do 6(△))2CH3CHO+2H2O (2分); 氧化反应;
22、(除标注外,每空1分,共13分)
?. (1) 放出, b+c-a 。 (2) 1127 ; 92 。 (3) 吸收 , 少。
??.(1) 4:3(2分) ; (2) 负极, 2NH3–6e-+6OH–= N2↑+6H2O(2分);
(3) 还原, a 。
23、(除标注外,每空1分,共14分)
?. (1) CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O(2分); CH3CO18OCH2CH3。
(2) 催化剂、吸水剂(2分)。 除去乙醇和乙酸,降低乙酸乙酯溶解度。(3分)
(3) 除去乙醇。 (4)水。
??. (1) C2H5; (2) C4H10; CH3—CH2—CH2—CH3、(CH3)3CH。(2分)
24、(方程式2分,其它每空1分,共14分)
(1)Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑。 (2)红色褪去;恢复红色。
(3)①AgNO3。 ②Cl2和水反应也会生成Cl- (或写方程式)。 SO42-(或硫酸)。
③SO2+2H2O+Cl2=4H++SO42-+2Cl-。
(4)SO2+2H2S == 3S+2H2O。 (5) 吸收剩余SO2防止污染, SO2+2OH-= SO32-+H2O。
化学试题
(满分:100分 时间:75分钟)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cu 64 Fe 56 S 32 Si 28
第I卷 选择题 (共45分)
一、选择题:(每小题只有一个正确选项,每小题 2 分,共30分)
1. 下列我国科研成果所涉及材料中,主要成分是有机物的是( )
A.C919发动机的新型材料氮化硅陶瓷 B.中国天眼用到传输信息用的光纤材料 C.“人造太阳”核聚变实验装置的钨合金 D.高铁轨道与地基之间填隙减震材料聚氨酯
2.某烯烃与H2加成后的产物如下,则烯烃可能的结构有( )
A.4种 B.5种 C.6种 D.7种
3.如图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是( )
溶液 现象 结论
A 品红溶液 红色溶液褪色 SO2有漂白性
B H2S溶液 产生黄色沉淀 SO2有还原性
C 酸性KMnO4溶液 紫色溶液褪色 SO2有还原性
D 滴有酚酞的NaOH溶液 红色溶液褪色 SO2的水溶液呈酸性
4. 中华民族为人类文明进步做出了巨大贡献,下列分析不正确的是( )
A. 中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2
B. 东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的黄芽是指硫
C.《本草纲目》拾遗中对“强水”的记载“……性最猛烈,能蚀五金……其水至强……惟玻璃可盛……”,“强水”为氢氟酸
D. “白墙黑瓦青石板,烟雨小巷油纸伞”中纸伞的主要成分为有机高分子材料
5.下图为番茄电池(已知番茄汁显酸性),下列说法正确的是( )
A.锌片是该电池的正极
B.铜电极附近会出现蓝色
C.一段时间后,锌片质量会变小
D.电子由铜通过导线流向锌
6. 医用外科口罩的结构示意图如下图所示,其中,过滤层所用的材料是熔喷聚丙烯,具有阻隔部分病毒和细菌的作用。下列关于医用外科口罩的说法不正确的是( )
A.防水层具有阻隔飞沫进入口鼻内的作用
B.熔喷聚丙烯属于合成高分子材料
C.熔喷聚丙烯材料难溶于水
D.用完后应投入的垃圾箱的标志为 (可回收物)
7.下列制取或收集气体装置中棉花作用不正确的是( )
A B C D
名 称 加热高锰酸钾制取氧气 铁粉与高温下的水蒸气反应 铜与浓硫酸反应制取SO2 制取并收集氨气
装 置
作 用 防止高锰酸钾颗粒进入导气管,造成堵塞 提供水蒸气 吸收过量的二氧化硫,防止二氧化硫污染空气 吸收过量氨气,防止氨气泄漏到空气中
8. 化学与生活密切相关,下列说法错误的是( )
A.推广使用新能源汽车可以减少尾气的排放
B.红葡萄酒中充入的少量SO2具有抗氧化的作用
C.“84”消毒液与75%的医用酒精共同使用可增强杀灭“新冠病毒”的效果
D.作为医用呼吸机原材料之一的ABS树脂属于有机高分子材料
9.1mol乙烯与氯化氢完全加成后再与氯气取代,整个过程最多需氯气( )
A.3 mol B.4 mol C.5 mol D.6 mol
10. 下列变化过程属于放热反应的是 ( )
①碳酸钙高温分解 ②H2在Cl2中燃烧 ③镁与稀硫酸反应 ④水蒸气变成液态水
⑤酸碱中和 ⑥NH4Cl晶体与Ba(OH)2·8H2O晶体混合搅拌 ⑦SO3与水反应
A. ①②③⑤ B. ②③④⑤ C. ②③⑤⑦ D. ②④⑤⑦
11.一种锂电池的工作原理如下图所示,正极反应液可以在正极区和氧化罐间循环流通,氧化罐中加入的(NH4)2S2O8可以将Fe2+氧化,自身被还原为SO。下列关于该电池说法正确的是( )
A.电池放电时将电能转化为化学能
B.放电时Li+由正极区移向负极区
C.放电时的负极反应为Fe3++e-=Fe2+
D.氧化罐中反应的离子方程式为:2Fe2++S2O=2Fe3++2SO
12. 氮及其化合物的转化关系如下图所示,则下列说法不正确的是( )
A. 路线①②③是工业生产硝酸的主要途径
B. 路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C. 路线③必须再加入氧化剂才能实现
D. 路线②变化过程中气体颜色会加深
13. 某华人科学家和他的团队研发出“纸电池”(如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,厚度仅为0.5毫米。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为Zn+2MnO2+H2O===ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生氧化反应
C.电池的正极反应式为MnO2+H2O+e-===MnO(OH)+OH-
D.当有0.1 mol锌溶解时,流经电解液的电子数为1.204×1023
14.2020年我国取得让世界瞩目的科技成果,化学功不可没。下列说法错误的是( )
A.“嫦娥五号”运载火箭用液氧液氢推进剂,产物对环境无污染
B.“硅-石墨烯-锗晶体管”为我国首创,石墨烯属于新型无机非金属材料
C.“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
D.“奋斗者”号潜水器外壳材料为钛合金,钛合金耐高压、耐腐蚀
15. 用石灰乳吸收硝酸工业的尾气(含NO、NO2)可获得Ca(NO2)2,其部分工艺流程如下, 下列说法不正确的是( )
A. 吸收时主要反应的化学方程式为NO+NO2+Ca(OH)2===Ca(NO2)2+H2O
B. 将石灰乳改为澄清石灰水吸收效率将会增大
C. 采用气液逆流接触有利于尾气中NO、NO2的充分吸收
D. 若尾气中n(NO2)∶n(NO)<1∶1,吸收后排放的气体中NO含量升高
二、选择题(每小题有1~2个选项符合题意,每小题3分,共15分)
16. 美国加州Miramar海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-=H2O+CO2。则下列推断中正确的是( )
A. 正极反应:4OH--4e-=2H2O+O2↑
B. 放电时CO32-向负极移动
C. 当电池中有4g H2发生反应时,另一极发生反应的CO2分子数目为1.204╳1024
D. 当电池生成1molH2O时,转移4mol电子
17.已知NH4CuSO3与足量的3 mol·L-1硫酸混合微热,产生下列现象:①有红色金属生成;②产生有刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是( )
A. 反应中硫酸作氧化剂
B. 1 mol NH4CuSO3完全反应转移0.5 mol电子
C. NH4CuSO3中硫元素被氧化
D. 有刺激性气味的气体是氨气
18.X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化能一步实现的是( )
序号 X Y Z W
A N2 NH3 NO NO2
B Al Al2O3 NaAlO2 Al(OH) 3
C Cl2 Ca(ClO)2 HClO HCl
D H2S S SO3 H2SO4
19.乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如下图所示,则下列说法正确的是( )
A. 反应①、②均是取代反应
B. 反应②、③的原子利用率均为100%
C. 反应④中该有机反应物只有一种结构
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
20. 稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多溶解铜粉19.2g(同时生成NO气体,下同)。向另一份中逐渐加入铁粉,产生气体的量与铁粉的质量变化如图所示,下列结论错误的是( )
A. ab段发生反应为:Fe+2Fe3+=3Fe2+
B. 原混合酸中c(HNO3)=2 mol/L
C. 原混合酸中c (H2SO4) =4 mol/L
D. c点时,溶液中的溶质只有Fe2(SO4)3
第Ⅱ卷 非选择题 (共55分)
21.(14分) ?.根据下列物质回答:
① CH2=CH2 ② CH3CH2CH2CH2CH3 ③ 石墨 ④ 乙醇 ⑤ CH2=CH—CH2—CH3
⑥ 金刚石 ⑦ CH3—O—CH3 ⑧ CH3—CH—CH2—CH3
(1) 互为同素异形体的是_________________(填序号,下同)。
(2) 互为同分异构体的是____________________。
(3) 互为同系物的是_______________________。
??. 已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味D,其合成路线如图所示。请回答下列问题:
(1)A的结构式为___________,B、C分子中官能团名称是___________、___________。
(2)E是一种常见的塑料,其结构简式为___________。
(3)写出下列反应的化学方程式,并注明反应类型:
①___________________________________,____________反应;
②___________________________________,____________反应。
22.(13分)?.工业合成氨的反应N2+3H2===2NH3的能量变化如图所示,请回答有关问题:
(1)合成1 mol NH3(l)________(填“吸收”或“放出”)__________ (用“a、b、c”表示)kJ的热量。?
(2)已知:拆开 1 mol H—H键、1 mol N—H键、1 mol N≡N 键分别需要的能量是436 kJ、391 kJ、946 kJ。则图中的a=___________ kJ;若有1 mol N2(g)发生反应生成NH3(g)产生的能量变化为_________ kJ。?
(3)推测反应 2NH3(g)=== N2 (g)+3H2(g) 比反应2NH3(l)=== N2 (g)+3H2(g) _________(填“吸收”或“放出”)的热量__________(填“多”或“少”)。
??. 根据原电池的工作原理,可设计电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
⑴此反应消耗的NH3与O2的物质的量之比为___________;
⑵a电极作为该原电池的_______(填“正极”或“负极”), 其电极反应式为______________;
⑶b电极上发生________(填“氧化”或“还原”)反应,溶液中OH-向________(填“a”或“b”)电极移动。
23.(14分)?.乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取乙酸乙酯用醋酸、乙醇、浓硫酸、饱和碳酸钠溶液以及极易与乙醇结合的氯化钙溶液。主要装置如图所示:
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率,使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物用分液漏斗分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1) 该制备反应的化学方程式为:______________________________________;若用示踪原子(18O)标注乙醇中的氧原子,则该原子还将存在于_____________(写结构简式)中。
(2) 实验中浓硫酸的主要作用是______________________。用饱和Na2CO3溶液洗涤粗酯的目的是___________________________________________________________。
(3)用饱和CaCl2溶液洗涤粗酯的目的是___________________。
(4)在步骤⑧所得的粗酯里可能还含有的少量杂质是_____________________。
??. 已知5.8克某烃在氧气中完全燃烧,其产物(110℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加9.0克,干燥管的质量增加17.6克。
(1)经计算该有机物的实验式为________________;
(2)相同条件下,该烃蒸汽相对氢气的密度为29,则该有机物的分子式为:____________;
写出该烃所有同分异构体的结构简式:__________________________________________。
24.(14分) 用如图所示实验装置探究铜丝与过量浓硫酸的反应。
(1)写出A中发生反应的化学方程式________________________________________。
(2)装置D通入产生的气体后(未加热)的现象是 ,点燃酒精灯加热后的现象是 。
(3)为验证SO2和Cl2发生了反应,小组同学进行如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl—,只要检验到生成的Cl—即可,甲取适量B中样品于试管中,向其中滴加少量 (写化学式)溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理, 理由是 。他认为若验证SO2和Cl2反应,需要检验到生成的 (写化学式)。
③一段时间后,观察到B中溶液黄绿色褪去,B中反应的离子方程式为_____________。
(4) C中反应的化学方程式为__________________________________。
(5) 装置E的作用是___________________________,发生反应的离子方程式是___________________________________________________________。
《高 一 化 学 试 题》参考答案
一、单项选择题(每题2分,共30分)
1-5 D C B C C 6-10 D D C C C 11-15 D C C C B
二、不定项选择题(每题3分,共15分,每题1-2个正确答案,少选1分,多选0分)
16-20 BC B AC BD D
21、(除标注外,每空1分,共14分)
?. (1) ③⑥ (2) ②⑧、④⑦ (2分) (3) ①⑤
??. (1) H–C=C–H , 羟基、羧基。(2) [CH2—CH2 ] n。
(3) ① CH2=CH2+H2OCH3CH2OH (2分); 加成反应;
② 2CH3CH2OH+O2),\s\do 6(△))2CH3CHO+2H2O (2分); 氧化反应;
22、(除标注外,每空1分,共13分)
?. (1) 放出, b+c-a 。 (2) 1127 ; 92 。 (3) 吸收 , 少。
??.(1) 4:3(2分) ; (2) 负极, 2NH3–6e-+6OH–= N2↑+6H2O(2分);
(3) 还原, a 。
23、(除标注外,每空1分,共14分)
?. (1) CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O(2分); CH3CO18OCH2CH3。
(2) 催化剂、吸水剂(2分)。 除去乙醇和乙酸,降低乙酸乙酯溶解度。(3分)
(3) 除去乙醇。 (4)水。
??. (1) C2H5; (2) C4H10; CH3—CH2—CH2—CH3、(CH3)3CH。(2分)
24、(方程式2分,其它每空1分,共14分)
(1)Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑。 (2)红色褪去;恢复红色。
(3)①AgNO3。 ②Cl2和水反应也会生成Cl- (或写方程式)。 SO42-(或硫酸)。
③SO2+2H2O+Cl2=4H++SO42-+2Cl-。
(4)SO2+2H2S == 3S+2H2O。 (5) 吸收剩余SO2防止污染, SO2+2OH-= SO32-+H2O。
同课章节目录
