湖北省广水市普通中学2020-2021学年高一下学期5月月考化学试卷 Word版含答案
文档属性
| 名称 | 湖北省广水市普通中学2020-2021学年高一下学期5月月考化学试卷 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 326.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-04 14:56:22 | ||
图片预览



文档简介
广水市2020级高一年级5月月考
化学试题
考试用时:75分钟 全卷满分:100分
注意事项:
1.答卷前,考生务必将自己的班级、姓名、学号填写在试题卷和答题卡上。
2.选择题用2B铅笔填涂在答题卡上,非选择题用黑色签字笔答在答题卡上对应的答题区域内。
★祝考试顺利★
相对原子质量:H 1 C 12 N 14 O 16
一、选择题(每小题只有一个选项符合题意,每题3分,共45分)
1.《黄帝内经》说“五谷为养,五果为助,五畜为益,五菜为充”,以上食物中富含糖类、蛋白质、油脂等营养物质。下列说法正确的是
A.葡萄糖不具有还原性 B.淀粉和纤维素互为同分异构体
C.油脂在常温下都呈液态 D.蛋白质水解的最终产物为氨基酸
2.下列有关物质用途的说法中,不正确的是
A.石膏可以用来制作各种模型和医疗用的绷带
B.硫化橡胶可用于制造汽车轮胎
C.晶体硅可用于制作光导纤维
D.液氨可用作制冷剂
3.下列有关化学用语表示正确的是
A.中子数为18的氯原子:B.甲基的电子式:
C.丙烷的结构式:CH3CH2CH3 D.聚氯乙烯的链节:
4.实验室用如右图所示的装置进行甲烷与氯气在光照下反应的实验。光照反应一段时间后,下列说法错误是
A.试管中液面上升 B.生成油状液体浮在水面
C.试管中黄绿色变浅或褪去 D.试管中发生了取代反应
5.粗盐中含有Ca2+、SO42-等可溶性杂质。实验室用下述方案模拟粗盐的精制:
粗盐粗盐水滤液精制盐
下列说法不正确的是
A.操作1需要用到的玻璃仪器有烧杯、漏斗、玻璃棒
B.试剂1可选用BaCl2溶液,试剂2可选用Na2CO3溶液
C.调pH时,可选用硫酸使滤液呈中性或微酸性
D.结晶时,当蒸发皿中岀现较多固体时,停止加热,利用蒸发皿的余热使溶剂蒸干
6.酒驾是交通事故的第一大“杀手”。一种酒精检测仪工作原理如图,a、b两个多孔铂电极外均覆盖了一层聚四氟乙烯纳米纤维膜,方便气体透过。下列说法错误的是
A.该酒精检测仪运用了原电池原理
B.b极的电极反应:O2-4e-+4H+=2H2O
C.采用多孔铂电极可增大电极与气体接触面积
D.乙醇浓度越大,电路中的电流强度就越大
7.下列4个反应中,在硫酸、硝酸、氨、高纯硅的工业制备过程中没有涉及到的是
A.2SO2+O2 2SO3 B.3NO2+H2O==2HNO3+NO
C.2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑ D.Si + 3HCl SiHCl3+ H2
8.用图示装置及相应药品进行实验能达到相应实验目的的是
实验目的 药品a 药品b 药品c 装置
A 制备并收集乙酸乙酯 醋酸 乙醇 饱和碳酸钠溶液
B 制备并干燥氨气 浓氨水 CaO 浓硫酸
C 比较C与Si非金属性强弱 浓醋酸 CaCO3 硅酸钠溶液
D 比较 Cl2与Br2的氧化性强弱 浓盐酸 KMnO4 溴化钠溶液
9.反应NO2(g) + CO(g) NO(g) + CO2(g)的能量变化如图所示,
下列说法正确的是
A.图中a→b为放热过程
B.理论上该反应可以设计成原电池
C.升高温度,该反应的化学反应速率减慢
D.该反应中,断裂反应物化学键的能量变化大于形成生成物化学键
的能量变化
10.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1 mol C2H6中含极性共价键的数目为7NA
B.在标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为NA
C.Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应等于0.1NA
D.将足量的Cu与50mL18mo/L的浓硫酸充分反应,转移的电子数为小于0.9NA
11.某温度下,将等物质的量的气体A、B混合于2L的密闭容器中,发生如下反应:
A(g)+3B(g)2C(g)+xD(g),经2min后测得C的浓度为0.5mol/L,B的物质的量分数为25%,以D表示的反应速率v(D)=0.25mol/(L?min),下列说法正确的是
A.2min时,A的反应速率为0.25 mol/(L?min)
B.2min时,B的物质的量为1.5mol
C.化学方程式中,x=1
D.反应前后容器内气体的压强之比为1:2
12.下列关于有机物的说法错误的是
A.其一氯代物有四种
B.与氢气加成的产物为异丁烷的同系物
C.与甲基环戊烷()互为同分异构体
D.所有碳原子可能在同一平面
13.下列说法不正确的是
A.烷烃的熔、沸点一般随着分子中碳原子数的增加而升高
B.C2H518OH与CH3COOH发生酯化反应,反应生成的水分子中不存在18O
C.不能用水区别乙醇、乙酸乙酯、CCl4三种有机试剂
D.总物质的量为1mol的C3H6和C4H6O2的混合物,不论二者以何种比例混合,完全燃烧时消耗O2的量和生成H2O的量都不变
14.恒温、恒容密闭容器中发生可逆反应:2X(g)Y(g)+Z(s);下列描述不能表明该可逆反应达到平衡状态的是
①混合气体密度不变 ??②反应容器中生成物的百分含量不变?? ③固体的质量不变??
④混合气体的压强不变 ⑤c(X):c(Y)=2:1 ⑥混合气体的总物质的量不变
⑦反应物的消耗速率与生成物的生成速率不再改变 ⑧2v正(X)=v逆(Y)
A.⑤⑧ B.①③⑤⑧ C.⑤⑦⑧ D.①②③④⑤⑥
15.下列有关实验操作、现象和解释或结论都正确的是
选项 实验操作 实验现象 解释或结论
A 加热碳酸盐X使其分解,将产生的气体通入BaCl2溶液 无明显现象 X不可能是
B 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 溶液呈红色 稀HNO3将Fe氧化为Fe3+
C 取适量20%的蔗糖溶液,加入少量稀硫酸,水浴加热,5分钟后加入新制氢氧化铜,加热至沸腾 有砖红色沉淀产生 蔗糖水解产生了葡萄糖
D 将一小块金属钠投入乙醇中,验纯后点燃产生的气体,并将干燥洁净的烧杯罩在火焰上方,过一会倒转烧杯,加入澄清石灰水 钠表面有气泡产生,烧杯内壁出现液滴,石灰水不变浑浊 乙醇与金属钠反应产生了H2,乙醇能够电离出H+
二、填空题(4个大题,共55分)
16.硝酸工业会产生氮氧化物(含N2O、NO和NO2)的尾气,需处理后才能排放。
(1)N2O的处理。N2O是氨催化氧化过程的副产物,用特种催化剂能使N2O分解。氨的催化氧化是工业制硝酸很重要的一步反应,写出此步反应的化学方程式_______________________________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,发生的主要反应为:
NO+NO2+2OH?2+H2O和2NO2+2OH?++H2O
①下列措施不能提高尾气中NO和NO2去除率的是________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。
①在酸性NaClO溶液中,HClO氧化NO的离子方程式为______________________________。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是______________________________。
17.硫及其化合物具有非常广泛的用途。研究硫及其化合物具有重要的意义。
I.科学酿造葡萄酒时会添加辅料SO2,起到杀菌消毒和抗氧化的作用。
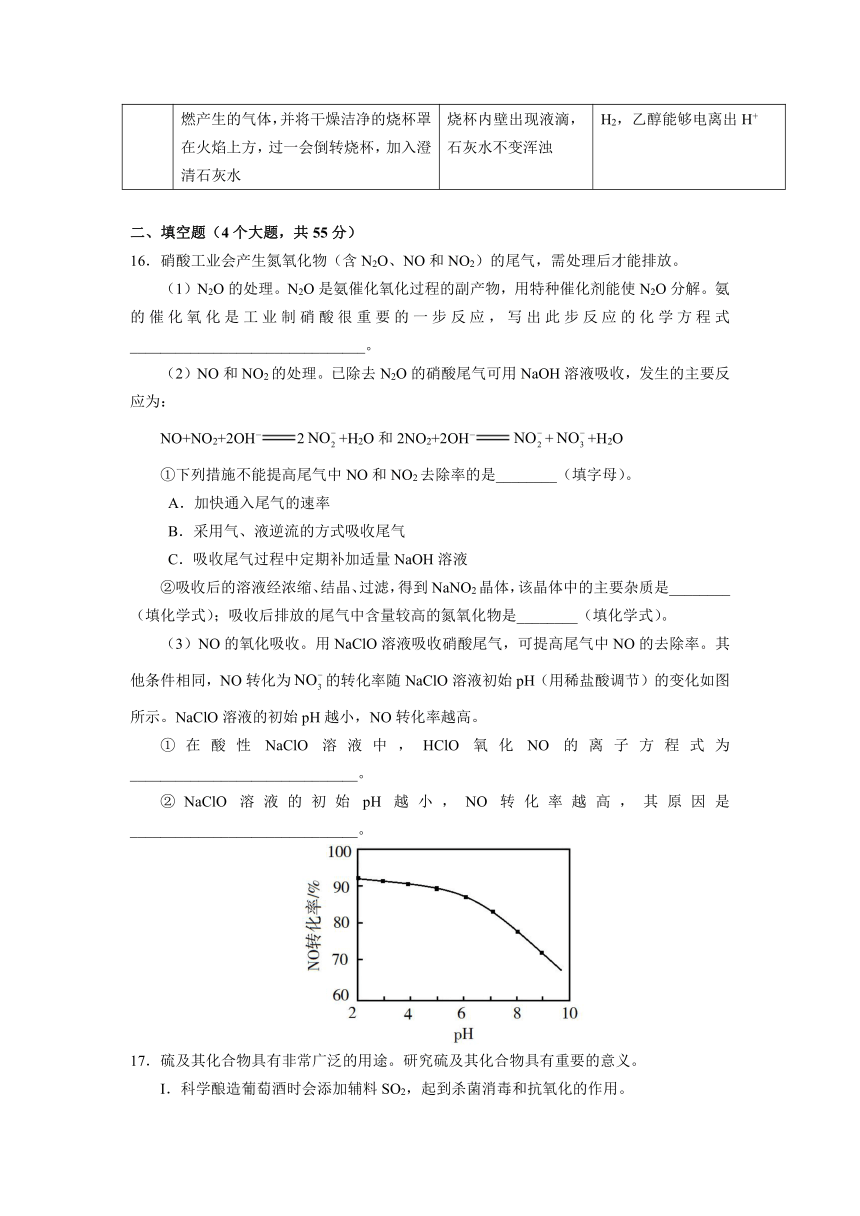
(1)用如图实验装置探究二氧化硫的氧化性。
充入气体前首先要检查装置的气密性,接着关闭旋塞1和2;按上图充入气体,连接装置。
打开旋塞1,可观察到的主要现象是_______________________________;若A瓶和B瓶的体积相等,恢复到常温,打开旋塞2,可观察到的现象是__________________________,此时A瓶中可能发生反应的化学方程式为_________________________________。
(2)从环保角度,利用上图装置设计验证二氧化硫具有还原性的最佳方案。
实验方案 预期现象
将烧杯中的氢氧化钠溶液换成________溶液,操作如(1) ________________________________。
II.Na2S2O3可用于解毒西药和织物及纸浆漂白的脱氯剂等。在实验室,我们可以用硫代硫酸钠与稀硫酸的反应来探究影响反应速率的因素。某同学设计了如下系列实验:
实验序号 反应温度/℃ Na2S2O3溶液 稀硫酸 H2O
V/ml c/(mol/L) V/ml c/(mol/L) V/ml
① 20 10.0 0.10 10.0 0.50 0
② 40 V1 0.10 V2 0.50 V3
③ 20 V4 0.10 4.0 0.50 V5
(3)写出硫代硫酸钠与稀硫酸反应的化学方程式______________________________。
(4)该实验①和②可探究温度对反应速率的影响,则V1=_______,V2=_______, V3=_______。
(5)若实验①和③可探究浓度对反应速率的影响,则V4=_______,V5=_______。
18.甲醇既是重要的化工原料,又是一种可再生的清洁能源,具有广泛的应用前景。工业上可以采用如下反应合成甲醇:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
(1)上述反应在一密闭容器中进行,下列条件的改变会使反应的速率增大的是__________。
A.将容器体积缩小一半
B.保持压强不变,充入Ne气使容器体积增大
C.保持容器体积不变,向反应容器中充入CO2
D.保持容器体积不变,将反应生成的甲醇及时液化并分离出去
(2)在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①0~10min内,H2表示的反应速率为___________________。
②3min时,CO2的转化率为_______,此时v正____v逆(填“>” 、“<”或 “=”)
(3)已知32 g甲醇燃烧生成二氧化碳气体和液态水放出的热量为725.76 kJ,若上述过程生成的水为气态,则放出的热量________(填“>” 、“<”或 “=”)725.76kJ。
(4)某甲醇—氧气燃料电池的工作原理如下图所示。
①c处通入的是______________,负极发生的电极反应式为__________________________。
②工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有______mol H+通过质子交换膜。
19.有机物A是重要的化工原料,还是一种植物生长调节剂;有机物G有水果香味。
(1)反应①的反应类型为_______________,C的官能团的名称为_______________;
(2)分别写出反应②和反应⑤化学方程式:
反应②_________________________;反应⑤_________________________。
(3)写出有机物G所有含羧基的同分异构体的结构简式__________________________。
(4)X为合成聚合物M的单体之一,则X的结构简式为____________________。
(5)下列关于乙烯和聚合物M的说法中,正确的是____________(填字母代号)。
A.乙烯在常温下是气体,为纯净物;聚合物M在常温下是固体,为混合物
B.乙烯的化学性质比聚合物M活泼
C.取等质量的乙烯和聚合物M完全燃烧后,生成的 CO2和H2O的质量分别相等
D.乙烯和聚合物M都能使溴水褪色
2020级高一年级下学期5月月考
地理试题参考答案
1.A 由于广大务工人员的户籍与常住地不一致,造成“人户分离”,其主要原因是我国严格的严格的户籍管理制度,导致务工人员难以在务工地入户,经济的快速发展,使大量务工人员外出务工,造成“人户分离”,②③正确,故选A。
2.C “有人无户(籍)”应该为经济发达区,外来务工人员多,但户籍不在,上海是我国发达的地区,外来务工人员多,出现这种现象普遍,C正确,ABD错误,故选C。
3.A 要对普查的区域进行细分,要了解该区域的人口密度,合理分配任务给普查员,必须进行区域的人口数量统计,而要完成这一任务,必须用到地理信息系统,通过该技术对区域人口进行初步统计,合理划定区域。A正确,BCD错误。故选A。
4.D 图中显示,甲、乙、丙、丁四个城市中,甲、乙、丙的建设用地增长率呈正值,城市建设用地规模扩大,且人口密度呈负正值,可能是城市面积不断扩大的结果,因此甲、乙、丙三城市正处于快速城市过程,不是处于城市化后期的城市,排除ABC;图中显示,丁城市建设用地增长率为0,城市规模没有扩大,城市人口密度增加,人均建设用地减少,城市建设用地的集约程度提高,表明城市化处于城市化后期,D符合题意。故选D。
5.A 据图可知,2000~2014年乙城市建设用地增长率最高,表明乙城市的城市规模迅速扩大,城市化水平应提高,A正确、D错误;图中建设用地的变化不能表明用地结构优化,排除B;图中表明乙城市人口密度增长率为负值,因此人口密度减少,排除C。故选A。
6.C 读图可知,通勤时间最短的地区位于城市中心地区,该地区住房成本最高,结合选项可推测其最可能为金融区,C正确。
7.D 与公交车相比,地铁运行速度快,能够缩短通勤时间,D正确。地铁的站点数量与公交车的差异不是很明显;乘坐地铁的价格相对较高;地铁发车频次较为稳定,虽然公交车受道路通行状况等影响较大,但发车频次并不低。D正确,ABC错误,故选D。
8.B 由图可知,通勤时间小于45分钟的地区,与市中心距离在8千米以内,住房成本大于6万元/平方米,A错误、B正确。通勤时间小于45分钟的地区,位于市中心附近,交通拥堵严重,地价较高,居民收入普遍较高,CD错误。B正确,ACD错误,故选B。
9.D 根据材料,生产性服务业是为生产提供服务的行业。餐饮业是为满足人们的餐饮需求服务的,A不对;人像摄影业是为满足人们的摄像需求的,与生产性服务无关,B不对;家政服务业是给人们提供家庭生活方面的服务的,C不对;金融服务业可以W为生产过程提供资金等服务,高层次人才就业最集中的产业,属于生产性服务业,D对。故选D。
10.B 中心城区人流量很大,噪音干扰多,环境条件不好,A不对;市中心是各种产业的总部集中之地,信息量大,因此生产性服务业集聚在此可以及时获取市场需求信息,B对;根据材料,生产性服务业为生产提供便利,因此与消费和提高生活品位关系不大,C不对;生产性服务业为生产提供服务,有利于其它行业生产的进行,本身并不生产产品,D不对。
11.C 根据材料推测农业生产性服务业主要通过提供农业生产性服务,为农业提供中间投入,为科技、信息、资金、人才等有效植入农业产业链提供途径等。农产品流通不畅问题日益突出应该开通绿色通道等,促进农产品流通,A不对; 城乡居民消费日益多元化应推动农业生产的多样化,B不对;我国大量农村劳动力进城务工经商,农村大片土地撂荒,需要进行土地流转,加快农业的现代化发展,需要发展农业的生产性服务业,C对;“三农”问题不可能彻底解决,D不对。故选C。
12.D 滴灌对土壤的盐分具有淋洗的作用,但当滴灌区域停水后,随着蒸发的加剧,下层土壤的盐分随水分蒸发上升,是上层湿润区盐分累计,并不是增加根系区域的土壤盐度,①错误。铺膜类似于大气的保温作用,可以保温,并且阻挡水汽蒸发,起到保湿的作用,有助于保苗、促苗,②正确。间做可以提高土地的利用率,减少光能的浪费,但不会增加某种作物的单产,③错误。滴灌可以通过控制水肥量,减少灌溉过程中造成的地下水污染,④正确。ABC项错误,D项正确。故选D。
13.C 像这种种植方式,需要在滩涂或盐碱地,三江平原位于东北,土壤肥沃,盐碱地较少,A项错误。洞庭湖平原地形平坦,主要问题是围湖造田,并不是土地盐碱化,盐碱土较少,不需要这种种植方式,B项错误。华北平原盐碱土广布,最适合这种种植方式,C项正确。湟水谷地位于青藏高原之上,蒸发较弱,谷地土地有一定坡度,盐碱化土地较少,不太适合借鉴该地种植方式,D项错误。故选C。
14.D 材料中得知,1930—1959年,凭借里程碑式的设计,通用汽车迅速成为华尔街(美国的金融中心)评价最高的公司之一,“凭借里程碑式的设计”是思考的关键信息;该信息的核心是“创新”。D正确。故本题选择D。
15.B 通用汽车公司在中国投资,主要目的是想占领中国庞大的汽车消费市场、获取更多的利润。B对;降低成本、增加就业机会和促进经济发展是通用汽车在中国投资的影响,而不是目的,排除ACD。故本题选择B。
16.D 材料中得知,通用汽车公司宣布将关闭美国境内的数家工厂,以优化产品组合,更好的整合生产基地和研发团队。“优化产品组合”是思考的关键,优化产品组合的根本目的的是适应市场变化,以提高公司的利润。减少工资支出、开拓国外市场和增加科研力量都是过程方式,不是根本目的,排除ABC。故本题选择D。
17.B 土壤的肥沃程度直接影响每年的收成,不肥沃的耕地因产出少,农户愿意休耕,反之则不愿休耕;对于休耕的损失,政府经济补贴多少直接影响农户是否参与休耕的意愿;人均耕地面积少的地区,为了维持基本生活需求,农户不愿参与休耕,人均耕地面积大的地区,部分耕地休耕对农户收益影响不大,可以减轻劳动压力,参与休耕的意愿更强;我国种植业区大多属于季风气候区,降水的年际变化较大,前一年降水较少,并不代表下一年降水较少,具有很强的不确定性;如果降水较少,还有地下水和地表水水资源进行补充;丰水年土地收益较高,农户可能不愿意休耕,枯水年为了保证基本收益,农户也可能不愿休耕,因此降水状况对农户休耕意愿影响最小。故选B。
18.A 华北地区“一季休耕、一季雨养”,是指将需抽水灌溉的冬小麦休耕,只种雨热同季的春玉米、马铃薯和耐旱耐瘠薄的杂粮杂豆,减少使用地下水。因此该地区因休耕而使产量明显减少的农作物是冬小麦。故选A。
19.(1)洛坤府多山,可栽种土地有限;成年树冠极大,植株密度较小;易受台风、洪涝等自然灾害,导致产量低。
(2)产量少,品质优,营养价值高,所以价格贵;人们对高品质水果的市场需求量大;柚子皮厚,耐运输和储存,果损耗率低(或抗市场风险能力大、利润大),所以商家愿意售卖。
(3)花期次数减少(一年一次)。原因∶梅州相比泰国,纬度较高,气温较低,年积温(或热量)较少。
20.(1)玄武岩分布广,制作石槽的材料丰富;盐田村地势平坦开阔,利于晒盐;距海近,海水盐度高,制盐效果好;纬度低,年均温高;位于夏季风的背风坡,晴天多,日照时数长,太阳辐射强;临近海洋,多大风天气,有利于海水蒸发。
(2)古法制盐方式生产效率和产量低;生产规模小,盐工经济收益低,生产积极性不高;大规模盐场的建设对盐由村制盐的冲击。
(3)传承和保护制盐工艺,防止古老的制盐工艺失传;保留古盐田原始的生产状态,满足外来旅游者的体验需求;激发村民对自身文化传统的自豪感和保护盐田的热情,在开发与保护、生产与旅游之间维持良好的平衡。
21.(1)总装厂位于图卢兹市区外围郊区,地价较低;距机场近,便于各地零部件空运到总装厂,便于原材料运输;共用基础设施,并可利用机场跑道进行试飞;该机场为国际机场,便于成品飞机销往(航空公司)各地市场。
(2)将零部件提前预制成大部件,可以节省现场总装的时间,提高生产效率;采用超大飞机运输可满足飞机“大部件”运输的需求;飞机运输可克服陆地桥隧等陆地运输对“大部件”运输的限制;”飞机零部件精密度高,采用航空运输,安全性高且速度快(或节约时间)。
化学试题
考试用时:75分钟 全卷满分:100分
注意事项:
1.答卷前,考生务必将自己的班级、姓名、学号填写在试题卷和答题卡上。
2.选择题用2B铅笔填涂在答题卡上,非选择题用黑色签字笔答在答题卡上对应的答题区域内。
★祝考试顺利★
相对原子质量:H 1 C 12 N 14 O 16
一、选择题(每小题只有一个选项符合题意,每题3分,共45分)
1.《黄帝内经》说“五谷为养,五果为助,五畜为益,五菜为充”,以上食物中富含糖类、蛋白质、油脂等营养物质。下列说法正确的是
A.葡萄糖不具有还原性 B.淀粉和纤维素互为同分异构体
C.油脂在常温下都呈液态 D.蛋白质水解的最终产物为氨基酸
2.下列有关物质用途的说法中,不正确的是
A.石膏可以用来制作各种模型和医疗用的绷带
B.硫化橡胶可用于制造汽车轮胎
C.晶体硅可用于制作光导纤维
D.液氨可用作制冷剂
3.下列有关化学用语表示正确的是
A.中子数为18的氯原子:B.甲基的电子式:
C.丙烷的结构式:CH3CH2CH3 D.聚氯乙烯的链节:
4.实验室用如右图所示的装置进行甲烷与氯气在光照下反应的实验。光照反应一段时间后,下列说法错误是
A.试管中液面上升 B.生成油状液体浮在水面
C.试管中黄绿色变浅或褪去 D.试管中发生了取代反应
5.粗盐中含有Ca2+、SO42-等可溶性杂质。实验室用下述方案模拟粗盐的精制:
粗盐粗盐水滤液精制盐
下列说法不正确的是
A.操作1需要用到的玻璃仪器有烧杯、漏斗、玻璃棒
B.试剂1可选用BaCl2溶液,试剂2可选用Na2CO3溶液
C.调pH时,可选用硫酸使滤液呈中性或微酸性
D.结晶时,当蒸发皿中岀现较多固体时,停止加热,利用蒸发皿的余热使溶剂蒸干
6.酒驾是交通事故的第一大“杀手”。一种酒精检测仪工作原理如图,a、b两个多孔铂电极外均覆盖了一层聚四氟乙烯纳米纤维膜,方便气体透过。下列说法错误的是
A.该酒精检测仪运用了原电池原理
B.b极的电极反应:O2-4e-+4H+=2H2O
C.采用多孔铂电极可增大电极与气体接触面积
D.乙醇浓度越大,电路中的电流强度就越大
7.下列4个反应中,在硫酸、硝酸、氨、高纯硅的工业制备过程中没有涉及到的是
A.2SO2+O2 2SO3 B.3NO2+H2O==2HNO3+NO
C.2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑ D.Si + 3HCl SiHCl3+ H2
8.用图示装置及相应药品进行实验能达到相应实验目的的是
实验目的 药品a 药品b 药品c 装置
A 制备并收集乙酸乙酯 醋酸 乙醇 饱和碳酸钠溶液
B 制备并干燥氨气 浓氨水 CaO 浓硫酸
C 比较C与Si非金属性强弱 浓醋酸 CaCO3 硅酸钠溶液
D 比较 Cl2与Br2的氧化性强弱 浓盐酸 KMnO4 溴化钠溶液
9.反应NO2(g) + CO(g) NO(g) + CO2(g)的能量变化如图所示,
下列说法正确的是
A.图中a→b为放热过程
B.理论上该反应可以设计成原电池
C.升高温度,该反应的化学反应速率减慢
D.该反应中,断裂反应物化学键的能量变化大于形成生成物化学键
的能量变化
10.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1 mol C2H6中含极性共价键的数目为7NA
B.在标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为NA
C.Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应等于0.1NA
D.将足量的Cu与50mL18mo/L的浓硫酸充分反应,转移的电子数为小于0.9NA
11.某温度下,将等物质的量的气体A、B混合于2L的密闭容器中,发生如下反应:
A(g)+3B(g)2C(g)+xD(g),经2min后测得C的浓度为0.5mol/L,B的物质的量分数为25%,以D表示的反应速率v(D)=0.25mol/(L?min),下列说法正确的是
A.2min时,A的反应速率为0.25 mol/(L?min)
B.2min时,B的物质的量为1.5mol
C.化学方程式中,x=1
D.反应前后容器内气体的压强之比为1:2
12.下列关于有机物的说法错误的是
A.其一氯代物有四种
B.与氢气加成的产物为异丁烷的同系物
C.与甲基环戊烷()互为同分异构体
D.所有碳原子可能在同一平面
13.下列说法不正确的是
A.烷烃的熔、沸点一般随着分子中碳原子数的增加而升高
B.C2H518OH与CH3COOH发生酯化反应,反应生成的水分子中不存在18O
C.不能用水区别乙醇、乙酸乙酯、CCl4三种有机试剂
D.总物质的量为1mol的C3H6和C4H6O2的混合物,不论二者以何种比例混合,完全燃烧时消耗O2的量和生成H2O的量都不变
14.恒温、恒容密闭容器中发生可逆反应:2X(g)Y(g)+Z(s);下列描述不能表明该可逆反应达到平衡状态的是
①混合气体密度不变 ??②反应容器中生成物的百分含量不变?? ③固体的质量不变??
④混合气体的压强不变 ⑤c(X):c(Y)=2:1 ⑥混合气体的总物质的量不变
⑦反应物的消耗速率与生成物的生成速率不再改变 ⑧2v正(X)=v逆(Y)
A.⑤⑧ B.①③⑤⑧ C.⑤⑦⑧ D.①②③④⑤⑥
15.下列有关实验操作、现象和解释或结论都正确的是
选项 实验操作 实验现象 解释或结论
A 加热碳酸盐X使其分解,将产生的气体通入BaCl2溶液 无明显现象 X不可能是
B 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 溶液呈红色 稀HNO3将Fe氧化为Fe3+
C 取适量20%的蔗糖溶液,加入少量稀硫酸,水浴加热,5分钟后加入新制氢氧化铜,加热至沸腾 有砖红色沉淀产生 蔗糖水解产生了葡萄糖
D 将一小块金属钠投入乙醇中,验纯后点燃产生的气体,并将干燥洁净的烧杯罩在火焰上方,过一会倒转烧杯,加入澄清石灰水 钠表面有气泡产生,烧杯内壁出现液滴,石灰水不变浑浊 乙醇与金属钠反应产生了H2,乙醇能够电离出H+
二、填空题(4个大题,共55分)
16.硝酸工业会产生氮氧化物(含N2O、NO和NO2)的尾气,需处理后才能排放。
(1)N2O的处理。N2O是氨催化氧化过程的副产物,用特种催化剂能使N2O分解。氨的催化氧化是工业制硝酸很重要的一步反应,写出此步反应的化学方程式_______________________________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,发生的主要反应为:
NO+NO2+2OH?2+H2O和2NO2+2OH?++H2O
①下列措施不能提高尾气中NO和NO2去除率的是________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。
①在酸性NaClO溶液中,HClO氧化NO的离子方程式为______________________________。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是______________________________。
17.硫及其化合物具有非常广泛的用途。研究硫及其化合物具有重要的意义。
I.科学酿造葡萄酒时会添加辅料SO2,起到杀菌消毒和抗氧化的作用。
(1)用如图实验装置探究二氧化硫的氧化性。
充入气体前首先要检查装置的气密性,接着关闭旋塞1和2;按上图充入气体,连接装置。
打开旋塞1,可观察到的主要现象是_______________________________;若A瓶和B瓶的体积相等,恢复到常温,打开旋塞2,可观察到的现象是__________________________,此时A瓶中可能发生反应的化学方程式为_________________________________。
(2)从环保角度,利用上图装置设计验证二氧化硫具有还原性的最佳方案。
实验方案 预期现象
将烧杯中的氢氧化钠溶液换成________溶液,操作如(1) ________________________________。
II.Na2S2O3可用于解毒西药和织物及纸浆漂白的脱氯剂等。在实验室,我们可以用硫代硫酸钠与稀硫酸的反应来探究影响反应速率的因素。某同学设计了如下系列实验:
实验序号 反应温度/℃ Na2S2O3溶液 稀硫酸 H2O
V/ml c/(mol/L) V/ml c/(mol/L) V/ml
① 20 10.0 0.10 10.0 0.50 0
② 40 V1 0.10 V2 0.50 V3
③ 20 V4 0.10 4.0 0.50 V5
(3)写出硫代硫酸钠与稀硫酸反应的化学方程式______________________________。
(4)该实验①和②可探究温度对反应速率的影响,则V1=_______,V2=_______, V3=_______。
(5)若实验①和③可探究浓度对反应速率的影响,则V4=_______,V5=_______。
18.甲醇既是重要的化工原料,又是一种可再生的清洁能源,具有广泛的应用前景。工业上可以采用如下反应合成甲醇:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
(1)上述反应在一密闭容器中进行,下列条件的改变会使反应的速率增大的是__________。
A.将容器体积缩小一半
B.保持压强不变,充入Ne气使容器体积增大
C.保持容器体积不变,向反应容器中充入CO2
D.保持容器体积不变,将反应生成的甲醇及时液化并分离出去
(2)在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①0~10min内,H2表示的反应速率为___________________。
②3min时,CO2的转化率为_______,此时v正____v逆(填“>” 、“<”或 “=”)
(3)已知32 g甲醇燃烧生成二氧化碳气体和液态水放出的热量为725.76 kJ,若上述过程生成的水为气态,则放出的热量________(填“>” 、“<”或 “=”)725.76kJ。
(4)某甲醇—氧气燃料电池的工作原理如下图所示。
①c处通入的是______________,负极发生的电极反应式为__________________________。
②工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有______mol H+通过质子交换膜。
19.有机物A是重要的化工原料,还是一种植物生长调节剂;有机物G有水果香味。
(1)反应①的反应类型为_______________,C的官能团的名称为_______________;
(2)分别写出反应②和反应⑤化学方程式:
反应②_________________________;反应⑤_________________________。
(3)写出有机物G所有含羧基的同分异构体的结构简式__________________________。
(4)X为合成聚合物M的单体之一,则X的结构简式为____________________。
(5)下列关于乙烯和聚合物M的说法中,正确的是____________(填字母代号)。
A.乙烯在常温下是气体,为纯净物;聚合物M在常温下是固体,为混合物
B.乙烯的化学性质比聚合物M活泼
C.取等质量的乙烯和聚合物M完全燃烧后,生成的 CO2和H2O的质量分别相等
D.乙烯和聚合物M都能使溴水褪色
2020级高一年级下学期5月月考
地理试题参考答案
1.A 由于广大务工人员的户籍与常住地不一致,造成“人户分离”,其主要原因是我国严格的严格的户籍管理制度,导致务工人员难以在务工地入户,经济的快速发展,使大量务工人员外出务工,造成“人户分离”,②③正确,故选A。
2.C “有人无户(籍)”应该为经济发达区,外来务工人员多,但户籍不在,上海是我国发达的地区,外来务工人员多,出现这种现象普遍,C正确,ABD错误,故选C。
3.A 要对普查的区域进行细分,要了解该区域的人口密度,合理分配任务给普查员,必须进行区域的人口数量统计,而要完成这一任务,必须用到地理信息系统,通过该技术对区域人口进行初步统计,合理划定区域。A正确,BCD错误。故选A。
4.D 图中显示,甲、乙、丙、丁四个城市中,甲、乙、丙的建设用地增长率呈正值,城市建设用地规模扩大,且人口密度呈负正值,可能是城市面积不断扩大的结果,因此甲、乙、丙三城市正处于快速城市过程,不是处于城市化后期的城市,排除ABC;图中显示,丁城市建设用地增长率为0,城市规模没有扩大,城市人口密度增加,人均建设用地减少,城市建设用地的集约程度提高,表明城市化处于城市化后期,D符合题意。故选D。
5.A 据图可知,2000~2014年乙城市建设用地增长率最高,表明乙城市的城市规模迅速扩大,城市化水平应提高,A正确、D错误;图中建设用地的变化不能表明用地结构优化,排除B;图中表明乙城市人口密度增长率为负值,因此人口密度减少,排除C。故选A。
6.C 读图可知,通勤时间最短的地区位于城市中心地区,该地区住房成本最高,结合选项可推测其最可能为金融区,C正确。
7.D 与公交车相比,地铁运行速度快,能够缩短通勤时间,D正确。地铁的站点数量与公交车的差异不是很明显;乘坐地铁的价格相对较高;地铁发车频次较为稳定,虽然公交车受道路通行状况等影响较大,但发车频次并不低。D正确,ABC错误,故选D。
8.B 由图可知,通勤时间小于45分钟的地区,与市中心距离在8千米以内,住房成本大于6万元/平方米,A错误、B正确。通勤时间小于45分钟的地区,位于市中心附近,交通拥堵严重,地价较高,居民收入普遍较高,CD错误。B正确,ACD错误,故选B。
9.D 根据材料,生产性服务业是为生产提供服务的行业。餐饮业是为满足人们的餐饮需求服务的,A不对;人像摄影业是为满足人们的摄像需求的,与生产性服务无关,B不对;家政服务业是给人们提供家庭生活方面的服务的,C不对;金融服务业可以W为生产过程提供资金等服务,高层次人才就业最集中的产业,属于生产性服务业,D对。故选D。
10.B 中心城区人流量很大,噪音干扰多,环境条件不好,A不对;市中心是各种产业的总部集中之地,信息量大,因此生产性服务业集聚在此可以及时获取市场需求信息,B对;根据材料,生产性服务业为生产提供便利,因此与消费和提高生活品位关系不大,C不对;生产性服务业为生产提供服务,有利于其它行业生产的进行,本身并不生产产品,D不对。
11.C 根据材料推测农业生产性服务业主要通过提供农业生产性服务,为农业提供中间投入,为科技、信息、资金、人才等有效植入农业产业链提供途径等。农产品流通不畅问题日益突出应该开通绿色通道等,促进农产品流通,A不对; 城乡居民消费日益多元化应推动农业生产的多样化,B不对;我国大量农村劳动力进城务工经商,农村大片土地撂荒,需要进行土地流转,加快农业的现代化发展,需要发展农业的生产性服务业,C对;“三农”问题不可能彻底解决,D不对。故选C。
12.D 滴灌对土壤的盐分具有淋洗的作用,但当滴灌区域停水后,随着蒸发的加剧,下层土壤的盐分随水分蒸发上升,是上层湿润区盐分累计,并不是增加根系区域的土壤盐度,①错误。铺膜类似于大气的保温作用,可以保温,并且阻挡水汽蒸发,起到保湿的作用,有助于保苗、促苗,②正确。间做可以提高土地的利用率,减少光能的浪费,但不会增加某种作物的单产,③错误。滴灌可以通过控制水肥量,减少灌溉过程中造成的地下水污染,④正确。ABC项错误,D项正确。故选D。
13.C 像这种种植方式,需要在滩涂或盐碱地,三江平原位于东北,土壤肥沃,盐碱地较少,A项错误。洞庭湖平原地形平坦,主要问题是围湖造田,并不是土地盐碱化,盐碱土较少,不需要这种种植方式,B项错误。华北平原盐碱土广布,最适合这种种植方式,C项正确。湟水谷地位于青藏高原之上,蒸发较弱,谷地土地有一定坡度,盐碱化土地较少,不太适合借鉴该地种植方式,D项错误。故选C。
14.D 材料中得知,1930—1959年,凭借里程碑式的设计,通用汽车迅速成为华尔街(美国的金融中心)评价最高的公司之一,“凭借里程碑式的设计”是思考的关键信息;该信息的核心是“创新”。D正确。故本题选择D。
15.B 通用汽车公司在中国投资,主要目的是想占领中国庞大的汽车消费市场、获取更多的利润。B对;降低成本、增加就业机会和促进经济发展是通用汽车在中国投资的影响,而不是目的,排除ACD。故本题选择B。
16.D 材料中得知,通用汽车公司宣布将关闭美国境内的数家工厂,以优化产品组合,更好的整合生产基地和研发团队。“优化产品组合”是思考的关键,优化产品组合的根本目的的是适应市场变化,以提高公司的利润。减少工资支出、开拓国外市场和增加科研力量都是过程方式,不是根本目的,排除ABC。故本题选择D。
17.B 土壤的肥沃程度直接影响每年的收成,不肥沃的耕地因产出少,农户愿意休耕,反之则不愿休耕;对于休耕的损失,政府经济补贴多少直接影响农户是否参与休耕的意愿;人均耕地面积少的地区,为了维持基本生活需求,农户不愿参与休耕,人均耕地面积大的地区,部分耕地休耕对农户收益影响不大,可以减轻劳动压力,参与休耕的意愿更强;我国种植业区大多属于季风气候区,降水的年际变化较大,前一年降水较少,并不代表下一年降水较少,具有很强的不确定性;如果降水较少,还有地下水和地表水水资源进行补充;丰水年土地收益较高,农户可能不愿意休耕,枯水年为了保证基本收益,农户也可能不愿休耕,因此降水状况对农户休耕意愿影响最小。故选B。
18.A 华北地区“一季休耕、一季雨养”,是指将需抽水灌溉的冬小麦休耕,只种雨热同季的春玉米、马铃薯和耐旱耐瘠薄的杂粮杂豆,减少使用地下水。因此该地区因休耕而使产量明显减少的农作物是冬小麦。故选A。
19.(1)洛坤府多山,可栽种土地有限;成年树冠极大,植株密度较小;易受台风、洪涝等自然灾害,导致产量低。
(2)产量少,品质优,营养价值高,所以价格贵;人们对高品质水果的市场需求量大;柚子皮厚,耐运输和储存,果损耗率低(或抗市场风险能力大、利润大),所以商家愿意售卖。
(3)花期次数减少(一年一次)。原因∶梅州相比泰国,纬度较高,气温较低,年积温(或热量)较少。
20.(1)玄武岩分布广,制作石槽的材料丰富;盐田村地势平坦开阔,利于晒盐;距海近,海水盐度高,制盐效果好;纬度低,年均温高;位于夏季风的背风坡,晴天多,日照时数长,太阳辐射强;临近海洋,多大风天气,有利于海水蒸发。
(2)古法制盐方式生产效率和产量低;生产规模小,盐工经济收益低,生产积极性不高;大规模盐场的建设对盐由村制盐的冲击。
(3)传承和保护制盐工艺,防止古老的制盐工艺失传;保留古盐田原始的生产状态,满足外来旅游者的体验需求;激发村民对自身文化传统的自豪感和保护盐田的热情,在开发与保护、生产与旅游之间维持良好的平衡。
21.(1)总装厂位于图卢兹市区外围郊区,地价较低;距机场近,便于各地零部件空运到总装厂,便于原材料运输;共用基础设施,并可利用机场跑道进行试飞;该机场为国际机场,便于成品飞机销往(航空公司)各地市场。
(2)将零部件提前预制成大部件,可以节省现场总装的时间,提高生产效率;采用超大飞机运输可满足飞机“大部件”运输的需求;飞机运输可克服陆地桥隧等陆地运输对“大部件”运输的限制;”飞机零部件精密度高,采用航空运输,安全性高且速度快(或节约时间)。
同课章节目录
