高中化学人教版(2019)选择性必修一第三章 第二节 水的电离和溶液的PH(共21张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修一第三章 第二节 水的电离和溶液的PH(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-05 06:28:40 | ||
图片预览







文档简介
(共21张PPT)
第三章
水溶液中的离子反应与平衡
第二节
水的电离和溶液的pH
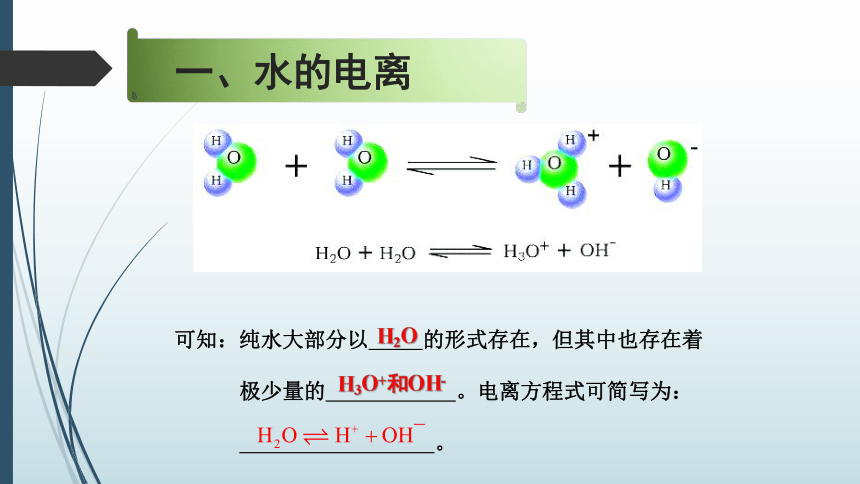
一、水的电离
可知:纯水大部分以
的形式存在,但其中也存在着
极少量的
。电离方程式可简写为:
。
H2O
H3O+和OH-
水的离子积常数
Kw叫做水的离子积常数,简称水的离子积。Kw可由实验测得,也可通过理论计算求得。
(1)表达式
(2)影响因素
25℃时,
。不仅适用于纯水(或其他中性溶液),也适用于稀的
溶液。
电解质
水的离子积Kw只受
的影响,温度升高,K
。(水的电离是吸热过程。)
温度
增大
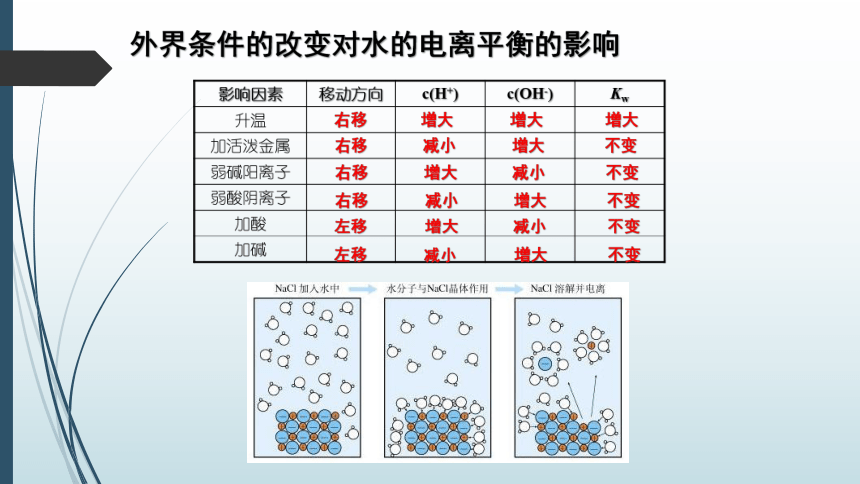
外界条件的改变对水的电离平衡的影响
增大
增大
右移
增大
不变
减小
右移
增大
不变
增大
右移
减小
不变
减小
右移
增大
不变
增大
左移
减小
不变
减小
左移
增大
①不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等,判断溶液中水的电离程度时,酸溶液看c(OH-),碱溶液看c(H+)。
②25
℃,任何稀的电解质水溶液中c(H+)·c(OH-)=KW这一关系不变,当改变其他条件使c(H+)增大时,c(OH-)必然降低,反之亦然。
特别提醒
二、溶液的酸碱性与pH
(1)溶液pH的定义:H+的物质的量浓度的负对数。表达式为pH=
。
﹣lgc(H+)
(2)溶液的酸碱性与pH的关系(25℃)
pH越小,溶液的酸性越强,碱性越弱,pH的适用范围是0~14。
①pH<7,c(H+)>10-7,溶液呈
。
②pH=7,c(H+)=10-7,溶液呈
。
③pH>7,c(H+)<10-7,溶液呈
。
酸性
碱性
中性
pH=7的溶液一定是中性溶液吗?
不一定。只有在25℃左右时,pH=7的溶液才是中性溶液。
溶液pH的测定方法
1.酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
2.pH试纸法
(1)种类:广泛pH试纸的范围为
(最常用)或0~10,用广泛pH试纸测定溶液的pH都为
;精密pH试纸的pH范围较窄,可以判别0.2或0.3的pH差值。
1~14
整数
(2)使用方法:使用时把一小片试纸放在
或点滴板上,用洁净干燥的玻璃棒直接蘸取少量待测液点在干燥的pH试纸上,半分钟内,与
对照可确定溶液的pH。
表面皿
标准比色卡
pH计又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
3.pH计法
三、酸碱中和滴定
酸碱滴定的定义和原理
(1)定义
依据中和反应,用
来测定
实验方法叫酸碱中和滴定。
(2)原理
酸碱中和反应的实质可用离子方程式
来表示,在中和反应中,H+、OH-之间的物质的量关系是
,若用参加反应的c(H+)、c(OH-)来表示,其关系式为
。即:
已知浓度的酸(或碱)
未知浓度的碱(或酸)
H++OH-=H2O
酸碱中和滴定的仪器和操作
、
、锥形瓶、
铁架台、
、烧杯、白纸,有时还需要
。
酸式滴定管
碱式滴定管
滴定管夹
移液管
(1)仪器
滴定管的“0”刻度在最上面,越往下数值越大,因为下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。滴定管读数时要精确到0.01mL。注意量筒与滴定管的区别。
(2)指示剂的选择
①原则:中和反应恰好完全反应的时刻叫滴定终点。终点时,指示剂的
。变色范围越窄越好,对溶液的酸碱性变化较灵敏。通常选用
,而不选用颜色变化不灵敏的
。
②中和滴定中,酸碱指示剂用量及颜色变化
黄色→橙色
红色→无色
红色→黄色
黄色→橙色
无色→粉红色
无色→粉红色
2~3滴
当指示剂恰好变色并在半分钟内不恢复原色,即认为达到滴定终点
颜色变化明显
酚酞或甲基橙
石蕊
(3)中和滴定的实验操作
调节活塞或玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于
以下。
查
洗
装
调
放
使用滴定管前,首先要检查是否
。
滴定管加入酸、碱反应液之前,先用蒸馏水洗涤干净,然后分别用
润洗2~3遍。
分别将酸、碱反应液加入酸式、碱式滴定管中,使液面位于“0”刻度以上
处。
从碱式滴定管中放出一定量的NaOH溶液于锥形瓶中,并滴2~3滴指示剂(甲基橙或酚酞)。
漏水
待装溶液
2~3
mL
“0”刻度或“0”刻度
滴定管
①滴定前的准备工作
锥形瓶
滴入2~3滴指示剂
洗
装
滴
用蒸馏水洗涤锥形瓶,切记不能用待测液润洗。
装入一定量的待测液
摇动锥形瓶
旋转酸式
滴定管活塞或挤压碱式滴定管玻璃珠
摇动锥形瓶
锥形瓶内
溶液颜色
变化
②滴定
实验测定酸碱滴定曲线
7
恰好完全反应
酸碱中和滴定的误差分析
偏
高
偏
高
偏
低
偏
低
不影响
不影响
偏
高
偏
高
偏
低
偏
低
偏
高
偏
高
偏
低
偏
低
偏
高
偏
高
偏
低
偏
低
偏
高
偏
高
第三章
水溶液中的离子反应与平衡
第二节
水的电离和溶液的pH
一、水的电离
可知:纯水大部分以
的形式存在,但其中也存在着
极少量的
。电离方程式可简写为:
。
H2O
H3O+和OH-
水的离子积常数
Kw叫做水的离子积常数,简称水的离子积。Kw可由实验测得,也可通过理论计算求得。
(1)表达式
(2)影响因素
25℃时,
。不仅适用于纯水(或其他中性溶液),也适用于稀的
溶液。
电解质
水的离子积Kw只受
的影响,温度升高,K
。(水的电离是吸热过程。)
温度
增大
外界条件的改变对水的电离平衡的影响
增大
增大
右移
增大
不变
减小
右移
增大
不变
增大
右移
减小
不变
减小
右移
增大
不变
增大
左移
减小
不变
减小
左移
增大
①不同的溶液中,c(H+)与c(OH-)不一定相等,但由水电离产生的c(H+)与c(OH-)一定相等,判断溶液中水的电离程度时,酸溶液看c(OH-),碱溶液看c(H+)。
②25
℃,任何稀的电解质水溶液中c(H+)·c(OH-)=KW这一关系不变,当改变其他条件使c(H+)增大时,c(OH-)必然降低,反之亦然。
特别提醒
二、溶液的酸碱性与pH
(1)溶液pH的定义:H+的物质的量浓度的负对数。表达式为pH=
。
﹣lgc(H+)
(2)溶液的酸碱性与pH的关系(25℃)
pH越小,溶液的酸性越强,碱性越弱,pH的适用范围是0~14。
①pH<7,c(H+)>10-7,溶液呈
。
②pH=7,c(H+)=10-7,溶液呈
。
③pH>7,c(H+)<10-7,溶液呈
。
酸性
碱性
中性
pH=7的溶液一定是中性溶液吗?
不一定。只有在25℃左右时,pH=7的溶液才是中性溶液。
溶液pH的测定方法
1.酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
2.pH试纸法
(1)种类:广泛pH试纸的范围为
(最常用)或0~10,用广泛pH试纸测定溶液的pH都为
;精密pH试纸的pH范围较窄,可以判别0.2或0.3的pH差值。
1~14
整数
(2)使用方法:使用时把一小片试纸放在
或点滴板上,用洁净干燥的玻璃棒直接蘸取少量待测液点在干燥的pH试纸上,半分钟内,与
对照可确定溶液的pH。
表面皿
标准比色卡
pH计又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
3.pH计法
三、酸碱中和滴定
酸碱滴定的定义和原理
(1)定义
依据中和反应,用
来测定
实验方法叫酸碱中和滴定。
(2)原理
酸碱中和反应的实质可用离子方程式
来表示,在中和反应中,H+、OH-之间的物质的量关系是
,若用参加反应的c(H+)、c(OH-)来表示,其关系式为
。即:
已知浓度的酸(或碱)
未知浓度的碱(或酸)
H++OH-=H2O
酸碱中和滴定的仪器和操作
、
、锥形瓶、
铁架台、
、烧杯、白纸,有时还需要
。
酸式滴定管
碱式滴定管
滴定管夹
移液管
(1)仪器
滴定管的“0”刻度在最上面,越往下数值越大,因为下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。滴定管读数时要精确到0.01mL。注意量筒与滴定管的区别。
(2)指示剂的选择
①原则:中和反应恰好完全反应的时刻叫滴定终点。终点时,指示剂的
。变色范围越窄越好,对溶液的酸碱性变化较灵敏。通常选用
,而不选用颜色变化不灵敏的
。
②中和滴定中,酸碱指示剂用量及颜色变化
黄色→橙色
红色→无色
红色→黄色
黄色→橙色
无色→粉红色
无色→粉红色
2~3滴
当指示剂恰好变色并在半分钟内不恢复原色,即认为达到滴定终点
颜色变化明显
酚酞或甲基橙
石蕊
(3)中和滴定的实验操作
调节活塞或玻璃球,使滴定管尖嘴部分充满反应液,并使液面处于
以下。
查
洗
装
调
放
使用滴定管前,首先要检查是否
。
滴定管加入酸、碱反应液之前,先用蒸馏水洗涤干净,然后分别用
润洗2~3遍。
分别将酸、碱反应液加入酸式、碱式滴定管中,使液面位于“0”刻度以上
处。
从碱式滴定管中放出一定量的NaOH溶液于锥形瓶中,并滴2~3滴指示剂(甲基橙或酚酞)。
漏水
待装溶液
2~3
mL
“0”刻度或“0”刻度
滴定管
①滴定前的准备工作
锥形瓶
滴入2~3滴指示剂
洗
装
滴
用蒸馏水洗涤锥形瓶,切记不能用待测液润洗。
装入一定量的待测液
摇动锥形瓶
旋转酸式
滴定管活塞或挤压碱式滴定管玻璃珠
摇动锥形瓶
锥形瓶内
溶液颜色
变化
②滴定
实验测定酸碱滴定曲线
7
恰好完全反应
酸碱中和滴定的误差分析
偏
高
偏
高
偏
低
偏
低
不影响
不影响
偏
高
偏
高
偏
低
偏
低
偏
高
偏
高
偏
低
偏
低
偏
高
偏
高
偏
低
偏
低
偏
高
偏
高
