人教版高中化学必修一2.1.2分散系及其分类 课件(30张ppt)
文档属性
| 名称 | 人教版高中化学必修一2.1.2分散系及其分类 课件(30张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-06 15:17:15 | ||
图片预览









文档简介
(共30张PPT)
【课前思考题】 1、将少量CuSO4·5H2O溶于水得到的体系是纯净物还是混合物?溶质是什么?溶剂是什么? 2、将泥沙溶于水得到的体系是纯净物还是混合物呢?将它们静置一段时间后,会出现什么现象?又与硫酸铜溶液有什么区别呢? 3、我们日常生活中所见的烟、雾、云属于纯净物吗?如果不是,是什么物质分散到什么物质里呢? 总结:有什么共同特点呢?
§2.1.2分散系及其分类
一、分散系的概念:
1、分散系:
2、分散质:
3、分散剂:
被分散的物质。
起容纳分散质作用的物质。
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
【随堂练习题】
请说出下列哪些物质是分散质,哪些是分散剂。
eg.1、灰尘分散在空气中
(灰尘是分散质,空气是分散剂)
eg.2、把食盐溶解在水中
(食盐是分散质,水是分散剂)
eg.3、把AgBr很细小的晶体颗粒均匀的分散在无色玻璃镜片中,制成变色镜
(AgCl是分散质,玻璃就是分散剂)
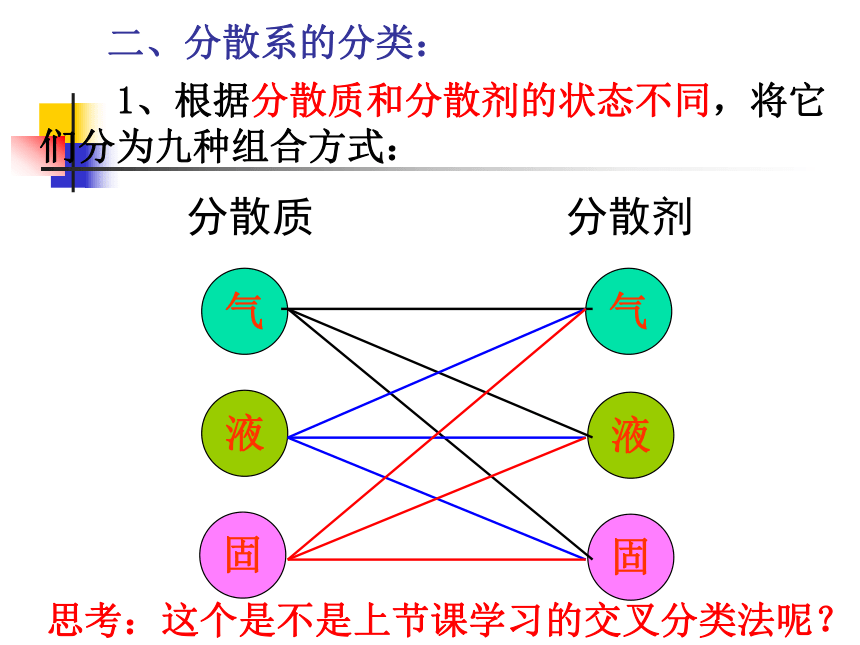
二、分散系的分类:
1、根据分散质和分散剂的状态不同,将它们分为九种组合方式:
分散质
分散剂
气
液
固
气
液
固
思考:这个是不是上节课学习的交叉分类法呢?
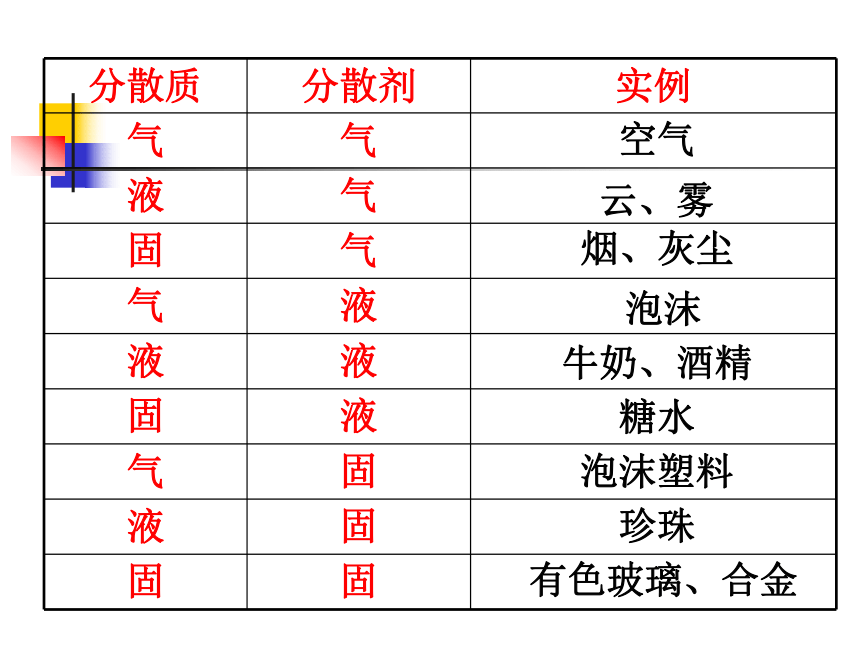
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟、灰尘
牛奶、酒精
泡沫
有色玻璃、合金
珍珠
泡沫塑料
糖水
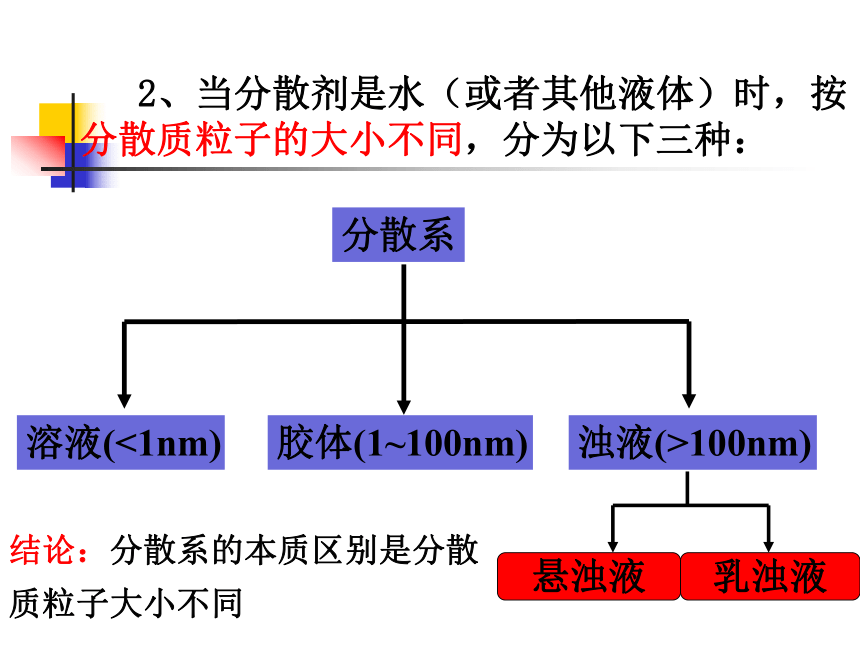
2、当分散剂是水(或者其他液体)时,按分散质粒子的大小不同,分为以下三种:
分散系
溶液(<1nm)
浊液(>100nm)
胶体(1~100nm)
悬浊液
乳浊液
结论:分散系的本质区别是分散质粒子大小不同
其中胶体按分散剂来分可分为:
气溶胶、液溶胶、固溶胶
气 溶 胶
晨雾
烟
白云
固 溶 胶
烟水晶
有色玻璃
牛奶
豆浆
果冻
液溶胶
三、Fe(OH)3胶体的制备
1、实验步骤:
在烧杯中加25ml蒸馏水加热至沸,向沸水中滴加5-6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
(胶体)
2、实验方程式:
FeCl3+3H2O Fe(OH)3+3HCl
△
3、实验现象:
制得的Fe(OH)3胶体呈红褐色
注意事项
1)制备Fe(OH)3胶体用的是沸水,不是氢氧化钠溶液,得到的是Fe(OH)3胶体,不是沉淀。
2)FeCl3要饱和但不能浑浊,太稀效果不好
3)加热过程中不能用玻璃棒搅拌,也不可加热时间过长,以免产生沉淀
提问:我们如何对溶液、胶体和浊液进行区别呢?
分散系 溶液 胶体 浊液
外观
实例
分散质粒子直径
分散质粒子组成
能否透过
滤纸
能否透过半透膜
稳定性
均一、透明
均一、透明
不均一、不透明
泥水、油水
CuSO4溶液
淀粉溶液
<1nm
1~100nm
>100nm
离子、分子
多分子集合体或有机高分子
巨大数目分子集合体
能
能
否
能
否
否
稳定
介稳定
不稳定
四、胶体的性质:
当一束可见光通过胶体时,可以看到一条光亮的“通路”,这条光亮的“通路”是由于胶体粒子对光线的散射(光波偏离原来的方向而分散传播)形成的,叫丁达尔现象。
1、丁达尔现象:
结论:
胶体能发生丁达尔效应,而溶液不能,丁达尔效应是区别溶液与胶体常用的物理方法。
光束照射时的现象
原因分析
Fe(OH)3
胶体
CuSO4溶液
形成一条光亮的通路
无光现象产生
胶体的直径在
1-100nm之间,
能使光波发生散射
溶液中粒子的直径小于1nm,散射极其微弱
树林中的丁达尔现象
电影院中的丁达尔现象
练习:
1. 根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A.溶液 B.悬浊液
C.乳浊液 D.胶体
2.下列物质能发生丁达尔效应的是 ( )
A.蔗糖水 B.豆浆
C.碘酒 D.碘化银胶体
3. 溶液、胶体和浊液这三种分散系的根本区别是 ( )
A.是否为大量分子或离子的集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
2、布朗运动:
四、胶体的性质:
悬浮在水中的花粉小颗粒作不停地,无秩序地运动,这种现象叫做布朗运动.
胶体粒子在分散系中做布朗运动,由于胶体粒子不停地、无序地运动,使它们不容易碰撞在一起,从而聚集成质量较大的颗粒而沉降下来。
注意:布朗运动不是胶粒专属性质,溶液中的离子、分子等也有此现象。
想一想
1、Fe(OH)3胶体中,分散质是_____,作____(定向或不规则)运动。
2.NaCl溶液中,Na+和Cl―作____运动。通直流电后作___ 运动,Na+向___极移动,Cl―向___极移动。
许多聚集的Fe(OH)3分子
无规则
无规则
定向运动
阴
阳
若给Fe(OH)3胶体通直流电,
胶体粒子的运动会怎样呢?
四、胶体的性质:
3、胶粒所带电荷:
(1)原因:胶体粒子带有电荷,这是因为胶体粒子具有很大的比表面积,能够吸附阴离子或阳离子造成的。
*胶粒电性
胶粒带正电荷;金属氧化物、金属氢氧化物的胶粒吸附阳离子如: Fe(OH)3胶体 Al(OH)3胶体
胶粒带负电荷:非金属氧化物、金属硫化物的胶粒吸附阴离子如:硅酸胶体 土壤胶体
强调:胶体本身不带电
胶粒不带电荷:如淀粉、蛋白质等高分子物质
2.分散剂为气体的胶体叫气溶胶,如云、雾、烟尘等,气溶胶中的胶体粒子也是可以带电荷的。现代工厂里静电除尘原理,就与气溶胶的某种性质有关:在烟道两侧设置高压直流电极,细小的烟尘颗粒在高压电厂作用下,向某极移动并与极板接触后下落,可以达到除尘的效果。该操作中,运用的胶体性质是( )
A.丁达尔效应 B.布朗运动 C.电泳 D.介稳性
C
[思考题]
胶体与溶液和浊液比,稳定性如何?请你推测其稳定性与上述哪些性质有关?
答:一般情况,胶体比浊液稳定,没有溶液稳定。胶体微粒作布朗运动是胶体稳定的原因之一,但是是次要原因。而胶粒带同种电荷,相互间产生排斥作用,不易结合成更大的沉淀微粒,这是胶体稳定的主要因素。
五、胶体性质的应用:
1、胶体的聚沉:
用一定的方法使胶体粒子聚集长大,形成了颗粒较大的沉淀从分散剂里析出,这个过程叫做聚沉。
思考:如何破坏胶体的稳定状态?
(提示:从胶体介稳定的原因方面考虑)
胶体聚沉的条件
原理:要使胶体凝聚成沉淀,就要减少或消除胶体微粒表面吸附的电荷,使之减弱或失去电性排斥力作用;使胶粒在运动中碰撞机率变大,结合成更大的颗粒。
胶体聚沉条件
加热
加电解质溶液
加带相反电荷
胶粒的胶体
搅拌
五、胶体性质的应用:
2、胶体的净化——渗析:
泥沙
淀粉胶体
氯化钠溶液
过滤
泥沙
滤液
(淀粉胶体、
氯化钠溶液)
渗析
半透膜
胶体
(淀粉胶体)
溶液
(氯化钠)溶液
半透膜
水
①日常生活:制豆腐原理(胶体的聚沉)和豆浆牛奶、粥、明矾净水,都跟胶体有关。
②农业生产:土壤的保肥作用。土壤里许多物质如粘土、腐殖质等常以胶体形式存在。
③医疗卫生:血液透析,血清纸上电泳,利用电泳分离各种氨基酸和蛋白质。 FeCl3溶液用于伤口止血。
④自然地理:江河入海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉。
⑤工业生产:制有色玻璃(固溶胶),冶金工业利用电泳原理选矿,原油脱水等。
【课前思考题】 1、将少量CuSO4·5H2O溶于水得到的体系是纯净物还是混合物?溶质是什么?溶剂是什么? 2、将泥沙溶于水得到的体系是纯净物还是混合物呢?将它们静置一段时间后,会出现什么现象?又与硫酸铜溶液有什么区别呢? 3、我们日常生活中所见的烟、雾、云属于纯净物吗?如果不是,是什么物质分散到什么物质里呢? 总结:有什么共同特点呢?
§2.1.2分散系及其分类
一、分散系的概念:
1、分散系:
2、分散质:
3、分散剂:
被分散的物质。
起容纳分散质作用的物质。
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
【随堂练习题】
请说出下列哪些物质是分散质,哪些是分散剂。
eg.1、灰尘分散在空气中
(灰尘是分散质,空气是分散剂)
eg.2、把食盐溶解在水中
(食盐是分散质,水是分散剂)
eg.3、把AgBr很细小的晶体颗粒均匀的分散在无色玻璃镜片中,制成变色镜
(AgCl是分散质,玻璃就是分散剂)
二、分散系的分类:
1、根据分散质和分散剂的状态不同,将它们分为九种组合方式:
分散质
分散剂
气
液
固
气
液
固
思考:这个是不是上节课学习的交叉分类法呢?
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟、灰尘
牛奶、酒精
泡沫
有色玻璃、合金
珍珠
泡沫塑料
糖水
2、当分散剂是水(或者其他液体)时,按分散质粒子的大小不同,分为以下三种:
分散系
溶液(<1nm)
浊液(>100nm)
胶体(1~100nm)
悬浊液
乳浊液
结论:分散系的本质区别是分散质粒子大小不同
其中胶体按分散剂来分可分为:
气溶胶、液溶胶、固溶胶
气 溶 胶
晨雾
烟
白云
固 溶 胶
烟水晶
有色玻璃
牛奶
豆浆
果冻
液溶胶
三、Fe(OH)3胶体的制备
1、实验步骤:
在烧杯中加25ml蒸馏水加热至沸,向沸水中滴加5-6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
(胶体)
2、实验方程式:
FeCl3+3H2O Fe(OH)3+3HCl
△
3、实验现象:
制得的Fe(OH)3胶体呈红褐色
注意事项
1)制备Fe(OH)3胶体用的是沸水,不是氢氧化钠溶液,得到的是Fe(OH)3胶体,不是沉淀。
2)FeCl3要饱和但不能浑浊,太稀效果不好
3)加热过程中不能用玻璃棒搅拌,也不可加热时间过长,以免产生沉淀
提问:我们如何对溶液、胶体和浊液进行区别呢?
分散系 溶液 胶体 浊液
外观
实例
分散质粒子直径
分散质粒子组成
能否透过
滤纸
能否透过半透膜
稳定性
均一、透明
均一、透明
不均一、不透明
泥水、油水
CuSO4溶液
淀粉溶液
<1nm
1~100nm
>100nm
离子、分子
多分子集合体或有机高分子
巨大数目分子集合体
能
能
否
能
否
否
稳定
介稳定
不稳定
四、胶体的性质:
当一束可见光通过胶体时,可以看到一条光亮的“通路”,这条光亮的“通路”是由于胶体粒子对光线的散射(光波偏离原来的方向而分散传播)形成的,叫丁达尔现象。
1、丁达尔现象:
结论:
胶体能发生丁达尔效应,而溶液不能,丁达尔效应是区别溶液与胶体常用的物理方法。
光束照射时的现象
原因分析
Fe(OH)3
胶体
CuSO4溶液
形成一条光亮的通路
无光现象产生
胶体的直径在
1-100nm之间,
能使光波发生散射
溶液中粒子的直径小于1nm,散射极其微弱
树林中的丁达尔现象
电影院中的丁达尔现象
练习:
1. 根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A.溶液 B.悬浊液
C.乳浊液 D.胶体
2.下列物质能发生丁达尔效应的是 ( )
A.蔗糖水 B.豆浆
C.碘酒 D.碘化银胶体
3. 溶液、胶体和浊液这三种分散系的根本区别是 ( )
A.是否为大量分子或离子的集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
2、布朗运动:
四、胶体的性质:
悬浮在水中的花粉小颗粒作不停地,无秩序地运动,这种现象叫做布朗运动.
胶体粒子在分散系中做布朗运动,由于胶体粒子不停地、无序地运动,使它们不容易碰撞在一起,从而聚集成质量较大的颗粒而沉降下来。
注意:布朗运动不是胶粒专属性质,溶液中的离子、分子等也有此现象。
想一想
1、Fe(OH)3胶体中,分散质是_____,作____(定向或不规则)运动。
2.NaCl溶液中,Na+和Cl―作____运动。通直流电后作___ 运动,Na+向___极移动,Cl―向___极移动。
许多聚集的Fe(OH)3分子
无规则
无规则
定向运动
阴
阳
若给Fe(OH)3胶体通直流电,
胶体粒子的运动会怎样呢?
四、胶体的性质:
3、胶粒所带电荷:
(1)原因:胶体粒子带有电荷,这是因为胶体粒子具有很大的比表面积,能够吸附阴离子或阳离子造成的。
*胶粒电性
胶粒带正电荷;金属氧化物、金属氢氧化物的胶粒吸附阳离子如: Fe(OH)3胶体 Al(OH)3胶体
胶粒带负电荷:非金属氧化物、金属硫化物的胶粒吸附阴离子如:硅酸胶体 土壤胶体
强调:胶体本身不带电
胶粒不带电荷:如淀粉、蛋白质等高分子物质
2.分散剂为气体的胶体叫气溶胶,如云、雾、烟尘等,气溶胶中的胶体粒子也是可以带电荷的。现代工厂里静电除尘原理,就与气溶胶的某种性质有关:在烟道两侧设置高压直流电极,细小的烟尘颗粒在高压电厂作用下,向某极移动并与极板接触后下落,可以达到除尘的效果。该操作中,运用的胶体性质是( )
A.丁达尔效应 B.布朗运动 C.电泳 D.介稳性
C
[思考题]
胶体与溶液和浊液比,稳定性如何?请你推测其稳定性与上述哪些性质有关?
答:一般情况,胶体比浊液稳定,没有溶液稳定。胶体微粒作布朗运动是胶体稳定的原因之一,但是是次要原因。而胶粒带同种电荷,相互间产生排斥作用,不易结合成更大的沉淀微粒,这是胶体稳定的主要因素。
五、胶体性质的应用:
1、胶体的聚沉:
用一定的方法使胶体粒子聚集长大,形成了颗粒较大的沉淀从分散剂里析出,这个过程叫做聚沉。
思考:如何破坏胶体的稳定状态?
(提示:从胶体介稳定的原因方面考虑)
胶体聚沉的条件
原理:要使胶体凝聚成沉淀,就要减少或消除胶体微粒表面吸附的电荷,使之减弱或失去电性排斥力作用;使胶粒在运动中碰撞机率变大,结合成更大的颗粒。
胶体聚沉条件
加热
加电解质溶液
加带相反电荷
胶粒的胶体
搅拌
五、胶体性质的应用:
2、胶体的净化——渗析:
泥沙
淀粉胶体
氯化钠溶液
过滤
泥沙
滤液
(淀粉胶体、
氯化钠溶液)
渗析
半透膜
胶体
(淀粉胶体)
溶液
(氯化钠)溶液
半透膜
水
①日常生活:制豆腐原理(胶体的聚沉)和豆浆牛奶、粥、明矾净水,都跟胶体有关。
②农业生产:土壤的保肥作用。土壤里许多物质如粘土、腐殖质等常以胶体形式存在。
③医疗卫生:血液透析,血清纸上电泳,利用电泳分离各种氨基酸和蛋白质。 FeCl3溶液用于伤口止血。
④自然地理:江河入海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉。
⑤工业生产:制有色玻璃(固溶胶),冶金工业利用电泳原理选矿,原油脱水等。
