2021年科学 中考二轮专题复习:化学基础 (中等难度)(含答案)
文档属性
| 名称 | 2021年科学 中考二轮专题复习:化学基础 (中等难度)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 201.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-06-08 15:44:50 | ||
图片预览



文档简介
中考二轮专题复习:化学基础 (中等难度)
一、单选题(共20题;共40分)
1.如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则在下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
A.?①单质、⑤化合物?????B.?②碱、⑤氧化物?????C.?④碱、⑤含氧化合物?????D.?④含氧化合物、③氧化物
2.下列关于二甲醚(C2H6O)的说法错误的是(??? )
A.?由碳、氢、氧三种元素组成????????????????????????????????B.?相对分子质量为46
C.?一个二甲醚分子中含有9个原子???????????????????????????D.?碳、氢、氧三种元素的质量比为2:6:1
3.实验室制取氧气的主要步骤有①装药品;②检查气密性;③固定装置;④加热;⑤收集气体.其正确的操作顺序是(?? )
A.?①②③④⑤???????????????????????B.?③①②⑤④???????????????????????C.?②①③④⑤???????????????????????D.?①③②④⑤
4.蜡烛、红磷、铁丝、木炭在氧气中燃烧的共同点是(?? )
A.?都能生成固体?????????????????B.?都是化合反应?????????????????C.?都有火焰出现?????????????????D.?都会放热、发光
5.地球大气的演化经历了原始大气、次生大气和现代大气三个阶段,次生大气中部分成分的微观示意图如下:一定条件下,3.4g甲物质和4.8g氧气恰好完全反应,生成5.4g乙物质和另一种物质X,下列判断不正确的是(??? )
A.?参与反应的甲和氧气的分子数之比为4∶3
B.?该反应的基本类型是置换反应
C.?甲物质与Mg3N2中相同元素的化合价相同
D.?该反应化学方程式中物质X与O2的化学计量数之比为3∶2
6.下列对某一主题知识归纳,正确的一组是(?? )
A.?生活常识:硬水与软水﹣﹣观察颜色区别;除铁锈﹣﹣用砂纸打磨
B.?物质鉴别:盐酸与硫酸﹣﹣锌粒;氯化钾与碳酸钙﹣﹣加水溶解
C.?安全常识:长时间堆放的柴草﹣﹣要不时翻动;进入陌生溶洞前﹣﹣先做灯火实验
D.?“一定”与“不一定”:有单质和化合物生成的反应一定是置换反应;浓溶液一定是饱和溶液、稀溶液一定是不饱和溶液
7.在温度和体积相同的条件下,密闭容器中含有的气体分子数目越多压强就越大.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是(??? )
A.?两种气体的压强相等???????????????????????????????????????????B.?O2比O3的质量小
C.?两种气体的分子数目相等????????????????????????????????????D.?两种气体的氧原子数目相等
8.如图是元素X 的原子结构示意图,下列说法正确的是( ??)
A.?该原子的核内电子数为16???????????????????????????????????B.?该原子最外电子层达到了稳定结构
C.?X 属于非金属元素???????????????????????????????????????????????D.?X 与Na 生成化合物NaX
9.推理是科学学习的一种重要方法,下列一些推理结论中,正确的是( ???)
选项
事实
结论
A
稀有气体由原子直接构成
由原子直接构成的就是稀有气体
B
单质是由同种元素组成的纯净物
由同种元素组成的纯净物就是单质
C
置换反应中一定有单质生成
有单质生成的反应一定是置换反应
D
使无色酚酞试液变红色的溶液是碱性溶液
碱一定能使无色酚酞试液变红色
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
10.下图是某化学反应的微观示意图。下列说法中错误的是( ???)
A.?甲是最简单的有机物???????????????????????????????????????????B.?反应前后原子种类没有发生改变
C.?反应生成的丙和丁的分子个数比为1:2??????????????D.?一个甲分子是由两个氧分子和一个碳原子构成
11.稀土元素铕(Eu)是激光及原子能应用的重要材料。已知氯化铕的化学式为EuCl3 , 则氧化铕的化学式为(? )
A.?EuO??????????????????????????????????B.?Eu2O3??????????????????????????????????C.?Eu3O2??????????????????????????????????D.?EuO3
12.同学们正在参加适应性考试,让我们来做个深呼吸,缓和一下紧张的考试气氛。你呼出的气体中体积含量最高的是(??? ) ?
A.?氮气????????????????????????????????B.?氧气????????????????????????????????C.?二氧化碳????????????????????????????????D.?稀有气体
13.碘元素对人体有着至关重要的作用,如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.下列相关说法正确的是(?? )
碘盐
配料:氯化钠、碘酸钾(KIO3)
含碘量:(20~30)mg/kg
保质期:18个月
食用方法:勿长时间炖炒
贮藏指南:避光、避热、密封防潮
A.?“食用碘盐”属于纯净物
B.?碘酸钾(KIO3)中钾元素、碘元素、氧元素的质量比是39:127:48
C.?碘酸钾(KIO3)中碘元素的质量分数是21.4%
D.?多吃“加碘食盐”可以预防骨质疏松
14.?下列操作或现象与分子特性对应关系不正确的是( )
选项
操作或现象
分子特性
A
气体可压缩储存于钢瓶中
分子间有间隙
B
物体的热胀冷缩
分子的大小是可以变化的
C
湿衣服晾干
分子是运动的
D
1滴水中大约有1.67×1021个水分子
分子很小
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
15.2019年3月10日,长征三号乙运载火箭在西昌卫星发射中心成功将”中星6C”卫星送入预定轨道,这种无污染的火箭采用液氢和液氧作为推进剂。其中液氧属于(????? )
A.?? 单质?????????????????????????????????B.?氧化物?????????????????????????????????C.?化合物?????????????????????????????????D.?混合物
16.模型可以帮助人们认识一些不能直接观察到的事物。如图是某化学反应的过程示意图。分析该图,下列判断正确的是( ???)
A.?该反应没有单质生成???????????????????????????????????????????B.?该反应是分解反应
C.?反应前后元素化合价没有发生变化??????????????????????D.?该化学反应为2H2O2=H2O+O2
17.下列反应既是化合反应又是氧化反应的是(?? )
A.?磷在氧气中燃烧??????????????????????????????????????????????????B.?高锰酸钾受热得到氧气
C.?蜡烛在氧气中燃烧??????????????????????????????????????????????D.?过氧化氢与二氧化锰混合制得氧气
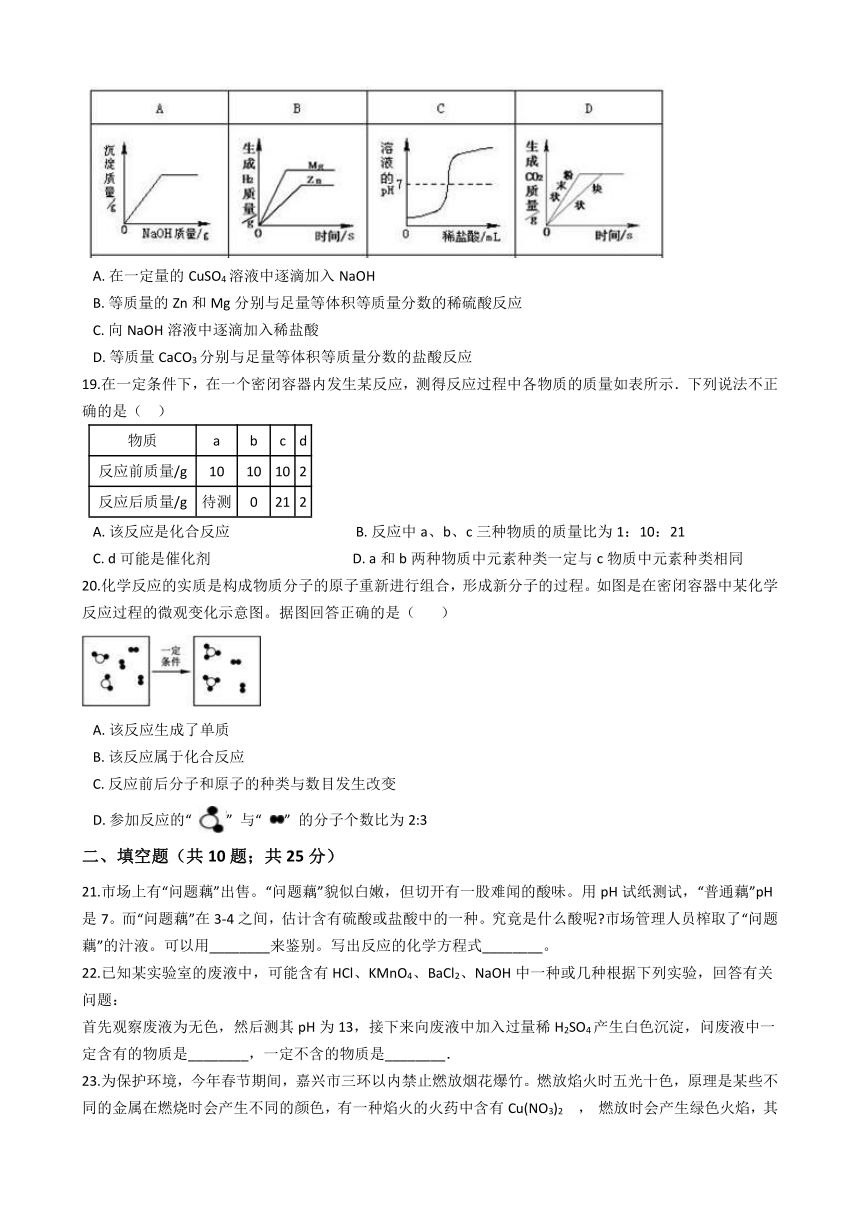
18.下列图像不能正确反映其对应操作的是( ??)
A.?在一定量的CuSO4溶液中逐滴加入NaOH
B.?等质量的Zn和Mg分别与足量等体积等质量分数的稀硫酸反应
C.?向NaOH溶液中逐滴加入稀盐酸
D.?等质量CaCO3分别与足量等体积等质量分数的盐酸反应
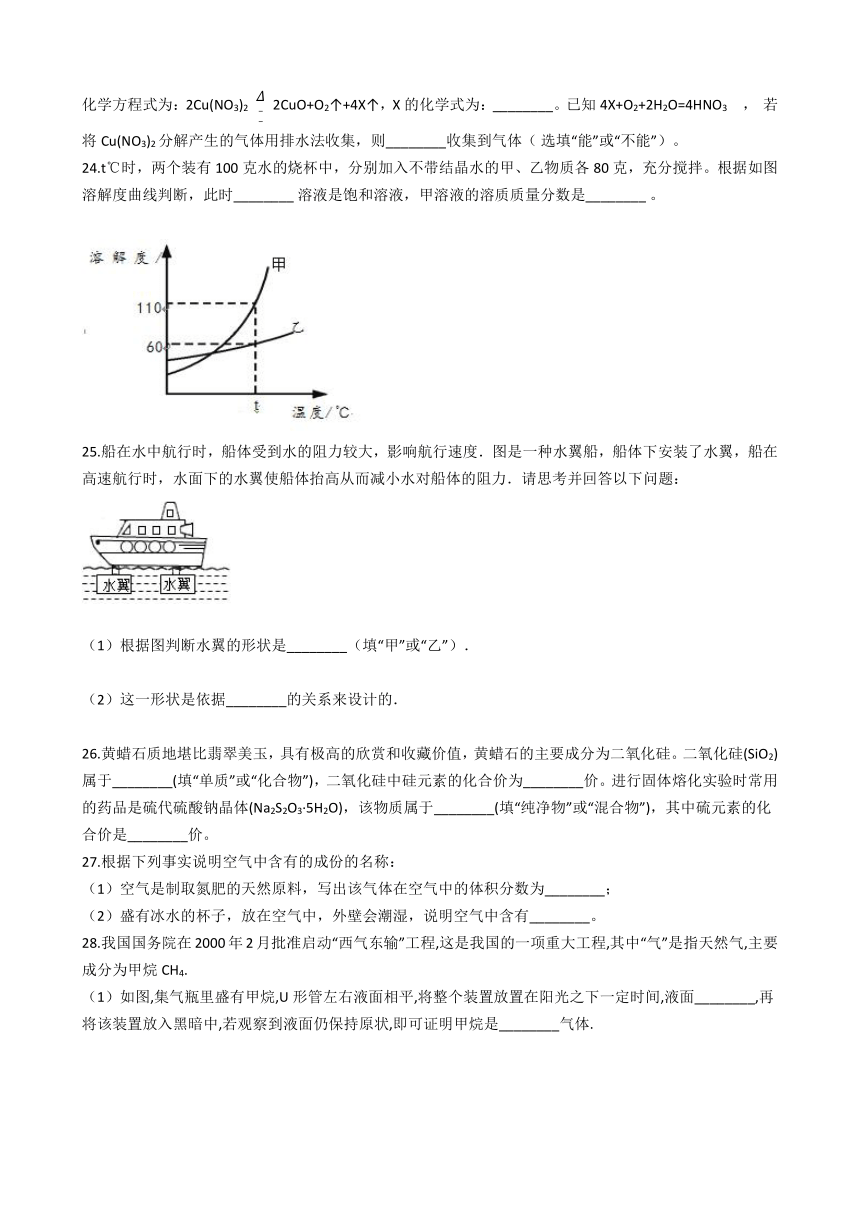
19.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示.下列说法不正确的是(?? )
物质
a
b
c
d
反应前质量/g
10
10
10
2
反应后质量/g
待测
0
21
2
A.?该反应是化合反应????????????????????????????????????B.?反应中a、b、c三种物质的质量比为1:10:21
C.?d可能是催化剂?????????????????????????????????????????D.?a和b两种物质中元素种类一定与c物质中元素种类相同
20.化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密闭容器中某化学反应过程的微观变化示意图。据图回答正确的是(????? )
A.?该反应生成了单质
B.?该反应属于化合反应
C.?反应前后分子和原子的种类与数目发生改变
D.?参加反应的“ ” 与“ ” 的分子个数比为2:3
二、填空题(共10题;共25分)
21.市场上有“问题藕”出售。“问题藕”貌似白嫩,但切开有一股难闻的酸味。用pH试纸测试,“普通藕”pH是7。而“问题藕”在3-4之间,估计含有硫酸或盐酸中的一种。究竟是什么酸呢?市场管理人员榨取了“问题藕”的汁液。可以用________来鉴别。写出反应的化学方程式________。
22.已知某实验室的废液中,可能含有HCl、KMnO4、BaCl2、NaOH中一种或几种根据下列实验,回答有关问题:
首先观察废液为无色,然后测其pH为13,接下来向废液中加入过量稀H2SO4产生白色沉淀,问废液中一定含有的物质是________,一定不含的物质是________.
23.为保护环境,今年春节期间,嘉兴市三环以内禁止燃放烟花爆竹。燃放焰火时五光十色,原理是某些不同的金属在燃烧时会产生不同的颜色,有一种焰火的火药中含有Cu(NO3)2 , 燃放时会产生绿色火焰,其化学方程式为:2Cu(NO3)2 Δ__ 2CuO+O2↑+4X↑,X的化学式为:________。已知4X+O2+2H2O=4HNO3 , 若将Cu(NO3)2分解产生的气体用排水法收集,则________收集到气体(?选填“能”或“不能”)。
24.t℃时,两个装有100克水的烧杯中,分别加入不带结晶水的甲、乙物质各80克,充分搅拌。根据如图溶解度曲线判断,此时________?溶液是饱和溶液,甲溶液的溶质质量分数是________?。
?
25.船在水中航行时,船体受到水的阻力较大,影响航行速度.图是一种水翼船,船体下安装了水翼,船在高速航行时,水面下的水翼使船体抬高从而减小水对船体的阻力.请思考并回答以下问题:
(1)根据图判断水翼的形状是________(填“甲”或“乙”).
(2)这一形状是依据________的关系来设计的.
26.黄蜡石质地堪比翡翠美玉,具有极高的欣赏和收藏价值,黄蜡石的主要成分为二氧化硅。二氧化硅(SiO2)属于________(填“单质”或“化合物”),二氧化硅中硅元素的化合价为________价。进行固体熔化实验时常用的药品是硫代硫酸钠晶体(Na2S2O3·5H2O),该物质属于________(填“纯净物”或“混合物”),其中硫元素的化合价是________价。
27.根据下列事实说明空气中含有的成份的名称:
(1)空气是制取氮肥的天然原料,写出该气体在空气中的体积分数为________;
(2)盛有冰水的杯子,放在空气中,外壁会潮湿,说明空气中含有________。
28.我国国务院在2000年2月批准启动“西气东输”工程,这是我国的一项重大工程,其中“气”是指天然气,主要成分为甲烷CH4.
(1)如图,集气瓶里盛有甲烷,U形管左右液面相平,将整个装置放置在阳光之下一定时间,液面________,再将该装置放入黑暗中,若观察到液面仍保持原状,即可证明甲烷是________气体.
(2)天然气管道在第一次输送到用户家里时必须先在管道内充满氮气,这样做的原因是________.
29.小金在研究硫酸的性质时,做了以下实验:
(1)小金用玻璃棒蘸取浓硫酸和稀硫酸在白纸上写字,放置一会儿发现用浓硫酸写的字变黑,这体现了浓硫酸的________性,属于________性质(选填“物理”或“化学”)。
(2)将生锈的铁钉投入到一定量的稀疏酸中,溶液会变成黄色,请写出该反应的化学方程式:________;同时,铁钉表面产生大量的气泡,请写出相应的化学方程式:________;
30.煤是一种常用的化石燃料,家庭用煤经过了从“煤球”到“蜂窝煤”的变化,以前人们把煤粉加工成略大于乒乓球的球体,后来人们把煤粉加工成圆柱体,并在圆柱体内打上一些孔(如图).
(1)请你分析这种变化的优点是:________.
(2)煤在燃烧时会产生许多污染物,为了减少煤燃烧时对环境的污染,可设法把煤转化成清洁的燃料.将水蒸气通过炽热的煤层可制得较洁净的水煤气(主要成分是CO和H2),请你写出该反应的化学方程式:________
(3)煤气厂常在家用水煤气中特意掺入少量有难闻气味的气体,其目的是:________.
三、解答题(共5题;共28分)
31.已知硝酸铵的化学式为NH4NO3 , 试求:
(1)硝酸铵的相对分子质量________;
(2)硝酸铵中氮元素的质量分数________;
(3)硝酸铵中氮、氢、氧三种元素的质量比________;
(4)100克硝酸铵跟多少克尿素CO(NH2)2的含氮量相等?
32.“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生。(整个反应只需要第一个反应发生,就好像多米诺骨牌游戏一样)以下就是一个“化学多米诺实验”,已知H2O2在MnO2的催化作用下可分解产生O2和H2O。如图所示的A~H各装置中分别盛放的物质为:A.稀硫酸;B.锌粒;C.3%H2O2溶液;D.MnO2;E.某溶液;F.某块状固体;G.滴有紫色石蕊的蒸馏水;H.足量澄清石灰水。请回答以下问题。
(1)反应开始后,若G中出现红色,H中有白色沉淀生成,判断E、F中的物质可能分别是________。
(2)按基本反应类型写出该实验中有关反应的化学方程式:
化合反应 ________?;
热分解反应________?;
置换反应________?;
复分解反应________?。
33.实验室里有一瓶氢氧化钙粉末由于较长时间敞口放置,已部分变质为碳酸钙。某课外兴趣小组为测定该瓶粉末中碳酸钙的质量分数,进行实验操作、数据收集和计算。
(1)配制稀盐酸:配制500克7.3%的稀盐酸,需要36.5%的浓盐酸________克。
(2)抽样测定:将瓶中粉末搅拌均匀后称取20克样品放入烧杯并置于电子秤上,再加入足量稀盐酸充分反应,总质量与反应时间的关系如下表所示:
反应时间/秒
0
10
20
30
40
总质量/克
310.0
309.6
308.6
307.8
307.8
完全反应后,生成的CO2气体的质量为________克。
(3)计算出该样品中CaCO3的质量分数(要有计算过程)。
(4)经过分析讨论,同学们觉得这样测得的结果有可能偏大,原因是________(指出一点即可)。
34.某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图)。疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O==2NaAlO2+3H2↑。请回答下列有关问题:
(1)该管道疏通剂需要密封保存的原因是________。
(2)按照使用说明,该同学对“疏通剂”作了进一步研究。先向烧杯中加人206g水,再加入本品200g,当铝粉全部反应后,求:(计算结果保留1位小数)
①生成氢气的体积多少升。(ρ氢气=0.09g/L)
②反应后溶液中氢氧化钠的质量分数。
35.中和反应是放热反应吗?三位同学为探究此问题进行了下列实验:
(1)甲同学取10毫升 10%的NaOH溶液于试管中,逐滴加入10%的稀硫酸,随着硫酸的加入,烧杯中溶液温度与加入硫酸体积之间的变化关系如图甲所示。本实验选用10%的NaOH溶液而不选用NaOH固体的原因是________。
(2)乙同学按图乙装置进行实验,其中的澄清饱和石灰水的作用是________。
(3)丙同学按图丙实验,可以根据________现象也能证明中和反应是放热的。
四、实验探究题(共5题;共15分)
36.化学是一门实验科学,关注物质变化过程,探究物质变化的条件很有必要。某化学兴趣小组做了如图所示的实验。?
根据上述实验,回答下列问题:
(1)实验中,中间试管的实验目的是?????????????????? 。
(2)请总结出铁制品发生锈蚀的主要条件:????????????????? 。
37.为测定空气中氧气的含量,小华同学打算设计如图所示的实验方案:在一个隔热效果良好的容器上方安装一个可自由上下移动的活塞(活塞质量忽略不计,起始位置在5刻度处).加热容器,使容器温度达到80℃(已知白磷燃烧所需的最低温度为40℃).请回答:
(1)实验过程中,可以观察到:白磷剧烈燃烧,产生大量白烟,活塞先向________(填“上”或“下”)移动,再向________移动,最后停在刻度________处.
(2)发生反应的表达式为________.
(3)有位同学做此实验时活塞最终停在4.5处,请你分析造成这一现象的可能原因是________(答一点即可).
38.现有两组实验小组的同学参与“测定空气中氧气的体积分数”实验.
(1)甲组同学采用课本实验装置(图2),他们先用图1的组合装置在空气中点燃红磷,然后慢慢地将燃烧匙从上到下插入广口瓶中,目的使上、下层空气中的氧气都能得到充分消耗,直到橡皮塞塞紧瓶口,红磷在瓶中继续燃烧直到熄灭,等广口瓶冷却后,打开止水夹.但这样测出的氧气的体积分数明显大于 15 .请分析原因________
(2)该装置本身在设计上还存在一定的缺陷,也是造成实验误差的原因,请分析其中一种缺陷,说明这种缺陷造成误差的理由________.
(3)乙组同学先查阅资料(如下表),然后对课本上的实验装置进行了图3所示的改进,右端玻璃管上端开口(其它仪器忽略).
颜色、状态
熔点/℃
着火点/℃
密度/(g/cm3)
红磷
暗红色固体
590
240
2.34
白磷
白色或黄白色固体
44.1
40
1.82
①乙组同学红磷换成了白磷的优点是________
②大家用改进的实验装置进行实验,待玻璃管冷却、管内白色的烟幕消失时,左玻璃管内的液面上升了一段距离,此时他们应该怎样操作之后,才能读取左管液面的刻度________.
39.小林同学收集了一些微粒的资料,请你和他一起根据表格数据回答下列问题。
微粒名称
质子数
中子数
电子数
带电性
A
14
14
14
不带电
B
26
30
24
带2个单位正电荷
C
14
14
16
D
14
16
14
不带电
(1)表格中属于互为同位素的是________。
(2)根据表格信息写出微粒C的符号________。
(3)比较C与D两种微粒,其中质量较大的是________。
40.在老师的指导下,化学兴趣小组利用下列装置进行了“可燃物燃烧的条件”的探究实验。
[实验目的]探究可燃物燃烧的条件[实验步骤]
①将所需仪器按照装置图连接起来;
②打开K1和K2 , 向上拉动任意一支注射器的活塞;
③将实验所需药品加入对应的仪器中;
④将装有适量白磷的具支试管放入冷水中;
⑤打开K1 , 关闭K2 , 往装置甲中加入适量的双氧水,氧气进入具支试管中;
⑥关闭K1 , 打开K2 , 往装置乙中加入适量的盐酸,二氧化碳进入具支试管中;
⑦将装有适量白磷的具支试管放入80℃的热水中;
⑧打开K1 , 关闭K2 , 往装置甲中加入适量双氧水,氧气进入具支试管中;
⑨关闭K1 , 打开K2 , 往装置乙中加入适量的盐酸。[问题解答]
(1)实验步骤②的目的是________。
(2)在实验步骤⑥中,具支试管中氧气已经排尽的实验现象是_________。
(3)能看到白磷燃烧起来的实验步骤是________。
[实验结论]可燃物燃烧必须同时满足两个条件:可燃物与氧气接触;温度达到可燃物的着火点。
答案解析部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 C
4.【答案】 D
5.【答案】 D
6.【答案】 C
7.【答案】 D
8.【答案】 C
9.【答案】 B
10.【答案】 D
11.【答案】 B
12.【答案】 A
13.【答案】 B
14.【答案】 B
15.【答案】 A
16.【答案】 B
17.【答案】 A
18.【答案】 C
19.【答案】 B
20.【答案】 B
二、填空题
21.【答案】 氯化钡;BaCl2+H2SO4=BaSO4+2HCl
22.【答案】 BaCl2、NaOH;HCl、KMnO4
23.【答案】 NO2;不能
24.【答案】 乙;44.4%
25.【答案】 (1)甲
(2)流体压强和流速
26.【答案】 化合物;+4;纯净物;+2
27.【答案】 (1)78%
(2)水蒸气
28.【答案】 (1)左低右高;温室
(2)除去管道中的空气,以防止点燃天然气与空气的混合物时发生爆炸
29.【答案】 (1)脱水;化学
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑
30.【答案】 (1)便于煤与空气的接触面积增大,燃烧更为充分
(2)H2O+C 高温_ CO+H2
(3)在煤气泄漏时,使人容易察觉,防止有毒一氧化碳使人中毒
三、解答题
31.【答案】 (1)80
(2)35%
(3)7:1:12
(4)设质量为x的尿素CO(NH2)2与100克硝酸铵含氮量相等
x×2860=100g×35%
x=75g
32.【答案】 (1)稀盐酸石灰石
(2)CO2+H2O __ H2CO3;2H2O2 MnO2__ 2H2O+O2↑;Zn+H2SO4 __ ZnSO4+H2↑;CaCO3+2HCl __ CaCl2+H2O+CO2↑
33.【答案】 (1)100
(2)2.2
(3)解:设该样品中CaCO3的质量分数为x
CaCO3+2HCl=CaCl2+H2O+
CO2↑
100
44
20x
2.2克
10020x=442.2克 ???
x=25%
(4)二氧化碳逸出时会带出水分(盐酸有挥发性)
34.【答案】 (1)易潮解,吸水后会变质
(2)设生成氢气的质量为x,参加反应的氢氧化钠的质量为y,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
????? 54???????????? 80???? 6
????? 54g??????????? y????? x
5454g=80y=6x ,x=6g,y=80g,
生成氢气的体积为: 6g0.09g/L=66.7L ,反应后剩余的氢氧化钠质量为:200g-54g-80g=66g,反应后溶液的质量为:206g+200g-6g=400g,反应后溶液中氢氧化钠的质量分数为: 66g400g×100%=16.5% ,
答:生成氢气的体积是66.7L,反应后溶液中氢氧化钠的质量分数是16.5%.
35.【答案】 (1)氢氧化钠固体溶于水放热,会对实验造成干扰
(2)通过饱和石灰水变浑浊,说明氢氧化钠与稀硫酸反应能放出热量
(3)红墨水右移
四、实验探究题
36.【答案】 (1)探究铁定在隔绝空气(氧气)的条件下是否生锈
(2)铁制品同时与空气和水直接接触
37.【答案】 (1)上;下;4
(2)磷+氧气 →点燃 五氧化二磷
(3)装置漏气、白磷量不足等
38.【答案】 (1)可能向瓶口塞入胶塞过慢由于磷燃烧放热使瓶内气体被赶出一部分
(2)燃烧时弹簧夹没有夹紧导致气体受热膨胀而出,最后进入液体多
(3)白磷的着火点低,可以较容易的发生燃烧;待充分反应后.冷却到原来的状况,调整两边的高度使容器左右中的液面保持水平,记录液面刻度
39.【答案】 (1)AD
(2)Si2-
(3)D
40.【答案】 (1)检查装置气密性
(2)烧杯中石灰水变浑浊
(3)⑧
一、单选题(共20题;共40分)
1.如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则在下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
A.?①单质、⑤化合物?????B.?②碱、⑤氧化物?????C.?④碱、⑤含氧化合物?????D.?④含氧化合物、③氧化物
2.下列关于二甲醚(C2H6O)的说法错误的是(??? )
A.?由碳、氢、氧三种元素组成????????????????????????????????B.?相对分子质量为46
C.?一个二甲醚分子中含有9个原子???????????????????????????D.?碳、氢、氧三种元素的质量比为2:6:1
3.实验室制取氧气的主要步骤有①装药品;②检查气密性;③固定装置;④加热;⑤收集气体.其正确的操作顺序是(?? )
A.?①②③④⑤???????????????????????B.?③①②⑤④???????????????????????C.?②①③④⑤???????????????????????D.?①③②④⑤
4.蜡烛、红磷、铁丝、木炭在氧气中燃烧的共同点是(?? )
A.?都能生成固体?????????????????B.?都是化合反应?????????????????C.?都有火焰出现?????????????????D.?都会放热、发光
5.地球大气的演化经历了原始大气、次生大气和现代大气三个阶段,次生大气中部分成分的微观示意图如下:一定条件下,3.4g甲物质和4.8g氧气恰好完全反应,生成5.4g乙物质和另一种物质X,下列判断不正确的是(??? )
A.?参与反应的甲和氧气的分子数之比为4∶3
B.?该反应的基本类型是置换反应
C.?甲物质与Mg3N2中相同元素的化合价相同
D.?该反应化学方程式中物质X与O2的化学计量数之比为3∶2
6.下列对某一主题知识归纳,正确的一组是(?? )
A.?生活常识:硬水与软水﹣﹣观察颜色区别;除铁锈﹣﹣用砂纸打磨
B.?物质鉴别:盐酸与硫酸﹣﹣锌粒;氯化钾与碳酸钙﹣﹣加水溶解
C.?安全常识:长时间堆放的柴草﹣﹣要不时翻动;进入陌生溶洞前﹣﹣先做灯火实验
D.?“一定”与“不一定”:有单质和化合物生成的反应一定是置换反应;浓溶液一定是饱和溶液、稀溶液一定是不饱和溶液
7.在温度和体积相同的条件下,密闭容器中含有的气体分子数目越多压强就越大.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是(??? )
A.?两种气体的压强相等???????????????????????????????????????????B.?O2比O3的质量小
C.?两种气体的分子数目相等????????????????????????????????????D.?两种气体的氧原子数目相等
8.如图是元素X 的原子结构示意图,下列说法正确的是( ??)
A.?该原子的核内电子数为16???????????????????????????????????B.?该原子最外电子层达到了稳定结构
C.?X 属于非金属元素???????????????????????????????????????????????D.?X 与Na 生成化合物NaX
9.推理是科学学习的一种重要方法,下列一些推理结论中,正确的是( ???)
选项
事实
结论
A
稀有气体由原子直接构成
由原子直接构成的就是稀有气体
B
单质是由同种元素组成的纯净物
由同种元素组成的纯净物就是单质
C
置换反应中一定有单质生成
有单质生成的反应一定是置换反应
D
使无色酚酞试液变红色的溶液是碱性溶液
碱一定能使无色酚酞试液变红色
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
10.下图是某化学反应的微观示意图。下列说法中错误的是( ???)
A.?甲是最简单的有机物???????????????????????????????????????????B.?反应前后原子种类没有发生改变
C.?反应生成的丙和丁的分子个数比为1:2??????????????D.?一个甲分子是由两个氧分子和一个碳原子构成
11.稀土元素铕(Eu)是激光及原子能应用的重要材料。已知氯化铕的化学式为EuCl3 , 则氧化铕的化学式为(? )
A.?EuO??????????????????????????????????B.?Eu2O3??????????????????????????????????C.?Eu3O2??????????????????????????????????D.?EuO3
12.同学们正在参加适应性考试,让我们来做个深呼吸,缓和一下紧张的考试气氛。你呼出的气体中体积含量最高的是(??? ) ?
A.?氮气????????????????????????????????B.?氧气????????????????????????????????C.?二氧化碳????????????????????????????????D.?稀有气体
13.碘元素对人体有着至关重要的作用,如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.下列相关说法正确的是(?? )
碘盐
配料:氯化钠、碘酸钾(KIO3)
含碘量:(20~30)mg/kg
保质期:18个月
食用方法:勿长时间炖炒
贮藏指南:避光、避热、密封防潮
A.?“食用碘盐”属于纯净物
B.?碘酸钾(KIO3)中钾元素、碘元素、氧元素的质量比是39:127:48
C.?碘酸钾(KIO3)中碘元素的质量分数是21.4%
D.?多吃“加碘食盐”可以预防骨质疏松
14.?下列操作或现象与分子特性对应关系不正确的是( )
选项
操作或现象
分子特性
A
气体可压缩储存于钢瓶中
分子间有间隙
B
物体的热胀冷缩
分子的大小是可以变化的
C
湿衣服晾干
分子是运动的
D
1滴水中大约有1.67×1021个水分子
分子很小
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
15.2019年3月10日,长征三号乙运载火箭在西昌卫星发射中心成功将”中星6C”卫星送入预定轨道,这种无污染的火箭采用液氢和液氧作为推进剂。其中液氧属于(????? )
A.?? 单质?????????????????????????????????B.?氧化物?????????????????????????????????C.?化合物?????????????????????????????????D.?混合物
16.模型可以帮助人们认识一些不能直接观察到的事物。如图是某化学反应的过程示意图。分析该图,下列判断正确的是( ???)
A.?该反应没有单质生成???????????????????????????????????????????B.?该反应是分解反应
C.?反应前后元素化合价没有发生变化??????????????????????D.?该化学反应为2H2O2=H2O+O2
17.下列反应既是化合反应又是氧化反应的是(?? )
A.?磷在氧气中燃烧??????????????????????????????????????????????????B.?高锰酸钾受热得到氧气
C.?蜡烛在氧气中燃烧??????????????????????????????????????????????D.?过氧化氢与二氧化锰混合制得氧气
18.下列图像不能正确反映其对应操作的是( ??)
A.?在一定量的CuSO4溶液中逐滴加入NaOH
B.?等质量的Zn和Mg分别与足量等体积等质量分数的稀硫酸反应
C.?向NaOH溶液中逐滴加入稀盐酸
D.?等质量CaCO3分别与足量等体积等质量分数的盐酸反应
19.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示.下列说法不正确的是(?? )
物质
a
b
c
d
反应前质量/g
10
10
10
2
反应后质量/g
待测
0
21
2
A.?该反应是化合反应????????????????????????????????????B.?反应中a、b、c三种物质的质量比为1:10:21
C.?d可能是催化剂?????????????????????????????????????????D.?a和b两种物质中元素种类一定与c物质中元素种类相同
20.化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密闭容器中某化学反应过程的微观变化示意图。据图回答正确的是(????? )
A.?该反应生成了单质
B.?该反应属于化合反应
C.?反应前后分子和原子的种类与数目发生改变
D.?参加反应的“ ” 与“ ” 的分子个数比为2:3
二、填空题(共10题;共25分)
21.市场上有“问题藕”出售。“问题藕”貌似白嫩,但切开有一股难闻的酸味。用pH试纸测试,“普通藕”pH是7。而“问题藕”在3-4之间,估计含有硫酸或盐酸中的一种。究竟是什么酸呢?市场管理人员榨取了“问题藕”的汁液。可以用________来鉴别。写出反应的化学方程式________。
22.已知某实验室的废液中,可能含有HCl、KMnO4、BaCl2、NaOH中一种或几种根据下列实验,回答有关问题:
首先观察废液为无色,然后测其pH为13,接下来向废液中加入过量稀H2SO4产生白色沉淀,问废液中一定含有的物质是________,一定不含的物质是________.
23.为保护环境,今年春节期间,嘉兴市三环以内禁止燃放烟花爆竹。燃放焰火时五光十色,原理是某些不同的金属在燃烧时会产生不同的颜色,有一种焰火的火药中含有Cu(NO3)2 , 燃放时会产生绿色火焰,其化学方程式为:2Cu(NO3)2 Δ__ 2CuO+O2↑+4X↑,X的化学式为:________。已知4X+O2+2H2O=4HNO3 , 若将Cu(NO3)2分解产生的气体用排水法收集,则________收集到气体(?选填“能”或“不能”)。
24.t℃时,两个装有100克水的烧杯中,分别加入不带结晶水的甲、乙物质各80克,充分搅拌。根据如图溶解度曲线判断,此时________?溶液是饱和溶液,甲溶液的溶质质量分数是________?。
?
25.船在水中航行时,船体受到水的阻力较大,影响航行速度.图是一种水翼船,船体下安装了水翼,船在高速航行时,水面下的水翼使船体抬高从而减小水对船体的阻力.请思考并回答以下问题:
(1)根据图判断水翼的形状是________(填“甲”或“乙”).
(2)这一形状是依据________的关系来设计的.
26.黄蜡石质地堪比翡翠美玉,具有极高的欣赏和收藏价值,黄蜡石的主要成分为二氧化硅。二氧化硅(SiO2)属于________(填“单质”或“化合物”),二氧化硅中硅元素的化合价为________价。进行固体熔化实验时常用的药品是硫代硫酸钠晶体(Na2S2O3·5H2O),该物质属于________(填“纯净物”或“混合物”),其中硫元素的化合价是________价。
27.根据下列事实说明空气中含有的成份的名称:
(1)空气是制取氮肥的天然原料,写出该气体在空气中的体积分数为________;
(2)盛有冰水的杯子,放在空气中,外壁会潮湿,说明空气中含有________。
28.我国国务院在2000年2月批准启动“西气东输”工程,这是我国的一项重大工程,其中“气”是指天然气,主要成分为甲烷CH4.
(1)如图,集气瓶里盛有甲烷,U形管左右液面相平,将整个装置放置在阳光之下一定时间,液面________,再将该装置放入黑暗中,若观察到液面仍保持原状,即可证明甲烷是________气体.
(2)天然气管道在第一次输送到用户家里时必须先在管道内充满氮气,这样做的原因是________.
29.小金在研究硫酸的性质时,做了以下实验:
(1)小金用玻璃棒蘸取浓硫酸和稀硫酸在白纸上写字,放置一会儿发现用浓硫酸写的字变黑,这体现了浓硫酸的________性,属于________性质(选填“物理”或“化学”)。
(2)将生锈的铁钉投入到一定量的稀疏酸中,溶液会变成黄色,请写出该反应的化学方程式:________;同时,铁钉表面产生大量的气泡,请写出相应的化学方程式:________;
30.煤是一种常用的化石燃料,家庭用煤经过了从“煤球”到“蜂窝煤”的变化,以前人们把煤粉加工成略大于乒乓球的球体,后来人们把煤粉加工成圆柱体,并在圆柱体内打上一些孔(如图).
(1)请你分析这种变化的优点是:________.
(2)煤在燃烧时会产生许多污染物,为了减少煤燃烧时对环境的污染,可设法把煤转化成清洁的燃料.将水蒸气通过炽热的煤层可制得较洁净的水煤气(主要成分是CO和H2),请你写出该反应的化学方程式:________
(3)煤气厂常在家用水煤气中特意掺入少量有难闻气味的气体,其目的是:________.
三、解答题(共5题;共28分)
31.已知硝酸铵的化学式为NH4NO3 , 试求:
(1)硝酸铵的相对分子质量________;
(2)硝酸铵中氮元素的质量分数________;
(3)硝酸铵中氮、氢、氧三种元素的质量比________;
(4)100克硝酸铵跟多少克尿素CO(NH2)2的含氮量相等?
32.“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生。(整个反应只需要第一个反应发生,就好像多米诺骨牌游戏一样)以下就是一个“化学多米诺实验”,已知H2O2在MnO2的催化作用下可分解产生O2和H2O。如图所示的A~H各装置中分别盛放的物质为:A.稀硫酸;B.锌粒;C.3%H2O2溶液;D.MnO2;E.某溶液;F.某块状固体;G.滴有紫色石蕊的蒸馏水;H.足量澄清石灰水。请回答以下问题。
(1)反应开始后,若G中出现红色,H中有白色沉淀生成,判断E、F中的物质可能分别是________。
(2)按基本反应类型写出该实验中有关反应的化学方程式:
化合反应 ________?;
热分解反应________?;
置换反应________?;
复分解反应________?。
33.实验室里有一瓶氢氧化钙粉末由于较长时间敞口放置,已部分变质为碳酸钙。某课外兴趣小组为测定该瓶粉末中碳酸钙的质量分数,进行实验操作、数据收集和计算。
(1)配制稀盐酸:配制500克7.3%的稀盐酸,需要36.5%的浓盐酸________克。
(2)抽样测定:将瓶中粉末搅拌均匀后称取20克样品放入烧杯并置于电子秤上,再加入足量稀盐酸充分反应,总质量与反应时间的关系如下表所示:
反应时间/秒
0
10
20
30
40
总质量/克
310.0
309.6
308.6
307.8
307.8
完全反应后,生成的CO2气体的质量为________克。
(3)计算出该样品中CaCO3的质量分数(要有计算过程)。
(4)经过分析讨论,同学们觉得这样测得的结果有可能偏大,原因是________(指出一点即可)。
34.某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图)。疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O==2NaAlO2+3H2↑。请回答下列有关问题:
(1)该管道疏通剂需要密封保存的原因是________。
(2)按照使用说明,该同学对“疏通剂”作了进一步研究。先向烧杯中加人206g水,再加入本品200g,当铝粉全部反应后,求:(计算结果保留1位小数)
①生成氢气的体积多少升。(ρ氢气=0.09g/L)
②反应后溶液中氢氧化钠的质量分数。
35.中和反应是放热反应吗?三位同学为探究此问题进行了下列实验:
(1)甲同学取10毫升 10%的NaOH溶液于试管中,逐滴加入10%的稀硫酸,随着硫酸的加入,烧杯中溶液温度与加入硫酸体积之间的变化关系如图甲所示。本实验选用10%的NaOH溶液而不选用NaOH固体的原因是________。
(2)乙同学按图乙装置进行实验,其中的澄清饱和石灰水的作用是________。
(3)丙同学按图丙实验,可以根据________现象也能证明中和反应是放热的。
四、实验探究题(共5题;共15分)
36.化学是一门实验科学,关注物质变化过程,探究物质变化的条件很有必要。某化学兴趣小组做了如图所示的实验。?
根据上述实验,回答下列问题:
(1)实验中,中间试管的实验目的是?????????????????? 。
(2)请总结出铁制品发生锈蚀的主要条件:????????????????? 。
37.为测定空气中氧气的含量,小华同学打算设计如图所示的实验方案:在一个隔热效果良好的容器上方安装一个可自由上下移动的活塞(活塞质量忽略不计,起始位置在5刻度处).加热容器,使容器温度达到80℃(已知白磷燃烧所需的最低温度为40℃).请回答:
(1)实验过程中,可以观察到:白磷剧烈燃烧,产生大量白烟,活塞先向________(填“上”或“下”)移动,再向________移动,最后停在刻度________处.
(2)发生反应的表达式为________.
(3)有位同学做此实验时活塞最终停在4.5处,请你分析造成这一现象的可能原因是________(答一点即可).
38.现有两组实验小组的同学参与“测定空气中氧气的体积分数”实验.
(1)甲组同学采用课本实验装置(图2),他们先用图1的组合装置在空气中点燃红磷,然后慢慢地将燃烧匙从上到下插入广口瓶中,目的使上、下层空气中的氧气都能得到充分消耗,直到橡皮塞塞紧瓶口,红磷在瓶中继续燃烧直到熄灭,等广口瓶冷却后,打开止水夹.但这样测出的氧气的体积分数明显大于 15 .请分析原因________
(2)该装置本身在设计上还存在一定的缺陷,也是造成实验误差的原因,请分析其中一种缺陷,说明这种缺陷造成误差的理由________.
(3)乙组同学先查阅资料(如下表),然后对课本上的实验装置进行了图3所示的改进,右端玻璃管上端开口(其它仪器忽略).
颜色、状态
熔点/℃
着火点/℃
密度/(g/cm3)
红磷
暗红色固体
590
240
2.34
白磷
白色或黄白色固体
44.1
40
1.82
①乙组同学红磷换成了白磷的优点是________
②大家用改进的实验装置进行实验,待玻璃管冷却、管内白色的烟幕消失时,左玻璃管内的液面上升了一段距离,此时他们应该怎样操作之后,才能读取左管液面的刻度________.
39.小林同学收集了一些微粒的资料,请你和他一起根据表格数据回答下列问题。
微粒名称
质子数
中子数
电子数
带电性
A
14
14
14
不带电
B
26
30
24
带2个单位正电荷
C
14
14
16
D
14
16
14
不带电
(1)表格中属于互为同位素的是________。
(2)根据表格信息写出微粒C的符号________。
(3)比较C与D两种微粒,其中质量较大的是________。
40.在老师的指导下,化学兴趣小组利用下列装置进行了“可燃物燃烧的条件”的探究实验。
[实验目的]探究可燃物燃烧的条件[实验步骤]
①将所需仪器按照装置图连接起来;
②打开K1和K2 , 向上拉动任意一支注射器的活塞;
③将实验所需药品加入对应的仪器中;
④将装有适量白磷的具支试管放入冷水中;
⑤打开K1 , 关闭K2 , 往装置甲中加入适量的双氧水,氧气进入具支试管中;
⑥关闭K1 , 打开K2 , 往装置乙中加入适量的盐酸,二氧化碳进入具支试管中;
⑦将装有适量白磷的具支试管放入80℃的热水中;
⑧打开K1 , 关闭K2 , 往装置甲中加入适量双氧水,氧气进入具支试管中;
⑨关闭K1 , 打开K2 , 往装置乙中加入适量的盐酸。[问题解答]
(1)实验步骤②的目的是________。
(2)在实验步骤⑥中,具支试管中氧气已经排尽的实验现象是_________。
(3)能看到白磷燃烧起来的实验步骤是________。
[实验结论]可燃物燃烧必须同时满足两个条件:可燃物与氧气接触;温度达到可燃物的着火点。
答案解析部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 C
4.【答案】 D
5.【答案】 D
6.【答案】 C
7.【答案】 D
8.【答案】 C
9.【答案】 B
10.【答案】 D
11.【答案】 B
12.【答案】 A
13.【答案】 B
14.【答案】 B
15.【答案】 A
16.【答案】 B
17.【答案】 A
18.【答案】 C
19.【答案】 B
20.【答案】 B
二、填空题
21.【答案】 氯化钡;BaCl2+H2SO4=BaSO4+2HCl
22.【答案】 BaCl2、NaOH;HCl、KMnO4
23.【答案】 NO2;不能
24.【答案】 乙;44.4%
25.【答案】 (1)甲
(2)流体压强和流速
26.【答案】 化合物;+4;纯净物;+2
27.【答案】 (1)78%
(2)水蒸气
28.【答案】 (1)左低右高;温室
(2)除去管道中的空气,以防止点燃天然气与空气的混合物时发生爆炸
29.【答案】 (1)脱水;化学
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑
30.【答案】 (1)便于煤与空气的接触面积增大,燃烧更为充分
(2)H2O+C 高温_ CO+H2
(3)在煤气泄漏时,使人容易察觉,防止有毒一氧化碳使人中毒
三、解答题
31.【答案】 (1)80
(2)35%
(3)7:1:12
(4)设质量为x的尿素CO(NH2)2与100克硝酸铵含氮量相等
x×2860=100g×35%
x=75g
32.【答案】 (1)稀盐酸石灰石
(2)CO2+H2O __ H2CO3;2H2O2 MnO2__ 2H2O+O2↑;Zn+H2SO4 __ ZnSO4+H2↑;CaCO3+2HCl __ CaCl2+H2O+CO2↑
33.【答案】 (1)100
(2)2.2
(3)解:设该样品中CaCO3的质量分数为x
CaCO3+2HCl=CaCl2+H2O+
CO2↑
100
44
20x
2.2克
10020x=442.2克 ???
x=25%
(4)二氧化碳逸出时会带出水分(盐酸有挥发性)
34.【答案】 (1)易潮解,吸水后会变质
(2)设生成氢气的质量为x,参加反应的氢氧化钠的质量为y,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
????? 54???????????? 80???? 6
????? 54g??????????? y????? x
5454g=80y=6x ,x=6g,y=80g,
生成氢气的体积为: 6g0.09g/L=66.7L ,反应后剩余的氢氧化钠质量为:200g-54g-80g=66g,反应后溶液的质量为:206g+200g-6g=400g,反应后溶液中氢氧化钠的质量分数为: 66g400g×100%=16.5% ,
答:生成氢气的体积是66.7L,反应后溶液中氢氧化钠的质量分数是16.5%.
35.【答案】 (1)氢氧化钠固体溶于水放热,会对实验造成干扰
(2)通过饱和石灰水变浑浊,说明氢氧化钠与稀硫酸反应能放出热量
(3)红墨水右移
四、实验探究题
36.【答案】 (1)探究铁定在隔绝空气(氧气)的条件下是否生锈
(2)铁制品同时与空气和水直接接触
37.【答案】 (1)上;下;4
(2)磷+氧气 →点燃 五氧化二磷
(3)装置漏气、白磷量不足等
38.【答案】 (1)可能向瓶口塞入胶塞过慢由于磷燃烧放热使瓶内气体被赶出一部分
(2)燃烧时弹簧夹没有夹紧导致气体受热膨胀而出,最后进入液体多
(3)白磷的着火点低,可以较容易的发生燃烧;待充分反应后.冷却到原来的状况,调整两边的高度使容器左右中的液面保持水平,记录液面刻度
39.【答案】 (1)AD
(2)Si2-
(3)D
40.【答案】 (1)检查装置气密性
(2)烧杯中石灰水变浑浊
(3)⑧
