化学实验设计
图片预览



文档简介
(共34张PPT)
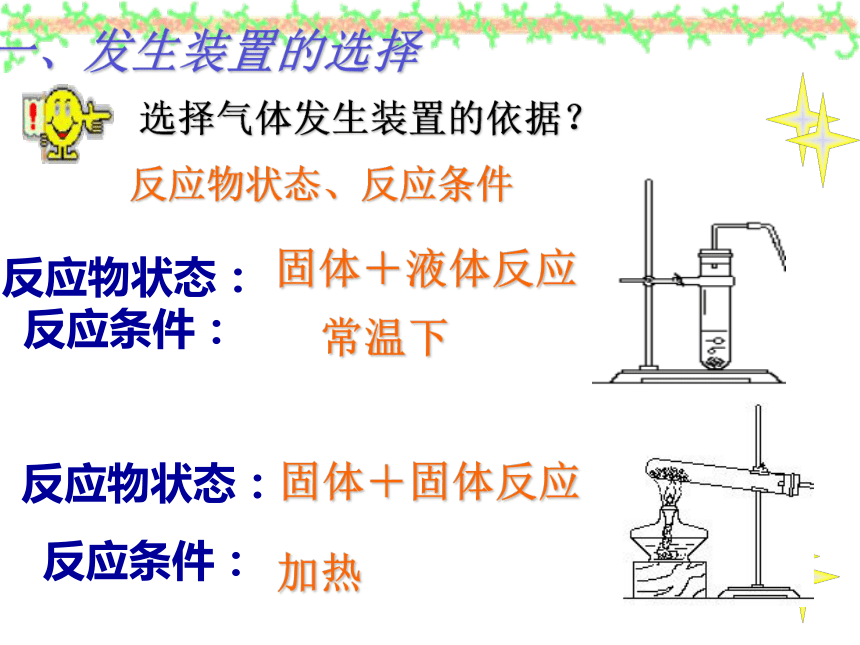
反应物状态:
反应条件:
固体+液体反应
常温下
反应物状态:
反应条件:
固体+固体反应
加热
一、发生装置的选择
选择气体发生装置的依据?
反应物状态、反应条件
排水集气法:
向上排空气法:
向下排空气法:
难溶或不易溶于水
密度比空气大
密度比空气小
二.收集装置的选择
密度、溶解性
选择气体收集装置的依据:
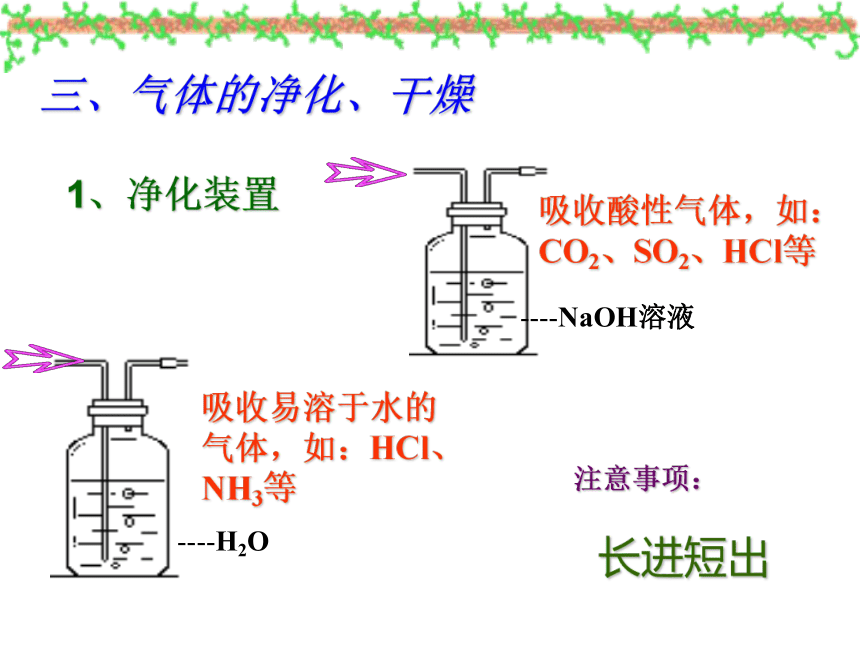
三、气体的净化、干燥
1、净化装置
----NaOH溶液
吸收酸性气体,如:CO2、SO2、HCl等
----H2O
吸收易溶于水的气体,如:HCl、NH3等
注意事项:
长进短出
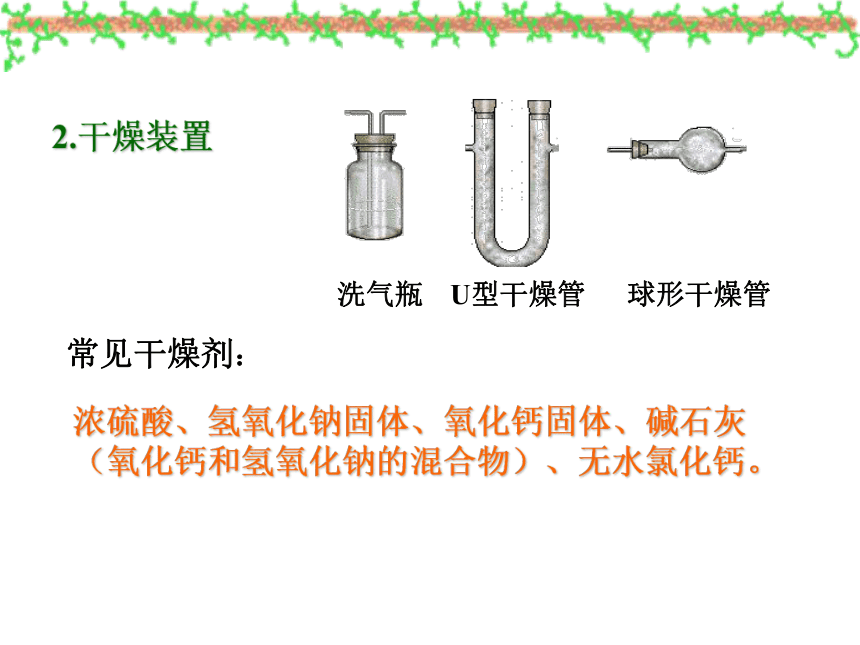
2.干燥装置
球形干燥管
U型干燥管
洗气瓶
常见干燥剂:
浓硫酸、氢氧化钠固体、氧化钙固体、碱石灰(氧化钙和氢氧化钠的混合物)、无水氯化钙。
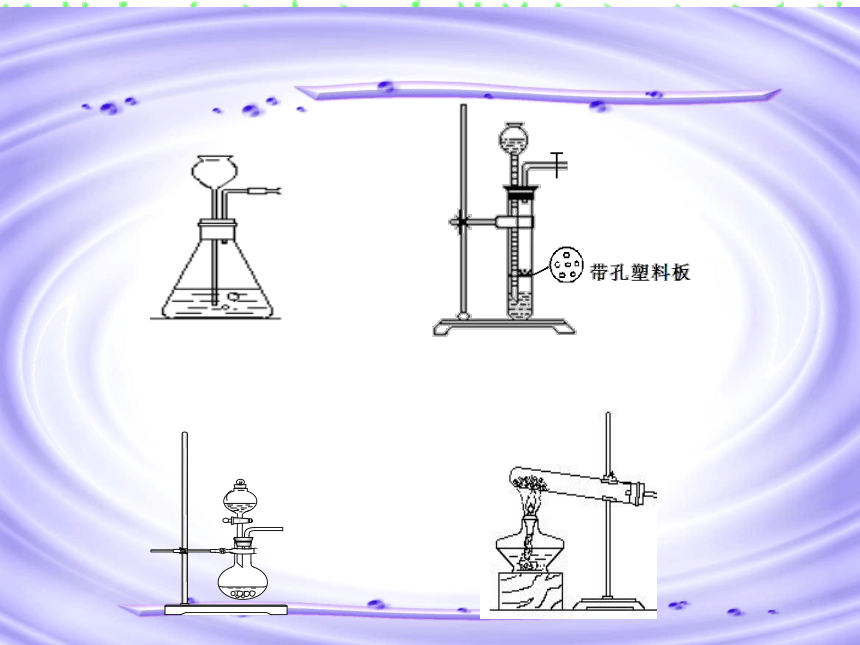
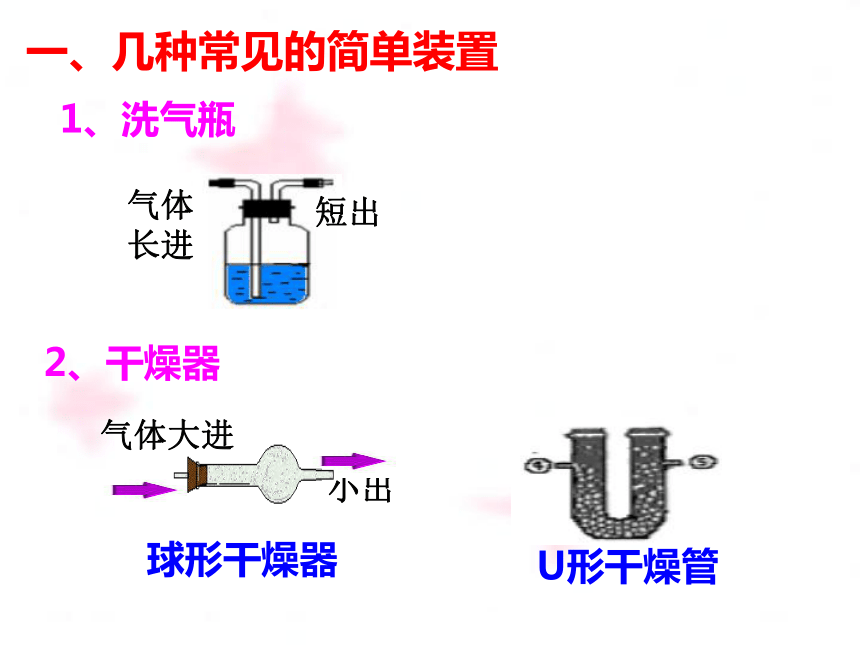
一、几种常见的简单装置
1、洗气瓶
2、干燥器
U形干燥管
气体
长进
短出
气体大进
小出
球形干燥器
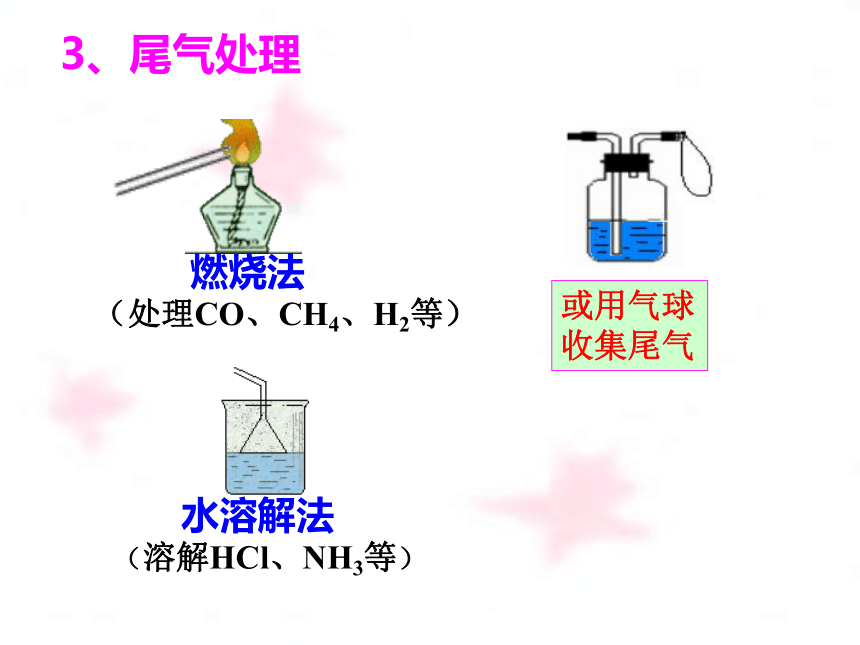
3、尾气处理
水溶解法
(溶解HCl、NH3等)
燃烧法
(处理CO、CH4、H2等)
或用气球
收集尾气
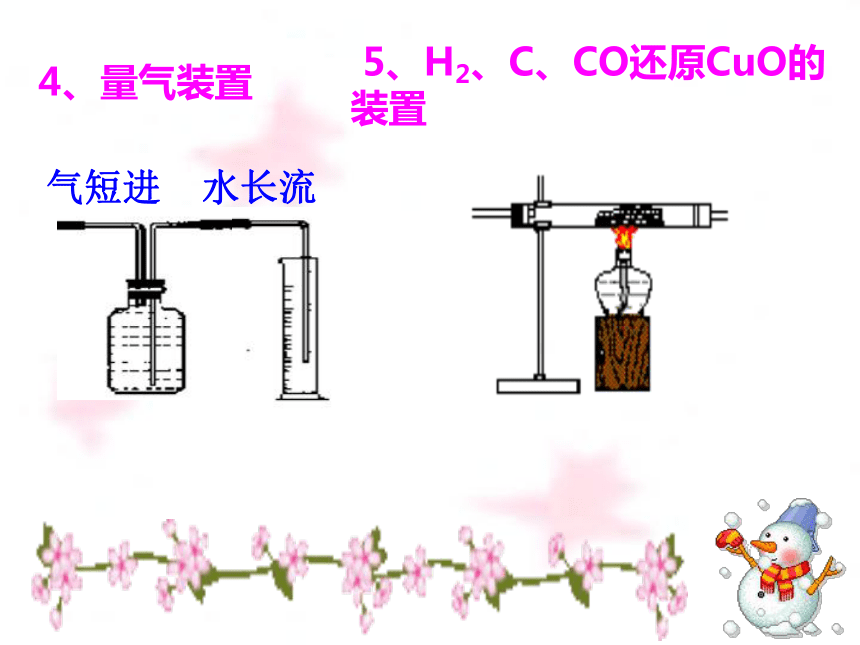
4、量气装置
5、H2、C、CO还原CuO的装置
气短进
水长流
练一练
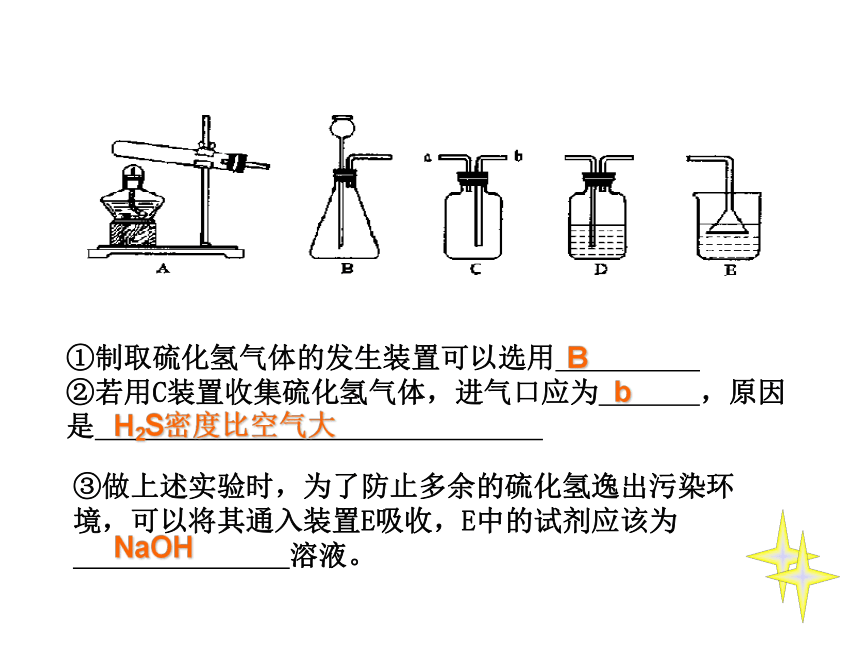
硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。试回答:
(l)实验室制取硫化氢的化学反应方程式__________________
(2)根据装置图回答下列问题:
FeS+H2SO4 ===== H2S +FeSO4
能溶于水
常温
密度比空气的密度大
块状固体硫化亚
铁(FeS)和稀硫酸
①制取硫化氢气体的发生装置可以选用
②若用C装置收集硫化氢气体,进气口应为 ,原因是
③做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中的试剂应该为 溶液。
B
b
H2S密度比空气大
NaOH
a
b
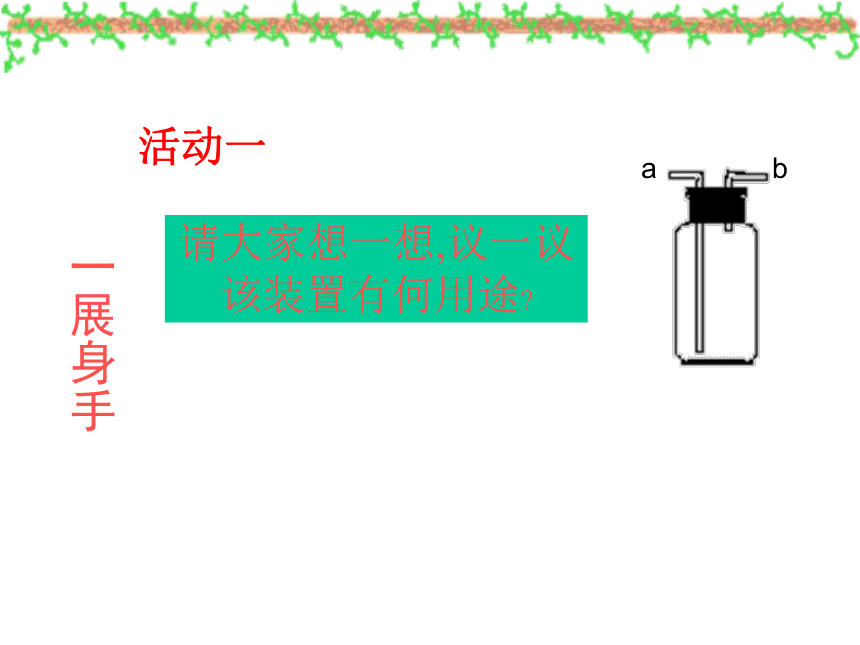
活动一
一展身手
请大家想一想,议一议
该装置有何用途
a
b
一 储气
a
若气体密度大于空气密度,应从___端进;
a
b
----H2O
若气体难溶于水,可用排水法收集,
应从___端进
b
二 洗气
吸收酸性气体
吸收易溶于水的气体
干燥中性或酸性气体
----NaOH溶液
---H2O
----浓硫酸
----AgNO3溶液
----澄清石灰水
检验HCl气体
检验CO2气体
-
三 检验
干燥方法:
中性的:H2、O2、N2、CO、CH4等
酸性的:CO2、HCl等
酸性、强氧化性的浓硫酸
中性的:H2、O2、N2、CO、CH4等
中性:无水氯化钙
碱性的:NH3
中性的:H2、O2、N2、CH4等
碱性:
生石灰、碱石灰
可干燥的气体
干燥剂
仪器装置
特别提醒:
当收集的是有毒气体,会污染环境,还需要考虑尾气的处理。
尾气处理的方法:
1、燃烧法
如:CO
2、液体吸收:
如:SO2
3、收集法
发生装置
净化
装置
干燥
装置
收集
装置
尾气处理
装置
小结
制取气体实验装置的设计包括哪些方面?
活动二:
某兴趣小组的同学用如图所示的装置制取二氧化碳,并将生成的气体通入澄清石灰水,结果始终没有看到有沉淀产生,请你来猜想一下没有产生沉淀的原因?并设计实验方案验证你的猜想.
假如药品不变,而澄清石灰水并未变质,要证明杂质气体成分并得 到干燥 纯净的二氧化碳,该怎样设计实验方案 可从下列器材中选出你所需要的.
I
H
无水硫酸铜
a
b
c
d
e
f
g
h
A
B
C
D
E
F
G
i
m
p
q
s
t
要证明杂质气体成分并得 到干燥 纯净的二氧化碳,正确的连接顺序是
a →f → g → e →d →b →c →i
(2)确认混合气体中含有H2的实验现象是:
B
A
C
E
D
NaOH溶液
浓硫酸
CuO
无水CuSO4
Ca(OH)2溶液
CO、CO2
H2、H2O
CuO由黑色变为红色,并且无水CuSO4变蓝
确认混合气体中含有CO的理由是(化学方程式表示):
CO + CuO= Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
(2)确认混合气体中含有H2的实验现象是:
B
A
C
E
D
NaOH溶液
浓硫酸
CuO
无水CuSO4
Ca(OH)2溶液
CO、CO2
H2、H2O
CuO由黑色变为红色,并且无水CuSO4变蓝
确认混合气体中含有CO的理由是(化学方程式表示):
CO + CuO= Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
用稀盐酸和锌粒反应制取氢气时,常常混有氯化氢、水蒸气等杂质。设计实验证明并除去杂质,取得纯净干燥的氢气。
1、要制备纯净干燥的氢气,各仪器的连接顺序是(按接口字母)___________________
2、C装置中发生的现象是__________作用是__________
3、D装置中发生的现象是__________作用是____________
无水硫酸铜
a
b
c
d
e
f
g
h
A
B
C
D
E
a→f →g →e →d →b →c →h
产生白色沉淀
检验并除去氯化氢气体
白色固体变蓝色
证明水蒸气的存在
证明并除去杂质,取得纯净干燥的氢气。
氯化氢、水蒸气
二、化学实验基本操作——检验气密性
练习1、为了除去N2中混有的少量的CO2和水蒸气,两位同学将混合气体分别通过下面两个装置,最后得到的气体分别是什么?
练习2、实验室用锌和盐酸反应来制取的氢气中常常混有少量的HCl气体和水蒸气,现用下面的装置除去HCl气体和水蒸气,装置如何连接?
例1、草酸(H2C2O4)是一种无色晶体,实验室用其加热制取CO气体:
H2C2O4 =CO↑+CO2 ↑ + H2O
①加热草酸制取CO的发生装置应选用与实验室制 (O2、H2、CO2)相同的装置
②要得到干燥纯净的CO,并用CO还原氧化铁,写出各装置正确连接顺序 。
③装置丙中NaOH的作用是 。
④尾气应如何处理 。
例2、为了验证某混合气体由H2、CO和HCl三种气体组成,请从下图中选择适当的装置设计一实验,并回答问题(假设每步均完全反应):
①装置连接的顺序是 。
②你所选 择的第一装置的作用 。
③最后一个装置中反应化学方程式 。
④A装置在实验过程中玻璃管中现象 。
⑤若省略第二个装置,不能验证的气体 。
例3、甲、乙两同学利用下面装置测定铜和氧化铜的混合物中铜元素的质量分数。回答问题:
①A中可观察到的现象 ,化学方程式 。
②B装置作用 ;C装置作用 。
③D装置中铜和氧化铜总质量为10克,充分反应后,E装置的质量增加1.8克,则原混合物中铜元素的质量分数为 。
④F装置的作用是吸收空气中的水,如果没有F装置,会使实验结果 (偏大、偏小)。
例4、现只有稀盐酸、浓硫酸和NaOH溶液。要用如图所示装置对H2和CO2的混合气体进行分离和干燥,则:
①甲中应盛 ,乙中应盛 ;
②首先打开活塞a,可分离出 ,反应化学方程式为 。
③再关闭活塞a,向b中加入稀盐酸,又可分离出 ,反应化学方程式 。
④b仪器为何要伸入液面下 。
根据上列装置图用序号回答:(1)根据实验现象能直接证明CO中含CO2应将气体通过_ 装置;(2)为验证CO2中含有少量的CO可将气体通过 装置;(3)为准确测定水的组成,用锌粒与盐酸反应制得的氢气还原氧化铜,并对生成的水进行称量。为防止杂质干扰,按正确连接顺序选用装置是:不纯的氢气→丙→ → → 。
甲
乙
丙
丁
戊
己
CuO
C粉
无水CuSO4 NaOH Ca(OH)2 浓H2SO4
丁
甲
戊
甲
乙
2、
4、某气体可能由H2、CO、CO2、H2O、HCl中的一种或几种组成,为确定其成分,进行如下实验:
装置编号 A B C D E
试 剂 硝酸银溶液 澄清石灰水 氧化铜粉末 澄清石灰水 无水硫酸铜
现 象 无明显变化 变浑浊 变红色 无明显变化 变蓝色
试推断: (1)该气体中一定含有 _________ 。(2)该气体中一定没有 __________ 。
气体通过有关装置时观察到的现象如下:
H2、CO2
CO、HCl
盐酸+大理石
A
NaOH溶液
D
AgNO3溶液
B
浓硫酸
C
Cu
Na2O2固体
F
E
过氧化钠(Na2O2)是一种黄色固体,在通常情况下跟CO2、H2O、HCl发生下列反应:
2 Na2O2+2CO2=2Na2CO3+O2↑
2 Na2O2+4HCl=4NaCl+2H2O+O2↑
2 Na2O2+2H2O=4NaOH+O2↑
用盐酸和大理石反应制得的CO2中混有水蒸气和HCl气体,请用下列全部或部分实验装置,验证CO2能跟Na2O2反应制取O2,仪器的连接顺序是____________,看到____现象证明CO2能跟Na2O2反应制取O2。
考 题 精 析
A B C F E
反应物状态:
反应条件:
固体+液体反应
常温下
反应物状态:
反应条件:
固体+固体反应
加热
一、发生装置的选择
选择气体发生装置的依据?
反应物状态、反应条件
排水集气法:
向上排空气法:
向下排空气法:
难溶或不易溶于水
密度比空气大
密度比空气小
二.收集装置的选择
密度、溶解性
选择气体收集装置的依据:
三、气体的净化、干燥
1、净化装置
----NaOH溶液
吸收酸性气体,如:CO2、SO2、HCl等
----H2O
吸收易溶于水的气体,如:HCl、NH3等
注意事项:
长进短出
2.干燥装置
球形干燥管
U型干燥管
洗气瓶
常见干燥剂:
浓硫酸、氢氧化钠固体、氧化钙固体、碱石灰(氧化钙和氢氧化钠的混合物)、无水氯化钙。
一、几种常见的简单装置
1、洗气瓶
2、干燥器
U形干燥管
气体
长进
短出
气体大进
小出
球形干燥器
3、尾气处理
水溶解法
(溶解HCl、NH3等)
燃烧法
(处理CO、CH4、H2等)
或用气球
收集尾气
4、量气装置
5、H2、C、CO还原CuO的装置
气短进
水长流
练一练
硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。试回答:
(l)实验室制取硫化氢的化学反应方程式__________________
(2)根据装置图回答下列问题:
FeS+H2SO4 ===== H2S +FeSO4
能溶于水
常温
密度比空气的密度大
块状固体硫化亚
铁(FeS)和稀硫酸
①制取硫化氢气体的发生装置可以选用
②若用C装置收集硫化氢气体,进气口应为 ,原因是
③做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中的试剂应该为 溶液。
B
b
H2S密度比空气大
NaOH
a
b
活动一
一展身手
请大家想一想,议一议
该装置有何用途
a
b
一 储气
a
若气体密度大于空气密度,应从___端进;
a
b
----H2O
若气体难溶于水,可用排水法收集,
应从___端进
b
二 洗气
吸收酸性气体
吸收易溶于水的气体
干燥中性或酸性气体
----NaOH溶液
---H2O
----浓硫酸
----AgNO3溶液
----澄清石灰水
检验HCl气体
检验CO2气体
-
三 检验
干燥方法:
中性的:H2、O2、N2、CO、CH4等
酸性的:CO2、HCl等
酸性、强氧化性的浓硫酸
中性的:H2、O2、N2、CO、CH4等
中性:无水氯化钙
碱性的:NH3
中性的:H2、O2、N2、CH4等
碱性:
生石灰、碱石灰
可干燥的气体
干燥剂
仪器装置
特别提醒:
当收集的是有毒气体,会污染环境,还需要考虑尾气的处理。
尾气处理的方法:
1、燃烧法
如:CO
2、液体吸收:
如:SO2
3、收集法
发生装置
净化
装置
干燥
装置
收集
装置
尾气处理
装置
小结
制取气体实验装置的设计包括哪些方面?
活动二:
某兴趣小组的同学用如图所示的装置制取二氧化碳,并将生成的气体通入澄清石灰水,结果始终没有看到有沉淀产生,请你来猜想一下没有产生沉淀的原因?并设计实验方案验证你的猜想.
假如药品不变,而澄清石灰水并未变质,要证明杂质气体成分并得 到干燥 纯净的二氧化碳,该怎样设计实验方案 可从下列器材中选出你所需要的.
I
H
无水硫酸铜
a
b
c
d
e
f
g
h
A
B
C
D
E
F
G
i
m
p
q
s
t
要证明杂质气体成分并得 到干燥 纯净的二氧化碳,正确的连接顺序是
a →f → g → e →d →b →c →i
(2)确认混合气体中含有H2的实验现象是:
B
A
C
E
D
NaOH溶液
浓硫酸
CuO
无水CuSO4
Ca(OH)2溶液
CO、CO2
H2、H2O
CuO由黑色变为红色,并且无水CuSO4变蓝
确认混合气体中含有CO的理由是(化学方程式表示):
CO + CuO= Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
(2)确认混合气体中含有H2的实验现象是:
B
A
C
E
D
NaOH溶液
浓硫酸
CuO
无水CuSO4
Ca(OH)2溶液
CO、CO2
H2、H2O
CuO由黑色变为红色,并且无水CuSO4变蓝
确认混合气体中含有CO的理由是(化学方程式表示):
CO + CuO= Cu + CO2
CO2 + Ca(OH)2 = CaCO3 + H2O
用稀盐酸和锌粒反应制取氢气时,常常混有氯化氢、水蒸气等杂质。设计实验证明并除去杂质,取得纯净干燥的氢气。
1、要制备纯净干燥的氢气,各仪器的连接顺序是(按接口字母)___________________
2、C装置中发生的现象是__________作用是__________
3、D装置中发生的现象是__________作用是____________
无水硫酸铜
a
b
c
d
e
f
g
h
A
B
C
D
E
a→f →g →e →d →b →c →h
产生白色沉淀
检验并除去氯化氢气体
白色固体变蓝色
证明水蒸气的存在
证明并除去杂质,取得纯净干燥的氢气。
氯化氢、水蒸气
二、化学实验基本操作——检验气密性
练习1、为了除去N2中混有的少量的CO2和水蒸气,两位同学将混合气体分别通过下面两个装置,最后得到的气体分别是什么?
练习2、实验室用锌和盐酸反应来制取的氢气中常常混有少量的HCl气体和水蒸气,现用下面的装置除去HCl气体和水蒸气,装置如何连接?
例1、草酸(H2C2O4)是一种无色晶体,实验室用其加热制取CO气体:
H2C2O4 =CO↑+CO2 ↑ + H2O
①加热草酸制取CO的发生装置应选用与实验室制 (O2、H2、CO2)相同的装置
②要得到干燥纯净的CO,并用CO还原氧化铁,写出各装置正确连接顺序 。
③装置丙中NaOH的作用是 。
④尾气应如何处理 。
例2、为了验证某混合气体由H2、CO和HCl三种气体组成,请从下图中选择适当的装置设计一实验,并回答问题(假设每步均完全反应):
①装置连接的顺序是 。
②你所选 择的第一装置的作用 。
③最后一个装置中反应化学方程式 。
④A装置在实验过程中玻璃管中现象 。
⑤若省略第二个装置,不能验证的气体 。
例3、甲、乙两同学利用下面装置测定铜和氧化铜的混合物中铜元素的质量分数。回答问题:
①A中可观察到的现象 ,化学方程式 。
②B装置作用 ;C装置作用 。
③D装置中铜和氧化铜总质量为10克,充分反应后,E装置的质量增加1.8克,则原混合物中铜元素的质量分数为 。
④F装置的作用是吸收空气中的水,如果没有F装置,会使实验结果 (偏大、偏小)。
例4、现只有稀盐酸、浓硫酸和NaOH溶液。要用如图所示装置对H2和CO2的混合气体进行分离和干燥,则:
①甲中应盛 ,乙中应盛 ;
②首先打开活塞a,可分离出 ,反应化学方程式为 。
③再关闭活塞a,向b中加入稀盐酸,又可分离出 ,反应化学方程式 。
④b仪器为何要伸入液面下 。
根据上列装置图用序号回答:(1)根据实验现象能直接证明CO中含CO2应将气体通过_ 装置;(2)为验证CO2中含有少量的CO可将气体通过 装置;(3)为准确测定水的组成,用锌粒与盐酸反应制得的氢气还原氧化铜,并对生成的水进行称量。为防止杂质干扰,按正确连接顺序选用装置是:不纯的氢气→丙→ → → 。
甲
乙
丙
丁
戊
己
CuO
C粉
无水CuSO4 NaOH Ca(OH)2 浓H2SO4
丁
甲
戊
甲
乙
2、
4、某气体可能由H2、CO、CO2、H2O、HCl中的一种或几种组成,为确定其成分,进行如下实验:
装置编号 A B C D E
试 剂 硝酸银溶液 澄清石灰水 氧化铜粉末 澄清石灰水 无水硫酸铜
现 象 无明显变化 变浑浊 变红色 无明显变化 变蓝色
试推断: (1)该气体中一定含有 _________ 。(2)该气体中一定没有 __________ 。
气体通过有关装置时观察到的现象如下:
H2、CO2
CO、HCl
盐酸+大理石
A
NaOH溶液
D
AgNO3溶液
B
浓硫酸
C
Cu
Na2O2固体
F
E
过氧化钠(Na2O2)是一种黄色固体,在通常情况下跟CO2、H2O、HCl发生下列反应:
2 Na2O2+2CO2=2Na2CO3+O2↑
2 Na2O2+4HCl=4NaCl+2H2O+O2↑
2 Na2O2+2H2O=4NaOH+O2↑
用盐酸和大理石反应制得的CO2中混有水蒸气和HCl气体,请用下列全部或部分实验装置,验证CO2能跟Na2O2反应制取O2,仪器的连接顺序是____________,看到____现象证明CO2能跟Na2O2反应制取O2。
考 题 精 析
A B C F E
