高中化学鲁科版(2019)选择性必修2 第3章测试卷(含解析)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修2 第3章测试卷(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-09 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
高中化学鲁科版(2019)选择性必修2 第3章测试卷
一、单选题
1.下列说法正确的是(??? )
A.?冰和氯化钠融化时克服的作用力均为分子间作用力
B.?某物质在熔融态能导电,则该物质中一定含有离子键
C.?CCl4和CO2两种分子中,每个原子的最外层都具有8电子稳定结构
D.?金刚石、C60都不存在单个小分子
2.熔融时需要破坏共价键的化合物是( ??)
A.?冰??????????????????????????????????B.?石英??????????????????????????????????C.?金刚石??????????????????????????????????D.?氢氧化钠
3.下列晶体中,①冰? ②_???è?±_???è?????_烯(C60)? ④食盐? ⑤白磷?? ⑥冰醋酸? ⑦晶体氩。晶体中除了存在原子与原子间的共价键外,同时也存在范德华力的有(? ) 2·1·c·n·j·y
A.?3种???????????????????????????????????????B.?4种???????????????????????????????????????C.?5种???????????????????????????????????????D.?6种
4.下列有关离子晶体的数据大小比较错误的是( ??)
A.?熔点:NaF>MgF2>AlF3?????????????????????????????? ??????B.?晶格能:NaF>NaCl>NaBr www-2-1-cnjy-com
C.?阴离子的配位数:CsCl>NaCl>CaF2???????????????????D.?硬度:MgO>CaO>BaO 【来源:21cnj*y.co*m】
5.下列说法正确的是( ??)
A.?氯化钠晶体熔_è?????é??è????????_离子键
B.?石英和干冰都属于原子晶体
C.?CH4、CO2中所有原子均满足最外层8 电子稳定结构
D.?KOH和 CaCl2 都是含有共价键的离子化合物【出处:21教育名师】
6.随着工业生产和社会发展对材料性能要求的提高,无机非金属材料成为高技术领域必须材料。下列说法错误的是(?? ) 21*cnjy*com
A.?高纯度的硅可用于制造计算机芯片
B.?用氢氟酸可以生产磨砂玻璃
C.?工业上利用硅的高熔点可以用物理方法制得高纯度硅
D.?碳纳米管表面积大、强度高,可用于生产感应器
7.制备纳米Fe3O4的过程如下:下列有关叙述不合理的是(?? )
A.?纳米Fe3O_4????????¨é?????_溶剂中,当强光照射时,会产生丁达尔现象
B.?反应①的反应类型为消去反应
C.?反应②中,环丙胺的作用可能是促进氯化铁水解
D.?反应③的化学方程式为:6FeOOH+CO═2Fe3 O4+3H2O+CO22-1-c-n-j-y
8.“纳米材料”是粒子直径为1n_m???100n_m的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的分散系①是溶液②是胶体③具有丁达尔现象④不能透过半透膜⑤不能透过滤纸⑥静置后会出现黑色沉淀。其中正确的是(??? )
A.?①④⑥???????????????????????????????B.?②③⑤???????????????????????????????C.?②③④???????????????????????????????D.?①③④⑥
二、综合题
9.根据问题填空:
(1)“纳米材料”是当今材料科_??????????????????_,其研究成果广泛应用于催化及军事科学中.所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 ?????? .
A.能全部透过半透膜
B.有丁达尔效应
C.所得液体呈胶状
D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题.
①鉴别水溶液和胶体可以利用的方法是________.
②60℃左右_????????¨?·????è??_体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应.从半透膜里析出的物质是________,该操作的名称是________.
10.硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1)Se元素基态原子的电子排布式为________;第四周期中第一电离能比Se元素大的共有________种(氪元素除外)。
(2)气态SeO3分子的价层电子对互斥模型为________ ;SeO42-离子中Se原子的杂化方式为 ________ 。
(3)固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。
①图1中Se-O键键长较短的是 ________(填“a"或“b"),其原因是________。
②SeO2熔点为350℃,固态SeO2属于________晶体,其熔点远高于SO2(-75.5℃)的原因是 ________。
(4)硒化锌(ZnSe)是一_?§?é??è???????????_体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= ________nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为________ g.cm-3。
11.B、Si和P 是组成半导体材料的重要元素。回答下列问题
(1)基态B、Si 和P中,单电子数最多的是________,电负性最大的是________。
(2)PCl3中心原子的杂化类型为________,BCl3与阴离子________互为等电子体。
(3)SiCl4 极易与水反应,其反应机理如图。
①上述反应机理涉及的分子中属于非极性分子的是________。(填化学式)
②关于上述反应机理的说法正确的是________。
A. Si 的杂化方式一直没有发生变化
B. H2O 中 O 通过孤对电子与 Si 形成配位键
C.只涉及了极性共价键的断裂与形成
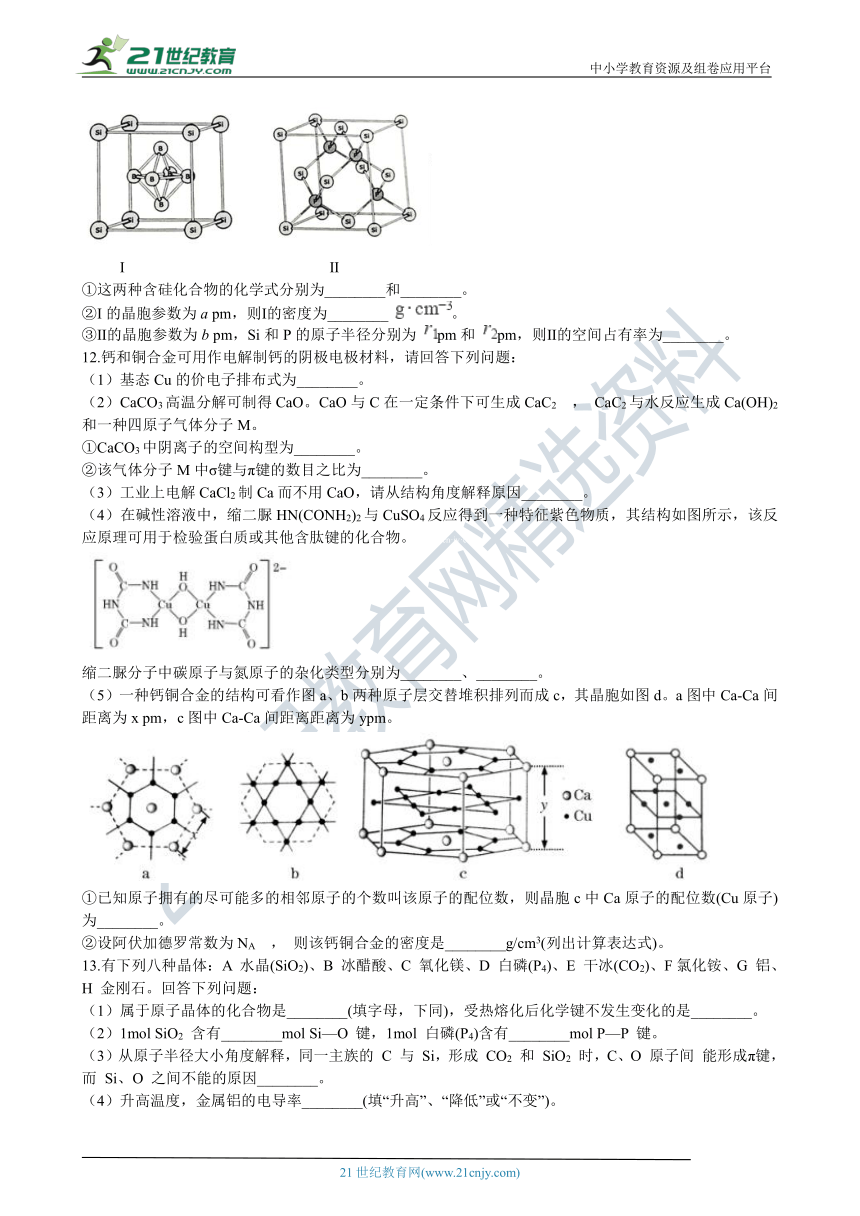
(4)两种含硅化合物的晶胞结构如图所示
???????? I???????????????????????????????????? ?? Ⅱ21·世纪*教育网
①这两种含硅化合物的化学式分别为________和________。
②I的晶胞参数为a pm,则Ⅰ的密度为________ 。
③Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为 pm和 pm,则Ⅱ的空间占有率为________。
12.钙和铜合金可用作电解制钙的阴极电极材料,请回答下列问题:
(1)基态Cu的价电子排布式为________。
(2)CaCO3高_??????è§??????????_CaO。CaO与C在一定条件下可生成CaC2 , CaC2与水反应生成Ca(OH)2和一种四原子气体分子M。
①CaCO3中阴离子的空间构型为________。
②该气体分子M中σ键与π键的数目之比为________。
(3)工业上电解CaCl2制Ca而不用CaO,请从结构角度解释原因________。
(4)在碱性溶液中,_??????è??HN(_CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含肽键的化合物。 21·cn·jy·com
缩二脲分子中碳原子与氮原子的杂化类型分别为________、________。
(5)一种钙_é?????é???????????_可看作图a、b两种原子层交替堆积排列而成c,其晶胞如图d。a图中Ca-Ca间距离为x pm,c图中Ca-Ca间距离距离为ypm。
①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为________。
②设阿伏加德罗常数为NA , 则该钙铜合金的密度是________g/cm3(列出计算表达式)。
13.有下列八种晶体:A__?°????(Si_O2)、B 冰醋酸、C 氧化镁、D 白磷(P4)、E 干冰(CO2)、F氯化铵、G 铝、H 金刚石。回答下列问题:
(1)属于原子晶体的化合物是________(填字母,下同),受热熔化后化学键不发生变化的是________。
(2)1mol SiO2 含有________mol Si—O 键,1mol 白磷(P4)含有________mol P—P 键。
(3)从原子半径大小角度解释,同_????????????_C_ 与 Si,形成 CO2 和 SiO2 时,C、O 原子间 能形成π键,而 Si、O 之间不能的原因________。
(4)升高温度,金属铝的电导率________(填“升高”、“降低”或“不变”)。
答案解析部分
一、单选题
1.答案: C
解析:A.冰是分子晶体,熔化时克服的作用力为分子间作用力,氯化钠是离子晶体,熔化时克服的作用力为离子键,故A不符合题意; 21cnjy.com
B.含有自由移动离子或电子的物质能导电,该物质在熔融状态下能导电,该物质中可能含有离子键,也可能含有自由移动的电子,故B不符合题意;
C.CO2和C原子中的最_?¤??±??????????4_,形成4个共用电子对,所以每个原子的最外层都具有8电子稳定结构,CCl4中每个原子的最外层都具有8电子稳定结构,故C符合题意;
D.C60为分子晶体,存在独立的分子,故D不符合题意。
故答案为:C。
分析:A.离子键和分_???é???????¨????±?_别不同
B.金属单质也能导电,但不具有离子键
C.根据成键的方式即可判断达到八个电子稳定结构
D.金刚石是原子晶体21教育名师原创作品
2.答案: B
解析:A.冰是共价化合物,分子晶体,熔融时只需要克服分子间作用力,不需要破坏化学键,故A不符合题意;
B.石英(SiO2)是共价化合物,属于原子晶体,熔融时需要克服共价键,故B符合题意;
C.金刚石是单质,属于原子晶体,熔融时需要克服共价键,故C不符合题意;
D.氢氧化钠是离子化合物,属于离子晶体,熔融时需要克服离子键,故D不符合题意;
故答案为:B。
分析:原子晶体(共价晶体)融化时需要破坏共价键。
3.答案: B
解析:①冰为水分子形成的晶体,水分子内存在共价键,水分子间存在范德华力,①符合题意;
②石英,为Si、O原子形成的原子晶体,晶体内只存在共价键,②不合题意;
③足球烯(C60),形成分子晶体,C60分子内C原子间形成共价键,C60分子间存在范德华力,③符合题意;
④食盐,形成离子晶体,晶体内只存在离子键,④不合题意;
⑤白磷,形成分子晶体,白磷分子内存在共价键,白磷分子间存在范德华力,⑤符合题意;
⑥冰醋酸,形成分子晶体,CH3COOH分子内存在共价键,醋酸分子间存在范德华力,⑥符合题意;
⑦晶体氩,形成分子晶体,但属于单原子分子,分子内不存在共价键,只存在分子间的范德华力,⑦不合题意;
综合以上分析,只有①③⑤⑥符合题意,
故答案为:B。
分析:晶体中除了存在原子与原子间的共价键外,同时也存在范德华力,此类晶体通常为分子晶体。
4.答案: A
解析:A. 离子半径越小,离子所带电荷越多,离子晶体熔点越高,所以熔点:NaFB. 离子半径越小,晶格能越大,所以晶格能:NaF>NaCl>NaBr,故B不符合题意;
C. CsCl、NaCl、Ca_F2???é????????_的配位数分别是8、6、4,所以阴离子的配位数:CsCl>NaCl>CaF2 , 故C不符合题意;
D. 离子半径:Ba2+>Ca2+>Mg2+ , 所以硬度:MgO>CaO>BaO,故D不符合题意。
故答案为:A。
分析:离子半径越小,离子所带电荷越多,离子晶体晶格能越大,熔点越高,硬度越大。
5.答案: A
解析:A. 氯化钠晶体只有离子键,熔融时克服离子键电离出钠离子和氯离子,A符合题意;
B. 石英是原子晶体,干冰是分子晶体,B不符合题意;
C. CH4中H最外层只有一个电子,形成共价键时最外层为2电子稳定结构,C不符合题意;
D. CaCl2 只含有离子键,D不符合题意;
故答案为:A。
分析:B、干冰属于分子晶体
C、H最外层只有2个电子
D、氯化钙只含离子键
6.答案: C
解析:A. 高纯度的硅可用于制造计算机芯片,A不符合题意;
B. 用氢氟酸可以生产磨砂玻璃,B不符合题意;
C. 由SiO2+2C Si+2CO↑反应可以制得粗硅,若要制得高纯度硅,其化学方程式为Si(s)+3HCl(g)=SiHCl3(g)+H2(g),SiHCl3(g)+H2(g) Si(s)+3HCl(g),该过程为化学变化,故C符合题意;
D. 碳纳米管表面积大、强度高,因此可用于生产感应器,D不符合题意;
故答案为:C。
分析_???A.?????????_导体材料,可以用来做太阳能电池板和计算机芯片,而二氧化硅一般做光导纤维
B.氢氟酸能与二氧化硅反应
C.制取高纯硅过程中发生了化学变化,产生了新物质,故不为物理变化
D.生产传感器对表面积和硬度要求比较高,碳纳米管有这个特性21世纪教育网版权所有
7.答案: B
解析:解:A、纳米四氧化三铁分散在适当分散剂中,属于胶体分散系,则具有丁达尔现象,故A正确; B、消去反应是指一定条件下,有机物分子里生成小分子.同时生成不饱和有机物的反应,故反应①不是消去反应,故B错误;
C、因反应②环丙胺不参加反应,但加快反应速率,即加快了氯化铁水解,故C正确;
D、由制备过_?¨????????????????_应③的反应物为FeOOH和CO,由一种生成物为Fe3O4和质量守恒定律可知反应为6FeOOH+CO═2Fe3O4+3H2O+CO2 , 故D正确;
故选B.
分析:A、利用胶体的性质来分析;
B、根据消去反应的定义来分析;
C、根据反应②环丙胺没有参加反应来分析.
D、根据反应③中的反应物与生成物及质量守恒定律来分析.
8.答案: C
解析:纳米碳属于“纳_?±????????????????_子直径为1nm~100nm,当将纳米碳均匀的分散到蒸馏水中,得到的分散系属于胶体;具有丁达尔现象;不能透过半透膜,但是能透过滤纸;⑥静置后不会出现黑色沉淀,故其中正确的是②③④,故答案为C。
分析:本题考查三种分散系的分类标准及胶体的性质,胶体中的分散质微粒能透过滤纸,不能透过半透膜是解题的关键。
二、综合题
9.答案: (1)B
(2)让一束可见光分别照射两瓶无色液体,可见到一条光亮通路的为淀粉胶体;麦芽糖;渗析
解析:解_??????1?????????_中分散质的直径在1nm~100nm之间的属于胶体分散系,由“纳米技术”是指粒子直径在几纳米到几十纳米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,则该混合物属于胶体,所以所得混合物可能具有的性质是胶体的性质,胶体的分散质微粒较大,不能通过半透膜,但能透过滤纸胶体都能产生丁达尔效应,故答案为:B;(2)①胶体和溶液的区别是:胶体具有丁达尔效应,而溶液不具备,可以据此来鉴别二者,故答案为:让一束可见光分别照射两瓶无色液体,可见到一条光亮通路的为淀粉胶体;②淀粉水解生成葡萄糖,胶粒不能透过半透膜,萄糖是小分子,能透过,可用渗析提纯胶体,故答案为:麦芽糖;渗析.
分析:(1)由“纳米技术_??????????????????_径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间;(2)①虽然外观相同的水溶液和胶体有很多性质差异,但用于区别二者最简便可靠的特征性质还是丁达尔现象;②淀粉在淀粉酶的作用下会水解成小分子,可透过半透膜,但酶作为蛋白质留在半透膜袋内.
10.答案:__???1???1_s22s22p63s23p63d104s24p4或[Ar]3d104s24p4;2
(2)平面三角形;sp3杂化
(3)b;b中含有π键,电子云重叠程度更大,使得键长缩短;分子;SeO2形成聚合分子,相对分子量远比SO2大,熔化时需要破坏分子间作用力更大
(4)0.198;5.45
解析:_???1???Se_与O元素同主族,位于第四周期,其元素序号为34,Se元素基态原子的电子排布式为1s22s22p63s23p63d104s4p4或[Ar]3d104s24p4;同一周期中,第一电离能从左至右有增大的趋势,但IIA族与IIIA族、VA族与VIA族反常,第四周期中第一电离能比Se元素大的有As、Br两种元素(氪除外);
?(2)SeO3分子中σ键电子对数为3,孤电子对数为 ,故分子构型为平面三角形; 中σ键电子对数为4,孤电子对数为 ,价层电子对数为4,因此Se原子采取sp3杂化;
(3)①根据结构图_?¤???????O??????_成键特点可知,a为单键,b为双键,因此键长较短的是b;其原因是:b中含有π键,电子云重叠程度更大,使得键长缩短;
②固态SeO3的熔点_????????????é?????_由此可知,固态SeO3为分子晶体;由题可知,SeO2形成聚合分子,相对分子量远比SO2大,熔化时需要破坏分子间作用力更大,因此熔点较SO2高;【版权所有:21教育】
(4)Se2-采取面心立方最密堆积方式,设r(Se2-)=rnm,则 ,解得r≈0.198;一个晶胞中含有Se2-个数为 ,含有Zn2+个数为4,硒化锌晶体的密度 。
分析:对于晶体的密度计算方_????????????è?????_一个晶胞的质量,然后根据晶胞参数计算晶胞的体积,然后利用密度公式计算晶胞密度,其主要易错点在于单位的换算以及晶胞内相关原子个数的计算。
?11.答案: (1)P;P
(2)sp3;或 等
(3)SiCl4、H4SiO4.;BC
(4)SiB6;SiP;;
解析:(1)基_???B?????????1_个单电子,Si有2个单电子,P有3个单电子,则单电子数最多的是P,同周期从左至右,元素的电负性逐渐增大,同主族从上往下电负性逐渐减小,则电负性最大的是P;
? (2)PCl3的中心原子P形成3个σ键电子对,孤电子对数为 ,则价层电子对数为4,则PCl3的中心原子P的杂化类型为sp3;,BCl3共含有24个价电子,与BCl3互为等电子体的阴离子为 或 等;
(3)①由各分子的结构图可知,SiCl4、H4SiO4为正四面体结构,故为非极性分子;
②A. SiCl_4???HSiC_l3O、H4SiO4中Si原子形成4个σ键电子对,无孤电子对,则Si原子采取的杂化类型为sp3;H2SiCl4 O中Si原子形成5个σ键电子对,Si原子采取的杂化类型不是sp3;故Si 的杂化方式并不是一直没有发生变化,故不正确;
B. Si原子最外层有_4????????????è??_形成4对共用电子对,在SiCl4中Si原子与4个Cl原子形成4对共用电子对,Si原子无孤电子对,有空轨道,则H2O 中 O 通过孤对电子与 Si 形成配位键,故正确;
C. 由图可知只涉及了极性共价键的断裂与形成,故正确;
故答案为:BC;
(4)①由图可知,I的一个晶胞中有6个B原子,Si原子个数为 ,则I的化学式为SiB6 , Ⅱ的一个晶胞中有4个P原子,Si原子个数为 ,则Ⅱ的化学式为SiP;
②I的一个晶胞中有6个B原子,1个Si原子,则一个晶胞的质量为 ,则Ⅰ的密度为 ;
③Ⅱ的一个晶胞中有4个P原子,4个Si原子,则Ⅱ的空间占有率为 。
分析:(1)根据核外电子排布即可判断,电负性和非金属性有关
(2)计算出磷原子的价层电子对和孤对电子即可,原子总数相等,价电子总数相等的分子或离子互为等电子体
(3)①找出正负电荷中心重合的结构即可②考查的是配位键的形成和键的断裂和形成
(4)①根据占位计算出晶胞中原子个数即可②根据化学式计算出晶胞的质量,根据ρ=计算③计算出所有原子占据的空间体积之和,再结合晶胞体积即可计算21教育网
?12.答案: (1)3d104s1
(2)平面三角形;3:2
(3)Cl-比O2-半径大,所带电荷数小,CaCl2熔点较低,熔化时消耗能量少
(4)sp2;sp3
(5)18;
解析:(1) Cu原子核外有29个电子,根据洪特规则,基态铜原子的价电子排布式为3d104s1;
? (2)①CaCO3中阴离子是CO32- , 中心C原子的价电子对数是 ,配位原子数是3,无孤电子对,空间构型为平面三角形;
②气体分子M是HC CH,结构式是H-C C-H,σ键与π键的数目之比为3:2;
(3) CaCl2和C_aO?????????O_2-比Cl-半径小、所带电荷数多,CaCl2熔点较低,熔化时消耗能量少,所以工业上电解CaCl2制Ca而不用CaO;
(4)根据图示 ,碳原子形成3个σ键,无孤电子对,碳原子杂化类型是sp2;氮原子形成3个σ键,有1对孤电子对,氮原子杂化类型是sp3;
(5)①根据晶胞c可知,离Ca原子最近且距离相等的Cu原子有18个,Ca的配位数是18;
②根据晶胞图d,晶胞的体积是 ,根据均摊法,1个晶胞中含有Ca原子数 ,Cu原子数是 ;则该钙铜合金的密度是 g/cm3。
分析:(1) Cu原子核外有29个电子,根据洪特规则书写基态铜原子的价电子排布式;
(2) CaC2与水反应生成Ca(OH)2和一种四原子气体分子HC CH。
(3) CaCl2和CaO相比,O2-比Cl-半径小、所带电荷数多;
(4) 根据图示 ,碳原子形成3个σ键,无孤电子对;氮原子形成3个σ键,有1对孤电子对;
(5)①根据晶胞c的结构判断;
②根据晶胞图d,晶胞的体积是 ,根据均摊法,1个晶胞中含有Ca原子数 ,Cu原子数是 。
?13.答案: (1)A;B_DE
???2???_4;6
(3)硅的原子半径大,硅、氧原子间距离较大,p-p 轨道肩并肩重叠程度小,不能形成稳定的π键
(4)降低
解析:(1)_?±????????????????_的化合物为A水晶;原子晶体受热熔化破坏共价键,离子晶体受热熔化破坏离子键,金属晶体受热熔化破坏金属键,分子晶体受热熔化破坏分子间作用力,化学键不发生变化,所以选BDE;
(2)二氧化硅晶体中每个Si原_??????4????°§???_子形成Si—O键,所以1molSiO2含有4molSi—O键;白磷属于分子晶体,白磷分子为正四面体形,4个P原子位于顶点,所以一个分子中有6个P—P键,则1mol白磷含有6molP—P键;【来源:21·世纪·教育·网】
(3)硅的原子半径大,硅、氧原子间距离较大,p-p轨道肩并肩重叠程度小,不能形成稳定的π键;
(4)温度越高,电子具有的能量越高,无规则运动越剧烈,越不容易发生定向移动,电导率降低。
分析:A水晶属于原_????????????B??°_醋酸属于分子晶体;C氧化镁属于离子晶体;D白磷属于分子晶体;E干冰属于分子晶体;F氯化铵属于离子晶体;G铝属于金属晶体;H金刚石属于原子晶体。
_21?????????è?????(www.21cnjy.com)_
高中化学鲁科版(2019)选择性必修2 第3章测试卷
一、单选题
1.下列说法正确的是(??? )
A.?冰和氯化钠融化时克服的作用力均为分子间作用力
B.?某物质在熔融态能导电,则该物质中一定含有离子键
C.?CCl4和CO2两种分子中,每个原子的最外层都具有8电子稳定结构
D.?金刚石、C60都不存在单个小分子
2.熔融时需要破坏共价键的化合物是( ??)
A.?冰??????????????????????????????????B.?石英??????????????????????????????????C.?金刚石??????????????????????????????????D.?氢氧化钠
3.下列晶体中,①冰? ②_???è?±_???è?????_烯(C60)? ④食盐? ⑤白磷?? ⑥冰醋酸? ⑦晶体氩。晶体中除了存在原子与原子间的共价键外,同时也存在范德华力的有(? ) 2·1·c·n·j·y
A.?3种???????????????????????????????????????B.?4种???????????????????????????????????????C.?5种???????????????????????????????????????D.?6种
4.下列有关离子晶体的数据大小比较错误的是( ??)
A.?熔点:NaF>MgF2>AlF3?????????????????????????????? ??????B.?晶格能:NaF>NaCl>NaBr www-2-1-cnjy-com
C.?阴离子的配位数:CsCl>NaCl>CaF2???????????????????D.?硬度:MgO>CaO>BaO 【来源:21cnj*y.co*m】
5.下列说法正确的是( ??)
A.?氯化钠晶体熔_è?????é??è????????_离子键
B.?石英和干冰都属于原子晶体
C.?CH4、CO2中所有原子均满足最外层8 电子稳定结构
D.?KOH和 CaCl2 都是含有共价键的离子化合物【出处:21教育名师】
6.随着工业生产和社会发展对材料性能要求的提高,无机非金属材料成为高技术领域必须材料。下列说法错误的是(?? ) 21*cnjy*com
A.?高纯度的硅可用于制造计算机芯片
B.?用氢氟酸可以生产磨砂玻璃
C.?工业上利用硅的高熔点可以用物理方法制得高纯度硅
D.?碳纳米管表面积大、强度高,可用于生产感应器
7.制备纳米Fe3O4的过程如下:下列有关叙述不合理的是(?? )
A.?纳米Fe3O_4????????¨é?????_溶剂中,当强光照射时,会产生丁达尔现象
B.?反应①的反应类型为消去反应
C.?反应②中,环丙胺的作用可能是促进氯化铁水解
D.?反应③的化学方程式为:6FeOOH+CO═2Fe3 O4+3H2O+CO22-1-c-n-j-y
8.“纳米材料”是粒子直径为1n_m???100n_m的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的分散系①是溶液②是胶体③具有丁达尔现象④不能透过半透膜⑤不能透过滤纸⑥静置后会出现黑色沉淀。其中正确的是(??? )
A.?①④⑥???????????????????????????????B.?②③⑤???????????????????????????????C.?②③④???????????????????????????????D.?①③④⑥
二、综合题
9.根据问题填空:
(1)“纳米材料”是当今材料科_??????????????????_,其研究成果广泛应用于催化及军事科学中.所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 ?????? .
A.能全部透过半透膜
B.有丁达尔效应
C.所得液体呈胶状
D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题.
①鉴别水溶液和胶体可以利用的方法是________.
②60℃左右_????????¨?·????è??_体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应.从半透膜里析出的物质是________,该操作的名称是________.
10.硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1)Se元素基态原子的电子排布式为________;第四周期中第一电离能比Se元素大的共有________种(氪元素除外)。
(2)气态SeO3分子的价层电子对互斥模型为________ ;SeO42-离子中Se原子的杂化方式为 ________ 。
(3)固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。
①图1中Se-O键键长较短的是 ________(填“a"或“b"),其原因是________。
②SeO2熔点为350℃,固态SeO2属于________晶体,其熔点远高于SO2(-75.5℃)的原因是 ________。
(4)硒化锌(ZnSe)是一_?§?é??è???????????_体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= ________nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为________ g.cm-3。
11.B、Si和P 是组成半导体材料的重要元素。回答下列问题
(1)基态B、Si 和P中,单电子数最多的是________,电负性最大的是________。
(2)PCl3中心原子的杂化类型为________,BCl3与阴离子________互为等电子体。
(3)SiCl4 极易与水反应,其反应机理如图。
①上述反应机理涉及的分子中属于非极性分子的是________。(填化学式)
②关于上述反应机理的说法正确的是________。
A. Si 的杂化方式一直没有发生变化
B. H2O 中 O 通过孤对电子与 Si 形成配位键
C.只涉及了极性共价键的断裂与形成
(4)两种含硅化合物的晶胞结构如图所示
???????? I???????????????????????????????????? ?? Ⅱ21·世纪*教育网
①这两种含硅化合物的化学式分别为________和________。
②I的晶胞参数为a pm,则Ⅰ的密度为________ 。
③Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为 pm和 pm,则Ⅱ的空间占有率为________。
12.钙和铜合金可用作电解制钙的阴极电极材料,请回答下列问题:
(1)基态Cu的价电子排布式为________。
(2)CaCO3高_??????è§??????????_CaO。CaO与C在一定条件下可生成CaC2 , CaC2与水反应生成Ca(OH)2和一种四原子气体分子M。
①CaCO3中阴离子的空间构型为________。
②该气体分子M中σ键与π键的数目之比为________。
(3)工业上电解CaCl2制Ca而不用CaO,请从结构角度解释原因________。
(4)在碱性溶液中,_??????è??HN(_CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含肽键的化合物。 21·cn·jy·com
缩二脲分子中碳原子与氮原子的杂化类型分别为________、________。
(5)一种钙_é?????é???????????_可看作图a、b两种原子层交替堆积排列而成c,其晶胞如图d。a图中Ca-Ca间距离为x pm,c图中Ca-Ca间距离距离为ypm。
①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为________。
②设阿伏加德罗常数为NA , 则该钙铜合金的密度是________g/cm3(列出计算表达式)。
13.有下列八种晶体:A__?°????(Si_O2)、B 冰醋酸、C 氧化镁、D 白磷(P4)、E 干冰(CO2)、F氯化铵、G 铝、H 金刚石。回答下列问题:
(1)属于原子晶体的化合物是________(填字母,下同),受热熔化后化学键不发生变化的是________。
(2)1mol SiO2 含有________mol Si—O 键,1mol 白磷(P4)含有________mol P—P 键。
(3)从原子半径大小角度解释,同_????????????_C_ 与 Si,形成 CO2 和 SiO2 时,C、O 原子间 能形成π键,而 Si、O 之间不能的原因________。
(4)升高温度,金属铝的电导率________(填“升高”、“降低”或“不变”)。
答案解析部分
一、单选题
1.答案: C
解析:A.冰是分子晶体,熔化时克服的作用力为分子间作用力,氯化钠是离子晶体,熔化时克服的作用力为离子键,故A不符合题意; 21cnjy.com
B.含有自由移动离子或电子的物质能导电,该物质在熔融状态下能导电,该物质中可能含有离子键,也可能含有自由移动的电子,故B不符合题意;
C.CO2和C原子中的最_?¤??±??????????4_,形成4个共用电子对,所以每个原子的最外层都具有8电子稳定结构,CCl4中每个原子的最外层都具有8电子稳定结构,故C符合题意;
D.C60为分子晶体,存在独立的分子,故D不符合题意。
故答案为:C。
分析:A.离子键和分_???é???????¨????±?_别不同
B.金属单质也能导电,但不具有离子键
C.根据成键的方式即可判断达到八个电子稳定结构
D.金刚石是原子晶体21教育名师原创作品
2.答案: B
解析:A.冰是共价化合物,分子晶体,熔融时只需要克服分子间作用力,不需要破坏化学键,故A不符合题意;
B.石英(SiO2)是共价化合物,属于原子晶体,熔融时需要克服共价键,故B符合题意;
C.金刚石是单质,属于原子晶体,熔融时需要克服共价键,故C不符合题意;
D.氢氧化钠是离子化合物,属于离子晶体,熔融时需要克服离子键,故D不符合题意;
故答案为:B。
分析:原子晶体(共价晶体)融化时需要破坏共价键。
3.答案: B
解析:①冰为水分子形成的晶体,水分子内存在共价键,水分子间存在范德华力,①符合题意;
②石英,为Si、O原子形成的原子晶体,晶体内只存在共价键,②不合题意;
③足球烯(C60),形成分子晶体,C60分子内C原子间形成共价键,C60分子间存在范德华力,③符合题意;
④食盐,形成离子晶体,晶体内只存在离子键,④不合题意;
⑤白磷,形成分子晶体,白磷分子内存在共价键,白磷分子间存在范德华力,⑤符合题意;
⑥冰醋酸,形成分子晶体,CH3COOH分子内存在共价键,醋酸分子间存在范德华力,⑥符合题意;
⑦晶体氩,形成分子晶体,但属于单原子分子,分子内不存在共价键,只存在分子间的范德华力,⑦不合题意;
综合以上分析,只有①③⑤⑥符合题意,
故答案为:B。
分析:晶体中除了存在原子与原子间的共价键外,同时也存在范德华力,此类晶体通常为分子晶体。
4.答案: A
解析:A. 离子半径越小,离子所带电荷越多,离子晶体熔点越高,所以熔点:NaF
C. CsCl、NaCl、Ca_F2???é????????_的配位数分别是8、6、4,所以阴离子的配位数:CsCl>NaCl>CaF2 , 故C不符合题意;
D. 离子半径:Ba2+>Ca2+>Mg2+ , 所以硬度:MgO>CaO>BaO,故D不符合题意。
故答案为:A。
分析:离子半径越小,离子所带电荷越多,离子晶体晶格能越大,熔点越高,硬度越大。
5.答案: A
解析:A. 氯化钠晶体只有离子键,熔融时克服离子键电离出钠离子和氯离子,A符合题意;
B. 石英是原子晶体,干冰是分子晶体,B不符合题意;
C. CH4中H最外层只有一个电子,形成共价键时最外层为2电子稳定结构,C不符合题意;
D. CaCl2 只含有离子键,D不符合题意;
故答案为:A。
分析:B、干冰属于分子晶体
C、H最外层只有2个电子
D、氯化钙只含离子键
6.答案: C
解析:A. 高纯度的硅可用于制造计算机芯片,A不符合题意;
B. 用氢氟酸可以生产磨砂玻璃,B不符合题意;
C. 由SiO2+2C Si+2CO↑反应可以制得粗硅,若要制得高纯度硅,其化学方程式为Si(s)+3HCl(g)=SiHCl3(g)+H2(g),SiHCl3(g)+H2(g) Si(s)+3HCl(g),该过程为化学变化,故C符合题意;
D. 碳纳米管表面积大、强度高,因此可用于生产感应器,D不符合题意;
故答案为:C。
分析_???A.?????????_导体材料,可以用来做太阳能电池板和计算机芯片,而二氧化硅一般做光导纤维
B.氢氟酸能与二氧化硅反应
C.制取高纯硅过程中发生了化学变化,产生了新物质,故不为物理变化
D.生产传感器对表面积和硬度要求比较高,碳纳米管有这个特性21世纪教育网版权所有
7.答案: B
解析:解:A、纳米四氧化三铁分散在适当分散剂中,属于胶体分散系,则具有丁达尔现象,故A正确; B、消去反应是指一定条件下,有机物分子里生成小分子.同时生成不饱和有机物的反应,故反应①不是消去反应,故B错误;
C、因反应②环丙胺不参加反应,但加快反应速率,即加快了氯化铁水解,故C正确;
D、由制备过_?¨????????????????_应③的反应物为FeOOH和CO,由一种生成物为Fe3O4和质量守恒定律可知反应为6FeOOH+CO═2Fe3O4+3H2O+CO2 , 故D正确;
故选B.
分析:A、利用胶体的性质来分析;
B、根据消去反应的定义来分析;
C、根据反应②环丙胺没有参加反应来分析.
D、根据反应③中的反应物与生成物及质量守恒定律来分析.
8.答案: C
解析:纳米碳属于“纳_?±????????????????_子直径为1nm~100nm,当将纳米碳均匀的分散到蒸馏水中,得到的分散系属于胶体;具有丁达尔现象;不能透过半透膜,但是能透过滤纸;⑥静置后不会出现黑色沉淀,故其中正确的是②③④,故答案为C。
分析:本题考查三种分散系的分类标准及胶体的性质,胶体中的分散质微粒能透过滤纸,不能透过半透膜是解题的关键。
二、综合题
9.答案: (1)B
(2)让一束可见光分别照射两瓶无色液体,可见到一条光亮通路的为淀粉胶体;麦芽糖;渗析
解析:解_??????1?????????_中分散质的直径在1nm~100nm之间的属于胶体分散系,由“纳米技术”是指粒子直径在几纳米到几十纳米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,则该混合物属于胶体,所以所得混合物可能具有的性质是胶体的性质,胶体的分散质微粒较大,不能通过半透膜,但能透过滤纸胶体都能产生丁达尔效应,故答案为:B;(2)①胶体和溶液的区别是:胶体具有丁达尔效应,而溶液不具备,可以据此来鉴别二者,故答案为:让一束可见光分别照射两瓶无色液体,可见到一条光亮通路的为淀粉胶体;②淀粉水解生成葡萄糖,胶粒不能透过半透膜,萄糖是小分子,能透过,可用渗析提纯胶体,故答案为:麦芽糖;渗析.
分析:(1)由“纳米技术_??????????????????_径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间;(2)①虽然外观相同的水溶液和胶体有很多性质差异,但用于区别二者最简便可靠的特征性质还是丁达尔现象;②淀粉在淀粉酶的作用下会水解成小分子,可透过半透膜,但酶作为蛋白质留在半透膜袋内.
10.答案:__???1???1_s22s22p63s23p63d104s24p4或[Ar]3d104s24p4;2
(2)平面三角形;sp3杂化
(3)b;b中含有π键,电子云重叠程度更大,使得键长缩短;分子;SeO2形成聚合分子,相对分子量远比SO2大,熔化时需要破坏分子间作用力更大
(4)0.198;5.45
解析:_???1???Se_与O元素同主族,位于第四周期,其元素序号为34,Se元素基态原子的电子排布式为1s22s22p63s23p63d104s4p4或[Ar]3d104s24p4;同一周期中,第一电离能从左至右有增大的趋势,但IIA族与IIIA族、VA族与VIA族反常,第四周期中第一电离能比Se元素大的有As、Br两种元素(氪除外);
?(2)SeO3分子中σ键电子对数为3,孤电子对数为 ,故分子构型为平面三角形; 中σ键电子对数为4,孤电子对数为 ,价层电子对数为4,因此Se原子采取sp3杂化;
(3)①根据结构图_?¤???????O??????_成键特点可知,a为单键,b为双键,因此键长较短的是b;其原因是:b中含有π键,电子云重叠程度更大,使得键长缩短;
②固态SeO3的熔点_????????????é?????_由此可知,固态SeO3为分子晶体;由题可知,SeO2形成聚合分子,相对分子量远比SO2大,熔化时需要破坏分子间作用力更大,因此熔点较SO2高;【版权所有:21教育】
(4)Se2-采取面心立方最密堆积方式,设r(Se2-)=rnm,则 ,解得r≈0.198;一个晶胞中含有Se2-个数为 ,含有Zn2+个数为4,硒化锌晶体的密度 。
分析:对于晶体的密度计算方_????????????è?????_一个晶胞的质量,然后根据晶胞参数计算晶胞的体积,然后利用密度公式计算晶胞密度,其主要易错点在于单位的换算以及晶胞内相关原子个数的计算。
?11.答案: (1)P;P
(2)sp3;或 等
(3)SiCl4、H4SiO4.;BC
(4)SiB6;SiP;;
解析:(1)基_???B?????????1_个单电子,Si有2个单电子,P有3个单电子,则单电子数最多的是P,同周期从左至右,元素的电负性逐渐增大,同主族从上往下电负性逐渐减小,则电负性最大的是P;
? (2)PCl3的中心原子P形成3个σ键电子对,孤电子对数为 ,则价层电子对数为4,则PCl3的中心原子P的杂化类型为sp3;,BCl3共含有24个价电子,与BCl3互为等电子体的阴离子为 或 等;
(3)①由各分子的结构图可知,SiCl4、H4SiO4为正四面体结构,故为非极性分子;
②A. SiCl_4???HSiC_l3O、H4SiO4中Si原子形成4个σ键电子对,无孤电子对,则Si原子采取的杂化类型为sp3;H2SiCl4 O中Si原子形成5个σ键电子对,Si原子采取的杂化类型不是sp3;故Si 的杂化方式并不是一直没有发生变化,故不正确;
B. Si原子最外层有_4????????????è??_形成4对共用电子对,在SiCl4中Si原子与4个Cl原子形成4对共用电子对,Si原子无孤电子对,有空轨道,则H2O 中 O 通过孤对电子与 Si 形成配位键,故正确;
C. 由图可知只涉及了极性共价键的断裂与形成,故正确;
故答案为:BC;
(4)①由图可知,I的一个晶胞中有6个B原子,Si原子个数为 ,则I的化学式为SiB6 , Ⅱ的一个晶胞中有4个P原子,Si原子个数为 ,则Ⅱ的化学式为SiP;
②I的一个晶胞中有6个B原子,1个Si原子,则一个晶胞的质量为 ,则Ⅰ的密度为 ;
③Ⅱ的一个晶胞中有4个P原子,4个Si原子,则Ⅱ的空间占有率为 。
分析:(1)根据核外电子排布即可判断,电负性和非金属性有关
(2)计算出磷原子的价层电子对和孤对电子即可,原子总数相等,价电子总数相等的分子或离子互为等电子体
(3)①找出正负电荷中心重合的结构即可②考查的是配位键的形成和键的断裂和形成
(4)①根据占位计算出晶胞中原子个数即可②根据化学式计算出晶胞的质量,根据ρ=计算③计算出所有原子占据的空间体积之和,再结合晶胞体积即可计算21教育网
?12.答案: (1)3d104s1
(2)平面三角形;3:2
(3)Cl-比O2-半径大,所带电荷数小,CaCl2熔点较低,熔化时消耗能量少
(4)sp2;sp3
(5)18;
解析:(1) Cu原子核外有29个电子,根据洪特规则,基态铜原子的价电子排布式为3d104s1;
? (2)①CaCO3中阴离子是CO32- , 中心C原子的价电子对数是 ,配位原子数是3,无孤电子对,空间构型为平面三角形;
②气体分子M是HC CH,结构式是H-C C-H,σ键与π键的数目之比为3:2;
(3) CaCl2和C_aO?????????O_2-比Cl-半径小、所带电荷数多,CaCl2熔点较低,熔化时消耗能量少,所以工业上电解CaCl2制Ca而不用CaO;
(4)根据图示 ,碳原子形成3个σ键,无孤电子对,碳原子杂化类型是sp2;氮原子形成3个σ键,有1对孤电子对,氮原子杂化类型是sp3;
(5)①根据晶胞c可知,离Ca原子最近且距离相等的Cu原子有18个,Ca的配位数是18;
②根据晶胞图d,晶胞的体积是 ,根据均摊法,1个晶胞中含有Ca原子数 ,Cu原子数是 ;则该钙铜合金的密度是 g/cm3。
分析:(1) Cu原子核外有29个电子,根据洪特规则书写基态铜原子的价电子排布式;
(2) CaC2与水反应生成Ca(OH)2和一种四原子气体分子HC CH。
(3) CaCl2和CaO相比,O2-比Cl-半径小、所带电荷数多;
(4) 根据图示 ,碳原子形成3个σ键,无孤电子对;氮原子形成3个σ键,有1对孤电子对;
(5)①根据晶胞c的结构判断;
②根据晶胞图d,晶胞的体积是 ,根据均摊法,1个晶胞中含有Ca原子数 ,Cu原子数是 。
?13.答案: (1)A;B_DE
???2???_4;6
(3)硅的原子半径大,硅、氧原子间距离较大,p-p 轨道肩并肩重叠程度小,不能形成稳定的π键
(4)降低
解析:(1)_?±????????????????_的化合物为A水晶;原子晶体受热熔化破坏共价键,离子晶体受热熔化破坏离子键,金属晶体受热熔化破坏金属键,分子晶体受热熔化破坏分子间作用力,化学键不发生变化,所以选BDE;
(2)二氧化硅晶体中每个Si原_??????4????°§???_子形成Si—O键,所以1molSiO2含有4molSi—O键;白磷属于分子晶体,白磷分子为正四面体形,4个P原子位于顶点,所以一个分子中有6个P—P键,则1mol白磷含有6molP—P键;【来源:21·世纪·教育·网】
(3)硅的原子半径大,硅、氧原子间距离较大,p-p轨道肩并肩重叠程度小,不能形成稳定的π键;
(4)温度越高,电子具有的能量越高,无规则运动越剧烈,越不容易发生定向移动,电导率降低。
分析:A水晶属于原_????????????B??°_醋酸属于分子晶体;C氧化镁属于离子晶体;D白磷属于分子晶体;E干冰属于分子晶体;F氯化铵属于离子晶体;G铝属于金属晶体;H金刚石属于原子晶体。
_21?????????è?????(www.21cnjy.com)_
