第六单元:碳和碳的氧化物复习(课件25页
图片预览





文档简介
(共25张PPT)
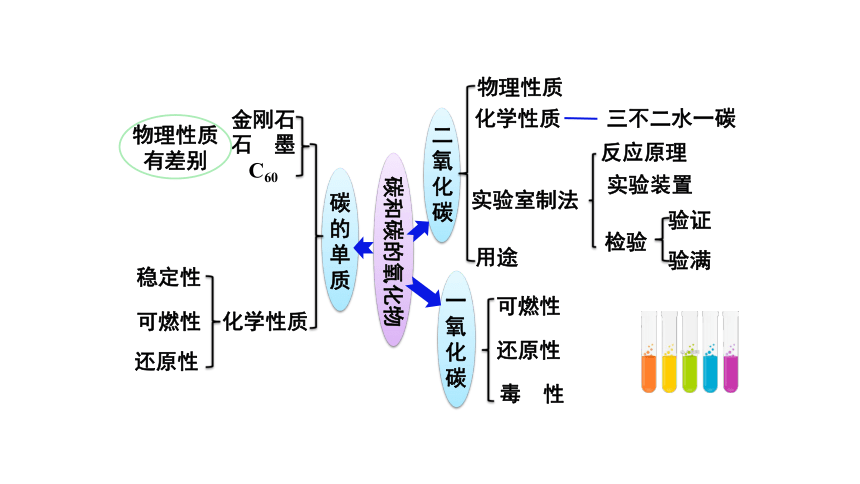
第六单元
碳和碳的氧化物
人教版
九年级上
小结与复习
金刚石
可燃性
C60
稳定性
石
墨
化学性质
碳的单质
二氧化碳
一氧化碳
还原性
可燃性
还原性
用途
检验
实验装置
反应原理
实验室制法
毒
性
化学性质
物理性质
物理性质
有差别
验满
验证
碳和碳的氧化物
三不二水一碳
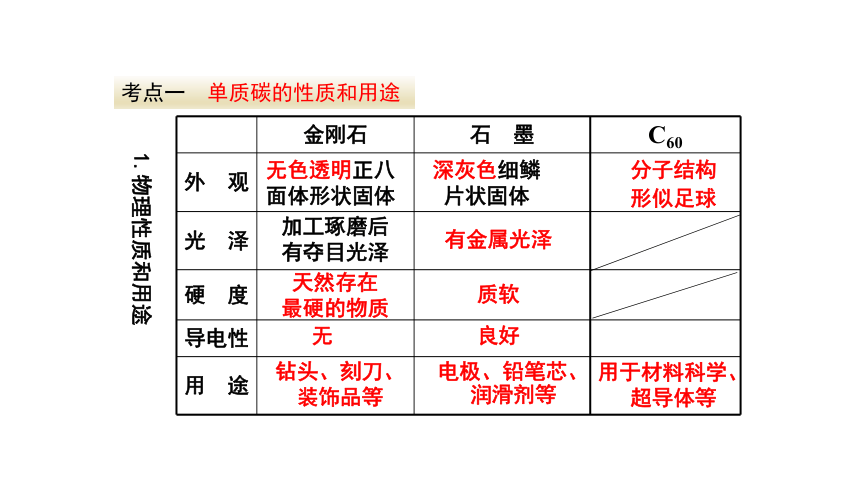
考点一
单质碳的性质和用途
金刚石
石
墨
C60
外
观
光
泽
硬
度
导电性
用
途
无色透明正八面体形状固体
深灰色细鳞片状固体
加工琢磨后
有夺目光泽
有金属光泽
天然存在
最硬的物质
质软
无
良好
电极、铅笔芯、润滑剂等
钻头、刻刀、
装饰品等
分子结构
形似足球
用于材料科学、超导体等
1.物理性质和用途
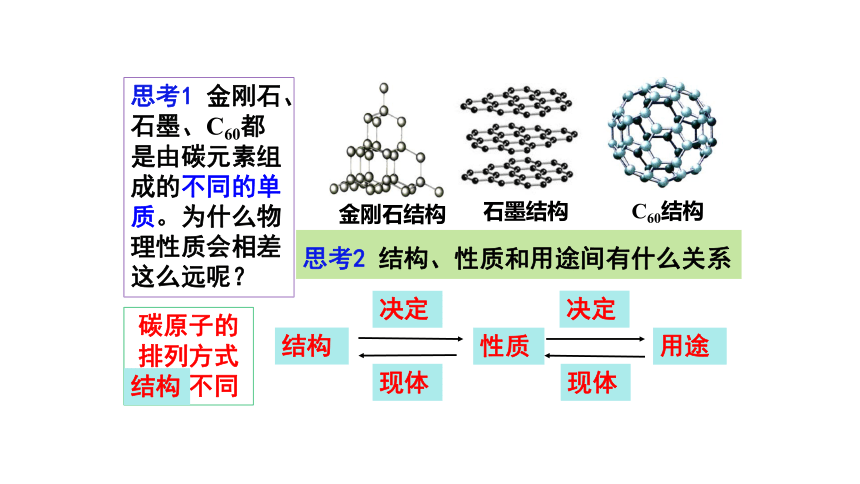
思考1
金刚石、石墨、C60都是由碳元素组成的不同的单质。为什么物理性质会相差这么远呢?
碳原子的排列方式结构不同
金刚石结构
石墨结构
C60结构
结构
决定
性质
决定
用途
现体
现体
思考2
结构、性质和用途间有什么关系
结构
2.单质碳的化学性质
碳的各种单质虽然物理性质差别很大,但都具有相同
的化学性质,这是因为它们都是由________构成的。
碳原子
(1)碳的单质在常温下化学性质__________。
不活泼
(2)可燃性
C+O2
CO2
点燃
2C+O2
2CO
点燃
(3)还原性
C+2CuO
===
2Cu+CO2↑
高温
C+
CO2
===
2CO
高温
(氧气充足)
(氧气不足)
什么是还原性?
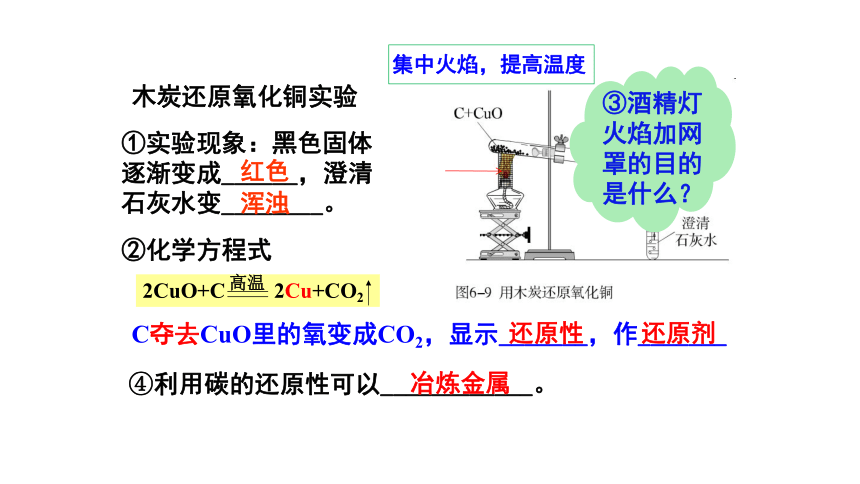
集中火焰,提高温度
木炭还原氧化铜实验
①实验现象:黑色固体
逐渐变成______,澄清
石灰水变________。
红色
浑浊
2CuO+C
2Cu+CO2
高温
②化学方程式
C夺去CuO里的氧变成CO2,显示_______,作_______
还原性
还原剂
③酒精灯火焰加网罩的目的是什么?
④利用碳的还原性可以____________。
冶炼金属
【练习1】(湖北宜昌中考)下列有关碳单质的说法错误的是(
)
A.金刚石是天然存在最硬的物质
B.石墨和C60是由不同种原子构成
C.金刚石和石墨的化学性质相似
D.活性炭包可放在冰箱中除异味
B
【练习2】化学上把同种元素组成的不同单质互称为同素异形体,例如白磷和红磷。下列各组物质互为同素异形体的是
(
)
A.一氧化碳和二氧化碳
B.金刚石和石墨
C.冰和干冰
D.氧气和液氧
B
【练习3】
A
考点二
碳的氧化物
项目
二氧化碳
一氧化碳
1.物
理
性
质
状
态
通常状况下,____色____味的气体,在加压和降温的情况下,二氧化碳会变成固体______。
____色____味的气体。
密度
比空气______
比空气______
溶
解
性
_________,在1体积水里约溶解1体积二氧化碳。
难溶于水
能溶于水
无
无
干冰
无
无
大
略小
2.CO2的化学性质:
三不二水一碳
不能燃烧不支持燃烧不能供给呼吸。
②二水
CO2
+H2O
H2CO3
CO2能使澄清石灰水变浑浊。这
个反应常用于检验CO2的存在。
CO2通入紫色石蕊溶液,使之变红色。
C+
CO2
===
2CO
高温
③一碳
主要用途
灭火、人工降雨、气体肥料、化工原料
①三不
CO2
+Ca(OH)2
CaCO3
↓+
H2O
3.CO的化学性质:
①可燃性
2CO+O2
2CO2
点燃
如何预防CO重点?一旦发生煤气泄漏,应该怎么做?
注意:点燃一氧化碳前应做什么?
气体燃料
②还原性
CO+CuO
Cu+CO2
△
Fe2O3+3CO
2Fe+3CO2
高温
冶炼金属
③毒性
一氧化碳跟血液中的血红蛋白的结合能力比氧气强,使人体缺少氧气而窒息,甚至死亡。
验纯
【例1】
D
解题思路:CO2的化学性质主要就是三不二水一碳;CO2的物理性质主要考察密度和溶解性。通常情况下,CO2的密度比空气大。本题选D。
【例2】(山西中考)分析下列化学反应,所得结论不正确的是(
)
2CO+O2
2CO2
点燃
C+O2
CO2
点燃
2C+O2
2CO
点燃
A.反应物相同,参加反应的物质的量不同,生成物不同
B.碳、一氧化碳和天然气都可做燃料
C.上述反应都是化合反应,且生成物都是氧化物
D.C→CO→CO2的转化都只能通过与O2的反应来实现
解题思路:准确把握C、CO、CO2的化学性质和用途是解题的关键。C、CO都具有可燃性和还原性,CO转化为CO2还可以通过还原反应来实现。本题选D。
D
【例3】
要除去二氧化碳中混有的一氧化碳,可把混合气体通过( )
A.水
B.灼热的氧化铜
C.澄清石灰水
D.炽热的炭层
解题思路:
一氧化碳不能溶于水,而二氧化碳能溶于水;把混合气体通过澄清石灰水,一氧化碳不与氢氧化钙发生反应,而二氧化碳与氢氧化钙发生反应而被除去;通过炽热的炭层,一氧化碳不与碳反应,二氧化碳却与碳反应生成一氧化碳而被除去。本题选B
B
考点三
实验室制取气体的思路
1.实验室制取气体的思路
(1)发生装置:由_______________________决定。
通常有______________和________________。
(2)收集方法:由气体的_______________决定。
难溶于水的气体可用__________收集。
密度比空气大的气体,可用________________收集;
密度比空气小的气体,可用________________收集。
固体加热型
固液常温型
反应物状态及反应条件
密度及溶解性
排水法
向上排空气法
向下排空气法
2.二氧化碳的实验室制法
(1)实验药品:___________________________。
(2)实验原理:__________________________________。
石灰石(或大理石)
、稀盐酸
CaCO3+2HCl===CaCl2+H2O+CO2↑
制取少
量CO2
制取较
多CO2
控制反
应速率
控制反应的发生和停止
(3)实验装置
CO2
CO2
(4)装置气密性的检查
A装置:_______________;B、C、D装置:_________
(5)验满:将________木条放在集气瓶________,若火焰_____,则说明二氧化碳已经集满。
燃着的
口
熄灭
(6)检验:将气体通入澄清石灰水中,若澄清石灰水________,则证明该气体是二氧化碳。
3.二氧化碳的工业制法
工业上利用高温煅烧石灰石的方法制取二氧化碳,化学方程式为_________________________________。
CaCO3
CaO+CO2↑
----
变浑浊
高温
手捂升温法
注水法
【例4】根据如图所示实验装置图,回答有关问题。
(1)写出图中标有序号的仪器名称:①__________,②________。
(2)实验室用大理石与稀盐酸反应制取二氧化碳,反应的化学方程式为____________________________________,制取二氧化碳最好选用的发生装置是____,该装置与另一个可选用的装置相比,其主要优点是____________________________。
酒精灯
长颈漏斗
CaCO3+2HCl===CaCl2+H2O+CO2↑
C
可以控制反应的发生和停止
G
(3)装入药品前应进行的操作是
________________。
检查装置的气密性
(4)请写出一种检验收集的气体为二氧化碳的方法______________________________________________________
;若将收集到的二氧化碳气体倒入如图G所示的烧杯中,烧杯中的气球(内部为空气)将________(填“上升”或“保持不动”)。
将收集到的
气体通入澄清石灰水中,若石灰水变浑浊,则气体是二氧化碳
上升
⑸用装置C制取气体,在反应过程中,用弹簧夹夹住导气管上的橡皮管,过一会儿反应就会停止。其原因是
。
气压增大,使稀盐酸与大理石脱离接触
(6)若利用装置A加热高锰酸钾制取氧气,还需要进行的改进是_______________________。
在试管口塞上一团棉花
考点四
自然界中的CO2循环及温室效应
(3)防治:使用清洁能源,倡导“低碳”生活。
二氧化碳
变暖
融化
1.自然界中的CO2循环
2.温室效应
(1)概念:大气中的____________就像温室的玻璃或塑料薄膜一样,既能让太阳光透过,又能使地面吸收的太阳光的热量不易向外散失,从而使全球变暖。
(2)危害:全球气候______,两极冰川______,海平面升高,淹没部分沿海城市,使土地沙漠化,农业减产等。
【练习4】按题意从O2、N2、H2、CO2、CO中选择适宜的化学式,填入下列横线上
(1)有剧毒的气体:_____;
(2)使带火星的木条复燃的气体:_____;
(3)能在空气中燃烧的体:
;
(4)空气中含量最多的气体:_______;
(5)能使澄清石灰水变浑浊的气体:_____;
(6)密度最小的是
;
(7)既有可燃性又有还原性的气体化合物是_____;
(8)只能用向上排空气法收集的是_________。
CO
O2
H2、
CO
N2
CO2
H2
CO
CO2
8、
H2CO3
=
CO2
↑
+
H2O
4、2CO+O2=2CO2
点燃
7、CO2
+
H2O
=
H2CO3
9、CO2
+Ca(OH)2
=
CaCO3↓+
H2O
10、CaCO3+2HCl=CaCl2+H2O+CO2↑
1、2C
+
O2
=
2CO
点燃
2、C
+
O2
=
CO2
点燃
6、C
+
CO2
=
2CO
高温
3、C+2CuO
=
2
Cu
+CO2
↑
高温
5、CO+
CuO=
Cu+
CO2
加热
11、CaCO3
=CaO+CO2↑
高温
本单元化学方程式
1.由同种元素组成的物质不一定是单质。
2.二氧化碳通入紫色石蕊溶液中使紫色石蕊溶液变红,是因为有碳酸生成,易误认为是二氧化碳本身使紫色石蕊溶液变红。
3.二氧化碳的过多排放会导致温室效应,易误认为二氧化碳是空气污染物。
4.二氧化碳不供给呼吸,易被学生误认为有毒。
5.二氧化碳的溶解性是能溶于水而不是“易”溶于水;一氧化碳的毒性是一氧化碳的化学性质而不是物理性质。
易错点归纳
https://www.21cnjy.com/help/help_extract.php
第六单元
碳和碳的氧化物
人教版
九年级上
小结与复习
金刚石
可燃性
C60
稳定性
石
墨
化学性质
碳的单质
二氧化碳
一氧化碳
还原性
可燃性
还原性
用途
检验
实验装置
反应原理
实验室制法
毒
性
化学性质
物理性质
物理性质
有差别
验满
验证
碳和碳的氧化物
三不二水一碳
考点一
单质碳的性质和用途
金刚石
石
墨
C60
外
观
光
泽
硬
度
导电性
用
途
无色透明正八面体形状固体
深灰色细鳞片状固体
加工琢磨后
有夺目光泽
有金属光泽
天然存在
最硬的物质
质软
无
良好
电极、铅笔芯、润滑剂等
钻头、刻刀、
装饰品等
分子结构
形似足球
用于材料科学、超导体等
1.物理性质和用途
思考1
金刚石、石墨、C60都是由碳元素组成的不同的单质。为什么物理性质会相差这么远呢?
碳原子的排列方式结构不同
金刚石结构
石墨结构
C60结构
结构
决定
性质
决定
用途
现体
现体
思考2
结构、性质和用途间有什么关系
结构
2.单质碳的化学性质
碳的各种单质虽然物理性质差别很大,但都具有相同
的化学性质,这是因为它们都是由________构成的。
碳原子
(1)碳的单质在常温下化学性质__________。
不活泼
(2)可燃性
C+O2
CO2
点燃
2C+O2
2CO
点燃
(3)还原性
C+2CuO
===
2Cu+CO2↑
高温
C+
CO2
===
2CO
高温
(氧气充足)
(氧气不足)
什么是还原性?
集中火焰,提高温度
木炭还原氧化铜实验
①实验现象:黑色固体
逐渐变成______,澄清
石灰水变________。
红色
浑浊
2CuO+C
2Cu+CO2
高温
②化学方程式
C夺去CuO里的氧变成CO2,显示_______,作_______
还原性
还原剂
③酒精灯火焰加网罩的目的是什么?
④利用碳的还原性可以____________。
冶炼金属
【练习1】(湖北宜昌中考)下列有关碳单质的说法错误的是(
)
A.金刚石是天然存在最硬的物质
B.石墨和C60是由不同种原子构成
C.金刚石和石墨的化学性质相似
D.活性炭包可放在冰箱中除异味
B
【练习2】化学上把同种元素组成的不同单质互称为同素异形体,例如白磷和红磷。下列各组物质互为同素异形体的是
(
)
A.一氧化碳和二氧化碳
B.金刚石和石墨
C.冰和干冰
D.氧气和液氧
B
【练习3】
A
考点二
碳的氧化物
项目
二氧化碳
一氧化碳
1.物
理
性
质
状
态
通常状况下,____色____味的气体,在加压和降温的情况下,二氧化碳会变成固体______。
____色____味的气体。
密度
比空气______
比空气______
溶
解
性
_________,在1体积水里约溶解1体积二氧化碳。
难溶于水
能溶于水
无
无
干冰
无
无
大
略小
2.CO2的化学性质:
三不二水一碳
不能燃烧不支持燃烧不能供给呼吸。
②二水
CO2
+H2O
H2CO3
CO2能使澄清石灰水变浑浊。这
个反应常用于检验CO2的存在。
CO2通入紫色石蕊溶液,使之变红色。
C+
CO2
===
2CO
高温
③一碳
主要用途
灭火、人工降雨、气体肥料、化工原料
①三不
CO2
+Ca(OH)2
CaCO3
↓+
H2O
3.CO的化学性质:
①可燃性
2CO+O2
2CO2
点燃
如何预防CO重点?一旦发生煤气泄漏,应该怎么做?
注意:点燃一氧化碳前应做什么?
气体燃料
②还原性
CO+CuO
Cu+CO2
△
Fe2O3+3CO
2Fe+3CO2
高温
冶炼金属
③毒性
一氧化碳跟血液中的血红蛋白的结合能力比氧气强,使人体缺少氧气而窒息,甚至死亡。
验纯
【例1】
D
解题思路:CO2的化学性质主要就是三不二水一碳;CO2的物理性质主要考察密度和溶解性。通常情况下,CO2的密度比空气大。本题选D。
【例2】(山西中考)分析下列化学反应,所得结论不正确的是(
)
2CO+O2
2CO2
点燃
C+O2
CO2
点燃
2C+O2
2CO
点燃
A.反应物相同,参加反应的物质的量不同,生成物不同
B.碳、一氧化碳和天然气都可做燃料
C.上述反应都是化合反应,且生成物都是氧化物
D.C→CO→CO2的转化都只能通过与O2的反应来实现
解题思路:准确把握C、CO、CO2的化学性质和用途是解题的关键。C、CO都具有可燃性和还原性,CO转化为CO2还可以通过还原反应来实现。本题选D。
D
【例3】
要除去二氧化碳中混有的一氧化碳,可把混合气体通过( )
A.水
B.灼热的氧化铜
C.澄清石灰水
D.炽热的炭层
解题思路:
一氧化碳不能溶于水,而二氧化碳能溶于水;把混合气体通过澄清石灰水,一氧化碳不与氢氧化钙发生反应,而二氧化碳与氢氧化钙发生反应而被除去;通过炽热的炭层,一氧化碳不与碳反应,二氧化碳却与碳反应生成一氧化碳而被除去。本题选B
B
考点三
实验室制取气体的思路
1.实验室制取气体的思路
(1)发生装置:由_______________________决定。
通常有______________和________________。
(2)收集方法:由气体的_______________决定。
难溶于水的气体可用__________收集。
密度比空气大的气体,可用________________收集;
密度比空气小的气体,可用________________收集。
固体加热型
固液常温型
反应物状态及反应条件
密度及溶解性
排水法
向上排空气法
向下排空气法
2.二氧化碳的实验室制法
(1)实验药品:___________________________。
(2)实验原理:__________________________________。
石灰石(或大理石)
、稀盐酸
CaCO3+2HCl===CaCl2+H2O+CO2↑
制取少
量CO2
制取较
多CO2
控制反
应速率
控制反应的发生和停止
(3)实验装置
CO2
CO2
(4)装置气密性的检查
A装置:_______________;B、C、D装置:_________
(5)验满:将________木条放在集气瓶________,若火焰_____,则说明二氧化碳已经集满。
燃着的
口
熄灭
(6)检验:将气体通入澄清石灰水中,若澄清石灰水________,则证明该气体是二氧化碳。
3.二氧化碳的工业制法
工业上利用高温煅烧石灰石的方法制取二氧化碳,化学方程式为_________________________________。
CaCO3
CaO+CO2↑
----
变浑浊
高温
手捂升温法
注水法
【例4】根据如图所示实验装置图,回答有关问题。
(1)写出图中标有序号的仪器名称:①__________,②________。
(2)实验室用大理石与稀盐酸反应制取二氧化碳,反应的化学方程式为____________________________________,制取二氧化碳最好选用的发生装置是____,该装置与另一个可选用的装置相比,其主要优点是____________________________。
酒精灯
长颈漏斗
CaCO3+2HCl===CaCl2+H2O+CO2↑
C
可以控制反应的发生和停止
G
(3)装入药品前应进行的操作是
________________。
检查装置的气密性
(4)请写出一种检验收集的气体为二氧化碳的方法______________________________________________________
;若将收集到的二氧化碳气体倒入如图G所示的烧杯中,烧杯中的气球(内部为空气)将________(填“上升”或“保持不动”)。
将收集到的
气体通入澄清石灰水中,若石灰水变浑浊,则气体是二氧化碳
上升
⑸用装置C制取气体,在反应过程中,用弹簧夹夹住导气管上的橡皮管,过一会儿反应就会停止。其原因是
。
气压增大,使稀盐酸与大理石脱离接触
(6)若利用装置A加热高锰酸钾制取氧气,还需要进行的改进是_______________________。
在试管口塞上一团棉花
考点四
自然界中的CO2循环及温室效应
(3)防治:使用清洁能源,倡导“低碳”生活。
二氧化碳
变暖
融化
1.自然界中的CO2循环
2.温室效应
(1)概念:大气中的____________就像温室的玻璃或塑料薄膜一样,既能让太阳光透过,又能使地面吸收的太阳光的热量不易向外散失,从而使全球变暖。
(2)危害:全球气候______,两极冰川______,海平面升高,淹没部分沿海城市,使土地沙漠化,农业减产等。
【练习4】按题意从O2、N2、H2、CO2、CO中选择适宜的化学式,填入下列横线上
(1)有剧毒的气体:_____;
(2)使带火星的木条复燃的气体:_____;
(3)能在空气中燃烧的体:
;
(4)空气中含量最多的气体:_______;
(5)能使澄清石灰水变浑浊的气体:_____;
(6)密度最小的是
;
(7)既有可燃性又有还原性的气体化合物是_____;
(8)只能用向上排空气法收集的是_________。
CO
O2
H2、
CO
N2
CO2
H2
CO
CO2
8、
H2CO3
=
CO2
↑
+
H2O
4、2CO+O2=2CO2
点燃
7、CO2
+
H2O
=
H2CO3
9、CO2
+Ca(OH)2
=
CaCO3↓+
H2O
10、CaCO3+2HCl=CaCl2+H2O+CO2↑
1、2C
+
O2
=
2CO
点燃
2、C
+
O2
=
CO2
点燃
6、C
+
CO2
=
2CO
高温
3、C+2CuO
=
2
Cu
+CO2
↑
高温
5、CO+
CuO=
Cu+
CO2
加热
11、CaCO3
=CaO+CO2↑
高温
本单元化学方程式
1.由同种元素组成的物质不一定是单质。
2.二氧化碳通入紫色石蕊溶液中使紫色石蕊溶液变红,是因为有碳酸生成,易误认为是二氧化碳本身使紫色石蕊溶液变红。
3.二氧化碳的过多排放会导致温室效应,易误认为二氧化碳是空气污染物。
4.二氧化碳不供给呼吸,易被学生误认为有毒。
5.二氧化碳的溶解性是能溶于水而不是“易”溶于水;一氧化碳的毒性是一氧化碳的化学性质而不是物理性质。
易错点归纳
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
