化学:2.1 脂肪烃课件 (人教版选修5)(临清实高)
文档属性
| 名称 | 化学:2.1 脂肪烃课件 (人教版选修5)(临清实高) |

|
|
| 格式 | zip | ||
| 文件大小 | 162.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-07 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
第二章 烃和卤代烃
第一节 脂肪烃
编制人:郝恩杰
审稿人:周延英
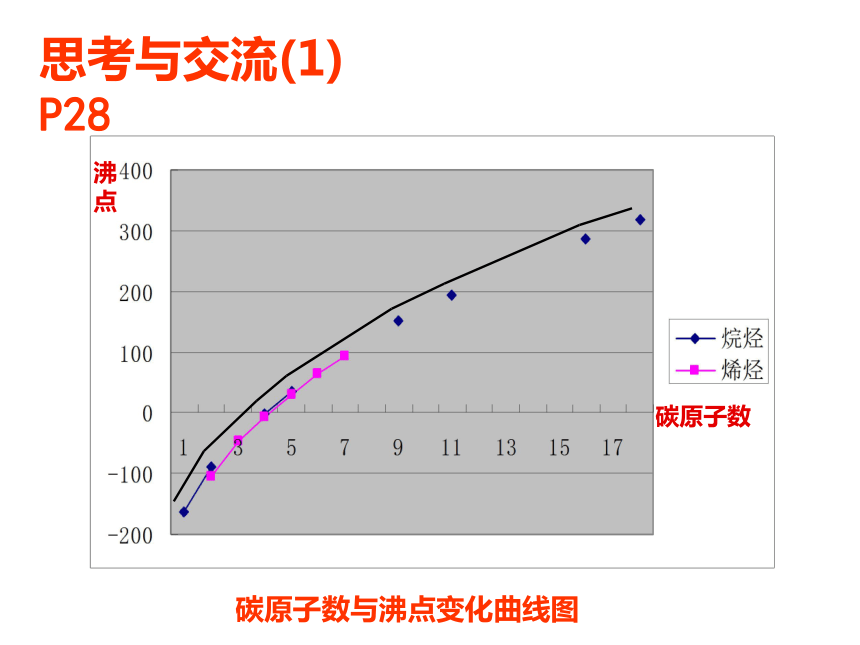
探究一:烷烃、烯烃的熔、沸点
阅读p28思考和交流(1)
沸点
碳原子数
碳原子数与沸点变化曲线图
思考与交流(1) P28
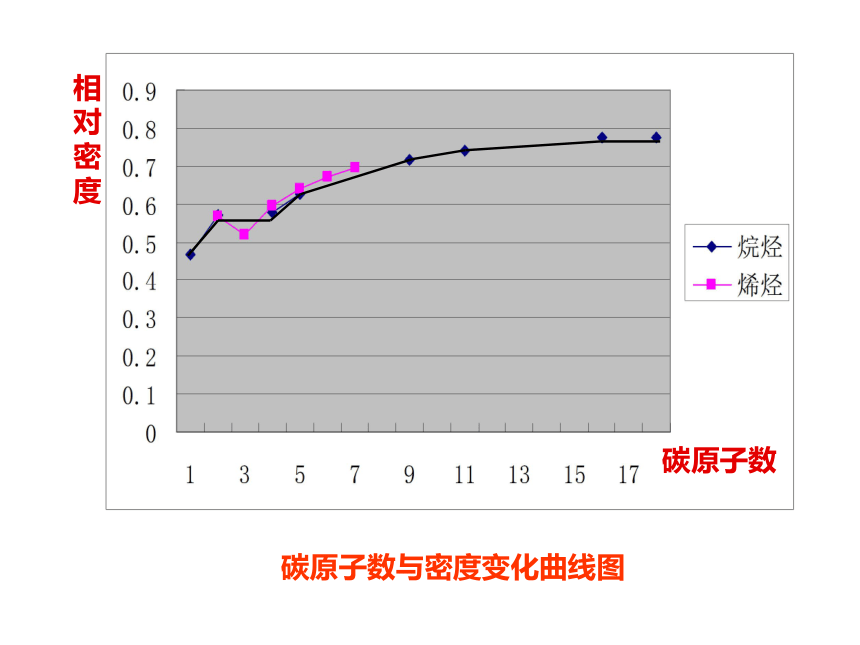
碳原子数与密度变化曲线图
碳原子数
相对密度
物理性质归纳:
烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈现规律性的变化,沸点逐渐 ,相对密度逐渐 ,常温下的存在状态,也由 。 分子里碳原子数等于或小于 的烃,在常温常压下是气体,其他烃在常温常压下都是液体或固体;
升高
增大
气态逐渐过渡到液态、固态
4
探究二:烷烃和烯烃化学性质
P29思考与交流(2)
(1)CH3CH3+Cl2 CH3CH2Cl+HCl
光
(2)CH2==CH2+Br2 CH2BrCH2Br
(3)CH2==CH2+H2O CH3CH2OH
催化剂
加压、加热
(4) nCH2==CH2
催化剂
CH2 CH2
[
]
n
取代反应:有机物分子中某些原子或原子团被其它原子或原子团所代替的反应。
聚合反应:通过加成反应聚合成高分子化合物的反应(加成聚合反应)。
加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
思考和交流
P30学与问
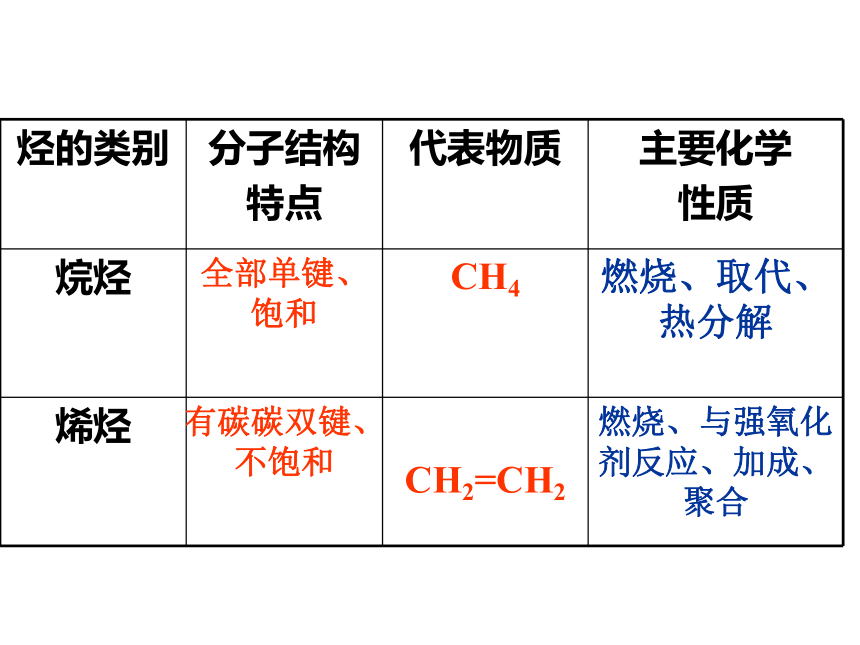
烃的类别 分子结构
特点 代表物质 主要化学
性质
烷烃 全部单键、饱和 CH4 燃烧、取代、热分解
烯烃 有碳碳双键、不饱和
CH2=CH2 燃烧、与强氧化剂反应、加成、聚合
1、烷烃组成、结构和化学性质
CnH2n+2
1)全部单键、饱和
2)烷烃的化学性质:
通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
1 、氧化反应
燃烧: CH4 + 2O2 CO2 + 2H2O
燃烧
2 、取代反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
3 、热分解----裂解
C4H10 C2H4+C2H6
△
C4H10 CH4+C3H6
△
(应用于石油的催化裂化)
2、烯烃
1)通式:CnH2n(n≥2 )
2)乙烯分子的结构
碳碳键以双键存在, 2C和4H在同一平面上。
3)烯烃的化学性质:
(1)加成反应 (与H2、Br2、HX、H2O等):
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
CH2==CH2+Br2 CH2BrCH2Br
使溴水褪色
(2)氧化反应:
①燃烧:
火焰明亮,冒黑烟。
②与酸性KMnO4的作用:
使KMnO4溶液褪色
(3)聚合反应:
nCH2==CH2
催化剂
CH2 CH2
[
]
n
探究三: 烯烃的顺反异构
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
思考题:下列物质中没有顺反异构的是哪些?
1、 1,2-二氯乙烯
2、 1,2-二氯丙烯
3、 2-甲基-2-丁烯
4、 2-氯-2-丁烯
练习1
下列哪些物质存在顺反异构?
(A)1,2-二氯丙烯 (B) 2-丁烯
(C) 丙烯 (D) 1-丁烯
形成顺反异构的条件:
1.具有碳碳双键
2.组成双键的每个碳原子必须连接
两个不同的原子或原子团.
AB
CH3 C=CH2
CH3
异丁烯
(2)
H3C CH3 H3C H
C=C C=C
H H H CH3
顺-2-丁烯 反-2-丁烯
(3) (4)
CH2=CH-CH2-CH3
1-丁烯
(1)
练习:写出丁烯属于烯烃的同分异构体。
烯烃的同分
异构现象
碳链异构
位置异构
官能团异构
顺反异构
3、乙炔
1、指分子中含有-C≡C-的不饱和烃
空间结构特点
三、炔烃:
C2H2
直线型
2、链状单炔烃的通式:CnH2n-2(n≥2)
1)
思考:在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构。请问在炔烃分子中是否也存在顺反异构?
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
a. 氧化反应
(1) 在空气或在氧气中燃烧—完全氧化
2C2H2 + 5O2 4CO2 + 2H2O
点燃
2)乙炔的化学性质:
在空气中的爆炸极限为2.5%~80%
(2)被氧化剂氧化:
可使酸性高锰酸钾褪色
b、加成反应
(比乙烯与溴的反应慢)
应用:用于鉴别乙炔和乙烯气体!
CH2≡CH2 + 2Br2 → CHBr2CHBr2
【练习】
对照乙炔的性质,写出有关1-丁炔的燃烧以及与溴水的反应
2CH≡CCH2CH3+11O2→8CO2+6H2O
CH≡CCH2CH3+Br2→CHBr=CBrCH2CH3
点燃
为避免反应速率过快,用饱和食盐水代替水!!
2)乙炔的实验室制法:
实验装置: P.32图2-6
注意事项:
a、怎样除去杂质气体?
原理:CaC2+2H2O Ca(OH)2+C2H2↑
将气体通过装有CuSO4溶液的洗气瓶
反思总结:
对比烷烃烯烃炔烃的结构和性质
烷烃 烯烃 炔烃
通式
结构特点
代表物
与溴(CCl4)
与酸性高锰酸钾
主要反应类型
烷烃 烯烃 炔烃
通式 CnH2n+2 (n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
结构特点 碳碳之间仅含单键 有碳碳双键 有碳碳三键
代表物 甲烷 乙烯 乙炔
主要化学性质 与溴(CCl4) 不 褪色 褪色 褪色
与高锰酸钾(H2SO4) 不褪色 褪色 褪色
主要反应类型 取代反应 氧化 加成 加聚 氧化 加成
第二章 烃和卤代烃
第一节 脂肪烃
编制人:郝恩杰
审稿人:周延英
探究一:烷烃、烯烃的熔、沸点
阅读p28思考和交流(1)
沸点
碳原子数
碳原子数与沸点变化曲线图
思考与交流(1) P28
碳原子数与密度变化曲线图
碳原子数
相对密度
物理性质归纳:
烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈现规律性的变化,沸点逐渐 ,相对密度逐渐 ,常温下的存在状态,也由 。 分子里碳原子数等于或小于 的烃,在常温常压下是气体,其他烃在常温常压下都是液体或固体;
升高
增大
气态逐渐过渡到液态、固态
4
探究二:烷烃和烯烃化学性质
P29思考与交流(2)
(1)CH3CH3+Cl2 CH3CH2Cl+HCl
光
(2)CH2==CH2+Br2 CH2BrCH2Br
(3)CH2==CH2+H2O CH3CH2OH
催化剂
加压、加热
(4) nCH2==CH2
催化剂
CH2 CH2
[
]
n
取代反应:有机物分子中某些原子或原子团被其它原子或原子团所代替的反应。
聚合反应:通过加成反应聚合成高分子化合物的反应(加成聚合反应)。
加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
思考和交流
P30学与问
烃的类别 分子结构
特点 代表物质 主要化学
性质
烷烃 全部单键、饱和 CH4 燃烧、取代、热分解
烯烃 有碳碳双键、不饱和
CH2=CH2 燃烧、与强氧化剂反应、加成、聚合
1、烷烃组成、结构和化学性质
CnH2n+2
1)全部单键、饱和
2)烷烃的化学性质:
通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
1 、氧化反应
燃烧: CH4 + 2O2 CO2 + 2H2O
燃烧
2 、取代反应
C
H
4
C
H
3
C
l
C
H
2
C
l
2
C
H
C
l
3
C
C
l
4
C
l
2
C
l
2
C
l
2
C
l
2
3 、热分解----裂解
C4H10 C2H4+C2H6
△
C4H10 CH4+C3H6
△
(应用于石油的催化裂化)
2、烯烃
1)通式:CnH2n(n≥2 )
2)乙烯分子的结构
碳碳键以双键存在, 2C和4H在同一平面上。
3)烯烃的化学性质:
(1)加成反应 (与H2、Br2、HX、H2O等):
CH3-CH=CH2 + H2 CH3CH2CH3
催化剂
CH2==CH2+Br2 CH2BrCH2Br
使溴水褪色
(2)氧化反应:
①燃烧:
火焰明亮,冒黑烟。
②与酸性KMnO4的作用:
使KMnO4溶液褪色
(3)聚合反应:
nCH2==CH2
催化剂
CH2 CH2
[
]
n
探究三: 烯烃的顺反异构
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
思考题:下列物质中没有顺反异构的是哪些?
1、 1,2-二氯乙烯
2、 1,2-二氯丙烯
3、 2-甲基-2-丁烯
4、 2-氯-2-丁烯
练习1
下列哪些物质存在顺反异构?
(A)1,2-二氯丙烯 (B) 2-丁烯
(C) 丙烯 (D) 1-丁烯
形成顺反异构的条件:
1.具有碳碳双键
2.组成双键的每个碳原子必须连接
两个不同的原子或原子团.
AB
CH3 C=CH2
CH3
异丁烯
(2)
H3C CH3 H3C H
C=C C=C
H H H CH3
顺-2-丁烯 反-2-丁烯
(3) (4)
CH2=CH-CH2-CH3
1-丁烯
(1)
练习:写出丁烯属于烯烃的同分异构体。
烯烃的同分
异构现象
碳链异构
位置异构
官能团异构
顺反异构
3、乙炔
1、指分子中含有-C≡C-的不饱和烃
空间结构特点
三、炔烃:
C2H2
直线型
2、链状单炔烃的通式:CnH2n-2(n≥2)
1)
思考:在烯烃分子中如果双键碳上连接了两个不同的原子或原子团,将可以出现顺反异构。请问在炔烃分子中是否也存在顺反异构?
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
a. 氧化反应
(1) 在空气或在氧气中燃烧—完全氧化
2C2H2 + 5O2 4CO2 + 2H2O
点燃
2)乙炔的化学性质:
在空气中的爆炸极限为2.5%~80%
(2)被氧化剂氧化:
可使酸性高锰酸钾褪色
b、加成反应
(比乙烯与溴的反应慢)
应用:用于鉴别乙炔和乙烯气体!
CH2≡CH2 + 2Br2 → CHBr2CHBr2
【练习】
对照乙炔的性质,写出有关1-丁炔的燃烧以及与溴水的反应
2CH≡CCH2CH3+11O2→8CO2+6H2O
CH≡CCH2CH3+Br2→CHBr=CBrCH2CH3
点燃
为避免反应速率过快,用饱和食盐水代替水!!
2)乙炔的实验室制法:
实验装置: P.32图2-6
注意事项:
a、怎样除去杂质气体?
原理:CaC2+2H2O Ca(OH)2+C2H2↑
将气体通过装有CuSO4溶液的洗气瓶
反思总结:
对比烷烃烯烃炔烃的结构和性质
烷烃 烯烃 炔烃
通式
结构特点
代表物
与溴(CCl4)
与酸性高锰酸钾
主要反应类型
烷烃 烯烃 炔烃
通式 CnH2n+2 (n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
结构特点 碳碳之间仅含单键 有碳碳双键 有碳碳三键
代表物 甲烷 乙烯 乙炔
主要化学性质 与溴(CCl4) 不 褪色 褪色 褪色
与高锰酸钾(H2SO4) 不褪色 褪色 褪色
主要反应类型 取代反应 氧化 加成 加聚 氧化 加成
