化学:3.2 醛 课件 (人教版选修5)(临清实高)
文档属性
| 名称 | 化学:3.2 醛 课件 (人教版选修5)(临清实高) |

|
|
| 格式 | zip | ||
| 文件大小 | 137.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-07 00:00:00 | ||
图片预览



文档简介
(共21张PPT)
高二化学选修5 第三章 烃的含氧衍生物
授课者:张磊
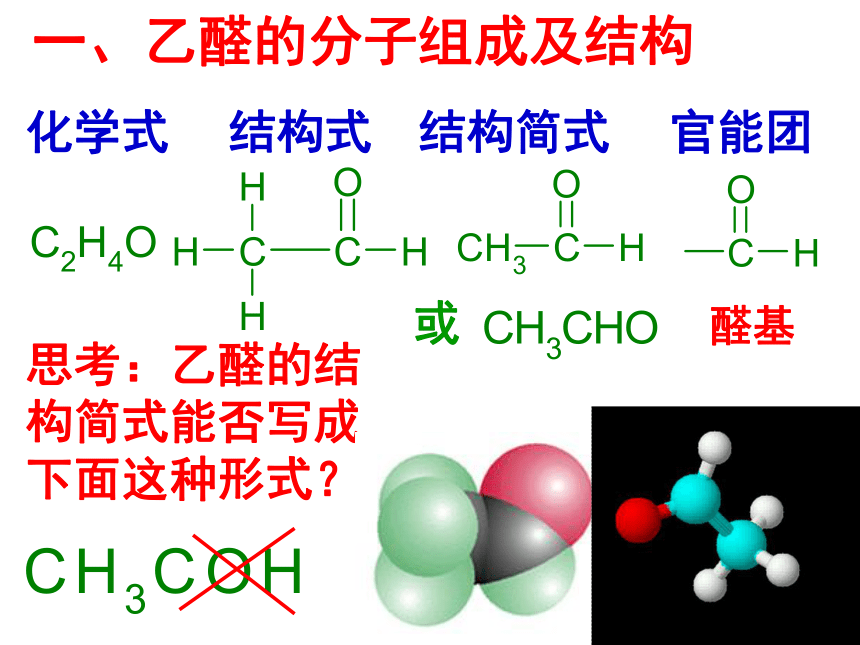
一、乙醛的分子组成及结构
化学式
结构式
结构简式
官能团
思考:乙醛的结构简式能否写成下面这种形式?
或
醛基
1、色、态、味:
无色、有刺激性气味的液体,密度比水小
2、溶解性:
能与水、乙醇、乙醚、氯仿等互溶
3、沸点:
20.8℃,易挥发
二、乙醛的物理性质
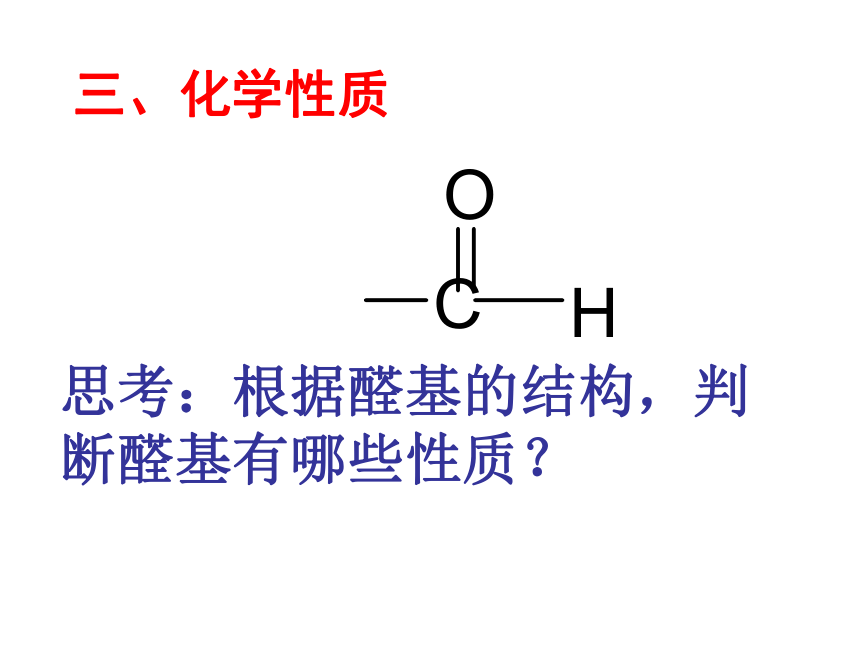
思考:根据醛基的结构,判断醛基有哪些性质?
三、化学性质
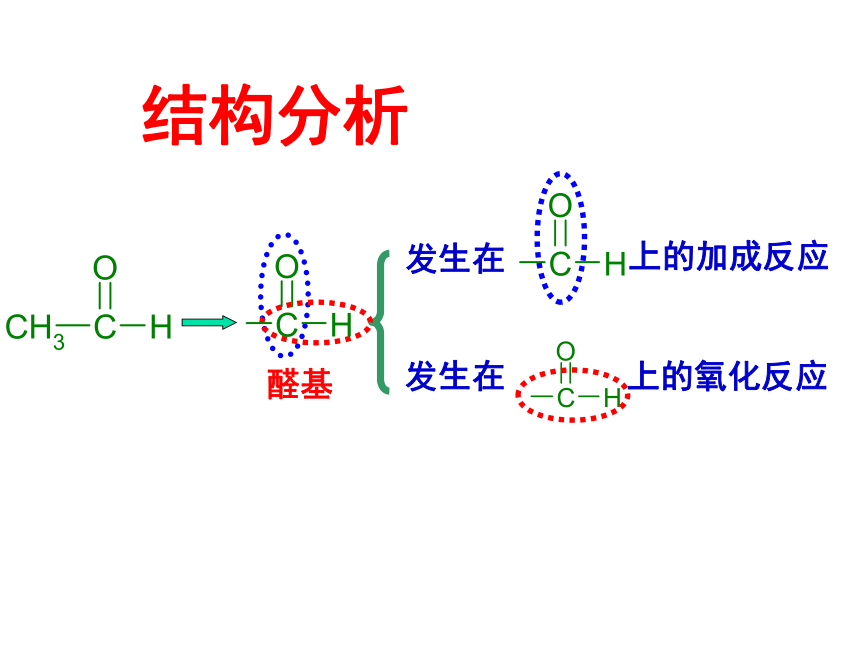
结构分析
上的氧化反应
发生在
上的加成反应
发生在
醛基
(1)乙醛的加成反应
+ H2
Ni
△
H H
H—C—C=O
H
H H
H—C—C—OH
H H
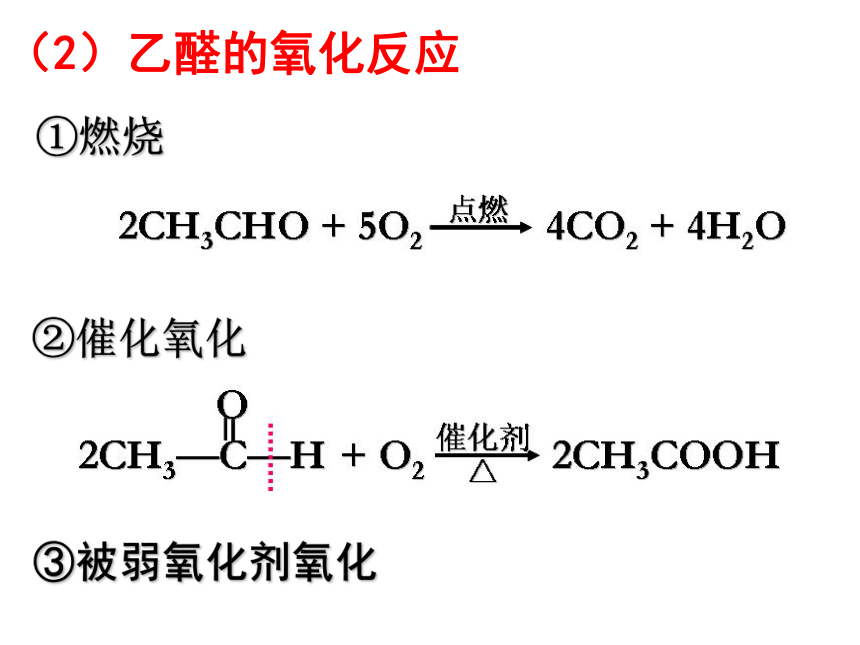
①燃烧
②催化氧化
(2)乙醛的氧化反应
③被弱氧化剂氧化
[实验] 银镜反应
:取一洁净试管,加入1ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
:在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
Ag++NH3·H2O→AgOH +NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
1、配制银氨溶液
2、水浴加热生成银镜
还原剂
氧化剂
(1)试管内壁必须洁净;如有油污,得不到光亮的银镜而是黑色沉淀。
(2)必须水浴;
(3)加热时不可振荡和摇动试管;
(4)配制银氨溶液时,氨水不能过量,否则生成易爆炸的物质(银氨溶液随配随用,不可久置。)
注意:
说明:
a.生成物,一水、二银、三氨、乙酸铵
b.1mol醛基 ~ 2mol Ag
应用:
a.检验醛基的存在
b.工业上利用此原理制镜和保温瓶胆
[实验]及注意点
1、配制新制的Cu(OH)2悬浊液:在2ml10%NaOH溶液中滴入2%CuSO4溶液4~6滴,振荡。
Cu2++2OH-= Cu(OH)2
2、乙醛的氧化:在上述蓝色浊液中加入0.5ml乙醛溶液,
碱必须过量
加热至沸腾。
Cu2O
砖红色
乙醛和新制的氢氧化铜反应
氧化剂
还原剂
说明:
1mol醛基 ~1mol Cu2O
应用:
a.检验醛基的存在
b. 医院里,利用这一反应原理检查尿糖是否正常(检查葡萄糖的醛基)
与酸性高锰酸钾和溴水反应
乙醛能使高锰酸钾溶液褪色和溴水褪色。
④被强氧化剂氧化
1.概念:
分子里由烃基和醛基相连而构成的化合物
2.通式:
或 RCHO
饱和一元醛:
CnH2nO
3.醛类的化学通性(与乙醛的相似)
四、醛类
醛类能与氢气发生加成反应;与银氨溶液、新制的Cu(OH)2悬浊液发生氧化反应;能使酸性高锰酸钾溶液及溴水褪色。
1、甲醛的分子组成及结构
2、甲醛的物理性质及用途
或
又叫蚁醛,无色、具有强烈刺激性气味的气体,35%—40%的甲醛溶液,叫福尔马林,具有防腐能力
甲醛是重要的有机合成原料,主要用于制酚醛树脂;另外还可用作农药、肥料、浸制生物标本等。
3、甲醛的化学性质(与乙醛的相似)
甲醛
注意甲醛的室内污染
思考:甲醛被催化氧化后的产物是否为甲酸?
写出下列转变的化学方程式:
HCHO + 4Ag(NH3)2OH → CO2 + 4Ag↓+3H2O + 8NH3
△
HCHO + 4Cu(OH)2 → CO2 + 2Cu2O + 5H2O
△
高二化学选修5 第三章 烃的含氧衍生物
授课者:张磊
一、乙醛的分子组成及结构
化学式
结构式
结构简式
官能团
思考:乙醛的结构简式能否写成下面这种形式?
或
醛基
1、色、态、味:
无色、有刺激性气味的液体,密度比水小
2、溶解性:
能与水、乙醇、乙醚、氯仿等互溶
3、沸点:
20.8℃,易挥发
二、乙醛的物理性质
思考:根据醛基的结构,判断醛基有哪些性质?
三、化学性质
结构分析
上的氧化反应
发生在
上的加成反应
发生在
醛基
(1)乙醛的加成反应
+ H2
Ni
△
H H
H—C—C=O
H
H H
H—C—C—OH
H H
①燃烧
②催化氧化
(2)乙醛的氧化反应
③被弱氧化剂氧化
[实验] 银镜反应
:取一洁净试管,加入1ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
:在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
Ag++NH3·H2O→AgOH +NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
1、配制银氨溶液
2、水浴加热生成银镜
还原剂
氧化剂
(1)试管内壁必须洁净;如有油污,得不到光亮的银镜而是黑色沉淀。
(2)必须水浴;
(3)加热时不可振荡和摇动试管;
(4)配制银氨溶液时,氨水不能过量,否则生成易爆炸的物质(银氨溶液随配随用,不可久置。)
注意:
说明:
a.生成物,一水、二银、三氨、乙酸铵
b.1mol醛基 ~ 2mol Ag
应用:
a.检验醛基的存在
b.工业上利用此原理制镜和保温瓶胆
[实验]及注意点
1、配制新制的Cu(OH)2悬浊液:在2ml10%NaOH溶液中滴入2%CuSO4溶液4~6滴,振荡。
Cu2++2OH-= Cu(OH)2
2、乙醛的氧化:在上述蓝色浊液中加入0.5ml乙醛溶液,
碱必须过量
加热至沸腾。
Cu2O
砖红色
乙醛和新制的氢氧化铜反应
氧化剂
还原剂
说明:
1mol醛基 ~1mol Cu2O
应用:
a.检验醛基的存在
b. 医院里,利用这一反应原理检查尿糖是否正常(检查葡萄糖的醛基)
与酸性高锰酸钾和溴水反应
乙醛能使高锰酸钾溶液褪色和溴水褪色。
④被强氧化剂氧化
1.概念:
分子里由烃基和醛基相连而构成的化合物
2.通式:
或 RCHO
饱和一元醛:
CnH2nO
3.醛类的化学通性(与乙醛的相似)
四、醛类
醛类能与氢气发生加成反应;与银氨溶液、新制的Cu(OH)2悬浊液发生氧化反应;能使酸性高锰酸钾溶液及溴水褪色。
1、甲醛的分子组成及结构
2、甲醛的物理性质及用途
或
又叫蚁醛,无色、具有强烈刺激性气味的气体,35%—40%的甲醛溶液,叫福尔马林,具有防腐能力
甲醛是重要的有机合成原料,主要用于制酚醛树脂;另外还可用作农药、肥料、浸制生物标本等。
3、甲醛的化学性质(与乙醛的相似)
甲醛
注意甲醛的室内污染
思考:甲醛被催化氧化后的产物是否为甲酸?
写出下列转变的化学方程式:
HCHO + 4Ag(NH3)2OH → CO2 + 4Ag↓+3H2O + 8NH3
△
HCHO + 4Cu(OH)2 → CO2 + 2Cu2O + 5H2O
△
