专题1 物质构成的奥秘
图片预览


文档简介
专题1 物质构成的奥秘
课时1 物质的微粒构成
【学习要求】:
1、认识物质的微粒性,知道原子、分子、离子都是构成物质的微粒。
2、能用微粒的观点解释某些常见的现象。
3、知道原子是由原子核和核外电子构成的。
4、知道原子可以结合成分子、同一元素的原子和离子可以相互转化,初步认识核外电子在化学反应中的作用。
【教学过程】
活动一:认识物质的微粒性
1、 请将下列物质按构成不同分成三组,并说说具体的分组理由:
金刚石、水、氢气、氯化钠、氦气、氢氧化钠
第一组 ;第二组 ;第三组 。
学生回答,教师评价,引导总结。
设计意图:题目要求按构成不同分组,这就要求学生回顾:微观上物质是由什么构成的?构成物质的微粒有哪些?这些物质分别由什么微粒构成?没有简单地将这几个问题直接呈现给学生,就是为了让学生通过对题目的思考、分析自主地去回忆,检测、加深对物质的微观构成的认识。同时,也为第2题的知识总结做一铺垫。
过渡:分别由分子、原子、离子构成的物质你还知道哪一些?
多媒体出示思考题2:
2、 试着总结:分别由分子、原子、离子构成的物质各有哪些类别。
由分子构成的物质
由原子构成的物质
由离子构成的物质
学生讨论回答,教师点拨评价引导总结。
设计意图:在总复习之前,学生仅对极少数物质的构成微粒有了解,通过该题,扩大物质的范围,帮助学生发展物质的微粒观,提升对物质的微观构成的认识。
活动二:学会微粒的表示方法
过渡:物质都是由微粒构成的,你会用符号表示微粒吗?
多媒体出示思考题3:
3、请写出第1题中,构成各物质的微粒的符号.
金刚石 水 氢气 氯化钠
氦气 氢氧化钠
学生书写符号,一生板演。师生共同评价。
教师再提出问题:想一想,怎样表示分子、原子、离子?
学生思考回答。教师评价,强调离子符号的书写方法和注意问题以及与表示化合价的不同。
反馈练习:用符号表示:
①铁锈的主要成分 ②三个氯原子
③五个氧分子 ④一个氢原子
⑤一个氨分子 ⑥铁离子 ⑦两个铵根离子
⑧人体中含量最多的元素 ⑨空气中含量最多的气体
⑩氧化镁中镁的化合价是+2
设计意图:进一步建立微观粒子与化学符号的联系,提高掌握运用化学用语的能力。
活动三:用微粒的观点解释某些常见的现象
过渡:物质是由微粒构成的,你能用微粒的观点解释以下物质的变化吗?
多媒体出示思考题4:
3、 请用分子、原子的观点解释下列现象:
① 酒精灯使用完毕要随时盖好灯帽。
② 体温表中的水银柱随温度升高而升高,随温度下降而下降。
③ 过滤时,水可以透过滤纸。
④ 用过氧化氢制得的氧气与空气中的氧气都可助燃。
学生思考回答,教师评价。生总结粒子的性质。
设计意图:回顾分子原子的性质,并能利用分子原子的性质,从微观上解释一些生活中的现象。
活动四、学会区分分子、原子、离子
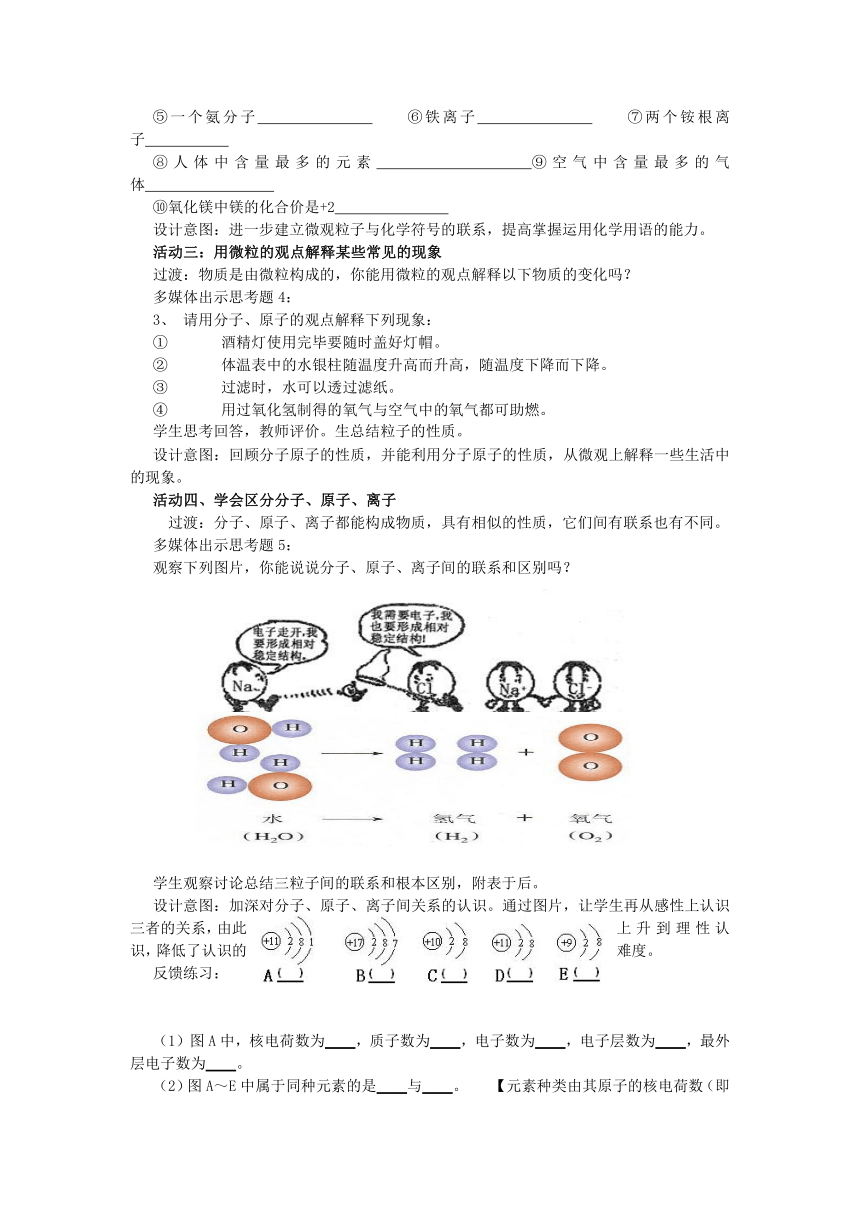
过渡:分子、原子、离子都能构成物质,具有相似的性质,它们间有联系也有不同。
多媒体出示思考题5:
观察下列图片,你能说说分子、原子、离子间的联系和区别吗?
学生观察讨论总结三粒子间的联系和根本区别,附表于后。
设计意图:加深对分子、原子、离子间关系的认识。通过图片,让学生再从感性上认识三者的关系,由此上升到理性认识,降低了认识的难度。
反馈练习:
(1)图A中,核电荷数为____,质子数为____,电子数为____,电子层数为____,最外层电子数为____。
(2)图A~E中属于同种元素的是____与____。 【元素种类由其原子的核电荷数(即质子数)决定】
(3)微粒化学性质相似的是____、____ 和____。 【元素化学性质与其原子的最外层电子数密切相关】
(4)属于原子的是____、____和____; 【核内质子数 = 核外电子数 原 子】
属于阳离子的是____; 【核内质子数 > 核外电子数 阳离子】
属于阴离子的是____。 【核内质子数 < 核外电子数 阴离子】
(5)化学反应中易失去电子的是___,易得到电子的是___,化学性质相对稳定的有___________。
【课堂小结】:
问题:构成物质的粒子:分子、原子、离子。什么是分子、原子、离子?这些微粒间有什么联系?
【变式反馈】
1.下列有关分子、原子、离子说法正确的是( )
A.分子是化学变化中最小的粒子
B.一切原子的原子核都是由质子、中子构成的
C.分子的质量总比原子质量大
D.分子、原子、离子都能直接构成物质
答案:D
2.(2009哈尔滨)农作物的种子经过发酵、蒸馏制得的乙醇被称为“绿色汽油”。乙醇的分子结构如图所示。则下列叙述正确的是( )
A.乙醇分子是由3种元素组成的有机物
B.一个乙醇分子中含有28个质子
C.乙醇中碳、氧元素的质量比为3︰2
D.乙醇中氧元素的质量分数最大
【解析】C 根据乙醇的分子结构图示,可知乙醇的化学式是C2H5OH,其分子是由三种原子构成,一个乙醇分子中含有的质子数是6×2+1×6+8=26,乙醇中质量分数最大的是碳元素。
3.下表呈现的是部分元素的原子结构示意图、主要化合价等信息。
下列叙述错误的是( )
A.铝原子结构示意图的最外层有3个电子
B.元素的正化合价数一定等于原子的最外层电子数
C.核电荷数分别为8和14的元素,组成化合物的化学式为SiO2
D.同一周期中,原子的核外电子层数相同,最外层电子数从左向右逐渐增多
【解析】B根据表中给出的正化合价数和原子的最外层电子数可以看出,它们的数值不一定相同。
4.用分子的相关知识解释下列生活中的现象,其中错误的是( )
A.热胀冷缩,说明分子的大小随温度升降而改娈
B.“酒香不怕巷子深”,说明分子在不停地运动
C.10mL酒精和10mL水混合后,体积小于20mL,说明分子间有空隙
D.湿衣服在夏天比冬天容易晾干,说明分子的运动速率随温度升高而加快
【解析】A 热胀冷缩是由于分子之间的间隔发生变化造成的,并非是分子大小发生变化。
5.春暖花开季节,滨河路边常闻到怡人的紫丁花香味 ,这一现象说明( )
A.分子在不停地运动 B.分子分裂成原子
C.分子很大 D.分子之间有间隔
【解析】A 由于分子在不停的运动着,所以人们可以闻到紫丁花的香味。
6.下列关于分子和原子的说法不正确的是( )
A.分子在化学反应前后种类和数目保持不变 B.分子在不停地运动
C.原子可以直接构成物质 D.原子是化学变化中的最小粒子
【解析】C 化学变化前后分子的种类一定会发生改变,其数目可能改变。
7.结构示意图所表示的粒子是( )
A.原子 B.分子 C. 阴离子 D.阳离子
【解析】C 由结构示意图可以看出,该粒子的核内是17个质子,而核外是18个电子,因此是阴离子。
8.下列原子结构示意图中,表示带两个单位正电荷的离子的是( )
A. B. C. D.
【解析】B 带两个单位的正电荷,则该微粒的核内质子数比核外电子数多两个。符合这一特点的只有B。
9.某粒子的结构示意图为,有关该粒子的说法错误的是( )
A.核内有14个质子 B.表示阴离子
C.核外有3个电子层 D.最外层电子数为4
【解析】B 由结构示意图可以看出,该粒子的核内质子数与核外电子数相等,因此是原子。
10.分析钠原子、钠离子的结构示意图得到的以下说法中,错误的是( )
A.钠原子有三个电子层,钠离子有两个电子层
B.钠原子、钠离子的质子数都为11
C.一个钠原子在化学反应中可失去一个电子,因此,钠元素为+1价
D.钠原子和钠离子不属于同一种元素
【解析】D 钠原子和钠离子的核内质子数相同,所以他们属于同种元素。
11.下列四种粒子的结构示意图中,说法正确的是( )
① ② ③ ④
A.它们表示四种不同的元素 B.②表示的元素在化合物中通常显+2价
C.①③④表示的元素都是非金属元素 D.①④表示的是阳离子
【解析】B 由结构示意图可以看出,②④的核电荷数相同,属于同种元素,故四种粒子的结构示意图表示的元素只有三种。①表示微粒属于氧元素,②③④表示的元素均属于金属元素。①表示的离子是氧离子,属于阴离子,④表示的离子是镁离子,属于阳离子。
12.参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是( )
A.铜 B.干冰 C.氯化钠 D.金刚石
【解析】C铜由铜原子直接构成,干冰是由二氧化碳分子构成,金刚石是由碳原子构成,只有氯化钠是由钠离子和氯离子构成。
13.下列说法中错误的是( )
A、所有的原子核都由质子和中子构成 B、铅笔芯里含有石墨
C、氢氧化钠固体可以干燥氧气 D、分子、原子都在不断地运动着
【解析】A有的原子核内没有中子,如氢原子的核内没有中子。
14.以下四位同学对分子和原子的认识正确的是( )
A. 分子运动而原子不运动 B. 分子可分而原子不可分
C. 分子构成物质而原子不能构成物质 D. 原子由原子核和核外电子构成
【解析】D分子和原子都在不停地运动着。在化学变化中分子可分,原子不可分。分子和原子都能构成物质,如铁就是由铁原子直接构成的。
15.用数字和化学符号表示:2个氧原子 ,3个钠离子 。
(2)镁的原子结构示意图为,Mg原子在化学反应中容易 (填“得到”或“失去”)2个电子。
【答案】(1)2O 3Na+ (2)失去
16.根据给出的原子结构示意图,回答下列问题:
He Mg Ca
(1)Mg和Ca的化学性质都比较 (填“活泼”或“不活泼”);镁离子的符号为 。(2)He的化学性质 (填“活泼”或“不活泼”);由此可知,最外层电子数相同时,化学性质 (填“一定”或“不一定”)相似。
【解析】镁和钙原子的最外层电子数都是2,属于不稳定结构,化学性质都比较活泼,容易失去电子,镁离子的符号是Mg2+。氦原子的核外只有一层电子,且有2个电子,属于稳定结构,化学性质不活泼,可见,最外层电子数相同时,化学性质不一定相似。
【答案】(1)活泼 Mg2+ (2)不活泼 不一定
【能力激活】
17.(1)某粒子的结构示意图为,若表示原子,则X 10;
若表示阴离子,则X l0(选填“>”、“=”或“<”)
(2)在四种粒子的结构示意图中,共表示了 种元素的粒子。
【解析】⑴根据结构示意图可以判断,当该粒子是原子时,x=2+8=10,当表示阴离子时,核外电子数要比核内质子数多,即x<10。⑵判断元素的种类是看核内质子数,质子数相同,则属于同种元素,故四种粒子结构示意图中,共表示了三种元素。
【答案】⑴ = < ⑵ 三
18.右图是锂原子的构成示意图,根据图示信息回答下列问题:
(1)锂元素的原子序数为 ,元素符号为 。
(2)锂原子的结构示意图为 (填字母)。
(3)锂元素与氧元素形成的化合物的化学式为 。
(4)下列对原子构成的理解错误的是 (填字母)。
A.原子整体不显电性 B.原子核比原子小得多
C.原子核是不可分割的实心球体 D.原子质量主要集中在原子核上
【解析】⑴根据锂原子的核内有三个质子,故其原子序数是3,符号式Li;⑵锂的核外电子数等于核内质子数,故其原子结构示意图是;⑶锂的最外层电子数是1,故锂元素的化合价是+1,氧元素通常显-2价,它与氧元素形成化合物的化学式是Li2O。⑷由图示可以看出,原子核并不是不可分割的实心球体,它是由带正电荷的质子和不带电的中子构成。
【答案】(1)3 Li (2)D (3)Li2O (4)C
附:分子、原子、离子的区别与联系
分 子 原 子 离 子
区别 概 念 保持物质 性质的 微粒 是化学变化中的 微粒 带电的 或
化学变化中是否可分 在化学变化中 分,变化前后种类和数目可能发生变化。 在化学变化中 分,变化前后种类和数目不发生变化。 在化学变化中单原子离子一般不可分,但原子团构成的离子可能分割成其它离子、原子或分子。
是否独立存在 能独立存在,构成物质并保持物质的化学性质不变。 有些能独立存在,并直接构成物质,且能保持物质的化学性质不变。 阴阳离子共同构成物质。
构 成 同种原子或不同种原子构成。 一般有 、 和核外电子三种微粒构成。 由原子得失电子形成,原子得电子带 电荷成为 离子,原子失去电子带 电荷,成为 离子。
所显电性情况 电性 电性 阴离子:带 电荷阳离子:带 电荷
表 示方 法 用 表示 用 或原子结构示意图表示。 分别以阴、阳离子符号或离子结构示意图表示。
联系 在化学反应中的表现 在化学反应中原分子破裂 在化学反应中得失电子分子 原子 离子 在化学反应中重新组合成新分子 在化学反应中得失电子
基 本 属 性 体积 ,质量 ,都是在不断 的,微粒之间有 。同种微粒 相同,不同种微粒性质不同。
+8
2
8
2
8
2
+12
2
8
+11
2
8
+12
A. B. C. D.
课时1 物质的微粒构成
【学习要求】:
1、认识物质的微粒性,知道原子、分子、离子都是构成物质的微粒。
2、能用微粒的观点解释某些常见的现象。
3、知道原子是由原子核和核外电子构成的。
4、知道原子可以结合成分子、同一元素的原子和离子可以相互转化,初步认识核外电子在化学反应中的作用。
【教学过程】
活动一:认识物质的微粒性
1、 请将下列物质按构成不同分成三组,并说说具体的分组理由:
金刚石、水、氢气、氯化钠、氦气、氢氧化钠
第一组 ;第二组 ;第三组 。
学生回答,教师评价,引导总结。
设计意图:题目要求按构成不同分组,这就要求学生回顾:微观上物质是由什么构成的?构成物质的微粒有哪些?这些物质分别由什么微粒构成?没有简单地将这几个问题直接呈现给学生,就是为了让学生通过对题目的思考、分析自主地去回忆,检测、加深对物质的微观构成的认识。同时,也为第2题的知识总结做一铺垫。
过渡:分别由分子、原子、离子构成的物质你还知道哪一些?
多媒体出示思考题2:
2、 试着总结:分别由分子、原子、离子构成的物质各有哪些类别。
由分子构成的物质
由原子构成的物质
由离子构成的物质
学生讨论回答,教师点拨评价引导总结。
设计意图:在总复习之前,学生仅对极少数物质的构成微粒有了解,通过该题,扩大物质的范围,帮助学生发展物质的微粒观,提升对物质的微观构成的认识。
活动二:学会微粒的表示方法
过渡:物质都是由微粒构成的,你会用符号表示微粒吗?
多媒体出示思考题3:
3、请写出第1题中,构成各物质的微粒的符号.
金刚石 水 氢气 氯化钠
氦气 氢氧化钠
学生书写符号,一生板演。师生共同评价。
教师再提出问题:想一想,怎样表示分子、原子、离子?
学生思考回答。教师评价,强调离子符号的书写方法和注意问题以及与表示化合价的不同。
反馈练习:用符号表示:
①铁锈的主要成分 ②三个氯原子
③五个氧分子 ④一个氢原子
⑤一个氨分子 ⑥铁离子 ⑦两个铵根离子
⑧人体中含量最多的元素 ⑨空气中含量最多的气体
⑩氧化镁中镁的化合价是+2
设计意图:进一步建立微观粒子与化学符号的联系,提高掌握运用化学用语的能力。
活动三:用微粒的观点解释某些常见的现象
过渡:物质是由微粒构成的,你能用微粒的观点解释以下物质的变化吗?
多媒体出示思考题4:
3、 请用分子、原子的观点解释下列现象:
① 酒精灯使用完毕要随时盖好灯帽。
② 体温表中的水银柱随温度升高而升高,随温度下降而下降。
③ 过滤时,水可以透过滤纸。
④ 用过氧化氢制得的氧气与空气中的氧气都可助燃。
学生思考回答,教师评价。生总结粒子的性质。
设计意图:回顾分子原子的性质,并能利用分子原子的性质,从微观上解释一些生活中的现象。
活动四、学会区分分子、原子、离子
过渡:分子、原子、离子都能构成物质,具有相似的性质,它们间有联系也有不同。
多媒体出示思考题5:
观察下列图片,你能说说分子、原子、离子间的联系和区别吗?
学生观察讨论总结三粒子间的联系和根本区别,附表于后。
设计意图:加深对分子、原子、离子间关系的认识。通过图片,让学生再从感性上认识三者的关系,由此上升到理性认识,降低了认识的难度。
反馈练习:
(1)图A中,核电荷数为____,质子数为____,电子数为____,电子层数为____,最外层电子数为____。
(2)图A~E中属于同种元素的是____与____。 【元素种类由其原子的核电荷数(即质子数)决定】
(3)微粒化学性质相似的是____、____ 和____。 【元素化学性质与其原子的最外层电子数密切相关】
(4)属于原子的是____、____和____; 【核内质子数 = 核外电子数 原 子】
属于阳离子的是____; 【核内质子数 > 核外电子数 阳离子】
属于阴离子的是____。 【核内质子数 < 核外电子数 阴离子】
(5)化学反应中易失去电子的是___,易得到电子的是___,化学性质相对稳定的有___________。
【课堂小结】:
问题:构成物质的粒子:分子、原子、离子。什么是分子、原子、离子?这些微粒间有什么联系?
【变式反馈】
1.下列有关分子、原子、离子说法正确的是( )
A.分子是化学变化中最小的粒子
B.一切原子的原子核都是由质子、中子构成的
C.分子的质量总比原子质量大
D.分子、原子、离子都能直接构成物质
答案:D
2.(2009哈尔滨)农作物的种子经过发酵、蒸馏制得的乙醇被称为“绿色汽油”。乙醇的分子结构如图所示。则下列叙述正确的是( )
A.乙醇分子是由3种元素组成的有机物
B.一个乙醇分子中含有28个质子
C.乙醇中碳、氧元素的质量比为3︰2
D.乙醇中氧元素的质量分数最大
【解析】C 根据乙醇的分子结构图示,可知乙醇的化学式是C2H5OH,其分子是由三种原子构成,一个乙醇分子中含有的质子数是6×2+1×6+8=26,乙醇中质量分数最大的是碳元素。
3.下表呈现的是部分元素的原子结构示意图、主要化合价等信息。
下列叙述错误的是( )
A.铝原子结构示意图的最外层有3个电子
B.元素的正化合价数一定等于原子的最外层电子数
C.核电荷数分别为8和14的元素,组成化合物的化学式为SiO2
D.同一周期中,原子的核外电子层数相同,最外层电子数从左向右逐渐增多
【解析】B根据表中给出的正化合价数和原子的最外层电子数可以看出,它们的数值不一定相同。
4.用分子的相关知识解释下列生活中的现象,其中错误的是( )
A.热胀冷缩,说明分子的大小随温度升降而改娈
B.“酒香不怕巷子深”,说明分子在不停地运动
C.10mL酒精和10mL水混合后,体积小于20mL,说明分子间有空隙
D.湿衣服在夏天比冬天容易晾干,说明分子的运动速率随温度升高而加快
【解析】A 热胀冷缩是由于分子之间的间隔发生变化造成的,并非是分子大小发生变化。
5.春暖花开季节,滨河路边常闻到怡人的紫丁花香味 ,这一现象说明( )
A.分子在不停地运动 B.分子分裂成原子
C.分子很大 D.分子之间有间隔
【解析】A 由于分子在不停的运动着,所以人们可以闻到紫丁花的香味。
6.下列关于分子和原子的说法不正确的是( )
A.分子在化学反应前后种类和数目保持不变 B.分子在不停地运动
C.原子可以直接构成物质 D.原子是化学变化中的最小粒子
【解析】C 化学变化前后分子的种类一定会发生改变,其数目可能改变。
7.结构示意图所表示的粒子是( )
A.原子 B.分子 C. 阴离子 D.阳离子
【解析】C 由结构示意图可以看出,该粒子的核内是17个质子,而核外是18个电子,因此是阴离子。
8.下列原子结构示意图中,表示带两个单位正电荷的离子的是( )
A. B. C. D.
【解析】B 带两个单位的正电荷,则该微粒的核内质子数比核外电子数多两个。符合这一特点的只有B。
9.某粒子的结构示意图为,有关该粒子的说法错误的是( )
A.核内有14个质子 B.表示阴离子
C.核外有3个电子层 D.最外层电子数为4
【解析】B 由结构示意图可以看出,该粒子的核内质子数与核外电子数相等,因此是原子。
10.分析钠原子、钠离子的结构示意图得到的以下说法中,错误的是( )
A.钠原子有三个电子层,钠离子有两个电子层
B.钠原子、钠离子的质子数都为11
C.一个钠原子在化学反应中可失去一个电子,因此,钠元素为+1价
D.钠原子和钠离子不属于同一种元素
【解析】D 钠原子和钠离子的核内质子数相同,所以他们属于同种元素。
11.下列四种粒子的结构示意图中,说法正确的是( )
① ② ③ ④
A.它们表示四种不同的元素 B.②表示的元素在化合物中通常显+2价
C.①③④表示的元素都是非金属元素 D.①④表示的是阳离子
【解析】B 由结构示意图可以看出,②④的核电荷数相同,属于同种元素,故四种粒子的结构示意图表示的元素只有三种。①表示微粒属于氧元素,②③④表示的元素均属于金属元素。①表示的离子是氧离子,属于阴离子,④表示的离子是镁离子,属于阳离子。
12.参考下列物质的微观结构图示,其中由阴,阳离子构成的物质是( )
A.铜 B.干冰 C.氯化钠 D.金刚石
【解析】C铜由铜原子直接构成,干冰是由二氧化碳分子构成,金刚石是由碳原子构成,只有氯化钠是由钠离子和氯离子构成。
13.下列说法中错误的是( )
A、所有的原子核都由质子和中子构成 B、铅笔芯里含有石墨
C、氢氧化钠固体可以干燥氧气 D、分子、原子都在不断地运动着
【解析】A有的原子核内没有中子,如氢原子的核内没有中子。
14.以下四位同学对分子和原子的认识正确的是( )
A. 分子运动而原子不运动 B. 分子可分而原子不可分
C. 分子构成物质而原子不能构成物质 D. 原子由原子核和核外电子构成
【解析】D分子和原子都在不停地运动着。在化学变化中分子可分,原子不可分。分子和原子都能构成物质,如铁就是由铁原子直接构成的。
15.用数字和化学符号表示:2个氧原子 ,3个钠离子 。
(2)镁的原子结构示意图为,Mg原子在化学反应中容易 (填“得到”或“失去”)2个电子。
【答案】(1)2O 3Na+ (2)失去
16.根据给出的原子结构示意图,回答下列问题:
He Mg Ca
(1)Mg和Ca的化学性质都比较 (填“活泼”或“不活泼”);镁离子的符号为 。(2)He的化学性质 (填“活泼”或“不活泼”);由此可知,最外层电子数相同时,化学性质 (填“一定”或“不一定”)相似。
【解析】镁和钙原子的最外层电子数都是2,属于不稳定结构,化学性质都比较活泼,容易失去电子,镁离子的符号是Mg2+。氦原子的核外只有一层电子,且有2个电子,属于稳定结构,化学性质不活泼,可见,最外层电子数相同时,化学性质不一定相似。
【答案】(1)活泼 Mg2+ (2)不活泼 不一定
【能力激活】
17.(1)某粒子的结构示意图为,若表示原子,则X 10;
若表示阴离子,则X l0(选填“>”、“=”或“<”)
(2)在四种粒子的结构示意图中,共表示了 种元素的粒子。
【解析】⑴根据结构示意图可以判断,当该粒子是原子时,x=2+8=10,当表示阴离子时,核外电子数要比核内质子数多,即x<10。⑵判断元素的种类是看核内质子数,质子数相同,则属于同种元素,故四种粒子结构示意图中,共表示了三种元素。
【答案】⑴ = < ⑵ 三
18.右图是锂原子的构成示意图,根据图示信息回答下列问题:
(1)锂元素的原子序数为 ,元素符号为 。
(2)锂原子的结构示意图为 (填字母)。
(3)锂元素与氧元素形成的化合物的化学式为 。
(4)下列对原子构成的理解错误的是 (填字母)。
A.原子整体不显电性 B.原子核比原子小得多
C.原子核是不可分割的实心球体 D.原子质量主要集中在原子核上
【解析】⑴根据锂原子的核内有三个质子,故其原子序数是3,符号式Li;⑵锂的核外电子数等于核内质子数,故其原子结构示意图是;⑶锂的最外层电子数是1,故锂元素的化合价是+1,氧元素通常显-2价,它与氧元素形成化合物的化学式是Li2O。⑷由图示可以看出,原子核并不是不可分割的实心球体,它是由带正电荷的质子和不带电的中子构成。
【答案】(1)3 Li (2)D (3)Li2O (4)C
附:分子、原子、离子的区别与联系
分 子 原 子 离 子
区别 概 念 保持物质 性质的 微粒 是化学变化中的 微粒 带电的 或
化学变化中是否可分 在化学变化中 分,变化前后种类和数目可能发生变化。 在化学变化中 分,变化前后种类和数目不发生变化。 在化学变化中单原子离子一般不可分,但原子团构成的离子可能分割成其它离子、原子或分子。
是否独立存在 能独立存在,构成物质并保持物质的化学性质不变。 有些能独立存在,并直接构成物质,且能保持物质的化学性质不变。 阴阳离子共同构成物质。
构 成 同种原子或不同种原子构成。 一般有 、 和核外电子三种微粒构成。 由原子得失电子形成,原子得电子带 电荷成为 离子,原子失去电子带 电荷,成为 离子。
所显电性情况 电性 电性 阴离子:带 电荷阳离子:带 电荷
表 示方 法 用 表示 用 或原子结构示意图表示。 分别以阴、阳离子符号或离子结构示意图表示。
联系 在化学反应中的表现 在化学反应中原分子破裂 在化学反应中得失电子分子 原子 离子 在化学反应中重新组合成新分子 在化学反应中得失电子
基 本 属 性 体积 ,质量 ,都是在不断 的,微粒之间有 。同种微粒 相同,不同种微粒性质不同。
+8
2
8
2
8
2
+12
2
8
+11
2
8
+12
A. B. C. D.
同课章节目录
