选修3第二章物质结构与性质分子的立体构型(说课课件)
文档属性
| 名称 | 选修3第二章物质结构与性质分子的立体构型(说课课件) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-10 11:16:49 | ||
图片预览










文档简介
(共33张PPT)
选修3第二章第二节
分子的立体构型
淄博市张店区第一中学 梁慎光
以“从具体性知识传授到核心观念建构,从知识解析为本到基于学生认识发展”为教学理念。不仅重视知识技能、过程方法和情感态度价值观等科学素养的静态要素内涵,而且更关注以认识素养为核心的科学素养的功能性结构即认识素养的基本结构。不仅重视新课程的三维目标,且更重视三维目标的化学本质与内涵;不仅关注一般的科学过程和方法,且更关注化学学科的思想方法;不仅提倡化学-技术-社会之间的关系及其相互影响,且更加提倡应用背景与化学之间的本质关系。
一、教学理念
本节内容选自必修三《物质结构和性质》第二章《分子结构和性质》。本章第一节介绍了共价键的主要类型(σ键和π键)和特征,三个键参数:键能、键长和键角等知识。在此基础上,本节内容介绍了分子的立体构型,本节首先介绍了形形色色的分子并配有立体结构模型图,并设问过渡:为什么这些分子有如此的空间结构?接着介绍了利用价层电子对互斥理论来判断简单分子或离子的简单构型,并对简单共价分子结构的多样性和复杂性进行了解释,还设计了“思考与交流”、“思考与探究”等内容让学生自主的去理解和运用这个理论。本节是第二章《分子结构与性质》的关键,体现了课标中所要求的四个主题中“化学键与物质的性质”这个主题。通过本节的学习,使学生进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质,逐步形成科学的价值观,为分子的性质学习奠定了基础。
二、全面分析
1、教材的地位与作用:
选修三《物质的结构和性质》物质的结构知识涉及微观世界,抽象,理论性强,学习难度大。学习的理念方法都很欠缺;这部分知识的学习要求有很强的学习能力和理解能力等。
学生虽具有一定的理性思维能力,但抽象思维能力较弱,还是易于接受感性认识。因此,本节课的教学起点低,并充分利用现代化教学手段,进行多媒体辅助教学,以求突出重点、突破难点。
2、学情分析
知识与技能:
认识共价分子结构的多样性和复杂性,能根据价层电子对互斥理论来判断简单分子或离子的构型,以此培养学生的空间想象能力;
过程与方法:
在学科方法及思想方面,要求学生能灵活运用“对比的方法”、“类比的思想”分析问题,解决问题,形成知识迁移能力;
情感态度与价值观:
使学生能够感受到学习的意义和价值,激发学生对化学学科的兴趣,让学生感悟生活、感受人生。
3、教学目标
教学重难点:1、分子的立体构型;
2、价层电子对互斥理论
本节课的设计以问题组形式出现,以《实效融合》模式为宗旨,使知识问题化、问题层次化,符合学生的认知发展。通过每课一题的设计检查学生的知识储备,并通过几个问题的归理为下面新知识部分的学习埋下伏笔,奠定了基础,指明了学习的方向;利用学生已知的“结构决定性质,性质反应结构”的原理,通过展示形形色色的分子图片,阐明学习分子构型的意义,以此激发学生对化学学科的学习兴趣。通过认识共价分子的多样性,能根据简单理论去判断分子的构型。简单分子,一般是一个中心原子,结构不大复杂,而且结合得原子数不是太多。用这些简单原子来处理,就是把环境简单化,突出主题,在处理这方面问题时突出体现化学学习的方法,分类的观点。简单分子孤电子对数可以由分子式和中心原子的价层电子数直接确定(氨和水分子中孤电子对数分别是1对和2对)所以,价层电子对数可以用简单加法心算。但有些分子因为含π键所以很难处理。所以又出来了专门计算孤电子对的计算公式,孤电子对数=1/2(a-xb)。让学生充分体会价层电子对互斥模型的应用价值,通过一系列的构型对比,让学生对分子构型更加明确。通过应用价层电子对互斥理论推断分子的构型,体现所学知识的应用,即知识的迁移,同时也体现了学科方法和学科思想的应用。
4、重难点分析及突破方式
通过用分类对比的方法,对CO2和H2O、NH3和CH2O等1:2和1:3型分子立体构型进行分析,可以得出一下认识:分子的立体构型与中心原子价层电子对的数目和性质有关。
首先介绍价层电子对互斥理论,利用电子式判断ABn型分子构型,从而引入孤对电子对和价层电子对的计算方法,从而解决问题。整堂课围绕“建构新知——知识应用——发现问题——再建构新知——再解决问题”这条主线张开,从而达到知识的螺旋上升。在解决问题的过程中发现新问题,再解决问题,让学生在不断发现问题解决问题的过程中体验成功的喜悦!
5、教学和学习方法分析
1、能说明CH4分子的5个原子不在同一平面的
理由是( )
A、任意两个C—H键之间的夹角为109°28′
B、4个C—H键均为s-p σ键
C、4个C—H键的键能相同
D、4个C—H键的键长相同
教学过程
2、试从能量角度解释下列问题:
1)自然界的水的流动有何规律?为什么?
2)自然界大多数的自发反应都是放热反应,
为什么?
3)Na原子在化学反应中如何变化?为什么?
4)一个C原子结合几个H原子形成分子?为什么?
5)空间中不受外力作用、有一定距离的一个
正电荷和一个负电荷,会如何运动?为什么?
6)空间中不受外力作用的两个同性电荷,
会如何运动?为什么?
3、试从空间相对位置角度回答下列问题:
1)若1个正电荷同时吸引2个负电荷,
试推测2个负电荷在空间如何占位,
才能使体系内能最低?
2)若1个正电荷同时吸引3个负电荷,
试推测3个负电荷在空间如何占位,
才能使体系内能最低?
3)若1个正电荷同时吸引4个负电荷,
试推测4个负电荷在空间如何占位,
才能使体系内能最低?
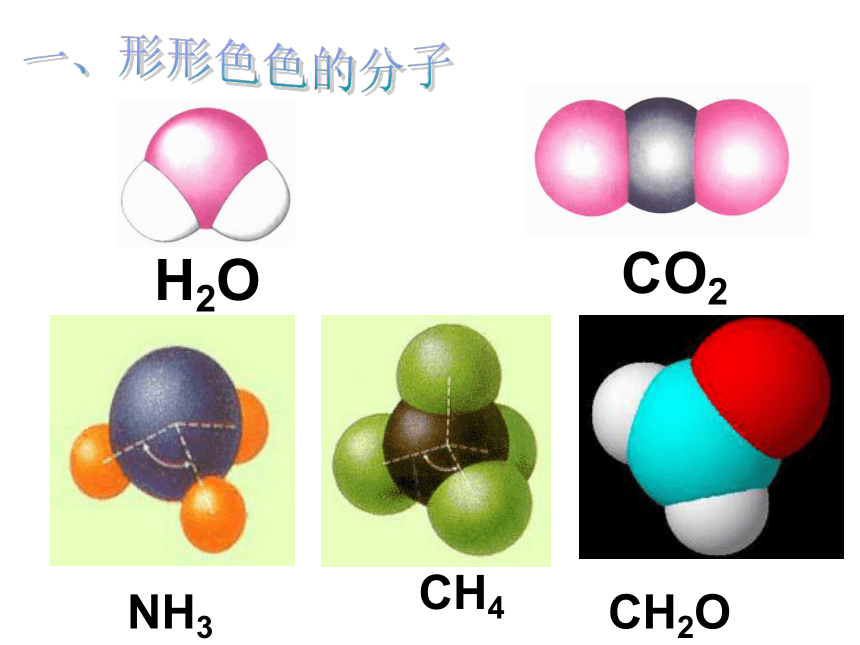
H2O
CO2
NH3
CH2O
CH4
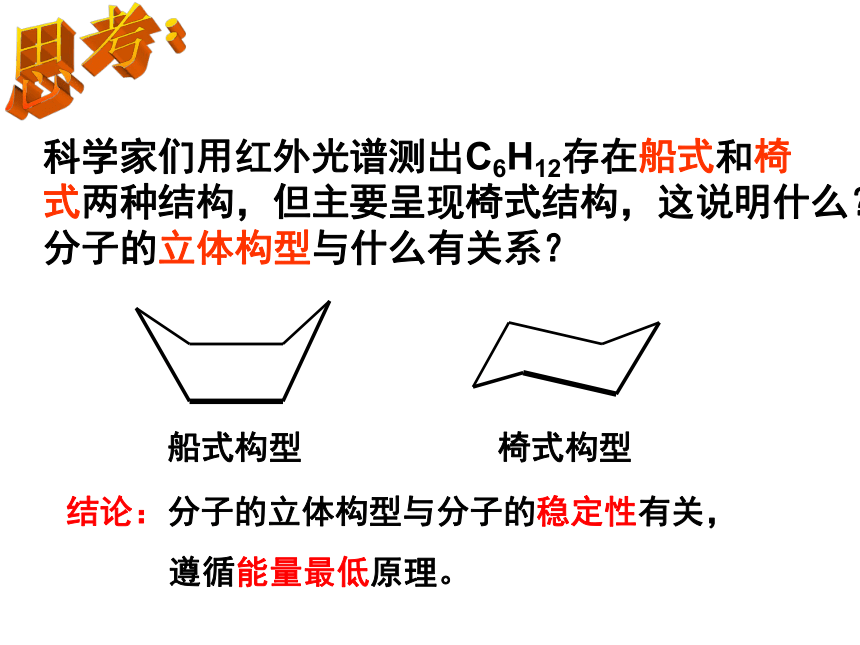
科学家们用红外光谱测出C6H12存在船式和椅 式两种结构,但主要呈现椅式结构,这说明什么?分子的立体构型与什么有关系?
船式构型 椅式构型
结论:分子的立体构型与分子的稳定性有关,
遵循能量最低原理。
H2O
CO2
CH2O
NH3
CH4
观察与中心原子相连的原子,彼此尽量 靠近,还是远离?
这说明原子间有什么作用?原子间为什么会产生这种作用?
写出CO2 、 H2O 、CH2O、NH3 、CH4的电子式,并预测它们的立体构型。
直线形
V形
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
同为四原子分子,CH2O与 NH3 分子的空间结构也不同,什么原因?
三角锥形
平面三角形
分子的空间结构我们看不见,
那么科学家是怎样测定的呢?
[阅读]科学视野—分子的立体结构是怎样测定的?
测分子体结构:红外光谱仪→吸收峰→分析。
在1940年,希吉维克(Sidgwick)和坡维尔(Powell)在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经吉列斯比(R.J,Gillespie)和尼霍尔姆(Nyholm)在20世纪50年代加以发展,定名为价层电子对互斥模型,简称VSEPR(Valence Shell Electron Pair Repulsion)。
价层电子对互斥理论认为,分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。电子对之间的夹角越大,排斥力越小。
价层电子对互斥模型把分子分成以下两大类:一类是中心原子上的价电子都用于形成共价键,如C02、CH20、CH4等分子中的碳原子,在这类分子中,由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离,成键原子的几何构型总是采取电子对排斥最小的那种结构。它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线型 C02、BeCl2
n=3 平面三角形 CH20、BF3
n=4 正四面体型 CH4、CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SF6
另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子,如H2O和NH3,对于这类分子,首先建立四面体模型,每个键占据一个方向(多重键只占据一个方向),孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H20和NH3的中心原子上分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
价层电子对互斥理论的具体应用
含孤电子对的价层电子对互斥模型
化学式
结构式
分子的立体结构模型
预测分子构型的思路:
计算σ键数与孤电子对数的和
确定价层电子对互斥模型
隐去孤电子对,得到分子的立体构型
找出中心原子
请确定BF3、NH4+、和SO32-的VESPR模型和它们的立体构型 。
价电子对间的斥力又是怎么样的呢?
结论:1.电子对之间的夹角越小,排斥力越大。
2.由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间的斥力大小顺序如下:孤电子对—孤电子对>孤电子对—成键电子>成键电子—成键电子
对比CH4 、NH3、H2O分子的立体构型,
据键角变化,可得出什么结论?
分子 键角
CH4 109°28′
NH3 107°
H2O 105°
说出CH4 、CH3Cl 、CH2Cl2 、CHCl3 、 CCl4的分子构型,可得出什么结论?
结论:与中心原子相连的原子只要不完全一样,
分子的立体构型就不对称。
1、能量最低原理在分子构型中的应用
2、会用价层电子对互斥模型预测简单
分子的立体构型
3、中心原子存在孤对电子的分子,
空间构型不对称
4、会恰当运用对比的方法、类比的思想
和已有知识解决新问题
价层电子对互斥
电子对排布方式
分子立体构型
影响
决定
判断
1、下列物质中,分子的立体结构与水分子相似的是 ( )
A、CO2 B、H2S C、PCl3 D、SiCl4
2、下列分子的立体结构,其中属于直线型分子的是 ( )
A、H2O B、CO2 C、C2H2 D、P4
3、写出你所知道的分子具有以下形状的物质的化学式,并指出它们分子中的键角分别是多少?
(1)直线形
(2)平面三角形
(3)三角锥形
(4)正四面体
4、下列分子中,各原子均处于同一平面上的是 ( )
A、NH3 B、CCl4 C、H2O D、CH2O
5、下列物质中,化学键类型和分子的立体构型皆相同的是( )
A、CO2和SO2 B、CH4和SiH4 C、BF3和NCl3 D、Na2O2和H2O2
价层电子对是指分子中的中心原子上的电子对,
包括σ键电子对和中心原子上的孤电子对
中心原子上的孤电子对数,确定方法如下:
a为中心原子的价电子数;x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数
价层电子对的确定方法:
每个σ键有一对电子
1、以s和p为例,说明如何根据主族元素在周期表中的位置确定它的价电子数。
2、以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。
说明:
对于阳离子来说,a为中心原子的价电子数减去离子的电荷数,
对于阴离子来说,a为中心原子的价电子数加上离子的电荷数。
3、以CO32-为例说明如何计算离子的孤电子对数。
分子或离子 中心原子上的孤电子对数 分子或离子的价层电子对数 VSEPR模型 VSEPR模型名称 分子或离子的立体构型 分子或离子的立体构型名称
CO2 0 2 直线型 直线型
SO2 1 3 平面三角形 V型
CO32- 0 3 平面三角形
平面三角形
CH4 0 4 正四面体形 正四面体形
选修3第二章第二节
分子的立体构型
淄博市张店区第一中学 梁慎光
以“从具体性知识传授到核心观念建构,从知识解析为本到基于学生认识发展”为教学理念。不仅重视知识技能、过程方法和情感态度价值观等科学素养的静态要素内涵,而且更关注以认识素养为核心的科学素养的功能性结构即认识素养的基本结构。不仅重视新课程的三维目标,且更重视三维目标的化学本质与内涵;不仅关注一般的科学过程和方法,且更关注化学学科的思想方法;不仅提倡化学-技术-社会之间的关系及其相互影响,且更加提倡应用背景与化学之间的本质关系。
一、教学理念
本节内容选自必修三《物质结构和性质》第二章《分子结构和性质》。本章第一节介绍了共价键的主要类型(σ键和π键)和特征,三个键参数:键能、键长和键角等知识。在此基础上,本节内容介绍了分子的立体构型,本节首先介绍了形形色色的分子并配有立体结构模型图,并设问过渡:为什么这些分子有如此的空间结构?接着介绍了利用价层电子对互斥理论来判断简单分子或离子的简单构型,并对简单共价分子结构的多样性和复杂性进行了解释,还设计了“思考与交流”、“思考与探究”等内容让学生自主的去理解和运用这个理论。本节是第二章《分子结构与性质》的关键,体现了课标中所要求的四个主题中“化学键与物质的性质”这个主题。通过本节的学习,使学生进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质,逐步形成科学的价值观,为分子的性质学习奠定了基础。
二、全面分析
1、教材的地位与作用:
选修三《物质的结构和性质》物质的结构知识涉及微观世界,抽象,理论性强,学习难度大。学习的理念方法都很欠缺;这部分知识的学习要求有很强的学习能力和理解能力等。
学生虽具有一定的理性思维能力,但抽象思维能力较弱,还是易于接受感性认识。因此,本节课的教学起点低,并充分利用现代化教学手段,进行多媒体辅助教学,以求突出重点、突破难点。
2、学情分析
知识与技能:
认识共价分子结构的多样性和复杂性,能根据价层电子对互斥理论来判断简单分子或离子的构型,以此培养学生的空间想象能力;
过程与方法:
在学科方法及思想方面,要求学生能灵活运用“对比的方法”、“类比的思想”分析问题,解决问题,形成知识迁移能力;
情感态度与价值观:
使学生能够感受到学习的意义和价值,激发学生对化学学科的兴趣,让学生感悟生活、感受人生。
3、教学目标
教学重难点:1、分子的立体构型;
2、价层电子对互斥理论
本节课的设计以问题组形式出现,以《实效融合》模式为宗旨,使知识问题化、问题层次化,符合学生的认知发展。通过每课一题的设计检查学生的知识储备,并通过几个问题的归理为下面新知识部分的学习埋下伏笔,奠定了基础,指明了学习的方向;利用学生已知的“结构决定性质,性质反应结构”的原理,通过展示形形色色的分子图片,阐明学习分子构型的意义,以此激发学生对化学学科的学习兴趣。通过认识共价分子的多样性,能根据简单理论去判断分子的构型。简单分子,一般是一个中心原子,结构不大复杂,而且结合得原子数不是太多。用这些简单原子来处理,就是把环境简单化,突出主题,在处理这方面问题时突出体现化学学习的方法,分类的观点。简单分子孤电子对数可以由分子式和中心原子的价层电子数直接确定(氨和水分子中孤电子对数分别是1对和2对)所以,价层电子对数可以用简单加法心算。但有些分子因为含π键所以很难处理。所以又出来了专门计算孤电子对的计算公式,孤电子对数=1/2(a-xb)。让学生充分体会价层电子对互斥模型的应用价值,通过一系列的构型对比,让学生对分子构型更加明确。通过应用价层电子对互斥理论推断分子的构型,体现所学知识的应用,即知识的迁移,同时也体现了学科方法和学科思想的应用。
4、重难点分析及突破方式
通过用分类对比的方法,对CO2和H2O、NH3和CH2O等1:2和1:3型分子立体构型进行分析,可以得出一下认识:分子的立体构型与中心原子价层电子对的数目和性质有关。
首先介绍价层电子对互斥理论,利用电子式判断ABn型分子构型,从而引入孤对电子对和价层电子对的计算方法,从而解决问题。整堂课围绕“建构新知——知识应用——发现问题——再建构新知——再解决问题”这条主线张开,从而达到知识的螺旋上升。在解决问题的过程中发现新问题,再解决问题,让学生在不断发现问题解决问题的过程中体验成功的喜悦!
5、教学和学习方法分析
1、能说明CH4分子的5个原子不在同一平面的
理由是( )
A、任意两个C—H键之间的夹角为109°28′
B、4个C—H键均为s-p σ键
C、4个C—H键的键能相同
D、4个C—H键的键长相同
教学过程
2、试从能量角度解释下列问题:
1)自然界的水的流动有何规律?为什么?
2)自然界大多数的自发反应都是放热反应,
为什么?
3)Na原子在化学反应中如何变化?为什么?
4)一个C原子结合几个H原子形成分子?为什么?
5)空间中不受外力作用、有一定距离的一个
正电荷和一个负电荷,会如何运动?为什么?
6)空间中不受外力作用的两个同性电荷,
会如何运动?为什么?
3、试从空间相对位置角度回答下列问题:
1)若1个正电荷同时吸引2个负电荷,
试推测2个负电荷在空间如何占位,
才能使体系内能最低?
2)若1个正电荷同时吸引3个负电荷,
试推测3个负电荷在空间如何占位,
才能使体系内能最低?
3)若1个正电荷同时吸引4个负电荷,
试推测4个负电荷在空间如何占位,
才能使体系内能最低?
H2O
CO2
NH3
CH2O
CH4
科学家们用红外光谱测出C6H12存在船式和椅 式两种结构,但主要呈现椅式结构,这说明什么?分子的立体构型与什么有关系?
船式构型 椅式构型
结论:分子的立体构型与分子的稳定性有关,
遵循能量最低原理。
H2O
CO2
CH2O
NH3
CH4
观察与中心原子相连的原子,彼此尽量 靠近,还是远离?
这说明原子间有什么作用?原子间为什么会产生这种作用?
写出CO2 、 H2O 、CH2O、NH3 、CH4的电子式,并预测它们的立体构型。
直线形
V形
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
同为四原子分子,CH2O与 NH3 分子的空间结构也不同,什么原因?
三角锥形
平面三角形
分子的空间结构我们看不见,
那么科学家是怎样测定的呢?
[阅读]科学视野—分子的立体结构是怎样测定的?
测分子体结构:红外光谱仪→吸收峰→分析。
在1940年,希吉维克(Sidgwick)和坡维尔(Powell)在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经吉列斯比(R.J,Gillespie)和尼霍尔姆(Nyholm)在20世纪50年代加以发展,定名为价层电子对互斥模型,简称VSEPR(Valence Shell Electron Pair Repulsion)。
价层电子对互斥理论认为,分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。电子对之间的夹角越大,排斥力越小。
价层电子对互斥模型把分子分成以下两大类:一类是中心原子上的价电子都用于形成共价键,如C02、CH20、CH4等分子中的碳原子,在这类分子中,由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离,成键原子的几何构型总是采取电子对排斥最小的那种结构。它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线型 C02、BeCl2
n=3 平面三角形 CH20、BF3
n=4 正四面体型 CH4、CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SF6
另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子,如H2O和NH3,对于这类分子,首先建立四面体模型,每个键占据一个方向(多重键只占据一个方向),孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H20和NH3的中心原子上分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
价层电子对互斥理论的具体应用
含孤电子对的价层电子对互斥模型
化学式
结构式
分子的立体结构模型
预测分子构型的思路:
计算σ键数与孤电子对数的和
确定价层电子对互斥模型
隐去孤电子对,得到分子的立体构型
找出中心原子
请确定BF3、NH4+、和SO32-的VESPR模型和它们的立体构型 。
价电子对间的斥力又是怎么样的呢?
结论:1.电子对之间的夹角越小,排斥力越大。
2.由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间的斥力大小顺序如下:孤电子对—孤电子对>孤电子对—成键电子>成键电子—成键电子
对比CH4 、NH3、H2O分子的立体构型,
据键角变化,可得出什么结论?
分子 键角
CH4 109°28′
NH3 107°
H2O 105°
说出CH4 、CH3Cl 、CH2Cl2 、CHCl3 、 CCl4的分子构型,可得出什么结论?
结论:与中心原子相连的原子只要不完全一样,
分子的立体构型就不对称。
1、能量最低原理在分子构型中的应用
2、会用价层电子对互斥模型预测简单
分子的立体构型
3、中心原子存在孤对电子的分子,
空间构型不对称
4、会恰当运用对比的方法、类比的思想
和已有知识解决新问题
价层电子对互斥
电子对排布方式
分子立体构型
影响
决定
判断
1、下列物质中,分子的立体结构与水分子相似的是 ( )
A、CO2 B、H2S C、PCl3 D、SiCl4
2、下列分子的立体结构,其中属于直线型分子的是 ( )
A、H2O B、CO2 C、C2H2 D、P4
3、写出你所知道的分子具有以下形状的物质的化学式,并指出它们分子中的键角分别是多少?
(1)直线形
(2)平面三角形
(3)三角锥形
(4)正四面体
4、下列分子中,各原子均处于同一平面上的是 ( )
A、NH3 B、CCl4 C、H2O D、CH2O
5、下列物质中,化学键类型和分子的立体构型皆相同的是( )
A、CO2和SO2 B、CH4和SiH4 C、BF3和NCl3 D、Na2O2和H2O2
价层电子对是指分子中的中心原子上的电子对,
包括σ键电子对和中心原子上的孤电子对
中心原子上的孤电子对数,确定方法如下:
a为中心原子的价电子数;x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数
价层电子对的确定方法:
每个σ键有一对电子
1、以s和p为例,说明如何根据主族元素在周期表中的位置确定它的价电子数。
2、以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。
说明:
对于阳离子来说,a为中心原子的价电子数减去离子的电荷数,
对于阴离子来说,a为中心原子的价电子数加上离子的电荷数。
3、以CO32-为例说明如何计算离子的孤电子对数。
分子或离子 中心原子上的孤电子对数 分子或离子的价层电子对数 VSEPR模型 VSEPR模型名称 分子或离子的立体构型 分子或离子的立体构型名称
CO2 0 2 直线型 直线型
SO2 1 3 平面三角形 V型
CO32- 0 3 平面三角形
平面三角形
CH4 0 4 正四面体形 正四面体形
