共价键说课课件
图片预览










文档简介
(共34张PPT)
第二章 分子结构与性质
第一节 共价键
主讲人:淄博市张店区第一中学 梁慎光
人教版选修三
以“从具体性知识传授到核心观念建构,从知识解析为本到基于学生认识发展”为教学理念。不仅重视知识技能、过程方法和情感态度价值观等科学素养的静态要素内涵,而且更关注以认识素养为核心的科学素养的功能性结构即认识素养的基本结构。不仅重视新课程的三维目标,且更重视三维目标的化学本质与内涵;不仅关注一般的科学过程和方法,且更关注化学学科的思想方法;不仅提倡化学-技术-社会之间的关系及其相互影响,且更加提倡应用背景与化学之间的本质关系。
一、教学理念
在第一章有关电子云和原子轨道等概念的基础上,介绍了共价键的主要类型σ键和π键。本节内容是第二章分子的结构与性质的基础。物质结构模块理论性非常强,而且概念非常抽象,对于学生来讲感觉比较难以接受。在必修阶段的时候,共价键和离子键的性质是截然不同的,但学习了第一章之后,要让学生明白共价键和离子键已经不是绝对的了。当两种原子之间的电负性相等时,就属于共价键中的非极性键,如果这个差值从0开始慢慢增大,就从非极性键过渡到极性键,让学生建立一个任何理论都不是绝对的,都是一个发展的过程。学生们从这块也能感受到一个认知的变化。从定量化的观点让学生来认识这种逐渐过渡的关系。通过本章的学习,学生能够在分子水平上,从分子结构的视角认识物质的性质,进一步形成有关物质结构的基本观念;学生的学习兴趣能得到有效保持,学生的科学素养能得到进一步提高。
二、全面分析
1、教材的地位与作用:
学生虽具有一定的理性思维能力,但抽象思维能力较弱,还是易于接受感性认识。因此,本节课的教学起点低,并充分利用现代化教学手段,进行多媒体辅助教学,以求突出重点、突破难点。学生在化学必修二中已经学习了化学键的初步知识,知道了离子键和共价键的形成过程。本节将在电子云和原子轨道等概念基础上继续学习共价键的知识,包括共价键的主要类型σ键和π键的知识。由于此部分内容比较抽象,教学过程中运用大量图片引导学生的形象思维,理解σ键和π键的特征。
2、学情分析
能从电子云重叠的角度更深入地了解共价键的实质。
知道共价键的基本类型σ键和π键的形成及其特点。
学会判断常见分子共价键中的σ键和π键。
通过类比、归纳、推理、判断,掌握学习抽象概念的方法,培养学生准确描述概念,深刻理解概念,比较辨析概念的能力。
通过动画演示和学生小组探究活动,培养学生的观察能力、动手能力及分析问题的能力。
通过创设探究活动,使学生主动参与学习过程,激发学生学习兴趣,体会成功获得知识的乐趣。
在分子水平上进一步形成有关物质结构的基本概念,能从物质结构决定性质的视角解释分子的某些性质,并能预测物质的有关性质,体验科学探究过程的乐趣,进而形成科学的价值观。
3、教学目标
(一)知识与技能
(二)过程与方法
(三)情感态度与价值观
在本节课的设计中,知识以问题的形式呈现,以《实效融合》模式为宗旨,使知识问题化、问题层次化,符合学生的认知发展。通过每课一题的设计检查学生的知识储备,并通过几个问题的归理为下面知识部分的学习埋下伏笔,奠定了基础,指明了学习的方向。结合教材的特点及所设计的教学方法,指导学生通过动画模拟微观粒子成键过程,开展学习活动。把微观抽象的变化过程转变为形象直观的画面,让枯燥的理论知识变得形象有趣。学生在前面学习了化学键的初步知识,知道了离子键和共价键的形成过程。在此基础上进一步创设问题情景,激发学生学习的主动性,并培养学生严谨求实的科学态度。同时把学生的被动接受转化为主动探索,以教师为主导,学生为主体,促使学生动眼看、动口说、动脑想,使学生的学习过程和认识过程统一为一个整体。
通过图片及动画模拟电子云图像的方式,形象生动地引出了共价键的主要类型σ键和π键,以及它们的差别。在处理这方面问题时突出体现化学学习的方法,分类、类比的观点。
4、重难点分析及突破方式
教学重点:σ键、π键的特征和性质
教学难点:σ键、π键的特征
根据本节课的内容特点,在教学上采用多媒体动画演示和模型实例相结合的方式,尽可能将抽象的知识具体化、形象化。指导学生从s、p两种形状的电子云按不同方式进行重叠成键的探究入手,帮助学生了解不同种类的共价键(σ键和π键)的特征和性质。
本节课的关键在于设法以尽可能形象化、生动化的手段解决相对抽象的问题。只要能在教学中有效突破电子云按不同方式进行重叠而形成共价键这一基本要点,就可以使学生更好理解两种共价键的特征和性质。
5、教学和学习方法分析
1、充分发挥学生的主体作用和教师的主导作用,采用启发式教学,并遵循循序渐进的教学原则创设问题情景:复习共价键的概念。提出问题:(1)两个H在形成H2时,电子云如何重叠?(2)在HCl、Cl2中,电子云如何重叠?制作动画模型,以H2、HCl、Cl2 为例,研究它们在形成分子时原子轨道的重叠方式,即σ键和π键的成键过程,体会σ键可以旋转而π键不能旋转。
2、对涉及原理的解释,力求通过动画模拟形象分析来解决,即遵守直观性教学的原则。这样有利于学生掌握从现象到本质,从已知到未知逐步形成概念的学习方法,有利于发展学生空间想象能力和逻辑推理能力。
知识铺垫(能层、能级、电子云和原子轨道)→过渡引入→探索新知(对比用电子式表示共价键的形成过程,引导学生从电子云角度分析共价键→学生自主探究s、p轨道以何种方式重叠程度比较大→利用分类思想归纳总结共价键的两种类型——σ键、π键 → 对比探究σ键、π键的共性和差异性)→学以致用(探究利用电子云重叠方式判断共价键成键的规律)→习题巩固强化→知识建构
教学流程
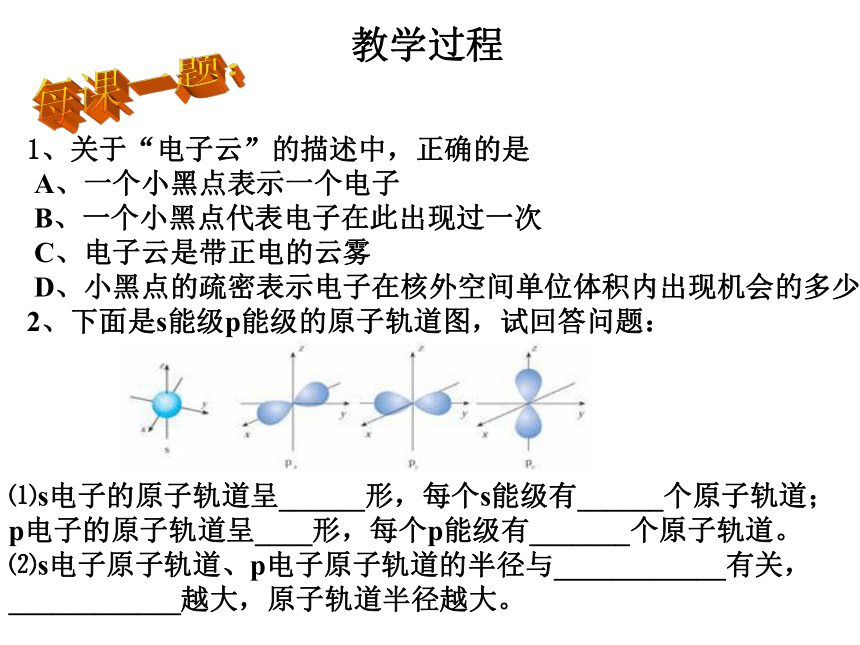
1、关于“电子云”的描述中,正确的是 A、一个小黑点表示一个电子 B、一个小黑点代表电子在此出现过一次 C、电子云是带正电的云雾 D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少
2、下面是s能级p能级的原子轨道图,试回答问题:
⑴s电子的原子轨道呈______形,每个s能级有______个原子轨道;p电子的原子轨道呈____形,每个p能级有_______个原子轨道。 ⑵s电子原子轨道、p电子原子轨道的半径与____________有关,____________越大,原子轨道半径越大。
教学过程
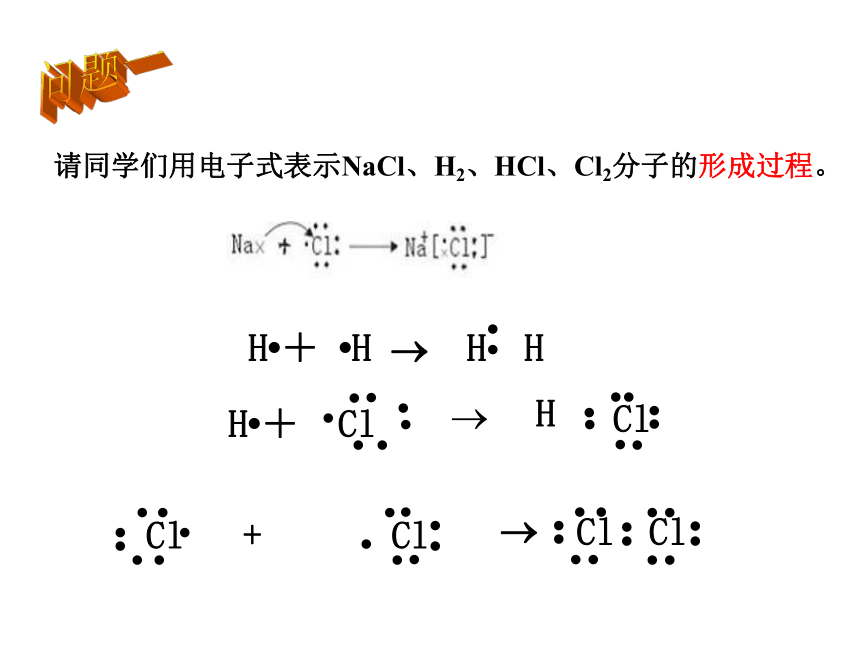
请同学们用电子式表示NaCl、H2、HCl、Cl2分子的形成过程。
Cl +
Cl
Cl
Cl
H + H H H
H + Cl
H
Cl
1、两个H在形成H2时,电子云如何重叠?
能否根据核外电子的运动轨迹来更形象地描述共价键的形成呢?
此图是运用氢原子核外电子的运动轨迹来描述氢分子的形成过程
2、在HCl、Cl2中,电子云如何重叠?
一、共价键
原子间要形成尽可能稳定的共价键,与电子云的重叠程度有关系吗?是什么关系?
电子云如何重叠才能使重叠的程度尽可能大呢?
(1)请同学们利用彩泥制作3个S 轨道(球形) 、 3个P轨道(哑铃形)模型;
(2)试一试能否运用S轨道、P轨道模型,寻找H2、HCl、C12分子在形成分子时原子轨道重叠的最佳方式?
H2分子的形成过程
用电子云来描述共价键的形成过程
相互靠拢
原子轨道以 方式相互 ,导致电子在两核间出现的概率 ,体系的能量 ,形成的共价键。
“头碰头”
重叠
降低
增大
(1)σ键:
共价键的形成
由两个氢原子各提供一个未成对电子1S的原子轨道重叠形成。
相互靠拢
S-S σ键
HCl分子的形成过程
未成对电子的
电子云相互靠拢
电子云相互重叠
s-p σ键
由氢原子各提供一个未成对电子1S的原子轨道和氯原子提供的未成对电子3p的原子轨道重叠形成。
Cl2分子的形成过程
p-p σ键
未成对电子的
电子云相互靠拢
电子云相互重叠
由两个氯原子各提供一个未成对电子3P的原子轨道重叠形成。
S-S重叠
S-P重叠
P-P重叠
σ键成键方式 “头碰头”
σ键的特征
以 方式形成化学键,以两
原子核的 为轴,作 操作,共价键电
子云的图形 ,这种特征称为 。
连线
旋转
不变
轴对称
“头碰头”
是不是分子中的共价键都是σ 键?请分析下图电子云的成键方式。
两个原子
相互接近
电子云重叠
p-p
π键
由两个原子的p电子以 方式重叠形成,导致电子在两核间出现的概率 ,体系的能量 ,形成的共价键。
“肩并肩”
(2)π键:
增大
降低
以 方式形成化学键,电子云是由 组成的,分别位于由两原子核构成平面的 ,如果以它们之间包含原子核的平面为镜面,它们互为 ,这种特征称为 。
π键特征
“肩并肩”
两块
两侧
镜像
镜像对称
比较σ键和π键
σ键 π键
成键方式
电子云形状
特 点
牢固程度
沿轴方向“头碰头”
平行方向“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
哪些共价键是σ键,哪些共价键是π键呢?
一般规律:共价单键是σ键;而共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键组成。
通过比较乙烷、乙烯、乙炔的性质及σ键、π键的牢固程度,推断分子中存在的共价键类型。
z
z
y
y
x
σ
N
N
πz
πy
1、已知氮分子的共价键是三键(N三N),你能模仿图2—1、图2—2、图2—3,通过画图来描述吗?
2.钠和氯通过得失电子同样也是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗 讨论后请填写表2-2:
0.9
2.1
2.5
2.1
0.9
1.0
离子
共价
3.0
3.0
3.5
原子 Na Cl H Cl C O
电负性
电负性之差(绝对值)
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是____键;而____键是电负性相差不大的原子之间形成的化学键。
有没有可能存在 H3 、Cl3 、H2Cl分子?为什么?
共价键的特征
具有饱和性
——决定分子的组成
一、共价键
共价键的形成
以“头碰头”成键,呈轴对称,
类型:s—sσ键、s—pσ键、p—pσ键
以“肩并肩”成键,呈镜像对称。
共价键的特征
1、σ键:
2、π键:
饱和性
——决定分子的组成
具体化
理论化
定量化
应用化
能力
分子组成
原子轨道的重叠方式
共价键的类型
电负性
判断键型
知识
情感态度价值观
走进生活
学科知识
学科思想
学科思想
现实应用
1、下列化合物中只含有一个π键的是( )
A.C2H2 B.H202
C.CH2═CH2 D.HCl
2、下列有关σ键的说法错误的是( )
A.如果电子云图像是由两个s电子重叠形成的,即形成s—sσ键
B.s电子与P电子形成s—pσ键
C.P电子与P电子不能形成σ键
D.HCl分子里含一个s一pσ键
3、下列说法正确的是( )
A.π键是由两个P电子“头碰头”重叠形成
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D.H2分子中含σ键而Cl2分子中还含π键
4、关于乙醇分子的说法正确的是
A.分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.分子中含有1个π键
5、1999年曾报道合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
A.N5+共有34个核外电子
B.N5+中氮一氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1
D.化合物N5AsF6中F化合价为-1
第二章 分子结构与性质
第一节 共价键
主讲人:淄博市张店区第一中学 梁慎光
人教版选修三
以“从具体性知识传授到核心观念建构,从知识解析为本到基于学生认识发展”为教学理念。不仅重视知识技能、过程方法和情感态度价值观等科学素养的静态要素内涵,而且更关注以认识素养为核心的科学素养的功能性结构即认识素养的基本结构。不仅重视新课程的三维目标,且更重视三维目标的化学本质与内涵;不仅关注一般的科学过程和方法,且更关注化学学科的思想方法;不仅提倡化学-技术-社会之间的关系及其相互影响,且更加提倡应用背景与化学之间的本质关系。
一、教学理念
在第一章有关电子云和原子轨道等概念的基础上,介绍了共价键的主要类型σ键和π键。本节内容是第二章分子的结构与性质的基础。物质结构模块理论性非常强,而且概念非常抽象,对于学生来讲感觉比较难以接受。在必修阶段的时候,共价键和离子键的性质是截然不同的,但学习了第一章之后,要让学生明白共价键和离子键已经不是绝对的了。当两种原子之间的电负性相等时,就属于共价键中的非极性键,如果这个差值从0开始慢慢增大,就从非极性键过渡到极性键,让学生建立一个任何理论都不是绝对的,都是一个发展的过程。学生们从这块也能感受到一个认知的变化。从定量化的观点让学生来认识这种逐渐过渡的关系。通过本章的学习,学生能够在分子水平上,从分子结构的视角认识物质的性质,进一步形成有关物质结构的基本观念;学生的学习兴趣能得到有效保持,学生的科学素养能得到进一步提高。
二、全面分析
1、教材的地位与作用:
学生虽具有一定的理性思维能力,但抽象思维能力较弱,还是易于接受感性认识。因此,本节课的教学起点低,并充分利用现代化教学手段,进行多媒体辅助教学,以求突出重点、突破难点。学生在化学必修二中已经学习了化学键的初步知识,知道了离子键和共价键的形成过程。本节将在电子云和原子轨道等概念基础上继续学习共价键的知识,包括共价键的主要类型σ键和π键的知识。由于此部分内容比较抽象,教学过程中运用大量图片引导学生的形象思维,理解σ键和π键的特征。
2、学情分析
能从电子云重叠的角度更深入地了解共价键的实质。
知道共价键的基本类型σ键和π键的形成及其特点。
学会判断常见分子共价键中的σ键和π键。
通过类比、归纳、推理、判断,掌握学习抽象概念的方法,培养学生准确描述概念,深刻理解概念,比较辨析概念的能力。
通过动画演示和学生小组探究活动,培养学生的观察能力、动手能力及分析问题的能力。
通过创设探究活动,使学生主动参与学习过程,激发学生学习兴趣,体会成功获得知识的乐趣。
在分子水平上进一步形成有关物质结构的基本概念,能从物质结构决定性质的视角解释分子的某些性质,并能预测物质的有关性质,体验科学探究过程的乐趣,进而形成科学的价值观。
3、教学目标
(一)知识与技能
(二)过程与方法
(三)情感态度与价值观
在本节课的设计中,知识以问题的形式呈现,以《实效融合》模式为宗旨,使知识问题化、问题层次化,符合学生的认知发展。通过每课一题的设计检查学生的知识储备,并通过几个问题的归理为下面知识部分的学习埋下伏笔,奠定了基础,指明了学习的方向。结合教材的特点及所设计的教学方法,指导学生通过动画模拟微观粒子成键过程,开展学习活动。把微观抽象的变化过程转变为形象直观的画面,让枯燥的理论知识变得形象有趣。学生在前面学习了化学键的初步知识,知道了离子键和共价键的形成过程。在此基础上进一步创设问题情景,激发学生学习的主动性,并培养学生严谨求实的科学态度。同时把学生的被动接受转化为主动探索,以教师为主导,学生为主体,促使学生动眼看、动口说、动脑想,使学生的学习过程和认识过程统一为一个整体。
通过图片及动画模拟电子云图像的方式,形象生动地引出了共价键的主要类型σ键和π键,以及它们的差别。在处理这方面问题时突出体现化学学习的方法,分类、类比的观点。
4、重难点分析及突破方式
教学重点:σ键、π键的特征和性质
教学难点:σ键、π键的特征
根据本节课的内容特点,在教学上采用多媒体动画演示和模型实例相结合的方式,尽可能将抽象的知识具体化、形象化。指导学生从s、p两种形状的电子云按不同方式进行重叠成键的探究入手,帮助学生了解不同种类的共价键(σ键和π键)的特征和性质。
本节课的关键在于设法以尽可能形象化、生动化的手段解决相对抽象的问题。只要能在教学中有效突破电子云按不同方式进行重叠而形成共价键这一基本要点,就可以使学生更好理解两种共价键的特征和性质。
5、教学和学习方法分析
1、充分发挥学生的主体作用和教师的主导作用,采用启发式教学,并遵循循序渐进的教学原则创设问题情景:复习共价键的概念。提出问题:(1)两个H在形成H2时,电子云如何重叠?(2)在HCl、Cl2中,电子云如何重叠?制作动画模型,以H2、HCl、Cl2 为例,研究它们在形成分子时原子轨道的重叠方式,即σ键和π键的成键过程,体会σ键可以旋转而π键不能旋转。
2、对涉及原理的解释,力求通过动画模拟形象分析来解决,即遵守直观性教学的原则。这样有利于学生掌握从现象到本质,从已知到未知逐步形成概念的学习方法,有利于发展学生空间想象能力和逻辑推理能力。
知识铺垫(能层、能级、电子云和原子轨道)→过渡引入→探索新知(对比用电子式表示共价键的形成过程,引导学生从电子云角度分析共价键→学生自主探究s、p轨道以何种方式重叠程度比较大→利用分类思想归纳总结共价键的两种类型——σ键、π键 → 对比探究σ键、π键的共性和差异性)→学以致用(探究利用电子云重叠方式判断共价键成键的规律)→习题巩固强化→知识建构
教学流程
1、关于“电子云”的描述中,正确的是 A、一个小黑点表示一个电子 B、一个小黑点代表电子在此出现过一次 C、电子云是带正电的云雾 D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少
2、下面是s能级p能级的原子轨道图,试回答问题:
⑴s电子的原子轨道呈______形,每个s能级有______个原子轨道;p电子的原子轨道呈____形,每个p能级有_______个原子轨道。 ⑵s电子原子轨道、p电子原子轨道的半径与____________有关,____________越大,原子轨道半径越大。
教学过程
请同学们用电子式表示NaCl、H2、HCl、Cl2分子的形成过程。
Cl +
Cl
Cl
Cl
H + H H H
H + Cl
H
Cl
1、两个H在形成H2时,电子云如何重叠?
能否根据核外电子的运动轨迹来更形象地描述共价键的形成呢?
此图是运用氢原子核外电子的运动轨迹来描述氢分子的形成过程
2、在HCl、Cl2中,电子云如何重叠?
一、共价键
原子间要形成尽可能稳定的共价键,与电子云的重叠程度有关系吗?是什么关系?
电子云如何重叠才能使重叠的程度尽可能大呢?
(1)请同学们利用彩泥制作3个S 轨道(球形) 、 3个P轨道(哑铃形)模型;
(2)试一试能否运用S轨道、P轨道模型,寻找H2、HCl、C12分子在形成分子时原子轨道重叠的最佳方式?
H2分子的形成过程
用电子云来描述共价键的形成过程
相互靠拢
原子轨道以 方式相互 ,导致电子在两核间出现的概率 ,体系的能量 ,形成的共价键。
“头碰头”
重叠
降低
增大
(1)σ键:
共价键的形成
由两个氢原子各提供一个未成对电子1S的原子轨道重叠形成。
相互靠拢
S-S σ键
HCl分子的形成过程
未成对电子的
电子云相互靠拢
电子云相互重叠
s-p σ键
由氢原子各提供一个未成对电子1S的原子轨道和氯原子提供的未成对电子3p的原子轨道重叠形成。
Cl2分子的形成过程
p-p σ键
未成对电子的
电子云相互靠拢
电子云相互重叠
由两个氯原子各提供一个未成对电子3P的原子轨道重叠形成。
S-S重叠
S-P重叠
P-P重叠
σ键成键方式 “头碰头”
σ键的特征
以 方式形成化学键,以两
原子核的 为轴,作 操作,共价键电
子云的图形 ,这种特征称为 。
连线
旋转
不变
轴对称
“头碰头”
是不是分子中的共价键都是σ 键?请分析下图电子云的成键方式。
两个原子
相互接近
电子云重叠
p-p
π键
由两个原子的p电子以 方式重叠形成,导致电子在两核间出现的概率 ,体系的能量 ,形成的共价键。
“肩并肩”
(2)π键:
增大
降低
以 方式形成化学键,电子云是由 组成的,分别位于由两原子核构成平面的 ,如果以它们之间包含原子核的平面为镜面,它们互为 ,这种特征称为 。
π键特征
“肩并肩”
两块
两侧
镜像
镜像对称
比较σ键和π键
σ键 π键
成键方式
电子云形状
特 点
牢固程度
沿轴方向“头碰头”
平行方向“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
哪些共价键是σ键,哪些共价键是π键呢?
一般规律:共价单键是σ键;而共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键组成。
通过比较乙烷、乙烯、乙炔的性质及σ键、π键的牢固程度,推断分子中存在的共价键类型。
z
z
y
y
x
σ
N
N
πz
πy
1、已知氮分子的共价键是三键(N三N),你能模仿图2—1、图2—2、图2—3,通过画图来描述吗?
2.钠和氯通过得失电子同样也是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗 讨论后请填写表2-2:
0.9
2.1
2.5
2.1
0.9
1.0
离子
共价
3.0
3.0
3.5
原子 Na Cl H Cl C O
电负性
电负性之差(绝对值)
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是____键;而____键是电负性相差不大的原子之间形成的化学键。
有没有可能存在 H3 、Cl3 、H2Cl分子?为什么?
共价键的特征
具有饱和性
——决定分子的组成
一、共价键
共价键的形成
以“头碰头”成键,呈轴对称,
类型:s—sσ键、s—pσ键、p—pσ键
以“肩并肩”成键,呈镜像对称。
共价键的特征
1、σ键:
2、π键:
饱和性
——决定分子的组成
具体化
理论化
定量化
应用化
能力
分子组成
原子轨道的重叠方式
共价键的类型
电负性
判断键型
知识
情感态度价值观
走进生活
学科知识
学科思想
学科思想
现实应用
1、下列化合物中只含有一个π键的是( )
A.C2H2 B.H202
C.CH2═CH2 D.HCl
2、下列有关σ键的说法错误的是( )
A.如果电子云图像是由两个s电子重叠形成的,即形成s—sσ键
B.s电子与P电子形成s—pσ键
C.P电子与P电子不能形成σ键
D.HCl分子里含一个s一pσ键
3、下列说法正确的是( )
A.π键是由两个P电子“头碰头”重叠形成
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D.H2分子中含σ键而Cl2分子中还含π键
4、关于乙醇分子的说法正确的是
A.分子中共含有8个极性键
B.分子中不含非极性键
C.分子中只含σ键
D.分子中含有1个π键
5、1999年曾报道合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
A.N5+共有34个核外电子
B.N5+中氮一氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1
D.化合物N5AsF6中F化合价为-1
