必修1第四章第三节硫和氮的氧化物(第一课时)
文档属性
| 名称 | 必修1第四章第三节硫和氮的氧化物(第一课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-10 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
《硫和氮的氧化物》 第1课时
安徽省石台中学 余明霞
2009、03、10
石台牯牛降原始森林一角
被酸雨侵蚀的森林
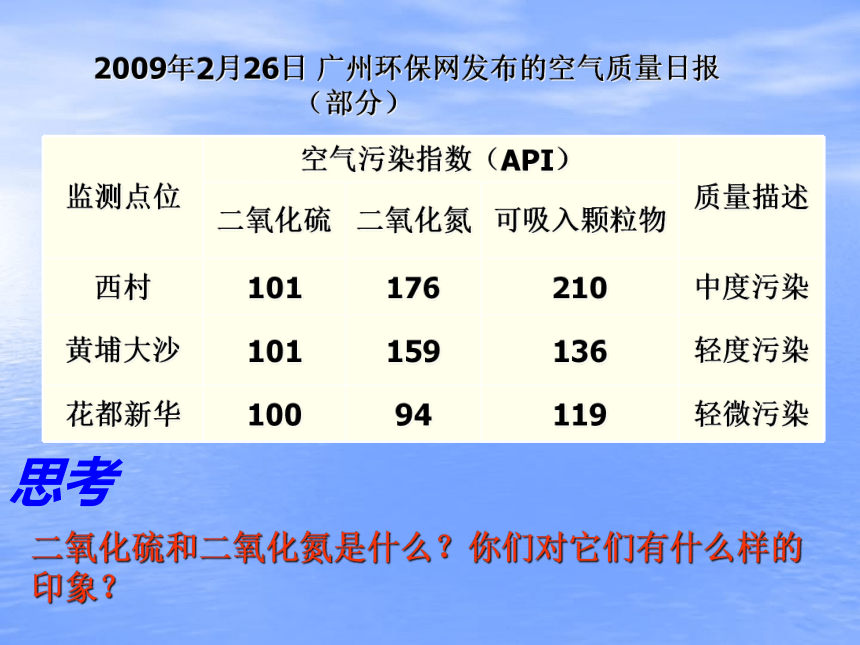
2009年2月26日 广州环保网发布的空气质量日报
(部分)
监测点位 空气污染指数(API) 质量描述
二氧化硫 二氧化氮 可吸入颗粒物
西村 101 176 210 中度污染
黄埔大沙 101 159 136 轻度污染
花都新华 100 94 119 轻微污染
二氧化硫和二氧化氮是什么?你们对它们有什么样的印象?
思考
1.天然:火山爆发、森林火灾、有机体分解、
海洋雾沫等。
2.人为:化石燃料的燃烧、工业尾气等。
一. SO2的来源
硫粉
点燃
S+O2 SO2
第三节 硫和氮的氧化物
P90实验4-7:观察并思考】
1、 实验中原盛有SO2 气体的试管水位有什么变化?说明了什么?
------试管内水位上升;说明
【
二、物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40).
SO2易溶水
【P90实验4-7:观察并思考】
推测SO2性质类似哪个氧化物?根据物质的分类判断SO2 属于哪种氧化物
2、用( ?)检验试管内水溶液酸碱性。
思考
*亚硫酸是一种弱酸,不稳定 ( 酸性:亚硫酸>醋酸>碳酸)
可逆反应: 在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应。
(2) 与碱反应 SO2+2NaOH=Na2SO3+H2O
(3) 与碱性氧化物反应:
SO2+Na2O=Na2SO3 (亚硫酸钠)
SO2 +CaO==CaSO3 (亚硫酸钙)
实验室制取SO2,可选择用碱液吸收尾气,防止空气污 染。
(1) 与H2O反应: SO2+H2O H2SO3(亚硫酸)
1:具有酸性氧化物的通性
与水反应、
与碱反应、
与碱性氧化物反应
三、SO2的化学性质
【P90实验4-7:观察并思考】
3、向试管中水溶液滴加品红溶液,振荡,观察颜色变化?加热试管,再观察有什么变化?
--使品红溶液的红色褪去;加热后,溶液又恢复红色
这是检验SO2的方法之一 .
2. SO2的漂白性
SO2溶于水产生的H2SO3能与某些有色物质结合成不稳定的无色物质而具有漂白性---暂时性.
选择性:不能使紫色石蕊试液褪色
(石蕊变红)
白木耳又叫银耳,属真菌类食品,具有生津、止咳、降火等功效。但一些不法生产者,为了得到更白的银耳,在大棚内放置了硫磺,采用这种传统的“硫黄熏蒸”工艺生产出来的银耳往往会残留一定量的二氧化硫。我国《食品添加剂使用卫生标准》对食品中二氧化硫的允许残留量做了强制性的规定,根据这一标准,银耳产品中不得含有二氧化硫残留。因此银耳并非越白越好。
阅读材料
为什么长时间放置的报纸和草帽会变黄?
【思考】硫有哪些常见化合价?根据有关理论推测 SO2除具有酸的通性外,可能还具有的性质。
可被X2(卤素单质)、KMnO4(H+)等许多氧化剂氧化。SO2能使氯水、溴水和酸性KMnO4溶液褪色。
2SO2 + O2 2SO3
催化剂
△
3:具有较强的还原性:
4、具有氧化性
SO2+ 2H2S = 3S↓+2H2O
{阅读}
资料卡片:(91页)
预防硫化氢中毒
四、SO2的用途
A.制硫酸:S—SO2—SO3—H2SO4
B.漂白纸浆、毛、丝、草帽。
C.杀菌消毒
课堂小结:
二
氧
化
硫
物理性质
1、具有酸性氧化物的通性 SO2 + H2O = H2SO3
SO2 + 2 NaOH = Na2SO3 + H2O
SO2+Na2O=Na2SO3
2、既有氧化性,又有还原性 2SO2 + O2 2SO3
4、漂白性:暂时性漂白,可逆 品红 褪色
红色 无色
无色、有刺激性气味、有毒、易液化、比空气重、易溶于水
化学性质
SO2
催化剂
△
SO2的用途
制硫酸、漂白、杀菌消毒
1、既能使石蕊试液变红,又能使品红试液变为无色,还能使溴水褪色的是( )
A.Cl2 B.HCl C.SO2 D.CO
2、下列气体能用NaOH干燥的是( )
A.NH3 B.SO2 C.Cl2 D.CO2
3、下列可以用来鉴别SO2 和CO2 的方法是( )
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
E、通入酸性高锰酸钾溶液
C
A
BDE
本节课到此结束
谢谢大家
《硫和氮的氧化物》 第1课时
安徽省石台中学 余明霞
2009、03、10
石台牯牛降原始森林一角
被酸雨侵蚀的森林
2009年2月26日 广州环保网发布的空气质量日报
(部分)
监测点位 空气污染指数(API) 质量描述
二氧化硫 二氧化氮 可吸入颗粒物
西村 101 176 210 中度污染
黄埔大沙 101 159 136 轻度污染
花都新华 100 94 119 轻微污染
二氧化硫和二氧化氮是什么?你们对它们有什么样的印象?
思考
1.天然:火山爆发、森林火灾、有机体分解、
海洋雾沫等。
2.人为:化石燃料的燃烧、工业尾气等。
一. SO2的来源
硫粉
点燃
S+O2 SO2
第三节 硫和氮的氧化物
P90实验4-7:观察并思考】
1、 实验中原盛有SO2 气体的试管水位有什么变化?说明了什么?
------试管内水位上升;说明
【
二、物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(常温常压下,1体积水能溶解40体积的二氧化硫,即1:40).
SO2易溶水
【P90实验4-7:观察并思考】
推测SO2性质类似哪个氧化物?根据物质的分类判断SO2 属于哪种氧化物
2、用( ?)检验试管内水溶液酸碱性。
思考
*亚硫酸是一种弱酸,不稳定 ( 酸性:亚硫酸>醋酸>碳酸)
可逆反应: 在同一条件下,既向正反应方向进行,
同时又向逆反应方向进行的反应。
(2) 与碱反应 SO2+2NaOH=Na2SO3+H2O
(3) 与碱性氧化物反应:
SO2+Na2O=Na2SO3 (亚硫酸钠)
SO2 +CaO==CaSO3 (亚硫酸钙)
实验室制取SO2,可选择用碱液吸收尾气,防止空气污 染。
(1) 与H2O反应: SO2+H2O H2SO3(亚硫酸)
1:具有酸性氧化物的通性
与水反应、
与碱反应、
与碱性氧化物反应
三、SO2的化学性质
【P90实验4-7:观察并思考】
3、向试管中水溶液滴加品红溶液,振荡,观察颜色变化?加热试管,再观察有什么变化?
--使品红溶液的红色褪去;加热后,溶液又恢复红色
这是检验SO2的方法之一 .
2. SO2的漂白性
SO2溶于水产生的H2SO3能与某些有色物质结合成不稳定的无色物质而具有漂白性---暂时性.
选择性:不能使紫色石蕊试液褪色
(石蕊变红)
白木耳又叫银耳,属真菌类食品,具有生津、止咳、降火等功效。但一些不法生产者,为了得到更白的银耳,在大棚内放置了硫磺,采用这种传统的“硫黄熏蒸”工艺生产出来的银耳往往会残留一定量的二氧化硫。我国《食品添加剂使用卫生标准》对食品中二氧化硫的允许残留量做了强制性的规定,根据这一标准,银耳产品中不得含有二氧化硫残留。因此银耳并非越白越好。
阅读材料
为什么长时间放置的报纸和草帽会变黄?
【思考】硫有哪些常见化合价?根据有关理论推测 SO2除具有酸的通性外,可能还具有的性质。
可被X2(卤素单质)、KMnO4(H+)等许多氧化剂氧化。SO2能使氯水、溴水和酸性KMnO4溶液褪色。
2SO2 + O2 2SO3
催化剂
△
3:具有较强的还原性:
4、具有氧化性
SO2+ 2H2S = 3S↓+2H2O
{阅读}
资料卡片:(91页)
预防硫化氢中毒
四、SO2的用途
A.制硫酸:S—SO2—SO3—H2SO4
B.漂白纸浆、毛、丝、草帽。
C.杀菌消毒
课堂小结:
二
氧
化
硫
物理性质
1、具有酸性氧化物的通性 SO2 + H2O = H2SO3
SO2 + 2 NaOH = Na2SO3 + H2O
SO2+Na2O=Na2SO3
2、既有氧化性,又有还原性 2SO2 + O2 2SO3
4、漂白性:暂时性漂白,可逆 品红 褪色
红色 无色
无色、有刺激性气味、有毒、易液化、比空气重、易溶于水
化学性质
SO2
催化剂
△
SO2的用途
制硫酸、漂白、杀菌消毒
1、既能使石蕊试液变红,又能使品红试液变为无色,还能使溴水褪色的是( )
A.Cl2 B.HCl C.SO2 D.CO
2、下列气体能用NaOH干燥的是( )
A.NH3 B.SO2 C.Cl2 D.CO2
3、下列可以用来鉴别SO2 和CO2 的方法是( )
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
E、通入酸性高锰酸钾溶液
C
A
BDE
本节课到此结束
谢谢大家
