无机推断
图片预览







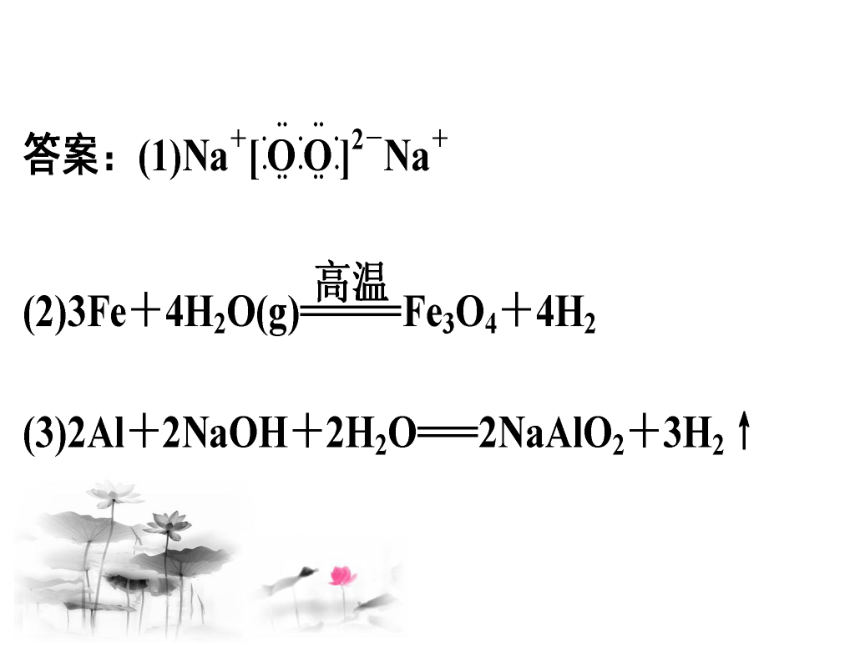




文档简介
(共43张PPT)
题目特点及应对策略
一、无机推断题的特点
无机推断题具有明显的化学学科特点,是现在每年高考理综卷的必考题型,是将基本概念、基本理论、元素单质及其重要化合物知识与化学实验及简单计算有机结合起来的综合题型。在高三复习中抓住无机推断题,不仅能进一步加深元素及其化合物的有关知识,还能培养分析推理、观察思维、获取信息及综合应用的能力。
二、无机推断题的类型
无机推断题包括两种题型:一种为文字推断题,另一种为框图推断题。
“无机文字推断题”属高考必考题型,其考查的知识覆盖面广,综合性强,涉及元素、化合物、物质结构,甚至包括化学计算、化学实验等知识的综合考查,命题方式灵活、形式多样。
“无机框图推断题”作为一种高考的常见题型,它有明显的学科特点,不 仅能考查学生对元素及其化合物主干知识的掌握情况,更能考查思维的敏捷性、发散性、严密性和分析推理能力及综合应用元素化合物知识的能力。这类题型的主要特点是:结构紧凑、文字表述少、包含信息多、综合性强、思维能力要求高。它是多年来考查元素化合物知识的热点题型,具有很高的区分度和很好的选拔功能,在历年的高考试卷中重现率较高。
三、无机推断题的解题方法与思路
解答此类题目的关键是抓住元素、化合物的特性,挖掘解题“题眼”,
并以此为突破口解题。此类试题常见的解题方法为“审→找→析(推)
→验→答”五步。即:
(1)审:审清题意,题干→问题→框图,迅速浏览一遍,尽量在框图
中把相关信息表示出来,明确求解要求。
(2)找:找“题眼”,即找到解题的突破口,此步非常关键。
(3)析(推):从“题眼”出发,联系新信息及所学知识,大胆猜测,
应用正、逆向思维、发散收敛思维、横向纵向思维等多种思维方式,
进行综合分析、推理,初步得出结论。
(4)验:验证确认,将结果放入原题检验,完全符合条件才算正确。
题型1 从物质的特征性质 (颜色、状态等)突破
【例1】 如下图,A、B、C、D、G是五种常见单质,其中A、G为气体。化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,图中部分生成物已略去。
试回答下列问题:
(1)H的电子式为 。
(2)写出反应①的化学方程式为:
________________________________________________________。
(3)C与T溶液反应的化学方程式为_________________________________________________________。
解析:由题意可知,A、G为常见气体单质,且它们能相互化合生成R(液态),则R为H2O;A、G分别为H2和O2中的一种,再结合“G+B(单质) H(淡黄色粉末)”可推知A、B、G、H依次为H2、Na、O2、Na2O2,T为NaOH。由D(单质)分别能与G(O2)、R(H2O)反应都可生成F(黑色晶体)可知,D为Fe,F为Fe3O4。由C(单质)+G(O2) M,且M能与T(NaOH)反应可知,M必为酸性氧化物或两性氧化物。再结合F(Fe3O4)与C生成M(C的氧化物)的反应可知该反应为铝热反应,故可推知C、M、N依次为Al、Al2O3、NaAlO2。
知识归纳——提纲挈领 优化整合
具有特征颜色和状态的常见物质
(淡)黄(棕)色固体:Na2O2、S、FeCl3、CuCl2;黑色固体:MnO2、C、CuO、FeO、Fe3O4;紫(黑)色固体:KMnO4、I2;(紫)红色固体:Cu;绿色固体:Cu2(OH)2CO3。
2. 有色气体:NO2(红棕色)、F2(浅黄绿色)、Cl2(黄绿色);无色刺激性气体:SO2、NH3、HX(X为F、Cl、Br、I);无色无味气体:H2、N2、O2、CO2、CO、CH4、NO。
题型2 从特殊现象突破
(3)为了确定X,现将(1)中的两种物质分别记为A和B,当C和B混合时产生红褐色沉淀和无色气体。C和A混合产生棕灰色沉淀,向沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则A是________(填化学式,下同);B是________;C是________;D是________;X是________。
答案:(1)Na2CO3 Ba(OH)2 (2)AC (3)Ba(OH)2 Na2CO3 Fe2(SO4)3 AlCl3、
SO
3.A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在 C2中燃烧的产物可使品红溶液褪色。F元素位于第四周期第ⅡA族,A与C可形成一种有毒的气体。D的单质是一种金属,该金属可在A与C形成的物质中,剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)AC和N2是等电子体,写出AC的电子式为________。
(2)A元素形成的同素异形体的晶体类型可能是(填序号)________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)A、B、C形成的10电子氢化物中,A、B的氢化物中沸点较低的是(写化学式)________;B、C的氢化物中其分子结合H+能力较强的是(写化学式)________,用一个离子方程式证明:___________________________________________________________。
(4)FA2构成的化合物属于 (填“共价化合物”或“离子化合物”);F形成的碱与过量的AC2反应的化学方程式为
__________________________________________________________。
(5)EC2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体,有关反应的离子方程式为__________________________________________________________。
由此可知EC2和无色气体的还原性较强的是(写化学式)________。
例3.有如图所示的反应(可加热),其中A、B、C、D
为中学化学中常见的单质或化合物,请按要求填空。
(1)若A为黑色固态单质,C为无色有刺激性气味的
气体,则该反应的化学方程式为
________________________________________。
(2)若A为红色金属单质,该反应在常温下剧烈发生且产生有色气
体,则反应中氧化剂与还原剂的物质的量之比为________。
(3)若A为黑色粉末,C为有色气态单质,则产生1 mol C时被氧化的B
的物质的量为________。
题型3 从特征反应突破
(4)若A为白色乳状物,且其溶解度随温度的升高而降低,D可作干燥剂,则该反应在工业上可用于制备________。
题型4 从反应条件突破
【例4】 已知A为液态化合物,B为固态单质,J为淡黄色固体,三者都是中学化学中常见的物质,它们之间相互反应以及生成物之间的关系如下图所示:
请回答下列问题:
(1)其中物质C是大气污染物之一,该物质导致的环境危害有
(写一个即可)。
(2)F、G、H、J、K代表的物质的化学式分别是________、________、________、________、________。
(3)写出A与B反应的化学方程式:___________________________________________________________。
(4)饱和的I溶液中通入过量的气体E出现的现象是____________,写出出现该现象的离子方程式是 。
答案:(1)酸雨、酸雾等
(2)SO3 NaOH O2 Na2O2 Mg
(3)2H2SO4(浓)+C2SO2↑+CO2↑+2H2O
(4)有晶体析出 2Na++CO+H2O+CO2===2NaHCO3↓
例5 A~I的转化关系如图所示:
题型5 从典型数据突破
(1)写出D的分子式:________,A的电子式:________。
(2)写出反应⑤的离子方程式:___________________________________________,
其中氧化剂与还原剂的物质的量之比为________。
(3)若保持反应体系的温度和体积不变,向反应③的平衡体系中加入一定量的D,则达到平衡时,D的转化率________(填“增大”、“减小”或“不变”)。
(4)假设C和D的物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐。写出用烧碱溶液吸收物质的量之比为1∶1的C、D混合物的化学方程式:__________________________________________。
知识归纳——提纲挈领 优化整合
1.具有相同摩尔质量的物质
摩尔质量(g/mol) 28 30 32 44
化学式 CO、N2、C2H4 NO、C2H6、CH2O O2、CH4O、
N2H4 CO2、N2O、C3H8、C2H4O
摩尔质量(g/mol) 46 78 100 120
化学式 NO2、C2H5OH、HCOOH C6H6、N a2O2、Na2S CaCO3、KHCO3、Mg3N2 MgSO4、NaHSO4、CaSO3、KHSO3
2.10电子和18电子微粒
(1)“10电子”的微粒
分子 离 子
一核10电子 Ne N3-、O2-、F-、Na+、Mg2+、Al3+
二核10电子 HF OH-
三核10电子 H2O NH
四核10电子 NH3 H3O+
五核10电子 CH4 NH
(2)“18电子”的微粒
分 子 离 子
一核18电子 Ar K+、Ca2+、Cl-、S2-
二核18电子 F2、HCl O、HS-
三核18电子 H2S
四核18电子 PH3、H2O2
五核18电子 SiH4、CH3F
六核18电子 N2H4、CH3OH
小结:无机推断题关键在找突破口,找不到突破口框图就是一张网,找到突破口则找到了解开这种网的“线头”,所有的问题就可能因为该突破口的突破而迎刃而解。
题目特点及应对策略
一、无机推断题的特点
无机推断题具有明显的化学学科特点,是现在每年高考理综卷的必考题型,是将基本概念、基本理论、元素单质及其重要化合物知识与化学实验及简单计算有机结合起来的综合题型。在高三复习中抓住无机推断题,不仅能进一步加深元素及其化合物的有关知识,还能培养分析推理、观察思维、获取信息及综合应用的能力。
二、无机推断题的类型
无机推断题包括两种题型:一种为文字推断题,另一种为框图推断题。
“无机文字推断题”属高考必考题型,其考查的知识覆盖面广,综合性强,涉及元素、化合物、物质结构,甚至包括化学计算、化学实验等知识的综合考查,命题方式灵活、形式多样。
“无机框图推断题”作为一种高考的常见题型,它有明显的学科特点,不 仅能考查学生对元素及其化合物主干知识的掌握情况,更能考查思维的敏捷性、发散性、严密性和分析推理能力及综合应用元素化合物知识的能力。这类题型的主要特点是:结构紧凑、文字表述少、包含信息多、综合性强、思维能力要求高。它是多年来考查元素化合物知识的热点题型,具有很高的区分度和很好的选拔功能,在历年的高考试卷中重现率较高。
三、无机推断题的解题方法与思路
解答此类题目的关键是抓住元素、化合物的特性,挖掘解题“题眼”,
并以此为突破口解题。此类试题常见的解题方法为“审→找→析(推)
→验→答”五步。即:
(1)审:审清题意,题干→问题→框图,迅速浏览一遍,尽量在框图
中把相关信息表示出来,明确求解要求。
(2)找:找“题眼”,即找到解题的突破口,此步非常关键。
(3)析(推):从“题眼”出发,联系新信息及所学知识,大胆猜测,
应用正、逆向思维、发散收敛思维、横向纵向思维等多种思维方式,
进行综合分析、推理,初步得出结论。
(4)验:验证确认,将结果放入原题检验,完全符合条件才算正确。
题型1 从物质的特征性质 (颜色、状态等)突破
【例1】 如下图,A、B、C、D、G是五种常见单质,其中A、G为气体。化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,图中部分生成物已略去。
试回答下列问题:
(1)H的电子式为 。
(2)写出反应①的化学方程式为:
________________________________________________________。
(3)C与T溶液反应的化学方程式为_________________________________________________________。
解析:由题意可知,A、G为常见气体单质,且它们能相互化合生成R(液态),则R为H2O;A、G分别为H2和O2中的一种,再结合“G+B(单质) H(淡黄色粉末)”可推知A、B、G、H依次为H2、Na、O2、Na2O2,T为NaOH。由D(单质)分别能与G(O2)、R(H2O)反应都可生成F(黑色晶体)可知,D为Fe,F为Fe3O4。由C(单质)+G(O2) M,且M能与T(NaOH)反应可知,M必为酸性氧化物或两性氧化物。再结合F(Fe3O4)与C生成M(C的氧化物)的反应可知该反应为铝热反应,故可推知C、M、N依次为Al、Al2O3、NaAlO2。
知识归纳——提纲挈领 优化整合
具有特征颜色和状态的常见物质
(淡)黄(棕)色固体:Na2O2、S、FeCl3、CuCl2;黑色固体:MnO2、C、CuO、FeO、Fe3O4;紫(黑)色固体:KMnO4、I2;(紫)红色固体:Cu;绿色固体:Cu2(OH)2CO3。
2. 有色气体:NO2(红棕色)、F2(浅黄绿色)、Cl2(黄绿色);无色刺激性气体:SO2、NH3、HX(X为F、Cl、Br、I);无色无味气体:H2、N2、O2、CO2、CO、CH4、NO。
题型2 从特殊现象突破
(3)为了确定X,现将(1)中的两种物质分别记为A和B,当C和B混合时产生红褐色沉淀和无色气体。C和A混合产生棕灰色沉淀,向沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则A是________(填化学式,下同);B是________;C是________;D是________;X是________。
答案:(1)Na2CO3 Ba(OH)2 (2)AC (3)Ba(OH)2 Na2CO3 Fe2(SO4)3 AlCl3、
SO
3.A、B、C、D、E、F是原子序数依次增大的六种常见元素。E的单质在 C2中燃烧的产物可使品红溶液褪色。F元素位于第四周期第ⅡA族,A与C可形成一种有毒的气体。D的单质是一种金属,该金属可在A与C形成的物质中,剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)AC和N2是等电子体,写出AC的电子式为________。
(2)A元素形成的同素异形体的晶体类型可能是(填序号)________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)A、B、C形成的10电子氢化物中,A、B的氢化物中沸点较低的是(写化学式)________;B、C的氢化物中其分子结合H+能力较强的是(写化学式)________,用一个离子方程式证明:___________________________________________________________。
(4)FA2构成的化合物属于 (填“共价化合物”或“离子化合物”);F形成的碱与过量的AC2反应的化学方程式为
__________________________________________________________。
(5)EC2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体,有关反应的离子方程式为__________________________________________________________。
由此可知EC2和无色气体的还原性较强的是(写化学式)________。
例3.有如图所示的反应(可加热),其中A、B、C、D
为中学化学中常见的单质或化合物,请按要求填空。
(1)若A为黑色固态单质,C为无色有刺激性气味的
气体,则该反应的化学方程式为
________________________________________。
(2)若A为红色金属单质,该反应在常温下剧烈发生且产生有色气
体,则反应中氧化剂与还原剂的物质的量之比为________。
(3)若A为黑色粉末,C为有色气态单质,则产生1 mol C时被氧化的B
的物质的量为________。
题型3 从特征反应突破
(4)若A为白色乳状物,且其溶解度随温度的升高而降低,D可作干燥剂,则该反应在工业上可用于制备________。
题型4 从反应条件突破
【例4】 已知A为液态化合物,B为固态单质,J为淡黄色固体,三者都是中学化学中常见的物质,它们之间相互反应以及生成物之间的关系如下图所示:
请回答下列问题:
(1)其中物质C是大气污染物之一,该物质导致的环境危害有
(写一个即可)。
(2)F、G、H、J、K代表的物质的化学式分别是________、________、________、________、________。
(3)写出A与B反应的化学方程式:___________________________________________________________。
(4)饱和的I溶液中通入过量的气体E出现的现象是____________,写出出现该现象的离子方程式是 。
答案:(1)酸雨、酸雾等
(2)SO3 NaOH O2 Na2O2 Mg
(3)2H2SO4(浓)+C2SO2↑+CO2↑+2H2O
(4)有晶体析出 2Na++CO+H2O+CO2===2NaHCO3↓
例5 A~I的转化关系如图所示:
题型5 从典型数据突破
(1)写出D的分子式:________,A的电子式:________。
(2)写出反应⑤的离子方程式:___________________________________________,
其中氧化剂与还原剂的物质的量之比为________。
(3)若保持反应体系的温度和体积不变,向反应③的平衡体系中加入一定量的D,则达到平衡时,D的转化率________(填“增大”、“减小”或“不变”)。
(4)假设C和D的物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐。写出用烧碱溶液吸收物质的量之比为1∶1的C、D混合物的化学方程式:__________________________________________。
知识归纳——提纲挈领 优化整合
1.具有相同摩尔质量的物质
摩尔质量(g/mol) 28 30 32 44
化学式 CO、N2、C2H4 NO、C2H6、CH2O O2、CH4O、
N2H4 CO2、N2O、C3H8、C2H4O
摩尔质量(g/mol) 46 78 100 120
化学式 NO2、C2H5OH、HCOOH C6H6、N a2O2、Na2S CaCO3、KHCO3、Mg3N2 MgSO4、NaHSO4、CaSO3、KHSO3
2.10电子和18电子微粒
(1)“10电子”的微粒
分子 离 子
一核10电子 Ne N3-、O2-、F-、Na+、Mg2+、Al3+
二核10电子 HF OH-
三核10电子 H2O NH
四核10电子 NH3 H3O+
五核10电子 CH4 NH
(2)“18电子”的微粒
分 子 离 子
一核18电子 Ar K+、Ca2+、Cl-、S2-
二核18电子 F2、HCl O、HS-
三核18电子 H2S
四核18电子 PH3、H2O2
五核18电子 SiH4、CH3F
六核18电子 N2H4、CH3OH
小结:无机推断题关键在找突破口,找不到突破口框图就是一张网,找到突破口则找到了解开这种网的“线头”,所有的问题就可能因为该突破口的突破而迎刃而解。
