2020-2021学年人教版高二化学选修3-3.1.1《 晶体与非晶体》课时训练试题(含解析)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3-3.1.1《 晶体与非晶体》课时训练试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 223.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-18 07:11:07 | ||
图片预览




文档简介
(人教版选修3)3.1.1《晶体与非晶体》课时训练试题(原卷版)
(时间:40分钟 满分:100分)
一、单项选择题:本题包括16小题,每小题5分,共80分。
1.下列物质都是固体,其中不是晶体的是( )
①橡胶 ②石墨 ③冰 ④干冰 ⑤冰醋酸 ⑥石蜡 ⑦玻璃
A.①⑥⑦ B.①②⑦
C.②④⑤⑦ D.①③⑥⑦
2.下列叙述不属于晶体特点的是
A.有规则的几何外形 B.具有各向异性
C.有自范性 D.没有固定熔点
3.下列各组物质前者是晶体后者是非晶体的是
A.白磷、胆矾 B.碘、橡胶
C.石蜡、塑料 D.食盐、蔗糖
4.下列关于各向异性的描述中正确的是
A.各向异性是指非晶体没有规则的几何形状
B.各向异性是指非晶体的物理性质与方向的关系
C.各向异性是指非晶体的内部结构与方向有关
D.各向异性是指晶体的物理性质与方向的关系
5.下列途径不能得到晶体的是
A.FeCl3蒸气冷凝 B.熔融态SiO2热液缓慢冷却
C.熔融态SiO2快速冷却 D.CuSO4饱和溶液蒸发浓缩后冷却
6.下列关于晶体的叙述中,不正确的是
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
7.下列对分子及其性质的解释中,不正确的是
A.区分晶体 Ni 和非晶体 Ni 最可靠的科学方法是 X-射线衍射法
B.CH4、CO2、BF3 都是含有极性键的非极性分子
C.[Cu(NH3)4]2+ 中含有离子键、极性键、配位键
D.基态碳原子核外有三种能量不同的电子
8.下列不能支持石墨是晶体这一事实的是
A.石墨和金刚石互为同素异形体
B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3850℃
D.在石墨的X射线衍射图谱上有分立的斑点或明锐的衍射峰
9.下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;④晶体内部的微粒按一定规律呈周期性排列;⑤晶胞是晶体结构的基本单元;⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
10.如图是某固体的微观结构示意图,请认真观察两图,判断下列说法正确的是
A.两种物质在一定条件下都会自动形成有规则几何外形的晶体
B.I形成的固体的物理性质有各向异性
C.Ⅱ形成的固体一定有固定的熔、沸点
D.二者都属于晶体
11.下列有关等离子体的叙述,不正确的是( )
A.等离子体是物质的另一种聚集状态 B.等离子体是很好的导体
C.水可能形成等离子体状态 D.等离子体中的微粒不带电荷
12.下列关于特殊聚集状态的应用的描述中,错误的是( )
A.运用等离子束切割金属
B.晶体合金的硬度和强度均比非晶体合金的硬度和强度高
C.液晶用于各种显示仪器上
D.化妆品中加入纳米颗粒可使其具备防紫外线的功能
13.下列过程得到的固体物质不是晶体的是
A.降低KCl饱和溶液的温度所得到的固体
B.气态碘直接冷却成固态碘
C.熔融的false冷却后所得到的固体
D.将液态的塑料冷却后所得到的固体
14.下列关于晶体的叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
15.如图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外4个紧邻的水分子形成四面体
B.冰晶体具有三维骨架结构,是共价晶体
C.水分子间通过H—O形成冰晶体
D.冰融化后,水分子之间空隙增大
16.下列说法不正确的是( )
A.Na2O中离子键的百分数为62%,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理;SiO2是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
二、非选择题:本体包括2小题,共20分。
17.(10分)(1)晶体的自范性即___________,区分晶体与非晶体最可靠的实验方法是____________________________________。
(2)原子间通过共用电子对所形成的相互作用叫作共价键。false键与false键都属于共价键,false键的特征是________________________,false键的特征是____________________。
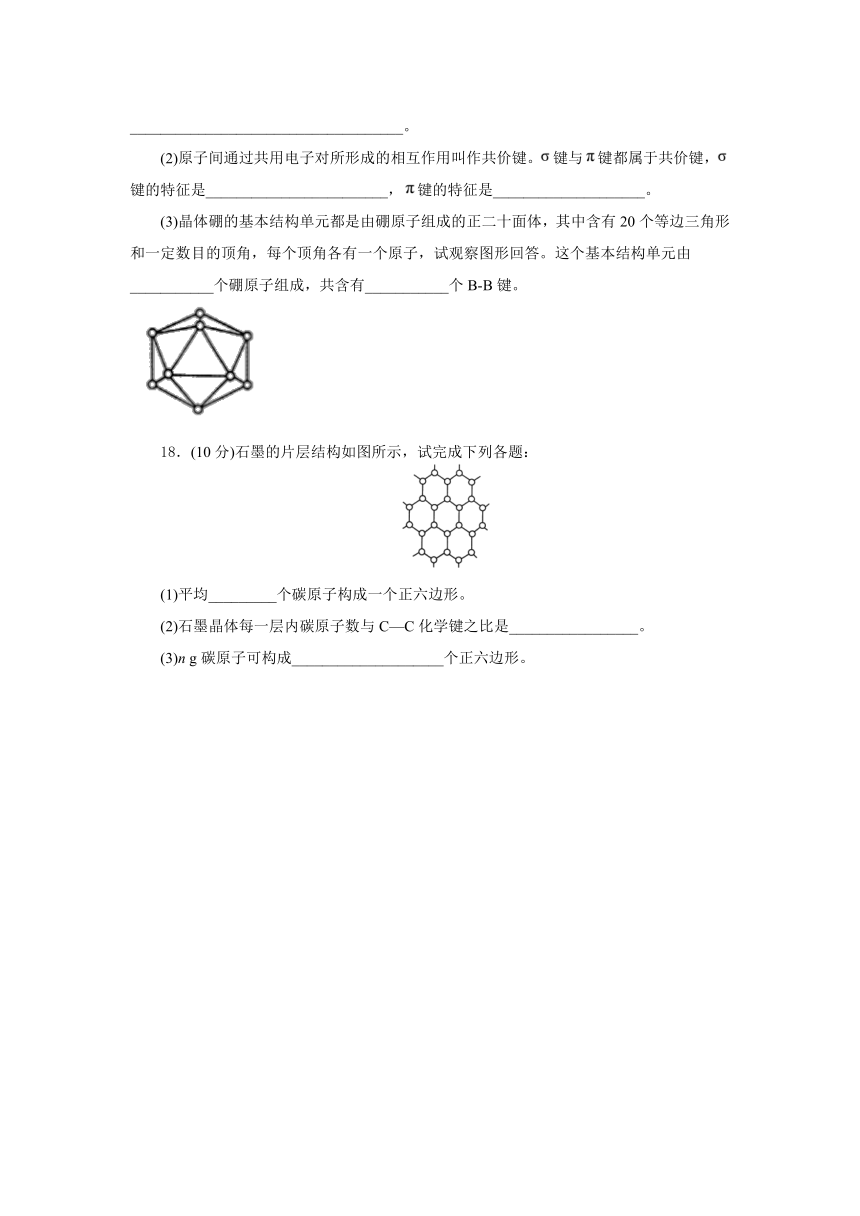
(3)晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由___________个硼原子组成,共含有___________个B-B键。
18.(10分)石墨的片层结构如图所示,试完成下列各题:
(1)平均_________个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是_________________。
(3)n g碳原子可构成____________________个正六边形。
(人教版选修3)3.1.1《晶体与非晶体》课时训练试题(解析版)
(时间:40分钟 满分:100分)
一、单项选择题:本题包括16小题,每小题5分,共80分。
1.下列物质都是固体,其中不是晶体的是( A )
①橡胶 ②石墨 ③冰 ④干冰 ⑤冰醋酸 ⑥石蜡 ⑦玻璃
A.①⑥⑦ B.①②⑦
C.②④⑤⑦ D.①③⑥⑦
【答案】A
【解析】石墨是一类特殊晶体,石蜡是石油分馏产物之一,是由多种烃组成的混合物。
2.下列叙述不属于晶体特点的是
A.有规则的几何外形 B.具有各向异性
C.有自范性 D.没有固定熔点
【答案】D
【解析】晶体具有规则的几何外形、各向异性、自范性等特点且晶体有固定的熔点.,故选:D。
3.下列各组物质前者是晶体后者是非晶体的是
A.白磷、胆矾 B.碘、橡胶
C.石蜡、塑料 D.食盐、蔗糖
【答案】B
【解析】A.白磷(P4)为分子晶体,胆矾(CuSO4·5H2O)为离子晶体,A不符合题意;B.碘为分子晶体,橡胶为非晶体,B符合题意;C.石蜡和塑料均为非晶体,C不符合题意;D.食盐为NaCl属于离子晶体,蔗糖为分子晶体,D不符合题意;综上所述答案为B。
4.下列关于各向异性的描述中正确的是
A.各向异性是指非晶体没有规则的几何形状
B.各向异性是指非晶体的物理性质与方向的关系
C.各向异性是指非晶体的内部结构与方向有关
D.各向异性是指晶体的物理性质与方向的关系
【答案】D
【解析】各向异性指晶体在不同的方向上表现出不同的物理性质,综上所述,故选D。
5.下列途径不能得到晶体的是
A.FeCl3蒸气冷凝 B.熔融态SiO2热液缓慢冷却
C.熔融态SiO2快速冷却 D.CuSO4饱和溶液蒸发浓缩后冷却
【答案】C
【解析】得到晶体一般有三条途径:①熔融态物质凝固;②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。A.FeCl3蒸气冷凝得到氯化铁晶体,A不符合题意;
B.熔融态SiO2热液缓慢冷却可以得到SiO2晶体,B不符合题意C.熔融态物质急速冷却得到玻璃态物质,不属于晶体,C符合题意;D.硫酸不挥发,所以CuSO4饱和溶液蒸发浓缩后冷却可以得到硫酸晶体,D不符合题意;综上所述答案为C。
6.下列关于晶体的叙述中,不正确的是
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
【答案】B
【解析】A.晶体的自范性是指在适宜条件下,晶体能够自发地呈现规则的多面体外形的性质,故A不选;B.许多固体粉末仍是晶体,具有晶体的性质,故B不选;C.构成晶体的粒子在微观空间里呈现周期性有序排列,则晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果,故C选;D.晶体在不同方向上物质微粒的排列情况不同,即为各向异性,具有特定的方向性,故D不选;故选:B。
7.下列对分子及其性质的解释中,不正确的是
A.区分晶体 Ni 和非晶体 Ni 最可靠的科学方法是 X-射线衍射法
B.CH4、CO2、BF3 都是含有极性键的非极性分子
C.[Cu(NH3)4]2+ 中含有离子键、极性键、配位键
D.基态碳原子核外有三种能量不同的电子
【答案】C
【解析】A.晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X-射线衍射可以看到微观结构,区分晶体 Ni 和非晶体 Ni 最可靠的科学方法是 X-射线衍射法,故A正确;B.CH4、CO2、BF3 的构型分别为正四面体形、直线形、正三角形,都是含有极性键的非极性分子,故B正确;C.[Cu(NH3)4]2+是阳离子,有阴离子存在时才能形成离子键,故C错误;D.基态碳原子的原子核外电子数排布为1s22s22p2,有1s、2s、2p三种能量不同的轨道,有三种能量不同的电子,故D正确;故选C。
8.下列不能支持石墨是晶体这一事实的是
A.石墨和金刚石互为同素异形体
B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3850℃
D.在石墨的X射线衍射图谱上有分立的斑点或明锐的衍射峰
【答案】A
【解析】原子在三维空间里呈周期性有序排列(B项)、有自范性、有固定的熔点(C项)、物理性质上本现各向异性、X射线衍射图谱上有分立的斑点或明税的衍射峰(D项)等特征,都是晶体在各个方面有别于非晶体的体现。而是否互为同素异形体与是否为晶体这两者之间并无联系,如无定形碳也与金刚石、石墨互为同素异形体,却属于非晶体,故A符合。故选A。
9.下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;④晶体内部的微粒按一定规律呈周期性排列;⑤晶胞是晶体结构的基本单元;⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
【答案】D
【解析】晶体中原子呈周期性有序排列,有自范性,非晶体中原子排列相对无序,无自范性,故①正确;晶胞是晶体中最小的重复的“平行六面体”,故②不正确;许多固体粉末虽然用肉眼看不到晶体外形,但通过光学显微镜或电子显微镜可以观察到规则的几何外形,这些固体粉末仍是晶体,故③不正确;晶体内部的微粒按一定规律呈周期性排列,故④正确;
晶胞是晶体结构的基本单元,故⑤正确;晶体尽量采取紧密堆积的方式,以使其更稳定,故⑥正确;不正确的是②③,选D。
10.如图是某固体的微观结构示意图,请认真观察两图,判断下列说法正确的是
A.两种物质在一定条件下都会自动形成有规则几何外形的晶体
B.I形成的固体的物理性质有各向异性
C.Ⅱ形成的固体一定有固定的熔、沸点
D.二者都属于晶体
【答案】B
【解析】观察题图知,I中微粒呈周期性有序排列,Ⅱ中微粒排列相对无序,故I为晶体,Ⅱ为非晶体。A.两种物质中I为晶体,Ⅱ为非晶体,I在一定条件下会自动形成有规则几何外形的晶体,Ⅱ为非晶体,无此特点,A错误;B.I为晶体具有各向异性,B正确;
C.Ⅱ为非晶体,非晶体没有固定的熔沸点,C错误;D.I为晶体,Ⅱ为非晶体,D错误;
案选B。
11.下列有关等离子体的叙述,不正确的是( )
A.等离子体是物质的另一种聚集状态 B.等离子体是很好的导体
C.水可能形成等离子体状态 D.等离子体中的微粒不带电荷
【答案】D
【解析】A.等离子体由离子、电子以及未电离的中性粒子的集合组成, 是物质的另一种聚集状态,故A正确;B.等离子体具有良好的导电性,是很好的导体,故B正确;C.通过强热、电磁辐射等方式也能由水形成等离子体,故C正确;D. 等离子体中的微粒带有电荷,而且能自由移动,所以等离子体具有良好的导电性,故D错误;答案选D。
12.下列关于特殊聚集状态的应用的描述中,错误的是( )
A.运用等离子束切割金属
B.晶体合金的硬度和强度均比非晶体合金的硬度和强度高
C.液晶用于各种显示仪器上
D.化妆品中加入纳米颗粒可使其具备防紫外线的功能
【答案】B
【解析】A.运用等离子束切割金属,是利用高温等离子电弧的热量使工件切口处的金属部分或局部熔化,故A正确;B.某些非晶体合金的硬度和强度比晶体合金的硬度和强度高,故B错误;C.液晶用于各种显示仪器上,液晶具有显著的电光特性,故C正确;D.纳米颗粒具有极强的紫外线屏蔽能力,化妆品中加入纳米颗粒可使其具备防紫外线的功能,故D正确;故选B。
13.下列过程得到的固体物质不是晶体的是
A.降低KCl饱和溶液的温度所得到的固体
B.气态碘直接冷却成固态碘
C.熔融的false冷却后所得到的固体
D.将液态的塑料冷却后所得到的固体
【答案】D
【解析】形成晶体的三种途径:,塑料是非晶体,综上所述,故选D。
14.下列关于晶体的叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
【答案】B
【解析】A.晶体的自范性是指在适宜条件下,晶体能够自发地呈现规则的多面体外形的性质,故A不选;B.许多固体粉末仍是晶体,具有晶体的性质,故B不选;C.构成晶体的粒子在微观空间里呈现周期性有序排列,则晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果,故C选;D.晶体在不同方向上物质微粒的排列情况不同,即为各向异性,具有特定的方向性,故D不选;故选:B。
15.如图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外4个紧邻的水分子形成四面体
B.冰晶体具有三维骨架结构,是共价晶体
C.水分子间通过H—O形成冰晶体
D.冰融化后,水分子之间空隙增大
【答案】A
【解析】A. H2O分子是沿O的4个false杂化轨道形成氢键的,冰晶体中每个水分子与另外4个紧邻的水分子形成四面体,故A正确;B. 冰晶体中的水分子是靠氢键结合在一起的,氢键不是化学键,故B错误;C. 水分子间通过氢键形成冰晶体,故C错误;D. 因为冰晶体中形成的氢键具有方向性和饱和性,故水分子靠氢键连接后,分子间空隙变大,导致冰融化成水后,水分子之间空隙减小,故D错误。故选A。
16.下列说法不正确的是( )
A.Na2O中离子键的百分数为62%,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理;SiO2是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
【答案】C
【解析】A.Na2O中离子键的百分数为62%,说明还存在共价键,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故A正确;B.离子键与共价键的区别在于形成化学键的两元素电负性差值,差值大为离子键,差值小为共价键,Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,故B正确;C.Al2O3、SiO2均是偏向共价晶体的过渡晶体,当作共价晶体来处理,故C错误;D.根据微粒间存在的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型,故D正确;故选C。
二、非选择题:本体包括2小题,共20分。
17.(10分)(1)晶体的自范性即___________,区分晶体与非晶体最可靠的实验方法是___________。
(2)原子间通过共用电子对所形成的相互作用叫作共价键。false键与false键都属于共价键,false键的特征是________________________,false键的特征是____________________。
(3)晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由___________个硼原子组成,共含有___________个B-B键。
【答案】(1)晶体能自发地呈现多面体外形的性质 X射线衍射实验 (2)轴对称 镜面对称 (3)12 30
【解析】(1)晶体的自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象;区分晶体和非晶体的最科学的实验方法是X射线衍射实验;故答案为:晶体能自发地呈现多面体外形的性质;X射线衍射实验。(2)原子间通过共用电子对所形成的相互作用叫作共价键。共价单键都是false键,而共价双键一个是false键,一个是false键,false键是电子云“头碰头”重合,false键的特征是轴对称,可以沿轴的方向旋转,false键是电子云“肩并肩”重合重叠程度小,false键的特征是镜面对称不能旋转,一旦旋转,共价键就被破坏;故答案为:轴对称;镜面对称。(3)硼原子组成的正二十面体,即每个面就是一个等边三角形,共有20个面,每个顶角为5个三角形所共用,所以20个等边三角形所含有的顶角数为false,即原子个数为12;因为每条边为2个三角形所共用,所以20个等边三角形含有的边数为false,即false键数目为30;故答案为:12; 30。
18.(10分)石墨的片层结构如图所示,试完成下列各题:
(1)平均_________个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是_________________。
(3)n g碳原子可构成____________________个正六边形。
【答案】(1)2(3分) (2)2:3 (3分) (3) (4分)
【解析】(1)方法1:利用点与面之间的关系,平均每个正六边形需碳原子:6×=2(个)。
方法2:每个碳原子提供的边数为3×=1.5,故=2(个)。
(2)分析每一正六边形:①所占的碳原子数为6×=2;②所占的C—C键数为6×=3,故答案为2?3。
(3)n g碳的原子数为NA,故答案为。
(时间:40分钟 满分:100分)
一、单项选择题:本题包括16小题,每小题5分,共80分。
1.下列物质都是固体,其中不是晶体的是( )
①橡胶 ②石墨 ③冰 ④干冰 ⑤冰醋酸 ⑥石蜡 ⑦玻璃
A.①⑥⑦ B.①②⑦
C.②④⑤⑦ D.①③⑥⑦
2.下列叙述不属于晶体特点的是
A.有规则的几何外形 B.具有各向异性
C.有自范性 D.没有固定熔点
3.下列各组物质前者是晶体后者是非晶体的是
A.白磷、胆矾 B.碘、橡胶
C.石蜡、塑料 D.食盐、蔗糖
4.下列关于各向异性的描述中正确的是
A.各向异性是指非晶体没有规则的几何形状
B.各向异性是指非晶体的物理性质与方向的关系
C.各向异性是指非晶体的内部结构与方向有关
D.各向异性是指晶体的物理性质与方向的关系
5.下列途径不能得到晶体的是
A.FeCl3蒸气冷凝 B.熔融态SiO2热液缓慢冷却
C.熔融态SiO2快速冷却 D.CuSO4饱和溶液蒸发浓缩后冷却
6.下列关于晶体的叙述中,不正确的是
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
7.下列对分子及其性质的解释中,不正确的是
A.区分晶体 Ni 和非晶体 Ni 最可靠的科学方法是 X-射线衍射法
B.CH4、CO2、BF3 都是含有极性键的非极性分子
C.[Cu(NH3)4]2+ 中含有离子键、极性键、配位键
D.基态碳原子核外有三种能量不同的电子
8.下列不能支持石墨是晶体这一事实的是
A.石墨和金刚石互为同素异形体
B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3850℃
D.在石墨的X射线衍射图谱上有分立的斑点或明锐的衍射峰
9.下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;④晶体内部的微粒按一定规律呈周期性排列;⑤晶胞是晶体结构的基本单元;⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
10.如图是某固体的微观结构示意图,请认真观察两图,判断下列说法正确的是
A.两种物质在一定条件下都会自动形成有规则几何外形的晶体
B.I形成的固体的物理性质有各向异性
C.Ⅱ形成的固体一定有固定的熔、沸点
D.二者都属于晶体
11.下列有关等离子体的叙述,不正确的是( )
A.等离子体是物质的另一种聚集状态 B.等离子体是很好的导体
C.水可能形成等离子体状态 D.等离子体中的微粒不带电荷
12.下列关于特殊聚集状态的应用的描述中,错误的是( )
A.运用等离子束切割金属
B.晶体合金的硬度和强度均比非晶体合金的硬度和强度高
C.液晶用于各种显示仪器上
D.化妆品中加入纳米颗粒可使其具备防紫外线的功能
13.下列过程得到的固体物质不是晶体的是
A.降低KCl饱和溶液的温度所得到的固体
B.气态碘直接冷却成固态碘
C.熔融的false冷却后所得到的固体
D.将液态的塑料冷却后所得到的固体
14.下列关于晶体的叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
15.如图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外4个紧邻的水分子形成四面体
B.冰晶体具有三维骨架结构,是共价晶体
C.水分子间通过H—O形成冰晶体
D.冰融化后,水分子之间空隙增大
16.下列说法不正确的是( )
A.Na2O中离子键的百分数为62%,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理;SiO2是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
二、非选择题:本体包括2小题,共20分。
17.(10分)(1)晶体的自范性即___________,区分晶体与非晶体最可靠的实验方法是____________________________________。
(2)原子间通过共用电子对所形成的相互作用叫作共价键。false键与false键都属于共价键,false键的特征是________________________,false键的特征是____________________。
(3)晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由___________个硼原子组成,共含有___________个B-B键。
18.(10分)石墨的片层结构如图所示,试完成下列各题:
(1)平均_________个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是_________________。
(3)n g碳原子可构成____________________个正六边形。
(人教版选修3)3.1.1《晶体与非晶体》课时训练试题(解析版)
(时间:40分钟 满分:100分)
一、单项选择题:本题包括16小题,每小题5分,共80分。
1.下列物质都是固体,其中不是晶体的是( A )
①橡胶 ②石墨 ③冰 ④干冰 ⑤冰醋酸 ⑥石蜡 ⑦玻璃
A.①⑥⑦ B.①②⑦
C.②④⑤⑦ D.①③⑥⑦
【答案】A
【解析】石墨是一类特殊晶体,石蜡是石油分馏产物之一,是由多种烃组成的混合物。
2.下列叙述不属于晶体特点的是
A.有规则的几何外形 B.具有各向异性
C.有自范性 D.没有固定熔点
【答案】D
【解析】晶体具有规则的几何外形、各向异性、自范性等特点且晶体有固定的熔点.,故选:D。
3.下列各组物质前者是晶体后者是非晶体的是
A.白磷、胆矾 B.碘、橡胶
C.石蜡、塑料 D.食盐、蔗糖
【答案】B
【解析】A.白磷(P4)为分子晶体,胆矾(CuSO4·5H2O)为离子晶体,A不符合题意;B.碘为分子晶体,橡胶为非晶体,B符合题意;C.石蜡和塑料均为非晶体,C不符合题意;D.食盐为NaCl属于离子晶体,蔗糖为分子晶体,D不符合题意;综上所述答案为B。
4.下列关于各向异性的描述中正确的是
A.各向异性是指非晶体没有规则的几何形状
B.各向异性是指非晶体的物理性质与方向的关系
C.各向异性是指非晶体的内部结构与方向有关
D.各向异性是指晶体的物理性质与方向的关系
【答案】D
【解析】各向异性指晶体在不同的方向上表现出不同的物理性质,综上所述,故选D。
5.下列途径不能得到晶体的是
A.FeCl3蒸气冷凝 B.熔融态SiO2热液缓慢冷却
C.熔融态SiO2快速冷却 D.CuSO4饱和溶液蒸发浓缩后冷却
【答案】C
【解析】得到晶体一般有三条途径:①熔融态物质凝固;②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。A.FeCl3蒸气冷凝得到氯化铁晶体,A不符合题意;
B.熔融态SiO2热液缓慢冷却可以得到SiO2晶体,B不符合题意C.熔融态物质急速冷却得到玻璃态物质,不属于晶体,C符合题意;D.硫酸不挥发,所以CuSO4饱和溶液蒸发浓缩后冷却可以得到硫酸晶体,D不符合题意;综上所述答案为C。
6.下列关于晶体的叙述中,不正确的是
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
【答案】B
【解析】A.晶体的自范性是指在适宜条件下,晶体能够自发地呈现规则的多面体外形的性质,故A不选;B.许多固体粉末仍是晶体,具有晶体的性质,故B不选;C.构成晶体的粒子在微观空间里呈现周期性有序排列,则晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果,故C选;D.晶体在不同方向上物质微粒的排列情况不同,即为各向异性,具有特定的方向性,故D不选;故选:B。
7.下列对分子及其性质的解释中,不正确的是
A.区分晶体 Ni 和非晶体 Ni 最可靠的科学方法是 X-射线衍射法
B.CH4、CO2、BF3 都是含有极性键的非极性分子
C.[Cu(NH3)4]2+ 中含有离子键、极性键、配位键
D.基态碳原子核外有三种能量不同的电子
【答案】C
【解析】A.晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X-射线衍射可以看到微观结构,区分晶体 Ni 和非晶体 Ni 最可靠的科学方法是 X-射线衍射法,故A正确;B.CH4、CO2、BF3 的构型分别为正四面体形、直线形、正三角形,都是含有极性键的非极性分子,故B正确;C.[Cu(NH3)4]2+是阳离子,有阴离子存在时才能形成离子键,故C错误;D.基态碳原子的原子核外电子数排布为1s22s22p2,有1s、2s、2p三种能量不同的轨道,有三种能量不同的电子,故D正确;故选C。
8.下列不能支持石墨是晶体这一事实的是
A.石墨和金刚石互为同素异形体
B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3850℃
D.在石墨的X射线衍射图谱上有分立的斑点或明锐的衍射峰
【答案】A
【解析】原子在三维空间里呈周期性有序排列(B项)、有自范性、有固定的熔点(C项)、物理性质上本现各向异性、X射线衍射图谱上有分立的斑点或明税的衍射峰(D项)等特征,都是晶体在各个方面有别于非晶体的体现。而是否互为同素异形体与是否为晶体这两者之间并无联系,如无定形碳也与金刚石、石墨互为同素异形体,却属于非晶体,故A符合。故选A。
9.下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;④晶体内部的微粒按一定规律呈周期性排列;⑤晶胞是晶体结构的基本单元;⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
【答案】D
【解析】晶体中原子呈周期性有序排列,有自范性,非晶体中原子排列相对无序,无自范性,故①正确;晶胞是晶体中最小的重复的“平行六面体”,故②不正确;许多固体粉末虽然用肉眼看不到晶体外形,但通过光学显微镜或电子显微镜可以观察到规则的几何外形,这些固体粉末仍是晶体,故③不正确;晶体内部的微粒按一定规律呈周期性排列,故④正确;
晶胞是晶体结构的基本单元,故⑤正确;晶体尽量采取紧密堆积的方式,以使其更稳定,故⑥正确;不正确的是②③,选D。
10.如图是某固体的微观结构示意图,请认真观察两图,判断下列说法正确的是
A.两种物质在一定条件下都会自动形成有规则几何外形的晶体
B.I形成的固体的物理性质有各向异性
C.Ⅱ形成的固体一定有固定的熔、沸点
D.二者都属于晶体
【答案】B
【解析】观察题图知,I中微粒呈周期性有序排列,Ⅱ中微粒排列相对无序,故I为晶体,Ⅱ为非晶体。A.两种物质中I为晶体,Ⅱ为非晶体,I在一定条件下会自动形成有规则几何外形的晶体,Ⅱ为非晶体,无此特点,A错误;B.I为晶体具有各向异性,B正确;
C.Ⅱ为非晶体,非晶体没有固定的熔沸点,C错误;D.I为晶体,Ⅱ为非晶体,D错误;
案选B。
11.下列有关等离子体的叙述,不正确的是( )
A.等离子体是物质的另一种聚集状态 B.等离子体是很好的导体
C.水可能形成等离子体状态 D.等离子体中的微粒不带电荷
【答案】D
【解析】A.等离子体由离子、电子以及未电离的中性粒子的集合组成, 是物质的另一种聚集状态,故A正确;B.等离子体具有良好的导电性,是很好的导体,故B正确;C.通过强热、电磁辐射等方式也能由水形成等离子体,故C正确;D. 等离子体中的微粒带有电荷,而且能自由移动,所以等离子体具有良好的导电性,故D错误;答案选D。
12.下列关于特殊聚集状态的应用的描述中,错误的是( )
A.运用等离子束切割金属
B.晶体合金的硬度和强度均比非晶体合金的硬度和强度高
C.液晶用于各种显示仪器上
D.化妆品中加入纳米颗粒可使其具备防紫外线的功能
【答案】B
【解析】A.运用等离子束切割金属,是利用高温等离子电弧的热量使工件切口处的金属部分或局部熔化,故A正确;B.某些非晶体合金的硬度和强度比晶体合金的硬度和强度高,故B错误;C.液晶用于各种显示仪器上,液晶具有显著的电光特性,故C正确;D.纳米颗粒具有极强的紫外线屏蔽能力,化妆品中加入纳米颗粒可使其具备防紫外线的功能,故D正确;故选B。
13.下列过程得到的固体物质不是晶体的是
A.降低KCl饱和溶液的温度所得到的固体
B.气态碘直接冷却成固态碘
C.熔融的false冷却后所得到的固体
D.将液态的塑料冷却后所得到的固体
【答案】D
【解析】形成晶体的三种途径:,塑料是非晶体,综上所述,故选D。
14.下列关于晶体的叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体外形的性质
B.固体粉末一定不具有晶体的性质
C.晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
【答案】B
【解析】A.晶体的自范性是指在适宜条件下,晶体能够自发地呈现规则的多面体外形的性质,故A不选;B.许多固体粉末仍是晶体,具有晶体的性质,故B不选;C.构成晶体的粒子在微观空间里呈现周期性有序排列,则晶体的对称性是微观粒子按一定规律做周期性有序排列的必然结果,故C选;D.晶体在不同方向上物质微粒的排列情况不同,即为各向异性,具有特定的方向性,故D不选;故选:B。
15.如图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外4个紧邻的水分子形成四面体
B.冰晶体具有三维骨架结构,是共价晶体
C.水分子间通过H—O形成冰晶体
D.冰融化后,水分子之间空隙增大
【答案】A
【解析】A. H2O分子是沿O的4个false杂化轨道形成氢键的,冰晶体中每个水分子与另外4个紧邻的水分子形成四面体,故A正确;B. 冰晶体中的水分子是靠氢键结合在一起的,氢键不是化学键,故B错误;C. 水分子间通过氢键形成冰晶体,故C错误;D. 因为冰晶体中形成的氢键具有方向性和饱和性,故水分子靠氢键连接后,分子间空隙变大,导致冰融化成水后,水分子之间空隙减小,故D错误。故选A。
16.下列说法不正确的是( )
A.Na2O中离子键的百分数为62%,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.Al2O3是偏向离子晶体的过渡晶体,当作离子晶体来处理;SiO2是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
【答案】C
【解析】A.Na2O中离子键的百分数为62%,说明还存在共价键,则Na2O不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故A正确;B.离子键与共价键的区别在于形成化学键的两元素电负性差值,差值大为离子键,差值小为共价键,Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,故B正确;C.Al2O3、SiO2均是偏向共价晶体的过渡晶体,当作共价晶体来处理,故C错误;D.根据微粒间存在的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型,故D正确;故选C。
二、非选择题:本体包括2小题,共20分。
17.(10分)(1)晶体的自范性即___________,区分晶体与非晶体最可靠的实验方法是___________。
(2)原子间通过共用电子对所形成的相互作用叫作共价键。false键与false键都属于共价键,false键的特征是________________________,false键的特征是____________________。
(3)晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由___________个硼原子组成,共含有___________个B-B键。
【答案】(1)晶体能自发地呈现多面体外形的性质 X射线衍射实验 (2)轴对称 镜面对称 (3)12 30
【解析】(1)晶体的自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象;区分晶体和非晶体的最科学的实验方法是X射线衍射实验;故答案为:晶体能自发地呈现多面体外形的性质;X射线衍射实验。(2)原子间通过共用电子对所形成的相互作用叫作共价键。共价单键都是false键,而共价双键一个是false键,一个是false键,false键是电子云“头碰头”重合,false键的特征是轴对称,可以沿轴的方向旋转,false键是电子云“肩并肩”重合重叠程度小,false键的特征是镜面对称不能旋转,一旦旋转,共价键就被破坏;故答案为:轴对称;镜面对称。(3)硼原子组成的正二十面体,即每个面就是一个等边三角形,共有20个面,每个顶角为5个三角形所共用,所以20个等边三角形所含有的顶角数为false,即原子个数为12;因为每条边为2个三角形所共用,所以20个等边三角形含有的边数为false,即false键数目为30;故答案为:12; 30。
18.(10分)石墨的片层结构如图所示,试完成下列各题:
(1)平均_________个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是_________________。
(3)n g碳原子可构成____________________个正六边形。
【答案】(1)2(3分) (2)2:3 (3分) (3) (4分)
【解析】(1)方法1:利用点与面之间的关系,平均每个正六边形需碳原子:6×=2(个)。
方法2:每个碳原子提供的边数为3×=1.5,故=2(个)。
(2)分析每一正六边形:①所占的碳原子数为6×=2;②所占的C—C键数为6×=3,故答案为2?3。
(3)n g碳的原子数为NA,故答案为。
