2020-2021学年人教版高二化学选修3-1.2.1《原子结构与元素周期表》课时训练试题(含解析)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3-1.2.1《原子结构与元素周期表》课时训练试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 203.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-18 07:16:03 | ||
图片预览




文档简介
1230630012319000(人教版选修3)1.2.1《原子结构与元素周期表》课时训练试题
(时间:40分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.元素周期表的结构与原子结构有着紧密的联系,把握它们之间的关系,就好比拿到一把开启元素大门的钥匙。下列说法中不正确的是( )
A.同一周期中,各元素原子核外的电子层数相等
B.同一周期中,从左到右元素原子中的质子数及中子数依次增加
C.同一主族中,各元素原子的最外层电子数相等
D.同一主族中,从上到下元素原子的核外电子层数依次增加
2.已知元素X的基态原子最外层电子排布式为nsn-1npn+2,则X元素的原子序数为( )
A.9 B.10
C.17 D.18
3.已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A.3s23p3 B.4s24p1
C.4s2 D.3s23p5
4.下列说法正确的是( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
5.下列说法正确的是( )
A.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共有16个纵列
B.X2+的核外电子数目为18,则X位于第四周期ⅡA族
C.Li是最活泼的金属,F是最活泼的非金属
D.NaOH的碱性比KOH的碱性强
6.下列说法中错误的是( )
A.所有的非金属元素都分布在p区
B.3p能级上只有一个空轨道的原子和4p能级上只有一个空轨道的原子一定属于同一族
C.除氦以外的稀有气体元素原子的最外层电子数都是8
D.同一元素的各种同位素的化学性质一定相同
7.下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )
A.X原子和Y原子最外层都只有一个电子
B.X原子的电子排布式为1s2,Y原子的电子排布式为1s22s2
C.X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
8.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素。关于该元素的判断错误的是( )
A.电子排布式为1s22s22p63s23p63d34s2
B.该元素为钒元素
C.该元素为ⅡA族元素
D.该元素位于d区
9.最活泼的金属单质、最活泼的非金属单质、常温下呈液态的金属单质,其组成元素分别位于下列元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区
C.f区、p区、ds区 D.s区、f区、ds区
10.已知某元素原子的下列结构或性质,能确定其在周期表中位置的是( )
A.某元素原子的第二电子层电子排布图为
B.某元素原子在某种化合物中的化合价为+4
C.某元素的原子最外层上电子数为6
D.某元素原子的外围电子排布式为5s25p1
11.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级上半充满的元素一定位于p区
D.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
12.如下图所示是元素周期表的一部分(表中数字和X代表原子序数),其中X的电子排布式为[Ar]3d104s24p5的是( )
二、非选择题:本体包括3小题,共40分。
13.(18分)原子结构与元素周期表存在内在联系,按要求回答下列问题:
(1)根据元素在周期表中的位置,写出元素基态原子的价电子排布式。
①第四周期ⅥB族__________________________________________;
②第五周期ⅠB族__________________________________________;
③第五周期ⅣA族__________________________________________;
④第六周期ⅡA族__________________________________________。
(2)根据元素电子排布可以确定元素在周期表中的位置。
①具有(n-1)d10ns2电子排布的元素位于周期表中的________族。
②基态金原子的价电子排布式为5d106s1,试判断金元素在元素周期表中位于第_______周期第________族。
③已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d3。该元素位于元素周期表________(填序号)。
A.第二周期第ⅡB族 B.第四周期第ⅡA族
C.第四周期第ⅤB族 D.第五周期第ⅡB族
④某元素原子的核电荷数为33,则其原子的价电子排布式为_____________________,其位于元素周期表中的____________________,属于________区的元素。
(3)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti)元素,基态原子价电子排布图为________________,Ti元素形成的化合物中,Ti呈现的最高价态为________价。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子的价电子排布式为3d54s1,该元素的名称是________。
14.(12分)在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的能级符号作为该区的符号,如图所示。
(1)在s区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为________。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为________________________________,其中较稳定的是________。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为________。
(4)在p区中,第二周期第ⅤA族元素原子价电子排布图为__________________。
(5)当今常用于核能开发的元素是铀和钚,它们在______区中。
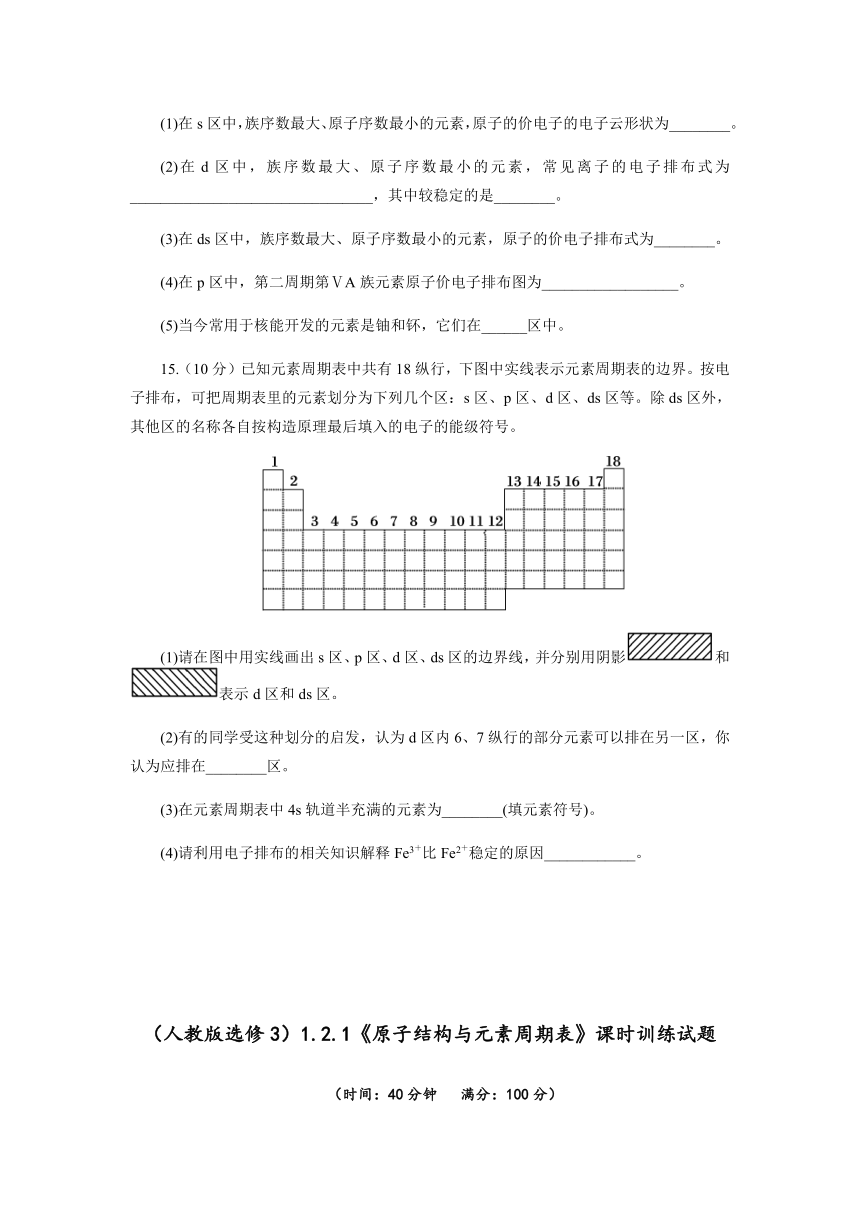
15.(10分)已知元素周期表中共有18纵行,下图中实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称各自按构造原理最后填入的电子的能级符号。
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影和表示d区和ds区。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在________区。
(3)在元素周期表中4s轨道半充满的元素为________(填元素符号)。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因____________。
1230630012319000(人教版选修3)1.2.1《原子结构与元素周期表》课时训练试题
(时间:40分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.元素周期表的结构与原子结构有着紧密的联系,把握它们之间的关系,就好比拿到一把开启元素大门的钥匙。下列说法中不正确的是( )
A.同一周期中,各元素原子核外的电子层数相等
B.同一周期中,从左到右元素原子中的质子数及中子数依次增加
C.同一主族中,各元素原子的最外层电子数相等
D.同一主族中,从上到下元素原子的核外电子层数依次增加
【答案】 B
2.已知元素X的基态原子最外层电子排布式为nsn-1npn+2,则X元素的原子序数为( )
A.9 B.10
C.17 D.18
【答案】 C
【解析】 s轨道最多容纳两个电子,即n-1=2,n=3,故X的基态原子最外层电子排布式为3s23p5,为Cl。
3.已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A.3s23p3 B.4s24p1
C.4s2 D.3s23p5
【答案】 C
【解析】 由元素原子的最外层电子排布式可知,3s23p3、4s24p1、3s23p5表示的元素均是处于元素周期表中p区的主族元素,4s2表示的元素可能是主族元素Ca,也可能是第四周期除Cr、Cu以外的过渡元素。
4.下列说法正确的是( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
【答案】 D
【解析】 常温常压下,溴、汞的单质都呈液态;周期表中有的元素是人工合成的;过渡元素全是金属元素;常温常压下,气态单质全是由非金属元素(稀有气体、F、Cl、O、N、H等)的原子形成的。
5.下列说法正确的是( )
A.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共有16个纵列
B.X2+的核外电子数目为18,则X位于第四周期ⅡA族
C.Li是最活泼的金属,F是最活泼的非金属
D.NaOH的碱性比KOH的碱性强
【答案】 B
【解析】 A项,元素周期表共有18个纵列,错误;C项,最活泼的金属是Cs(放射性元素除外),错误;D项,Na与K为同主族元素,钾的金属性比钠的强,故NaOH的碱性比KOH的弱,错误。
6.下列说法中错误的是( )
A.所有的非金属元素都分布在p区
B.3p能级上只有一个空轨道的原子和4p能级上只有一个空轨道的原子一定属于同一族
C.除氦以外的稀有气体元素原子的最外层电子数都是8
D.同一元素的各种同位素的化学性质一定相同
【答案】 A
【解析】 氢元素位于s区,故A错。
7.下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )
A.X原子和Y原子最外层都只有一个电子
B.X原子的电子排布式为1s2,Y原子的电子排布式为1s22s2
C.X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
【答案】 C
【解析】 最外层只有一个电子的不一定在同一族,如金属钠和金属铜的最外层都是一个电子,但是钠属于ⅠA族,而铜属于ⅠB族,A选项错误;B选项中X原子是He,属0族元素,Y原子是Be,属于ⅡA族,B选项错误;X原子核外M层上仅有两个电子,X是镁原子,属于ⅡA族,N层上也仅有两个电子的原子除了钙原子,还有锌、铁等元素原子,D选项错误。
8.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素。关于该元素的判断错误的是( )
A.电子排布式为1s22s22p63s23p63d34s2
B.该元素为钒元素
C.该元素为ⅡA族元素
D.该元素位于d区
【答案】 C
【解析】 主族元素的最外层电子数=价电子数,因其最外层电子数与价电子数不相等,因此不是主族元素,C项错误;因该元素是同族中原子序数最小的元素,所以位于第四周期,其价电子数为5,推测价电子排布为3d34s2,其电子排布式为1s22s22p63s23p63d34s2,为钒元素,位于第ⅤB族,属于d区元素,A、B、D项正确。
9.最活泼的金属单质、最活泼的非金属单质、常温下呈液态的金属单质,其组成元素分别位于下列元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区
C.f区、p区、ds区 D.s区、f区、ds区
【答案】 A
【解析】 理论上最活泼的金属单质是Fr,但由于其具有放射性,故一般认为最活泼的金属单质是Cs,而Cs和Fr都属于第ⅠA族元素,位于s区;最活泼的非金属单质是F2,F位于p区;常温下呈液态的金属单质为Hg,Hg属于过渡元素,位于ds区。
10.已知某元素原子的下列结构或性质,能确定其在周期表中位置的是( )
A.某元素原子的第二电子层电子排布图为
B.某元素原子在某种化合物中的化合价为+4
C.某元素的原子最外层上电子数为6
D.某元素原子的外围电子排布式为5s25p1
【答案】 D
【解析】 A项错误,所给的第二电子层为充满结构,不能确定其第二层以外是否还有电子;B项错误,仅凭化合价不能确定元素所在的周期和族;C项错误,据最外层电子数为6仅能确定该元素所在主族,不能确定其所在周期;D项已明确给出了原子的外围电子排布,即可顺利找到元素所在的周期和族,这是铟(In)元素。
11.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级上半充满的元素一定位于p区
D.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
【答案】 C
【解析】 基态原子的N层上只有一个电子的元素,可能为钾元素,也可能为铬元素或者铜元素,A错误;原子的价电子排布为(n-1)d6~8ns2的元素是Ⅷ族元素,不是副族元素,B错误;基态原子的p能级上半充满的元素的基态原子价电子排布式为ns2np3,则一定属于p区元素,C正确;基态原子的价电子排布为(n-1)dxnsy的元素的族序数可能为x+y(x+y≤7),也可能为第Ⅷ族(10≥x+y>7),还可能为y(x=10),D错误。
12.如下图所示是元素周期表的一部分(表中数字和X代表原子序数),其中X的电子排布式为[Ar]3d104s24p5的是( )
【答案】 A
【解析】 [Ar]3d104s24p5代表35号元素。根据周期表的结构可知,同主族相邻两周期的元素,原子序数之差可以是2,8,18,32。A项中X上方的原子序数为17,与X相差18,X的序数为35;B项中X上方的原子序数为27,处在第四周期与X相差18,X应为45;C项中X下方的原子序数为75,X为43;D项中X下方的原子序数为52,因此X应为34。
二、非选择题:本体包括3小题,共40分。
13.(18分)原子结构与元素周期表存在内在联系,按要求回答下列问题:
(1)根据元素在周期表中的位置,写出元素基态原子的价电子排布式。
①第四周期ⅥB族__________________________________________;
②第五周期ⅠB族__________________________________________;
③第五周期ⅣA族__________________________________________;
④第六周期ⅡA族__________________________________________。
(2)根据元素电子排布可以确定元素在周期表中的位置。
①具有(n-1)d10ns2电子排布的元素位于周期表中的________族。
②基态金原子的价电子排布式为5d106s1,试判断金元素在元素周期表中位于第_______周期第________族。
③已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d3。该元素位于元素周期表________(填序号)。
A.第二周期第ⅡB族 B.第四周期第ⅡA族
C.第四周期第ⅤB族 D.第五周期第ⅡB族
④某元素原子的核电荷数为33,则其原子的价电子排布式为_____________________,其位于元素周期表中的____________________,属于________区的元素。
(3)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti)元素,基态原子价电子排布图为________________,Ti元素形成的化合物中,Ti呈现的最高价态为________价。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子的价电子排布式为3d54s1,该元素的名称是________。
【答案】 (1)①3d54s1 ②4d105s1 ③5s25p2
④6s2 (2)①ⅡB ②六 ⅠB ③C ④4s24p3 第四周期第ⅤA族 p
②铬
【解析】 (1)ⅢB族~ⅦB族元素的价电子排布式分别为(n-1)dxns2(x=1~5),且价电子数等于族序数。故①为3d44s2,但据洪特规则应为3d54s1。ⅠB族和ⅡB族的价电子排布式分别为(n-1)d10ns1和(n-1)d10ns2,故②为4d105s1。主族元素的价电子全都排布在最外层的ns或np上,且价电子数等于族序数。故③为5s25p2,④为6s2。
(2)①具有(n-1)d10ns2电子排布的元素位于周期表第ⅡB族。
②元素基态原子价电子排布为5d106s1,位于第六周期第ⅠB族。
③该元素基态原子价电子排布式为3d34s2,该元素为d区副族元素(价电子排在d轨道和s轨道上),根据周期数=能层序数,族序数=价电子数,可知该元素位于第四周期第ⅤB族。
④根据构造原理可知该元素基态原子核外电子排布式为1s22s22p63s23p63d104s24p3,该元素原子价电子排布在ns和np轨道,故为主族元素,价电子数为5,故该元素在周期表中位于第四周期第ⅤA族,属于p区元素。
(3)①钛位于第四周期第ⅣB族,价电子排布为3d24s2。Ti的最高化合价=价电子数=4。
②原子价电子排布式为3d54s1的元素为铬元素。
14.(12分)在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的能级符号作为该区的符号,如图所示。
(1)在s区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为________。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为________________________________,其中较稳定的是________。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为________。
(4)在p区中,第二周期第ⅤA族元素原子价电子排布图为__________________。
(5)当今常用于核能开发的元素是铀和钚,它们在______区中。
【答案】 (1)球形
(2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5
Fe3+ (3)3d104s2 (4) (5)f
【解析】 (1)s区为第ⅠA族、第ⅡA族,符合条件的元素为Be,其电子排布式为1s22s2,价电子的电子云形状为球形;(2)d区为第ⅢB族~第ⅦB族、第Ⅷ族,族序数最大且原子序数最小的元素为Fe,常见离子为Fe2+、Fe3+,电子排布式为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d轨道“半充满”,其稳定性强于Fe2+;(3)ds区符合条件的元素为Zn,其电子排布式为1s22s22p63s23p63d104s2,价电子排布式为3d104s2;(4)该题中符合题意的元素为N,其价电子排布图为;(5)铀和钚均为锕系元素,位于f区。
15.(10分)已知元素周期表中共有18纵行,下图中实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称各自按构造原理最后填入的电子的能级符号。
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影和表示d区和ds区。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在________区。
(3)在元素周期表中4s轨道半充满的元素为________(填元素符号)。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因____________。
【答案】 (1)如下图:
(2)ds (3)K、Cr、Cu
(4)Fe的价电子排布式为3d64s2,Fe2+和Fe3+的价电子排布式分别为3d6、3d5,依据“能量相同的轨道处于全空、全充满和半充满时能量最低”的原则,3d5处于半充满状态,结构更稳定,故Fe3+比Fe2+稳定
【解析】 依据构造原理最后填入的电子的能级符号,将元素周期表划分为几个区,对于24号元素,其核外价电子排布似乎应该是3d44s2,而实际上是3d54s1,原因是能量相同的轨道处于全空、全充满和半充满时能量最低,而29号元素也正是因为这一点排成3d104s1,而不是3d94s2,故29号、30号元素所在纵行归为ds区,所以该同学认为d区内6、7纵行的部分元素可以排在ds区是有道理的。对于Fe3+比Fe2+稳定的原因也可从铁的核外电子排布特点来解释(Fe3+的价电子排布式为3d5,为半充满状态,比Fe2+的价电子排布式3d6稳定)。
(时间:40分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.元素周期表的结构与原子结构有着紧密的联系,把握它们之间的关系,就好比拿到一把开启元素大门的钥匙。下列说法中不正确的是( )
A.同一周期中,各元素原子核外的电子层数相等
B.同一周期中,从左到右元素原子中的质子数及中子数依次增加
C.同一主族中,各元素原子的最外层电子数相等
D.同一主族中,从上到下元素原子的核外电子层数依次增加
2.已知元素X的基态原子最外层电子排布式为nsn-1npn+2,则X元素的原子序数为( )
A.9 B.10
C.17 D.18
3.已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A.3s23p3 B.4s24p1
C.4s2 D.3s23p5
4.下列说法正确的是( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
5.下列说法正确的是( )
A.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共有16个纵列
B.X2+的核外电子数目为18,则X位于第四周期ⅡA族
C.Li是最活泼的金属,F是最活泼的非金属
D.NaOH的碱性比KOH的碱性强
6.下列说法中错误的是( )
A.所有的非金属元素都分布在p区
B.3p能级上只有一个空轨道的原子和4p能级上只有一个空轨道的原子一定属于同一族
C.除氦以外的稀有气体元素原子的最外层电子数都是8
D.同一元素的各种同位素的化学性质一定相同
7.下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )
A.X原子和Y原子最外层都只有一个电子
B.X原子的电子排布式为1s2,Y原子的电子排布式为1s22s2
C.X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
8.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素。关于该元素的判断错误的是( )
A.电子排布式为1s22s22p63s23p63d34s2
B.该元素为钒元素
C.该元素为ⅡA族元素
D.该元素位于d区
9.最活泼的金属单质、最活泼的非金属单质、常温下呈液态的金属单质,其组成元素分别位于下列元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区
C.f区、p区、ds区 D.s区、f区、ds区
10.已知某元素原子的下列结构或性质,能确定其在周期表中位置的是( )
A.某元素原子的第二电子层电子排布图为
B.某元素原子在某种化合物中的化合价为+4
C.某元素的原子最外层上电子数为6
D.某元素原子的外围电子排布式为5s25p1
11.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级上半充满的元素一定位于p区
D.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
12.如下图所示是元素周期表的一部分(表中数字和X代表原子序数),其中X的电子排布式为[Ar]3d104s24p5的是( )
二、非选择题:本体包括3小题,共40分。
13.(18分)原子结构与元素周期表存在内在联系,按要求回答下列问题:
(1)根据元素在周期表中的位置,写出元素基态原子的价电子排布式。
①第四周期ⅥB族__________________________________________;
②第五周期ⅠB族__________________________________________;
③第五周期ⅣA族__________________________________________;
④第六周期ⅡA族__________________________________________。
(2)根据元素电子排布可以确定元素在周期表中的位置。
①具有(n-1)d10ns2电子排布的元素位于周期表中的________族。
②基态金原子的价电子排布式为5d106s1,试判断金元素在元素周期表中位于第_______周期第________族。
③已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d3。该元素位于元素周期表________(填序号)。
A.第二周期第ⅡB族 B.第四周期第ⅡA族
C.第四周期第ⅤB族 D.第五周期第ⅡB族
④某元素原子的核电荷数为33,则其原子的价电子排布式为_____________________,其位于元素周期表中的____________________,属于________区的元素。
(3)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti)元素,基态原子价电子排布图为________________,Ti元素形成的化合物中,Ti呈现的最高价态为________价。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子的价电子排布式为3d54s1,该元素的名称是________。
14.(12分)在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的能级符号作为该区的符号,如图所示。
(1)在s区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为________。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为________________________________,其中较稳定的是________。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为________。
(4)在p区中,第二周期第ⅤA族元素原子价电子排布图为__________________。
(5)当今常用于核能开发的元素是铀和钚,它们在______区中。
15.(10分)已知元素周期表中共有18纵行,下图中实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称各自按构造原理最后填入的电子的能级符号。
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影和表示d区和ds区。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在________区。
(3)在元素周期表中4s轨道半充满的元素为________(填元素符号)。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因____________。
1230630012319000(人教版选修3)1.2.1《原子结构与元素周期表》课时训练试题
(时间:40分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.元素周期表的结构与原子结构有着紧密的联系,把握它们之间的关系,就好比拿到一把开启元素大门的钥匙。下列说法中不正确的是( )
A.同一周期中,各元素原子核外的电子层数相等
B.同一周期中,从左到右元素原子中的质子数及中子数依次增加
C.同一主族中,各元素原子的最外层电子数相等
D.同一主族中,从上到下元素原子的核外电子层数依次增加
【答案】 B
2.已知元素X的基态原子最外层电子排布式为nsn-1npn+2,则X元素的原子序数为( )
A.9 B.10
C.17 D.18
【答案】 C
【解析】 s轨道最多容纳两个电子,即n-1=2,n=3,故X的基态原子最外层电子排布式为3s23p5,为Cl。
3.已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
A.3s23p3 B.4s24p1
C.4s2 D.3s23p5
【答案】 C
【解析】 由元素原子的最外层电子排布式可知,3s23p3、4s24p1、3s23p5表示的元素均是处于元素周期表中p区的主族元素,4s2表示的元素可能是主族元素Ca,也可能是第四周期除Cr、Cu以外的过渡元素。
4.下列说法正确的是( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
【答案】 D
【解析】 常温常压下,溴、汞的单质都呈液态;周期表中有的元素是人工合成的;过渡元素全是金属元素;常温常压下,气态单质全是由非金属元素(稀有气体、F、Cl、O、N、H等)的原子形成的。
5.下列说法正确的是( )
A.元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共有16个纵列
B.X2+的核外电子数目为18,则X位于第四周期ⅡA族
C.Li是最活泼的金属,F是最活泼的非金属
D.NaOH的碱性比KOH的碱性强
【答案】 B
【解析】 A项,元素周期表共有18个纵列,错误;C项,最活泼的金属是Cs(放射性元素除外),错误;D项,Na与K为同主族元素,钾的金属性比钠的强,故NaOH的碱性比KOH的弱,错误。
6.下列说法中错误的是( )
A.所有的非金属元素都分布在p区
B.3p能级上只有一个空轨道的原子和4p能级上只有一个空轨道的原子一定属于同一族
C.除氦以外的稀有气体元素原子的最外层电子数都是8
D.同一元素的各种同位素的化学性质一定相同
【答案】 A
【解析】 氢元素位于s区,故A错。
7.下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )
A.X原子和Y原子最外层都只有一个电子
B.X原子的电子排布式为1s2,Y原子的电子排布式为1s22s2
C.X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子
D.X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
【答案】 C
【解析】 最外层只有一个电子的不一定在同一族,如金属钠和金属铜的最外层都是一个电子,但是钠属于ⅠA族,而铜属于ⅠB族,A选项错误;B选项中X原子是He,属0族元素,Y原子是Be,属于ⅡA族,B选项错误;X原子核外M层上仅有两个电子,X是镁原子,属于ⅡA族,N层上也仅有两个电子的原子除了钙原子,还有锌、铁等元素原子,D选项错误。
8.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素。关于该元素的判断错误的是( )
A.电子排布式为1s22s22p63s23p63d34s2
B.该元素为钒元素
C.该元素为ⅡA族元素
D.该元素位于d区
【答案】 C
【解析】 主族元素的最外层电子数=价电子数,因其最外层电子数与价电子数不相等,因此不是主族元素,C项错误;因该元素是同族中原子序数最小的元素,所以位于第四周期,其价电子数为5,推测价电子排布为3d34s2,其电子排布式为1s22s22p63s23p63d34s2,为钒元素,位于第ⅤB族,属于d区元素,A、B、D项正确。
9.最活泼的金属单质、最活泼的非金属单质、常温下呈液态的金属单质,其组成元素分别位于下列元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区
C.f区、p区、ds区 D.s区、f区、ds区
【答案】 A
【解析】 理论上最活泼的金属单质是Fr,但由于其具有放射性,故一般认为最活泼的金属单质是Cs,而Cs和Fr都属于第ⅠA族元素,位于s区;最活泼的非金属单质是F2,F位于p区;常温下呈液态的金属单质为Hg,Hg属于过渡元素,位于ds区。
10.已知某元素原子的下列结构或性质,能确定其在周期表中位置的是( )
A.某元素原子的第二电子层电子排布图为
B.某元素原子在某种化合物中的化合价为+4
C.某元素的原子最外层上电子数为6
D.某元素原子的外围电子排布式为5s25p1
【答案】 D
【解析】 A项错误,所给的第二电子层为充满结构,不能确定其第二层以外是否还有电子;B项错误,仅凭化合价不能确定元素所在的周期和族;C项错误,据最外层电子数为6仅能确定该元素所在主族,不能确定其所在周期;D项已明确给出了原子的外围电子排布,即可顺利找到元素所在的周期和族,这是铟(In)元素。
11.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级上半充满的元素一定位于p区
D.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
【答案】 C
【解析】 基态原子的N层上只有一个电子的元素,可能为钾元素,也可能为铬元素或者铜元素,A错误;原子的价电子排布为(n-1)d6~8ns2的元素是Ⅷ族元素,不是副族元素,B错误;基态原子的p能级上半充满的元素的基态原子价电子排布式为ns2np3,则一定属于p区元素,C正确;基态原子的价电子排布为(n-1)dxnsy的元素的族序数可能为x+y(x+y≤7),也可能为第Ⅷ族(10≥x+y>7),还可能为y(x=10),D错误。
12.如下图所示是元素周期表的一部分(表中数字和X代表原子序数),其中X的电子排布式为[Ar]3d104s24p5的是( )
【答案】 A
【解析】 [Ar]3d104s24p5代表35号元素。根据周期表的结构可知,同主族相邻两周期的元素,原子序数之差可以是2,8,18,32。A项中X上方的原子序数为17,与X相差18,X的序数为35;B项中X上方的原子序数为27,处在第四周期与X相差18,X应为45;C项中X下方的原子序数为75,X为43;D项中X下方的原子序数为52,因此X应为34。
二、非选择题:本体包括3小题,共40分。
13.(18分)原子结构与元素周期表存在内在联系,按要求回答下列问题:
(1)根据元素在周期表中的位置,写出元素基态原子的价电子排布式。
①第四周期ⅥB族__________________________________________;
②第五周期ⅠB族__________________________________________;
③第五周期ⅣA族__________________________________________;
④第六周期ⅡA族__________________________________________。
(2)根据元素电子排布可以确定元素在周期表中的位置。
①具有(n-1)d10ns2电子排布的元素位于周期表中的________族。
②基态金原子的价电子排布式为5d106s1,试判断金元素在元素周期表中位于第_______周期第________族。
③已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d3。该元素位于元素周期表________(填序号)。
A.第二周期第ⅡB族 B.第四周期第ⅡA族
C.第四周期第ⅤB族 D.第五周期第ⅡB族
④某元素原子的核电荷数为33,则其原子的价电子排布式为_____________________,其位于元素周期表中的____________________,属于________区的元素。
(3)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti)元素,基态原子价电子排布图为________________,Ti元素形成的化合物中,Ti呈现的最高价态为________价。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子的价电子排布式为3d54s1,该元素的名称是________。
【答案】 (1)①3d54s1 ②4d105s1 ③5s25p2
④6s2 (2)①ⅡB ②六 ⅠB ③C ④4s24p3 第四周期第ⅤA族 p
②铬
【解析】 (1)ⅢB族~ⅦB族元素的价电子排布式分别为(n-1)dxns2(x=1~5),且价电子数等于族序数。故①为3d44s2,但据洪特规则应为3d54s1。ⅠB族和ⅡB族的价电子排布式分别为(n-1)d10ns1和(n-1)d10ns2,故②为4d105s1。主族元素的价电子全都排布在最外层的ns或np上,且价电子数等于族序数。故③为5s25p2,④为6s2。
(2)①具有(n-1)d10ns2电子排布的元素位于周期表第ⅡB族。
②元素基态原子价电子排布为5d106s1,位于第六周期第ⅠB族。
③该元素基态原子价电子排布式为3d34s2,该元素为d区副族元素(价电子排在d轨道和s轨道上),根据周期数=能层序数,族序数=价电子数,可知该元素位于第四周期第ⅤB族。
④根据构造原理可知该元素基态原子核外电子排布式为1s22s22p63s23p63d104s24p3,该元素原子价电子排布在ns和np轨道,故为主族元素,价电子数为5,故该元素在周期表中位于第四周期第ⅤA族,属于p区元素。
(3)①钛位于第四周期第ⅣB族,价电子排布为3d24s2。Ti的最高化合价=价电子数=4。
②原子价电子排布式为3d54s1的元素为铬元素。
14.(12分)在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的能级符号作为该区的符号,如图所示。
(1)在s区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为________。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为________________________________,其中较稳定的是________。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为________。
(4)在p区中,第二周期第ⅤA族元素原子价电子排布图为__________________。
(5)当今常用于核能开发的元素是铀和钚,它们在______区中。
【答案】 (1)球形
(2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5
Fe3+ (3)3d104s2 (4) (5)f
【解析】 (1)s区为第ⅠA族、第ⅡA族,符合条件的元素为Be,其电子排布式为1s22s2,价电子的电子云形状为球形;(2)d区为第ⅢB族~第ⅦB族、第Ⅷ族,族序数最大且原子序数最小的元素为Fe,常见离子为Fe2+、Fe3+,电子排布式为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d轨道“半充满”,其稳定性强于Fe2+;(3)ds区符合条件的元素为Zn,其电子排布式为1s22s22p63s23p63d104s2,价电子排布式为3d104s2;(4)该题中符合题意的元素为N,其价电子排布图为;(5)铀和钚均为锕系元素,位于f区。
15.(10分)已知元素周期表中共有18纵行,下图中实线表示元素周期表的边界。按电子排布,可把周期表里的元素划分为下列几个区:s区、p区、d区、ds区等。除ds区外,其他区的名称各自按构造原理最后填入的电子的能级符号。
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并分别用阴影和表示d区和ds区。
(2)有的同学受这种划分的启发,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在________区。
(3)在元素周期表中4s轨道半充满的元素为________(填元素符号)。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因____________。
【答案】 (1)如下图:
(2)ds (3)K、Cr、Cu
(4)Fe的价电子排布式为3d64s2,Fe2+和Fe3+的价电子排布式分别为3d6、3d5,依据“能量相同的轨道处于全空、全充满和半充满时能量最低”的原则,3d5处于半充满状态,结构更稳定,故Fe3+比Fe2+稳定
【解析】 依据构造原理最后填入的电子的能级符号,将元素周期表划分为几个区,对于24号元素,其核外价电子排布似乎应该是3d44s2,而实际上是3d54s1,原因是能量相同的轨道处于全空、全充满和半充满时能量最低,而29号元素也正是因为这一点排成3d104s1,而不是3d94s2,故29号、30号元素所在纵行归为ds区,所以该同学认为d区内6、7纵行的部分元素可以排在ds区是有道理的。对于Fe3+比Fe2+稳定的原因也可从铁的核外电子排布特点来解释(Fe3+的价电子排布式为3d5,为半充满状态,比Fe2+的价电子排布式3d6稳定)。
