2020-2021学年人教版高二化学选修3-2.1.1《共价键的形成及类型》课时训练试题(含解析)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3-2.1.1《共价键的形成及类型》课时训练试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 76.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-18 07:18:34 | ||
图片预览



文档简介
1070610010312400(人教版选修3)2.1.1《共价键的形成及类型》课时训练试题
(时间:40分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有非极性键的分子一定是单质分子
D.含有共价键的化合物一定是共价化合物
2. 下列不属于共价键成键因素的是( )
A. 共用电子对在两原子核之间高概率出现
B. 共用的电子必有成对
C. 成键后体系能量降低,趋于稳定
D. 两原子核体积大小要适中
3.下列各组化合物中,化学键类型完全相同的是( )
A.C2H6、H2O2、C2H5OH B.HCl、NaCl、MgCl2
C.H2O、CO2、Na2O2 D.NaOH、NaClO、Na2O
4.σ键可由s轨道与s轨道、s轨道与p轨道以及p轨道与p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由s轨道与p轨道以“头碰头”方式重叠而成的是( )
A.H2 B.HCl
C.Cl2 D.F2
5.在氯化氢分子中,形成共价键的原子轨道是( )
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
6.关于乙醇分子的说法正确的是( )
A.分子中共含有8个极性键 B.分子中不含非极性键
C.分子中只含σ键 D.分子中含有1个π键
7.下列物质的分子中既有σ键又有π键的是( )
A.HCl B.Cl2
C.CH4 D.C2H2
8.下列说法中不正确的是( )
A.一般σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,两个π键
9.下列反应中,有机物化学键的断裂只涉及π键断裂的是( )
A.CH4的燃烧 B.C2H4与Cl2的加成反应
C.CH4与Cl2的取代反应 D.C2H4被酸性KMnO4溶液氧化
10.氰气分子式为(CN)2,结构式为N≡C—C≡N,性质与卤素相近。下列叙述不正确的是( )
A.在一定条件下可与乙烯加成
B.分子中C—C大于C≡N的键长
C.不和氢氧化钠溶液发生反应
D.氰气中既有σ键又有π键
11.下列有关σ键与π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
12.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图所示。下列有关该物质的说法正确的是( )
A.分子式为C3H2O3 B.分子中含6个σ键
C.分子中只有极性键 D.8.6 g该物质完全燃烧得到6.72 L CO2
二、非选择题:本体包括4小题,共40分。
13.(8分)A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p轨道中有3个电子。
(1)C原子的电子排布式为_______________。若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_________键。
(2)若A元素的原子最外层电子排布为2s1,B元素的最外层电子排布为3s23p2,元素A在元素周期表中的位置是___________________,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________________(用元素符号表示)。
14.(11分)有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N);
(1)只含有极性键的是________;只含有非极性键的是________;既有极性键,又有非极性键的是________。
(2)只有σ键的是______________;既有σ键又有π键的是_____________。
(3)含有由两个原子的s轨道重叠形成的σ键的是________________。
(4)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______________。
(5)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是______________。
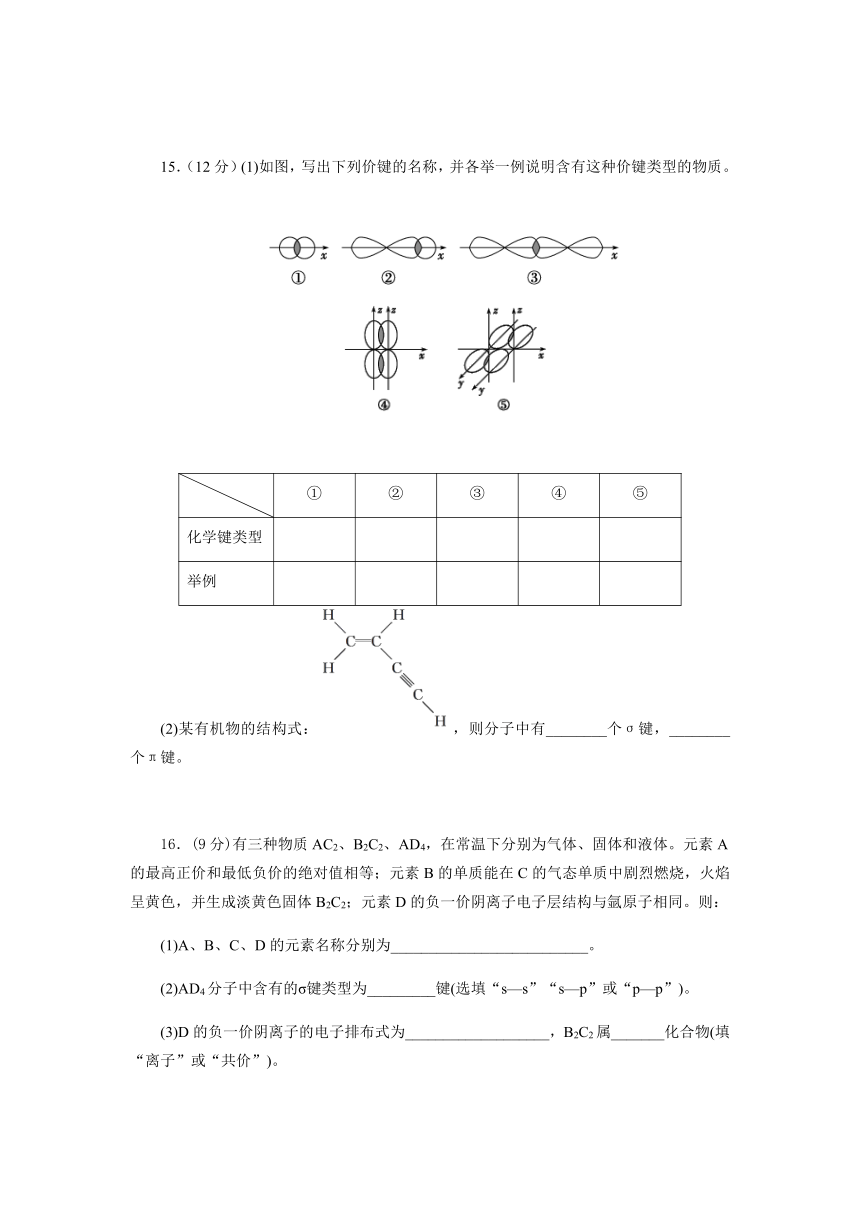
15.(12分)(1)如图,写出下列价键的名称,并各举一例说明含有这种价键类型的物质。
①
②
③
④
⑤
化学键类型
举例
(2)某有机物的结构式:,则分子中有________个σ键,________个π键。
16.(9分)有三种物质AC2、B2C2、AD4,在常温下分别为气体、固体和液体。元素A的最高正价和最低负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同。则:
(1)A、B、C、D的元素名称分别为__________________________。
(2)AD4分子中含有的σ键类型为_________键(选填“s—s”“s—p”或“p—p”)。
(3)D的负一价阴离子的电子排布式为___________________,B2C2属_______化合物(填“离子”或“共价”)。
(人教版选修3)2.1.1《共价键的形成及类型》课时训练试题
参考答案
1.【答案】 A
【解析】 A项正确:阴阳离子通过静电作用形成的化合物,叫离子化合物,离子化合物中一定含有离子键。B项错误:除稀有气体元素形成的单质分子中不含有化学键外,其余的单质分子中都存在化学键。C项错误:化合物中也可能有非极性共价键。D项错误:离子化合物中可以含共价键,如NaOH、NH4Cl等。
2.【答案】 D
【解析】 A.两原子形成共价键时电子云发生重叠,即电子在两核之间出现的机会更多,A正确;B.成键原子相互靠近,自旋方向相反两个电子形成共用电子对,B正确;C.两原子电子云重叠越多,键越牢固,体系的能量也越低,C正确;D.原子的体积大小与能否形成共价键无必然联系,D错误;正确选项D。
3.【答案】 A
【解析】 A项:三者都有极性共价键和非极性共价键。B项:HCl只含极性共价键,NaCl、MgCl2只含离子键。C项:H2O、CO2只含极性共价键,Na2O2含离子键和非极性共价键。D项:NaOH、NaClO含离子键和极性共价键,Na2O只含离子键。
4.【答案】 B
【解析】 H2中的σ键为s-s σ键,HCl中的σ键为s-p σ键,Cl2、F2中的σ键均为p-p σ键。
5.【答案】 C
【解析】 H原子和Cl原子的核外电子排布式分别为1s1和1s22s22p63s23p5,由此可以看出,H原子的1s轨道和Cl原子的3p轨道上各有一个未成对电子,故两者在形成氯化氢分子时,形成共价键的原子轨道是氯原子的3p轨道和氢原子的1s轨道。
6.【答案】 C
【解析】 乙醇的结构式为,共含有8个共价键,其中C—H、C—O、O—H键为极性键,共7个,C—C键为非极性键。由于乙醇分子中只有单键,故无π键。
7.【答案】 D
【解析】 四种分子的结构式分别为H—Cl、Cl—Cl、,两个原子间形成的共价单键为σ键,而要存在π键,两原子之间必须存在双键或三键,故符合题意的为D项。
8.【答案】 C
【解析】 气体单质分子中,可能有σ键,如Cl2,可能有π键,如N2,也可能没有化学键,如稀有气体。
9.【答案】 B
【解析】 有机物的燃烧和被酸性KMnO4溶液氧化,断裂了所有的化学键,包括单键和双键,CH4与Cl2的取代反应只有单键断裂。
10【答案】 C
【解析】 (CN)2性质与卤素相近,则它能与NaOH溶液反应。
11.【答案】 D
【解析】 由于π键的强度一般小于σ键的强度,所以反应时π键比σ键易断裂,A项正确;分子的形成是为了使其能量降低,首先形成σ键,再根据成键原子的核外电子排布判断是否有π键形成,B项正确;H原子形成分子时,只能形成σ键,不能形成π键,C项正确;原子跟其他原子首先形成σ键,故分子中不可能只有π键而没有σ键。
12.【答案】 A
【解析】 A.由图示可知,该物质的分子式为C3H2O3。B.分子中碳碳双键和碳氧双键中各有一个σ键,碳氧单键全部是σ键(4个),碳氢键也是σ键(2个),共有8个σ键。C.分子中的碳氧键、碳氢键都是极性键,而碳碳键是非极性键。D.8.6 g 该物质的物质的量为0.1 mol,完全燃烧后得到0.3 mol CO2,只有在标准状况下0.3 mol CO2的体积才是6.72 L。13.【答案】(1)1s22s22p4 σ
(2)第二周期ⅠA族 O>P>Si>Li
【解析】 “A元素的原子最外层电子排布为ns1”,则A可能为H、Li、Na。“B元素的原子价电子排布为ns2np2”,可知B可能为C、Si。“C元素原子的最外层电子数是其电子层数的3倍”,可知C为O元素;“D元素原子的M电子层的p轨道中有3个电子”,可知D为P元素。(1)H原子的电子在s能级,不能形成π键,只能形成σ键。(2)A为Li,位于第二周期ⅠA族。B为Si元素。依据第一电离能的变化规律,同主族从上到下依次减小,同周期从左到右呈增大趋势,A、B、C、D四种元素的第一电离能由大到小的顺序为O>P>Si>Li。
14.【答案】 (1)①③⑨ ②④⑦ ⑤⑥⑧
(2)①②③⑥⑦⑧ ④⑤⑨
(3)⑦
(4)①③⑤⑥⑧⑨
(5)②④⑤⑥⑧⑨
【解析】(1)由同一种非金属元素的原子间形成的共价键是非极性键,由不同种元素的原子间形成的共价键是极性键。所以只含有极性键的是①③⑨;只含有非极性键的是②④⑦;既有极性键,又有非极性键的是⑤⑥⑧。
(2)σ键是头碰头的方式形成的,而π键是以肩并肩的方式形成的;单键都是σ键,而双键或三键中才含有π键,所以只有σ键的是①②③⑥⑦⑧;既有σ键又有π键的是④⑤⑨。
(3)构成氢气的氢原子都是只有s轨道,所以含有由两个原子的s轨道重叠形成的σ键的只能是氢气⑦。
(4)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键,说明共价键中一定含有氢原子,所以正确的答案选①③⑤⑥⑧⑨。
(5)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键,正确的答案选②④⑤⑥⑧⑨。
15.【答案】 (1)
①
②
③
④
⑤
化学键类型
s?s σ键
s?p σ键
p?p σ键
pz?pz π键
py?py π键
举例
H2
HCl
Cl2
N2
N2
(2)7 3
【解析】 (1)①②③中的原子轨道是“头碰头”重叠,属于σ键,④⑤中的原子轨道是“肩并肩”重叠,属于π键;(2)共价双键有一个σ键、一个π键,共价三键有一个σ键、两个π键,故中有7个σ键、3个π键。
16.【答案】(1)碳、钠、氧、氯 (2)p—p ( 3)1s22s22p63s23p6 离子
【解析】 (1)焰色呈黄色,说明有钠元素,则淡黄色固体为Na2O2,所以元素B为Na元素,元素C为O元素。“元素D的负一价阴离子电子层结构与氩原子相同”,知D为Cl元素。“元素A的最高正价和最低负价的绝对值相等”,可知A为ⅣA族元素,又由于AC2是气体,所以AC2是二氧化碳(ⅣA族Si及其以下元素形成的AC2常温下均为固体),即A是C元素。(2)CCl4中只有σ键,且其类型为p—p σ键。
(时间:40分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有非极性键的分子一定是单质分子
D.含有共价键的化合物一定是共价化合物
2. 下列不属于共价键成键因素的是( )
A. 共用电子对在两原子核之间高概率出现
B. 共用的电子必有成对
C. 成键后体系能量降低,趋于稳定
D. 两原子核体积大小要适中
3.下列各组化合物中,化学键类型完全相同的是( )
A.C2H6、H2O2、C2H5OH B.HCl、NaCl、MgCl2
C.H2O、CO2、Na2O2 D.NaOH、NaClO、Na2O
4.σ键可由s轨道与s轨道、s轨道与p轨道以及p轨道与p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由s轨道与p轨道以“头碰头”方式重叠而成的是( )
A.H2 B.HCl
C.Cl2 D.F2
5.在氯化氢分子中,形成共价键的原子轨道是( )
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
6.关于乙醇分子的说法正确的是( )
A.分子中共含有8个极性键 B.分子中不含非极性键
C.分子中只含σ键 D.分子中含有1个π键
7.下列物质的分子中既有σ键又有π键的是( )
A.HCl B.Cl2
C.CH4 D.C2H2
8.下列说法中不正确的是( )
A.一般σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,两个π键
9.下列反应中,有机物化学键的断裂只涉及π键断裂的是( )
A.CH4的燃烧 B.C2H4与Cl2的加成反应
C.CH4与Cl2的取代反应 D.C2H4被酸性KMnO4溶液氧化
10.氰气分子式为(CN)2,结构式为N≡C—C≡N,性质与卤素相近。下列叙述不正确的是( )
A.在一定条件下可与乙烯加成
B.分子中C—C大于C≡N的键长
C.不和氢氧化钠溶液发生反应
D.氰气中既有σ键又有π键
11.下列有关σ键与π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
12.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图所示。下列有关该物质的说法正确的是( )
A.分子式为C3H2O3 B.分子中含6个σ键
C.分子中只有极性键 D.8.6 g该物质完全燃烧得到6.72 L CO2
二、非选择题:本体包括4小题,共40分。
13.(8分)A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p轨道中有3个电子。
(1)C原子的电子排布式为_______________。若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_________键。
(2)若A元素的原子最外层电子排布为2s1,B元素的最外层电子排布为3s23p2,元素A在元素周期表中的位置是___________________,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________________(用元素符号表示)。
14.(11分)有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N);
(1)只含有极性键的是________;只含有非极性键的是________;既有极性键,又有非极性键的是________。
(2)只有σ键的是______________;既有σ键又有π键的是_____________。
(3)含有由两个原子的s轨道重叠形成的σ键的是________________。
(4)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______________。
(5)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是______________。
15.(12分)(1)如图,写出下列价键的名称,并各举一例说明含有这种价键类型的物质。
①
②
③
④
⑤
化学键类型
举例
(2)某有机物的结构式:,则分子中有________个σ键,________个π键。
16.(9分)有三种物质AC2、B2C2、AD4,在常温下分别为气体、固体和液体。元素A的最高正价和最低负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同。则:
(1)A、B、C、D的元素名称分别为__________________________。
(2)AD4分子中含有的σ键类型为_________键(选填“s—s”“s—p”或“p—p”)。
(3)D的负一价阴离子的电子排布式为___________________,B2C2属_______化合物(填“离子”或“共价”)。
(人教版选修3)2.1.1《共价键的形成及类型》课时训练试题
参考答案
1.【答案】 A
【解析】 A项正确:阴阳离子通过静电作用形成的化合物,叫离子化合物,离子化合物中一定含有离子键。B项错误:除稀有气体元素形成的单质分子中不含有化学键外,其余的单质分子中都存在化学键。C项错误:化合物中也可能有非极性共价键。D项错误:离子化合物中可以含共价键,如NaOH、NH4Cl等。
2.【答案】 D
【解析】 A.两原子形成共价键时电子云发生重叠,即电子在两核之间出现的机会更多,A正确;B.成键原子相互靠近,自旋方向相反两个电子形成共用电子对,B正确;C.两原子电子云重叠越多,键越牢固,体系的能量也越低,C正确;D.原子的体积大小与能否形成共价键无必然联系,D错误;正确选项D。
3.【答案】 A
【解析】 A项:三者都有极性共价键和非极性共价键。B项:HCl只含极性共价键,NaCl、MgCl2只含离子键。C项:H2O、CO2只含极性共价键,Na2O2含离子键和非极性共价键。D项:NaOH、NaClO含离子键和极性共价键,Na2O只含离子键。
4.【答案】 B
【解析】 H2中的σ键为s-s σ键,HCl中的σ键为s-p σ键,Cl2、F2中的σ键均为p-p σ键。
5.【答案】 C
【解析】 H原子和Cl原子的核外电子排布式分别为1s1和1s22s22p63s23p5,由此可以看出,H原子的1s轨道和Cl原子的3p轨道上各有一个未成对电子,故两者在形成氯化氢分子时,形成共价键的原子轨道是氯原子的3p轨道和氢原子的1s轨道。
6.【答案】 C
【解析】 乙醇的结构式为,共含有8个共价键,其中C—H、C—O、O—H键为极性键,共7个,C—C键为非极性键。由于乙醇分子中只有单键,故无π键。
7.【答案】 D
【解析】 四种分子的结构式分别为H—Cl、Cl—Cl、,两个原子间形成的共价单键为σ键,而要存在π键,两原子之间必须存在双键或三键,故符合题意的为D项。
8.【答案】 C
【解析】 气体单质分子中,可能有σ键,如Cl2,可能有π键,如N2,也可能没有化学键,如稀有气体。
9.【答案】 B
【解析】 有机物的燃烧和被酸性KMnO4溶液氧化,断裂了所有的化学键,包括单键和双键,CH4与Cl2的取代反应只有单键断裂。
10【答案】 C
【解析】 (CN)2性质与卤素相近,则它能与NaOH溶液反应。
11.【答案】 D
【解析】 由于π键的强度一般小于σ键的强度,所以反应时π键比σ键易断裂,A项正确;分子的形成是为了使其能量降低,首先形成σ键,再根据成键原子的核外电子排布判断是否有π键形成,B项正确;H原子形成分子时,只能形成σ键,不能形成π键,C项正确;原子跟其他原子首先形成σ键,故分子中不可能只有π键而没有σ键。
12.【答案】 A
【解析】 A.由图示可知,该物质的分子式为C3H2O3。B.分子中碳碳双键和碳氧双键中各有一个σ键,碳氧单键全部是σ键(4个),碳氢键也是σ键(2个),共有8个σ键。C.分子中的碳氧键、碳氢键都是极性键,而碳碳键是非极性键。D.8.6 g 该物质的物质的量为0.1 mol,完全燃烧后得到0.3 mol CO2,只有在标准状况下0.3 mol CO2的体积才是6.72 L。13.【答案】(1)1s22s22p4 σ
(2)第二周期ⅠA族 O>P>Si>Li
【解析】 “A元素的原子最外层电子排布为ns1”,则A可能为H、Li、Na。“B元素的原子价电子排布为ns2np2”,可知B可能为C、Si。“C元素原子的最外层电子数是其电子层数的3倍”,可知C为O元素;“D元素原子的M电子层的p轨道中有3个电子”,可知D为P元素。(1)H原子的电子在s能级,不能形成π键,只能形成σ键。(2)A为Li,位于第二周期ⅠA族。B为Si元素。依据第一电离能的变化规律,同主族从上到下依次减小,同周期从左到右呈增大趋势,A、B、C、D四种元素的第一电离能由大到小的顺序为O>P>Si>Li。
14.【答案】 (1)①③⑨ ②④⑦ ⑤⑥⑧
(2)①②③⑥⑦⑧ ④⑤⑨
(3)⑦
(4)①③⑤⑥⑧⑨
(5)②④⑤⑥⑧⑨
【解析】(1)由同一种非金属元素的原子间形成的共价键是非极性键,由不同种元素的原子间形成的共价键是极性键。所以只含有极性键的是①③⑨;只含有非极性键的是②④⑦;既有极性键,又有非极性键的是⑤⑥⑧。
(2)σ键是头碰头的方式形成的,而π键是以肩并肩的方式形成的;单键都是σ键,而双键或三键中才含有π键,所以只有σ键的是①②③⑥⑦⑧;既有σ键又有π键的是④⑤⑨。
(3)构成氢气的氢原子都是只有s轨道,所以含有由两个原子的s轨道重叠形成的σ键的只能是氢气⑦。
(4)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键,说明共价键中一定含有氢原子,所以正确的答案选①③⑤⑥⑧⑨。
(5)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键,正确的答案选②④⑤⑥⑧⑨。
15.【答案】 (1)
①
②
③
④
⑤
化学键类型
s?s σ键
s?p σ键
p?p σ键
pz?pz π键
py?py π键
举例
H2
HCl
Cl2
N2
N2
(2)7 3
【解析】 (1)①②③中的原子轨道是“头碰头”重叠,属于σ键,④⑤中的原子轨道是“肩并肩”重叠,属于π键;(2)共价双键有一个σ键、一个π键,共价三键有一个σ键、两个π键,故中有7个σ键、3个π键。
16.【答案】(1)碳、钠、氧、氯 (2)p—p ( 3)1s22s22p63s23p6 离子
【解析】 (1)焰色呈黄色,说明有钠元素,则淡黄色固体为Na2O2,所以元素B为Na元素,元素C为O元素。“元素D的负一价阴离子电子层结构与氩原子相同”,知D为Cl元素。“元素A的最高正价和最低负价的绝对值相等”,可知A为ⅣA族元素,又由于AC2是气体,所以AC2是二氧化碳(ⅣA族Si及其以下元素形成的AC2常温下均为固体),即A是C元素。(2)CCl4中只有σ键,且其类型为p—p σ键。
