2020-2021学年人教版(2019)高二化学选择性必修二第三章能力提升卷 (含解析)
文档属性
| 名称 | 2020-2021学年人教版(2019)高二化学选择性必修二第三章能力提升卷 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 447.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-21 14:35:03 | ||
图片预览



文档简介
绝密★启用前
第三章能力提升卷
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、单选题(共48分)
1.(本题3分)如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中○—X、●—Y、?—Z。其对应的化学式不正确的是
A. B. C. D.
2.(本题3分)下列说法正确的是
A.熔点:金刚石>晶体硅>碳化硅
B.熔点:邻羟基苯甲醛>对羟基苯甲醛
C.电负性:Na<P<Cl
D.熔沸点:HF<HCl<HBr<HI
3.(本题3分)锶(Sr)元素与镁元素是同主族元素,下列说法错误的是
A.单质Sr保存在煤油中 B.false的碱性比false强
C.false是离子晶体 D.false的分解温度比false低
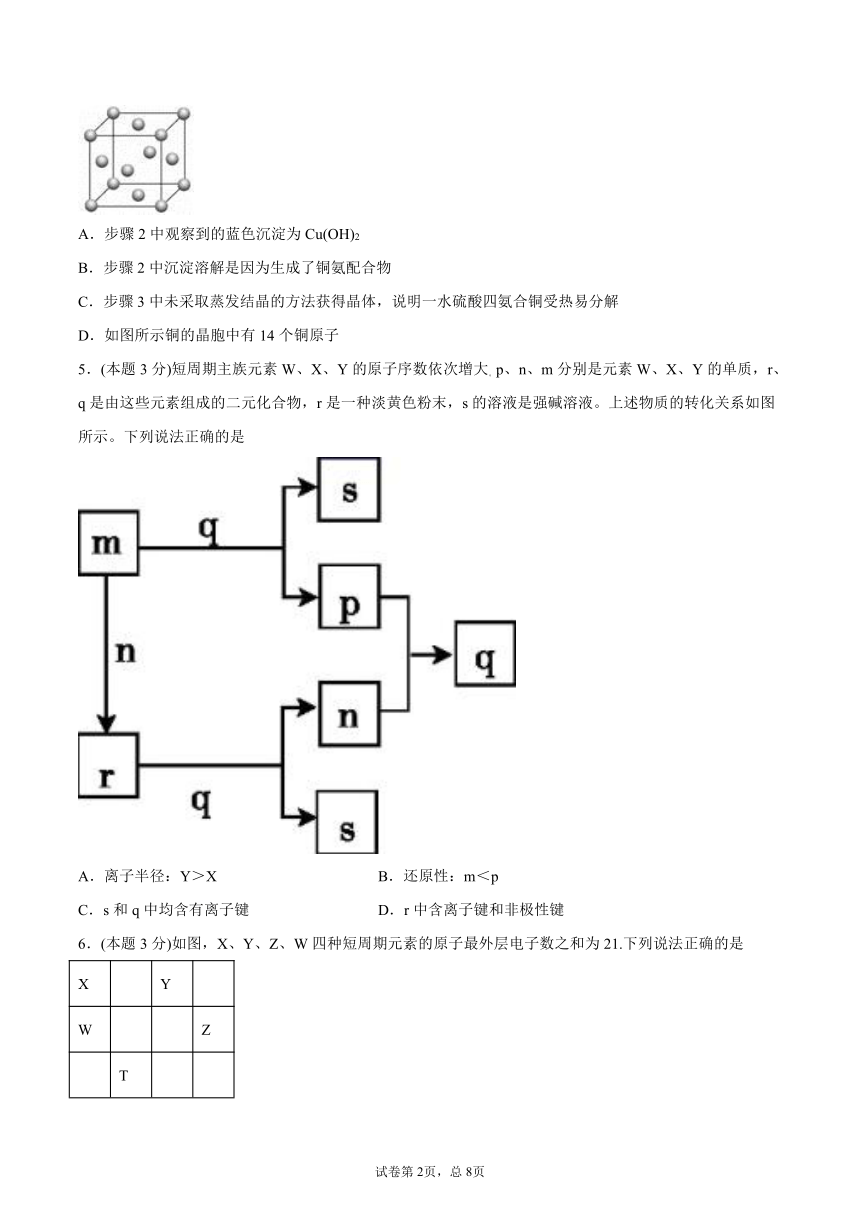
4.(本题3分)一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体,实验室可以用氧化铜为原料通过以下方法制取。
步骤1:向试管中加入一定量的氧化铜固体,加入足量稀硫酸充分反应,观察到固体完全溶解,溶液变蓝色;
步骤2:向试管中继续滴加过量的2%氨水,观察到先有蓝色沉淀,后又逐渐完全溶解得到深蓝色溶液。
步骤3:再向试管中加入无水乙醇,振荡静置,有深蓝色晶体析出。
下列说法不正确的是
A.步骤2中观察到的蓝色沉淀为Cu(OH)2
B.步骤2中沉淀溶解是因为生成了铜氨配合物
C.步骤3中未采取蒸发结晶的方法获得晶体,说明一水硫酸四氨合铜受热易分解
D.如图所示铜的晶胞中有14个铜原子
5.(本题3分)短周期主族元素W、X、Y的原子序数依次增大。p、n、m分别是元素W、X、Y的单质,r、q是由这些元素组成的二元化合物,r是一种淡黄色粉末,s的溶液是强碱溶液。上述物质的转化关系如图所示。下列说法正确的是
A.离子半径:Y>X B.还原性:m<p
C.s和q中均含有离子键 D.r中含离子键和非极性键
6.(本题3分)如图,X、Y、Z、W四种短周期元素的原子最外层电子数之和为21.下列说法正确的是
X
Y
W
Z
T
A.原子半径(r):r(Z)>r(Y)>r(X)
B.X的氢化物一定比Y的氢化物的沸点要低
C.WY2、WZ4、WX均有熔点高、硬度大的特性
D.某病毒DNA链中有T元素,可能是T取代了普通DNA链中的P元素
7.(本题3分)下列“类比”合理的是
A.C在足量O2中燃烧生成CO2,则S在足量O2中燃烧生成SO3
B.铜丝在氯气中燃烧生成CuCl2,则铁丝在氯气中燃烧生成FeCl2
C.Mg在CO2中燃烧生成MgO和C,则Na在CO2中燃烧可能生成Na2CO3和C
D.往AlCl3溶液中加入过量氨水生成Al(OH)3沉淀,则往CuCl2溶液中加入过量氨水生成Cu(OH)2沉淀
8.(本题3分)由EDTA制备食品铁强化剂Na[FeEDTA]的合成路线如下:
下列有关说法正确的是
A.Na[FeEDTA]中的Fe元素的化合价为+2价 B.1molNa[FeEDTA]中含有6mol配位键
C.[FeEDTA]-中碳原子的杂化类型为sp2 D.EDTA分子间可通过取代反应形成肽键
9.(本题3分)下列物质的结构或性质与氢键无关的是
A.乙醇的沸点 B.冰的密度 C.氢化镁的晶格能 D.DNA的双螺旋结构
10.(本题3分)有一种蓝色晶体[可表示为MxFey(CN)6],经X-射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法不正确的是
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体
C.该晶体中M呈+2 价
D.晶体中与每个 Fe3+距离最近且等距离的 CN-为6个
11.(本题3分)下列化学用语表达正确的是
A.乙烯的实验式:false
B.电镀铜时,铁制镀件上的电极反应式:false
C.false在水中的电离方程式:false
D.用电子式表示false的形成过程:
12.(本题3分)某物质的化学式为false,其水溶液不导电。加入false溶液也不产生沉淀,以强碱处理并没有false放出,则关于此化合物的说法正确的是
A.配合物中中心原子的电荷数和配位数均为6
B.false和false分子均与false形成配位键
C.该配合物的配体只有false
D.false该配合物中有false键
13.(本题3分)下列有关晶体的说法正确的有
①石英和金刚石都是共价晶体,最小环上都有6个原子
②在晶体中只要有阴离子就一定有阳离子
③金刚石、金刚砂、冰、干冰晶体的熔点依次降低
④石墨晶体中碳原子数和C-C键个数之比为1:2
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
A.1项 B.2项 C.3项 D.4项
14.(本题3分)由Li、Al、Si构成的某三元化合物固态晶体结构如图,下列说法正确的是
A.晶体中Al和Si构成二氧化硅型骨架
B.晶体中Li、Al、Si三种微粒的比例为2:2:1
C.Si原子从1s22s22p63s23pfalse3pfalse转变为1s22s22p63s23pfalse3pfalse会吸收能量,产生吸收光谱
D.晶体中与每个Al紧邻的Si有4个
15.(本题3分)false晶体被业内称为“半导体贵族”,2001年7月31日,我国科学家宣布掌握其生产技术,中国成为继日本和德国之后第三个拥有此项技术的国家。它的熔点很高,硬度很大,其原子间以共价键(配位键)相连,密度为false,false和false的摩尔质量分别为false和false,原子半径分别为false和false,阿伏加德罗常数值为false,其晶胞结构如图所示。下列说法错误的是
A.该晶体为原子晶体
B.在该晶体中false和false的配位数均为4
C.所有原子均满足8电子稳定结构
D.原子的体积占晶胞体积的百分率为false
16.(本题3分)某同学对false和false都是离子化合物”有下列4点感悟,其中不正确的是
A.离子化合物中可能含共价键 B.false晶体中既含离子键也含共价键
C.离子化合物中不一定含金属元素 D.NaOH和false混合加热过程中只有离子键发生断裂
第II卷(非选择题)
二、填空题(共25分)
17.(本题13分)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN。
(1)Zn2+基态核外电子排布式为___________。画出配合物离子[Zn(H2O)4]2+中的配位键___________
(2)1molHCHO分子中含有σ键的数目为___________。
(3)HOCH2CN的结构简式,HOCH2CN分子中碳原子轨道的杂化类型分别是___________和___________。
(4)与H2O分子互为等电子体的阴离子为___________。
(5)下列一组微粒中键角由大到小顺序排列为___________(用编号填写)
①CO2 ②SiF4 ③SCl2 ④COfalse ⑤H3O+
(6)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
①H、B、N中,原子半径最大的是___________。根据对角线规则,B的一些化学性质与元素___________的相似。
②NH3BH3分子中,N-B化学键称为___________键,其电子对由___________提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+false+9H2,false的结构如图所示:;在该反应中,B原子的杂化轨道类型由___________变为___________。
18.(本题12分)氮元素可形成丰富多彩的物质。
(1)光化学烟雾易在PM2.5的催化作用下形成,其中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。下列说法正确的是___________(填字母)。
A.N2O与CO2互为等电子体,其结构式为N=N=O
B.O3的沸点高于O2的沸点
C.CH2=CHCHO分子中碳原子采取sp2和sp3杂化
D.HCOOH在水中的溶解度大,与氢键有关
(2)在配合物中,微粒NH3、NHfalse、NH2OH中不能作为配体的是___________。
(3)图a为六方氮化硼晶体的结构示意图,该晶体中存在的作用力有___________。
(4)六方氮化硼在高温高压下可转化为立方氮化硼,立方氮化硼的晶胞结构如图b所示,晶胞边长为dcm,该晶胞中含有___________个氮原子、___________个硼原子,立方氮化硼晶体的密度为___________ g·cm-3(设阿伏加德罗常数的值为NA)。
三、元素或物质推断题(共27分)
19.(本题13分)N、A、B、D、E均为原子序数依次递增的前四周期元素,M原子内的电子只有一种运动状态,N原子的双原子分子内的键能在同周期非金属元素的单质中最大,A与B同主族,且A元素的原子序数是B元素原子序数的false,D属于第IIB的元素,E元素原子的4p轨道上有3个未成对电子。
(1)A原子核外电子能量最高的能层的符号是_______,D原子价电子的排布式为________。
(2)设计实验,比较A元素与B元素非金属活泼性__________。
(3)NM3的键角________(填“﹥”“﹤”“=”)EM3的键角,NM3的沸点_______(填“高于”、“低于”“等于”)EM3的沸点。
(4)与E同周期的主族元素中,第一电离能最大的是_______(填元素名称)。A和E形成分子的结构如图所示,该分子的分子式为________,E原子的杂化类型为_________。
(5)与BA2分子的中心原子价电子对几何构型不同但分子构型相同的是 _________。
A.BeCl2 B.PH3 C.H2O D.OF2
(6)金属D晶体中的原子堆积方式如图所示,这种堆积方式称为_______,D原子的配位数为_________,六棱柱高为ccm,底边边长为acm,阿伏伽德罗常数的值为NA,D晶体的密度为_______g·cm–3(列出计算式)。
20.(本题14分)A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
(1)写出M与甲的浓溶液加热时反应的化学方程式___________
(2)X、Y、Z、W属于同一类物质,这类化合物通常熔沸点较___________(填“高”或“低”); X、Y、W都能与Z反应,则Z的结构式为___________
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n=___________,写出反应的化学方程式___________
(4)化合物ED2与元素B形成的某种单质能在高温下能发生置换反应,若反应中有1mol电子发生了转移,则参加反应的化合物ED2的质量为___________g。
(5)元素B的另一种单质能导电,具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12g该单质中含有___________NA个正六边形。
参考答案
1.B
【详解】
A.图中X、Y均处于顶点,且个数均为4,个数比为1:1,化学式为XY,故A正确;
B.Y有8个位于顶点,个数为8×false=1,X位于体心,个数为1,个数比为1:1,化学式为X2Y,故B错误;
C.图中X的数目:4×false+1=false,Y的数目:4×false=false,化学式X3Y正确,故C正确;
D.图中,X的数目:8×false=1,Y的数目:6×false=3,Z位于体心,数目为1,化学式XY3Z,故D正确;
故选:B。
2.C
【详解】
A.三者都为原子晶体,原子半径越小,键长越短,键能越大,熔点越高,因此熔点:金刚石>碳化硅>晶体硅,故A错误;
B.由于对羟基苯甲醛含有分子间氢键,邻羟基苯甲醛含有分子内氢键,分子间氢键使得熔点升高,因此熔点:对羟基苯甲醛>邻羟基苯甲醛,故B错误;
C.同周期从左到右电负性逐渐增大,因此电负性:Na<P<Cl,故C正确;
D.HF含有分子间氢键,分子间氢键使得熔点升高,因此熔沸点:HCl<HF,HCl、HBr、HI三者,结构和组成相似,相对分子质量越大,范德华力越大,熔沸点越高,故D错误;
答案选C。
3.D
【详解】
A.锶(Sr)元素与镁元素是同主族元素,则与Ca也同周期,同主族元素自上而下金属性增强,所以Sr的活泼性比Ca要强,则易和空气中的氧气、水蒸气等反应,其密度比煤油大,所以可以保存在煤油中,A正确;
B.同主族元素自上而下金属性增强,最高价氧化物的水化物的碱性增强,所以false的碱性比false强,B正确;
C.Sr金属性很强,而Cl的非金属性较强,所以false是有Sr2+和Cl-构成的离子晶体,C正确;
D.Sr2+的半径要大于Mg2+,对O的吸引力较小,不容易与碳酸根中的O形成离子键,所以false的分解温度比false高,D错误;
综上所述答案为D。
4.D
【详解】
A.步骤1中氧化铜和硫酸反应生成硫酸铜和水,步骤2中加入氨水,生成的蓝色沉淀为Cu(OH)2,故A正确;
B.步骤2中先产生的蓝色沉淀是氢氧化铜,继续加氨水沉淀溶解,是因为生成了铜氨配合物,故B正确;
C.蒸发结晶需要加热,不稳定的物质容易分解,步骤3中未采取蒸发结晶的方法获得晶体,说明一水硫酸四氨合铜受热易分解,故C正确;
D.根据晶胞结构,如图所示铜的晶胞中含有的铜原子个数为false=4,故D错误;
故选D。
5.D
【分析】
r、q是由这些元素组成的二元化合物,r是一种淡黄色粉末,则r为false,s的溶液是强碱溶液,则s为false,m为false,n为false,q为false,p为false,W、X、Y的原子序数依次增大,则W、X、Y分别为H、O、Na,据此分析答题。
【详解】
A.false和false离子核外电子排布相同,离子半径序小径大,false<false,A错误;
B.钠和水发生如下反应:false,还原剂的还原性强于还原产物,所以还原性:false>false,B错误;
C.s为false,钠离子与氢氧根离子之间形成离子键,q为false,氢原子和氧原子之间形成共价键,C错误;
D.r为false,过氧根内部为非极性键,钠离子和过氧根离子之间为离子键,D正确;
答案为:D
6.D
【分析】
设X的最外层电子数为a,则Y、W、Z的最外层电子数分别为(a+2)、a、(a+3),从而得出a+ (a+2)+a+(a+3)=21,a=4,故X、Y、W、Z分别为C、O、Si、Cl,则T为As元素。
【详解】
A.X、Y、Z分别为C、O、Cl,C、O为同周期元素,C在O的左边,则原子半径(r):r(C) >r(O),故A错误;
B.X、Y分别为C、O,若X的氢化物中碳原子数比较多(如石蜡),常温下呈固态,则其沸点可能比Y的氢化物(H2O)的沸点要高,故B错误;
C.SiCl4在固态时形成分子晶体,其熔点较低、硬度较小,故C错误;
D.某病毒DNA链中有As元素,As与P属于同主族元素,可能是As取代了普通DNA链中的P元素生成的,故D正确;
故选D。
7.C
【详解】
A.S在足量O2中燃烧只能生成SO2,不能生成SO3,故A错误;
B.铁丝在氯气中燃烧只能生成FeCl3,不能生成FeCl2,故B错误;
C.钠的金属性比镁强,则钠也能在二氧化碳中燃烧生成氧化钠和碳,氧化钠与过量的二氧化碳反应生成碳酸钠,则钠在二氧化碳中燃烧可能生成碳酸钠和碳,故C正确;
D.氢氧化铜能与氨水反应生成四氨合铜离子,则氯化铜溶液中加入过量氨水生成生成四氨合铜离子,不能生成氢氧化铜沉淀,故D错误;
故选C。
8.B
【详解】
A.根据化合物化合价代数和为0可判断Na[FeEDTA]中的Fe元素的化合价为+3价,A错误;
B.根据示意图可知4个O和2个N与Fe形成配位键,则1molNa[FeEDTA]中含有6mol配位键,B正确;
C.[FeEDTA]-中碳原子的杂化类型有sp2、sp3两种,C错误;
D.EDTA分子中N原子上没有氢原子,分子间不能通过取代反应形成肽键,D错误;
答案选B。
9.C
【详解】
A.乙醇分子间能形成氢键,从而使它的沸点升高,A不符合题意;
B.冰中的水分子间通过形成氢键而构成正四面体结构,使冰的密度减小,B不符合题意;
C.氢化镁为离子化合物,由Mg2+和H-构成,晶格能由离子键决定,与氢键无关,C符合题意;
D.DNA分子间通过形成氢键,形成双螺旋结构,D不符合题意;
故选C。
10.C
【分析】
由阴离子的晶胞结构可知,晶胞中亚铁离子的个数为4×false=false,铁离子的的个数为4×false=false,氰酸根离子的个数为12×false=3,则阴离子为[Fe2(CN)6]—,由化合价代数和为0可知,MxFey(CN)6只能为MFe2(CN)6。
【详解】
A.由分析可知,该晶体的化学式为MFe2(CN)6,故A正确;
B.由题意可知,该晶体为M+离子和[Fe2(CN)6]—离子形成的离子晶体,故B正确;
C.由题意可知,该晶体为M+离子和[Fe2(CN)6]—离子形成的离子晶体,该晶体中M呈+1 价故C错误;
D.由阴离子的晶胞结构可知,位于顶点的铁离子与位于棱上的氰酸根离子的距离最近,则每个铁离子距离最近且等距离的CN—为6个,故D正确;
故选C。
11.D
【详解】
A.乙烯的实验式即最简式,应该为CH2,A错误;
B.电镀铜时,铁制镀件上的电极反应式:false,B错误;
C.false在水中完全电离,电离方程式:false,C错误;
D.NaCl为离子化合物,用电子式表示false的形成过程:,D正确;
答案选D。
12.B
【分析】
实验式为PtCl4?2NH3的物质,其水溶液不导电说明它不是离子化合物,在溶液中不能电离出阴、阳离子,加入AgNO3不产生沉淀,用强碱处理没有NH3放出,说明不存在游离的氯离子和氨分子,所以该物质的配位化学式为[PtCl4(NH3)2]。
【详解】
A. 配合物中中心原子的电荷数电荷数为4,配位数为6,故A错误;
B. false和false分子均与false形成配位键,形成的配合物为[PtCl4(NH3)2],故B正确;
C. 由分析可知,Cl-和NH3分子均与Pt4+配位,故C错误;
D. 每个[PtCl4(NH3)2]分子中含4个σPt-Cl键、2个σPt-N键、6个σN-H键,false该配合物中有false键,故D错误;
故选B。
13.C
【详解】
①石英是SiO2,其空间结构示意图为,其最小环中有12个原子,①错误;
②晶体只要有阴离子就一定有阳离子,②正确;
③金刚砂为SiC。金刚石和金刚砂均为原子晶体,原子半径越小,键长越小,化学键越强,熔点越高;键长C-C<Si-C,化学键的强弱C-C>Si-C,金刚石的熔点高于金刚砂。原子晶体的熔点比分子晶体熔点高。冰中水分子间存在氢键,使得熔点升高,使得冰的熔点大于CO2;因此金刚石、金刚砂、冰、干冰晶体的熔点依次降低,③正确;
④石墨晶体中,C原子形成3个C-C,而1个C-C键由2个C构成,则碳原子数和C-C键个数比为2:3,④错误;
⑤Al2O3晶体中离子键成分百分数较小,可以当作共价晶体处理,⑤正确;
⑥石墨晶体中除含有的C-C键为σ键,还含有π键,⑥错误;
综上只有3项是正确的;
答案选C。
【点睛】
晶体中含有阳离子,但不一定含有阴离子,如金属晶体由金属阳离子和电子构成。
14.D
【详解】
A.二氧化硅型骨架:,晶体中Al和Si在顶角处有硅与铝原子不相连,故A错误;
B.晶体中Li=12×false+1=4,Al=8×false+6×false=4,Si=4,三种微粒的比例为1:1:1,故B错误;
C.Si原子从1s22s22p63s23pfalse3pfalse转变为1s22s22p63s23pfalse3pfalse能量不改变,不产生吸收光谱,故C错误;
D.由图中晶胞可知,观察顶角的Al原子,晶体中与每个Al紧邻的Si有4个,故D正确;
故选D。
15.D
【详解】
A.它的熔点很高,硬度很大,该晶体为原子晶体,故A正确;
B.晶胞中false原子数目=4,false原子数目=false,在该晶体中false和false的配位数均为4,故B正确;
C.每个false、false都形成4个共价键,均没有孤电子对,所有原子均满足8电子稳定结构,故C正确;
D.晶胞中原子总体积false,晶胞质量 false,晶胞体积false,原子的体积占晶胞体积的百分率为 false×100%=false×100%,故D错误;
故选D。
16.D
【详解】
A.NH4Cl是离子化合物,但是其含有共价键,故离子化合物中可能含共价键,A项正确;
B.F元素的非金属性强于Cl的,则NH4F也是离子化合物,B项正确;
C.离子化合物中可含金属元素,也可含false等类金属离子原子团,C项正确;
D.在加热过程中会生成NH3,说明false离子失去了H,故有N-H键断裂,故反应中也有共价键断裂,D项错误;
答案选D。
17.1s22s22p63s23p63d10或[Ar]3d10 3mol或3NA sp3杂化 sp杂化 false ①>④>②>⑤>③ B(硼) Si(硅) 配位键 N sp3杂化 sp2杂化
【详解】
(1)Zn是30号元素,其原子核外有30个电子,失去最外层两个电子生成锌离子,根据构造原理书写其核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;Zn为中心离子,H2O为配体,配位数为4,所以配合物离子[Zn(H2O)4]2+中的配位键为;
(2)单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键,HCHO分子中含有2个C-H键、1个C= O双键,分子中含有3个σ键,所以1mol甲醛(HCHO)分 子中含有的σ键数目为3mol或3NA,故为:3 mol或3NA;
(3)根据HOCH2CN的结构简式,其中与羟基(-OH)相连的一个碳为饱和碳原子,价层电子对为4+0=4,杂化类型为sp3,另一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,价层电子对为2+false ,所以杂化类型为sp杂化;
(4)原子个数相等、价电子数相等的微粒为等电子体,与水互为等电子体的微粒该是3原子最外层电子数为8 的分子或离子,这样的微粒有:H2S、 NHfalse ,阴离子为: NHfalse,故答案为NHfalse;
(5)①CO2是直线结构,键角为180°;②SiF4为正四面体结构,键角为109°28′;③SCl2中S采用sp3杂化,为V形结构;④COfalse 中C采用sp2杂化,为正三角形结构,键角为120°;⑤H3O+中O采用sp3杂化,为三角锥形结构,③中2个孤电子对之间的斥力较大,使得③中键角小于⑤,同理⑤中键角小于②,因此键角由大到小顺序排列为①④②⑤③,故答案为:①>④>②>⑤>③;
(6)①根据同一周期从左到右主族元素的原子半径逐渐减小,可知H、B、N中原子半径最大的是B(硼);元素周期表中B与Si(硅)处于对角线上,二者化学性质相似;
②NH3BH3中N有孤电子对,B有空轨道,N和B形成配位键;电子对由N提供;NH3BH3中B形成四个σ键,为sp3杂化,B3Ofalse 中B形成3个σ键,为sp2杂化。
18.ABD false 共价键、范德华力 4 4 false
【详解】
(1)A.N2O与CO2分子中含有的原子总数相等,价电子总数也相等,因此二者互为等电子体,其结构式为N=N=O,选项A正确;
B.由于相对分子质量O3>O2,相对分子质量越大,分子之间作用力越大,物质的熔沸点就越高所以O3的沸点大于O2,选项B正确;
C.在CH2=CHCHO分子中碳原子的杂化方式都是为sp2杂化,选项C错误;
D.HCOOH分子与水分子之间会形成氢键,使其在水中溶解度大,选项D正确;
答案选ABD;
(2)在配合物中,微粒NH3、NH2OH的N原子上都有孤对电子,可以形成配位键,能够作配体,而false无孤对电子,不可以形成配位键,因此不能作配体;答案为false;
(3)根据六方氮化硼晶体结构示意图可知,在层内原子之间以共价键结合,而在层间以范德华力结合。故该晶体含用的作用力的类型有共价键、范德华力;
(4)在立方氮化硼晶体结构中,每个晶胞中含有的B原子个数是false×8+false×6=4;含有的N原子数是1×4=4;所以在一个晶胞中含有4个B原子,4个N原子。由于晶胞的边长是dcm,所以立方氮化硼的密度false,答案为4;4;false。
19.2P false 可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性O>S. > > 溴 As2O3 sp3 CD 立方最密堆积 12 false
【分析】
前四周期元素,由M原子内的电子只有一种运动状态知M为H,由N原子的双原子分子内的键能在同周期非金属元素的单质中最大知N为氮,由A与B同主族,且A元素的原子序数是B元素原子序数的false知A为氧,B为硫,由D属于第IIB的元素,且是第四周期知D是锌,由E元素原子的4p轨道上有3个未成对电子知E是As。
【详解】
(1)A为O原子,电子排布式是false,所以能量最高的能层的符号是2P,D原子电子的排布式为false,价电子的排布式为false,故答案为:2P;false。
(2)设计实验比较O与S的非金属性,可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性O>S。故答案为:可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性O>S
(3)因为氮的电负性强于砷的,所以键角false,因为氨气中存在氢键,所以沸点false,故答案为:>;>.
(4)同周期的主族元素中从左到右第一电离能逐渐增大,所以是溴,根据O和As形成的分子结构可知化合物的分子式为As2O3, As原子形成了三个共价键,且有一对孤电子,所以原子的杂化类型为sp3.故答案为:As2O3; sp3.
(5)SO2分子的中心原子价电子对为false=2+1=3几何构型为平面三角形,但分子构型为V形。
A.BeCl2分子的中心原子价电子对为false=2+1=3几何构型为平面三角形,但分子构型为V形。
B.PH3分子的中心原子价电子对为false=3+1=4几何构型为正四面体形,但分子构型为三角锥形。
C.H2O分子的中心原子价电子对为false=2+2=4几何构型为正四面体形,但分子构型为V形。
D.OF2分子的中心原子价电子对为false=2+2=4几何构型为正四面体形,但分子构型为V形。
故与SO2分子的中心原子价电子对几何构型不同但分子构型相同的是CD.故答案为:CD
(6)由金属锌晶体中的原子堆积方式图示可知,堆积方式称为立方最密堆积,配位数为12,图中结构单元中Zn原子数目为false,结构单元中Zn的总质量为false,晶体密度为falsefalse,故答案为: 立方最密堆积;12;false
【点睛】
本题考查物质结构和性质,涉及核外电子排布式书写及排布规律、电离能、晶体类型与性质,晶胞结构及计算等,要求学生知识面比较全,难度较大,是物质结构与性质的综合题。
20.C+4HNO3(浓)falseCO2↑+4NO2↑+2H2O 低 H-O-H false 4SO2+4NO2+3O2+6H2O=4HNO3+4H2SO4 15 0.5
【分析】
A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大B、F原子的最外层电子数均为其电子层数的两倍,由于F的原子序数大于B,则B是C元素,F是S元素;D、F元素原子的最外层电子数相等,二者为同主族元素,则D为O元素;C的原子序数介于B、D之间,所以C为N元素;X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应,则甲、乙分别为浓硝酸和浓硫酸,相对分子质量甲<乙,所以甲为浓硝酸,乙为浓硫酸;由转化关系图可知,X为NO2,W为SO2;元素E形成的单质是“21世纪的能源”,是目前应用最多的半导体材料,则E为Si元素;由于A原子序数最小,结合反应过程的物质所含元素,可知A是H元素;据此答题。
【详解】
通过上述分析可知A是H元素;B是C元素;C是N元素;D是O元素;E是Si元素;F是S元素;甲是浓硝酸,乙是浓硫酸;X是NO2;Y、Z一种是CO2,一种是H2O;W是SO2;由于NO2、SO2、CO2、H2O属于同一类物质,且X、Y、W都能与Z反应,则Z为H2O,Y是CO2;
(1)M是C单质,C与浓硝酸在加热时发生反应,产生CO2、NO2、H2O,反应的方程式为:C+4HNO3(浓)falseCO2↑+4NO2↑+2H2O;
(2)NO2、SO2、CO2、H2O属于同一类物质,这类化合物固态时的晶体类型为都为分子晶体,通常熔沸点较低,X、Y、W都能与Z反应,则Z为H2O,它的结构式为H-O-H;
(3)NO2、SO2与O2按1∶1∶n的物质的量之比通入H2O中,充分反应后无气体剩余或生成,则根据反应过程中电子转移数目相等,可得反应方程式:4SO2+4NO2+3O2+6H2O=4H2SO4+4HNO3,可见n(SO2):n(NO2):n(O2)=4:4:3=1:1:false,所以n=false;
(4)化合物SiO2与C在高温下发生反应:SiO2+2CfalseSi+2CO,根据价态变化可知反应1molSiO2转移4mol电子,所以转移1mol电子时消耗SiO2的物质的量是0.25mol,所以反应的SiO2的质量是m(SiO2)=0.25mol×60g/mol=15g;
(5)元素B的另一种单质具有平面层状结构,则该单质是石墨,在同一层中的C原子构成许许多多的正六边形,每个C原子与相邻的3个C原子形成共价键,C原子之间形成正六边形,每个正六边形含有这样的6个C原子,所以一个正六边形中含有的C原子数目为6×false=2,12g石墨中含有C原子物质的量是1mol,则其中含有的正六边形的物质的量是1÷2=0.5mol,则含有的正六边形的数目为0.5NA个正六边形。
第三章能力提升卷
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
一、单选题(共48分)
1.(本题3分)如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中○—X、●—Y、?—Z。其对应的化学式不正确的是
A. B. C. D.
2.(本题3分)下列说法正确的是
A.熔点:金刚石>晶体硅>碳化硅
B.熔点:邻羟基苯甲醛>对羟基苯甲醛
C.电负性:Na<P<Cl
D.熔沸点:HF<HCl<HBr<HI
3.(本题3分)锶(Sr)元素与镁元素是同主族元素,下列说法错误的是
A.单质Sr保存在煤油中 B.false的碱性比false强
C.false是离子晶体 D.false的分解温度比false低
4.(本题3分)一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体,实验室可以用氧化铜为原料通过以下方法制取。
步骤1:向试管中加入一定量的氧化铜固体,加入足量稀硫酸充分反应,观察到固体完全溶解,溶液变蓝色;
步骤2:向试管中继续滴加过量的2%氨水,观察到先有蓝色沉淀,后又逐渐完全溶解得到深蓝色溶液。
步骤3:再向试管中加入无水乙醇,振荡静置,有深蓝色晶体析出。
下列说法不正确的是
A.步骤2中观察到的蓝色沉淀为Cu(OH)2
B.步骤2中沉淀溶解是因为生成了铜氨配合物
C.步骤3中未采取蒸发结晶的方法获得晶体,说明一水硫酸四氨合铜受热易分解
D.如图所示铜的晶胞中有14个铜原子
5.(本题3分)短周期主族元素W、X、Y的原子序数依次增大。p、n、m分别是元素W、X、Y的单质,r、q是由这些元素组成的二元化合物,r是一种淡黄色粉末,s的溶液是强碱溶液。上述物质的转化关系如图所示。下列说法正确的是
A.离子半径:Y>X B.还原性:m<p
C.s和q中均含有离子键 D.r中含离子键和非极性键
6.(本题3分)如图,X、Y、Z、W四种短周期元素的原子最外层电子数之和为21.下列说法正确的是
X
Y
W
Z
T
A.原子半径(r):r(Z)>r(Y)>r(X)
B.X的氢化物一定比Y的氢化物的沸点要低
C.WY2、WZ4、WX均有熔点高、硬度大的特性
D.某病毒DNA链中有T元素,可能是T取代了普通DNA链中的P元素
7.(本题3分)下列“类比”合理的是
A.C在足量O2中燃烧生成CO2,则S在足量O2中燃烧生成SO3
B.铜丝在氯气中燃烧生成CuCl2,则铁丝在氯气中燃烧生成FeCl2
C.Mg在CO2中燃烧生成MgO和C,则Na在CO2中燃烧可能生成Na2CO3和C
D.往AlCl3溶液中加入过量氨水生成Al(OH)3沉淀,则往CuCl2溶液中加入过量氨水生成Cu(OH)2沉淀
8.(本题3分)由EDTA制备食品铁强化剂Na[FeEDTA]的合成路线如下:
下列有关说法正确的是
A.Na[FeEDTA]中的Fe元素的化合价为+2价 B.1molNa[FeEDTA]中含有6mol配位键
C.[FeEDTA]-中碳原子的杂化类型为sp2 D.EDTA分子间可通过取代反应形成肽键
9.(本题3分)下列物质的结构或性质与氢键无关的是
A.乙醇的沸点 B.冰的密度 C.氢化镁的晶格能 D.DNA的双螺旋结构
10.(本题3分)有一种蓝色晶体[可表示为MxFey(CN)6],经X-射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法不正确的是
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体
C.该晶体中M呈+2 价
D.晶体中与每个 Fe3+距离最近且等距离的 CN-为6个
11.(本题3分)下列化学用语表达正确的是
A.乙烯的实验式:false
B.电镀铜时,铁制镀件上的电极反应式:false
C.false在水中的电离方程式:false
D.用电子式表示false的形成过程:
12.(本题3分)某物质的化学式为false,其水溶液不导电。加入false溶液也不产生沉淀,以强碱处理并没有false放出,则关于此化合物的说法正确的是
A.配合物中中心原子的电荷数和配位数均为6
B.false和false分子均与false形成配位键
C.该配合物的配体只有false
D.false该配合物中有false键
13.(本题3分)下列有关晶体的说法正确的有
①石英和金刚石都是共价晶体,最小环上都有6个原子
②在晶体中只要有阴离子就一定有阳离子
③金刚石、金刚砂、冰、干冰晶体的熔点依次降低
④石墨晶体中碳原子数和C-C键个数之比为1:2
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
A.1项 B.2项 C.3项 D.4项
14.(本题3分)由Li、Al、Si构成的某三元化合物固态晶体结构如图,下列说法正确的是
A.晶体中Al和Si构成二氧化硅型骨架
B.晶体中Li、Al、Si三种微粒的比例为2:2:1
C.Si原子从1s22s22p63s23pfalse3pfalse转变为1s22s22p63s23pfalse3pfalse会吸收能量,产生吸收光谱
D.晶体中与每个Al紧邻的Si有4个
15.(本题3分)false晶体被业内称为“半导体贵族”,2001年7月31日,我国科学家宣布掌握其生产技术,中国成为继日本和德国之后第三个拥有此项技术的国家。它的熔点很高,硬度很大,其原子间以共价键(配位键)相连,密度为false,false和false的摩尔质量分别为false和false,原子半径分别为false和false,阿伏加德罗常数值为false,其晶胞结构如图所示。下列说法错误的是
A.该晶体为原子晶体
B.在该晶体中false和false的配位数均为4
C.所有原子均满足8电子稳定结构
D.原子的体积占晶胞体积的百分率为false
16.(本题3分)某同学对false和false都是离子化合物”有下列4点感悟,其中不正确的是
A.离子化合物中可能含共价键 B.false晶体中既含离子键也含共价键
C.离子化合物中不一定含金属元素 D.NaOH和false混合加热过程中只有离子键发生断裂
第II卷(非选择题)
二、填空题(共25分)
17.(本题13分)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN。
(1)Zn2+基态核外电子排布式为___________。画出配合物离子[Zn(H2O)4]2+中的配位键___________
(2)1molHCHO分子中含有σ键的数目为___________。
(3)HOCH2CN的结构简式,HOCH2CN分子中碳原子轨道的杂化类型分别是___________和___________。
(4)与H2O分子互为等电子体的阴离子为___________。
(5)下列一组微粒中键角由大到小顺序排列为___________(用编号填写)
①CO2 ②SiF4 ③SCl2 ④COfalse ⑤H3O+
(6)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
①H、B、N中,原子半径最大的是___________。根据对角线规则,B的一些化学性质与元素___________的相似。
②NH3BH3分子中,N-B化学键称为___________键,其电子对由___________提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+false+9H2,false的结构如图所示:;在该反应中,B原子的杂化轨道类型由___________变为___________。
18.(本题12分)氮元素可形成丰富多彩的物质。
(1)光化学烟雾易在PM2.5的催化作用下形成,其中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。下列说法正确的是___________(填字母)。
A.N2O与CO2互为等电子体,其结构式为N=N=O
B.O3的沸点高于O2的沸点
C.CH2=CHCHO分子中碳原子采取sp2和sp3杂化
D.HCOOH在水中的溶解度大,与氢键有关
(2)在配合物中,微粒NH3、NHfalse、NH2OH中不能作为配体的是___________。
(3)图a为六方氮化硼晶体的结构示意图,该晶体中存在的作用力有___________。
(4)六方氮化硼在高温高压下可转化为立方氮化硼,立方氮化硼的晶胞结构如图b所示,晶胞边长为dcm,该晶胞中含有___________个氮原子、___________个硼原子,立方氮化硼晶体的密度为___________ g·cm-3(设阿伏加德罗常数的值为NA)。
三、元素或物质推断题(共27分)
19.(本题13分)N、A、B、D、E均为原子序数依次递增的前四周期元素,M原子内的电子只有一种运动状态,N原子的双原子分子内的键能在同周期非金属元素的单质中最大,A与B同主族,且A元素的原子序数是B元素原子序数的false,D属于第IIB的元素,E元素原子的4p轨道上有3个未成对电子。
(1)A原子核外电子能量最高的能层的符号是_______,D原子价电子的排布式为________。
(2)设计实验,比较A元素与B元素非金属活泼性__________。
(3)NM3的键角________(填“﹥”“﹤”“=”)EM3的键角,NM3的沸点_______(填“高于”、“低于”“等于”)EM3的沸点。
(4)与E同周期的主族元素中,第一电离能最大的是_______(填元素名称)。A和E形成分子的结构如图所示,该分子的分子式为________,E原子的杂化类型为_________。
(5)与BA2分子的中心原子价电子对几何构型不同但分子构型相同的是 _________。
A.BeCl2 B.PH3 C.H2O D.OF2
(6)金属D晶体中的原子堆积方式如图所示,这种堆积方式称为_______,D原子的配位数为_________,六棱柱高为ccm,底边边长为acm,阿伏伽德罗常数的值为NA,D晶体的密度为_______g·cm–3(列出计算式)。
20.(本题14分)A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
(1)写出M与甲的浓溶液加热时反应的化学方程式___________
(2)X、Y、Z、W属于同一类物质,这类化合物通常熔沸点较___________(填“高”或“低”); X、Y、W都能与Z反应,则Z的结构式为___________
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n=___________,写出反应的化学方程式___________
(4)化合物ED2与元素B形成的某种单质能在高温下能发生置换反应,若反应中有1mol电子发生了转移,则参加反应的化合物ED2的质量为___________g。
(5)元素B的另一种单质能导电,具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12g该单质中含有___________NA个正六边形。
参考答案
1.B
【详解】
A.图中X、Y均处于顶点,且个数均为4,个数比为1:1,化学式为XY,故A正确;
B.Y有8个位于顶点,个数为8×false=1,X位于体心,个数为1,个数比为1:1,化学式为X2Y,故B错误;
C.图中X的数目:4×false+1=false,Y的数目:4×false=false,化学式X3Y正确,故C正确;
D.图中,X的数目:8×false=1,Y的数目:6×false=3,Z位于体心,数目为1,化学式XY3Z,故D正确;
故选:B。
2.C
【详解】
A.三者都为原子晶体,原子半径越小,键长越短,键能越大,熔点越高,因此熔点:金刚石>碳化硅>晶体硅,故A错误;
B.由于对羟基苯甲醛含有分子间氢键,邻羟基苯甲醛含有分子内氢键,分子间氢键使得熔点升高,因此熔点:对羟基苯甲醛>邻羟基苯甲醛,故B错误;
C.同周期从左到右电负性逐渐增大,因此电负性:Na<P<Cl,故C正确;
D.HF含有分子间氢键,分子间氢键使得熔点升高,因此熔沸点:HCl<HF,HCl、HBr、HI三者,结构和组成相似,相对分子质量越大,范德华力越大,熔沸点越高,故D错误;
答案选C。
3.D
【详解】
A.锶(Sr)元素与镁元素是同主族元素,则与Ca也同周期,同主族元素自上而下金属性增强,所以Sr的活泼性比Ca要强,则易和空气中的氧气、水蒸气等反应,其密度比煤油大,所以可以保存在煤油中,A正确;
B.同主族元素自上而下金属性增强,最高价氧化物的水化物的碱性增强,所以false的碱性比false强,B正确;
C.Sr金属性很强,而Cl的非金属性较强,所以false是有Sr2+和Cl-构成的离子晶体,C正确;
D.Sr2+的半径要大于Mg2+,对O的吸引力较小,不容易与碳酸根中的O形成离子键,所以false的分解温度比false高,D错误;
综上所述答案为D。
4.D
【详解】
A.步骤1中氧化铜和硫酸反应生成硫酸铜和水,步骤2中加入氨水,生成的蓝色沉淀为Cu(OH)2,故A正确;
B.步骤2中先产生的蓝色沉淀是氢氧化铜,继续加氨水沉淀溶解,是因为生成了铜氨配合物,故B正确;
C.蒸发结晶需要加热,不稳定的物质容易分解,步骤3中未采取蒸发结晶的方法获得晶体,说明一水硫酸四氨合铜受热易分解,故C正确;
D.根据晶胞结构,如图所示铜的晶胞中含有的铜原子个数为false=4,故D错误;
故选D。
5.D
【分析】
r、q是由这些元素组成的二元化合物,r是一种淡黄色粉末,则r为false,s的溶液是强碱溶液,则s为false,m为false,n为false,q为false,p为false,W、X、Y的原子序数依次增大,则W、X、Y分别为H、O、Na,据此分析答题。
【详解】
A.false和false离子核外电子排布相同,离子半径序小径大,false<false,A错误;
B.钠和水发生如下反应:false,还原剂的还原性强于还原产物,所以还原性:false>false,B错误;
C.s为false,钠离子与氢氧根离子之间形成离子键,q为false,氢原子和氧原子之间形成共价键,C错误;
D.r为false,过氧根内部为非极性键,钠离子和过氧根离子之间为离子键,D正确;
答案为:D
6.D
【分析】
设X的最外层电子数为a,则Y、W、Z的最外层电子数分别为(a+2)、a、(a+3),从而得出a+ (a+2)+a+(a+3)=21,a=4,故X、Y、W、Z分别为C、O、Si、Cl,则T为As元素。
【详解】
A.X、Y、Z分别为C、O、Cl,C、O为同周期元素,C在O的左边,则原子半径(r):r(C) >r(O),故A错误;
B.X、Y分别为C、O,若X的氢化物中碳原子数比较多(如石蜡),常温下呈固态,则其沸点可能比Y的氢化物(H2O)的沸点要高,故B错误;
C.SiCl4在固态时形成分子晶体,其熔点较低、硬度较小,故C错误;
D.某病毒DNA链中有As元素,As与P属于同主族元素,可能是As取代了普通DNA链中的P元素生成的,故D正确;
故选D。
7.C
【详解】
A.S在足量O2中燃烧只能生成SO2,不能生成SO3,故A错误;
B.铁丝在氯气中燃烧只能生成FeCl3,不能生成FeCl2,故B错误;
C.钠的金属性比镁强,则钠也能在二氧化碳中燃烧生成氧化钠和碳,氧化钠与过量的二氧化碳反应生成碳酸钠,则钠在二氧化碳中燃烧可能生成碳酸钠和碳,故C正确;
D.氢氧化铜能与氨水反应生成四氨合铜离子,则氯化铜溶液中加入过量氨水生成生成四氨合铜离子,不能生成氢氧化铜沉淀,故D错误;
故选C。
8.B
【详解】
A.根据化合物化合价代数和为0可判断Na[FeEDTA]中的Fe元素的化合价为+3价,A错误;
B.根据示意图可知4个O和2个N与Fe形成配位键,则1molNa[FeEDTA]中含有6mol配位键,B正确;
C.[FeEDTA]-中碳原子的杂化类型有sp2、sp3两种,C错误;
D.EDTA分子中N原子上没有氢原子,分子间不能通过取代反应形成肽键,D错误;
答案选B。
9.C
【详解】
A.乙醇分子间能形成氢键,从而使它的沸点升高,A不符合题意;
B.冰中的水分子间通过形成氢键而构成正四面体结构,使冰的密度减小,B不符合题意;
C.氢化镁为离子化合物,由Mg2+和H-构成,晶格能由离子键决定,与氢键无关,C符合题意;
D.DNA分子间通过形成氢键,形成双螺旋结构,D不符合题意;
故选C。
10.C
【分析】
由阴离子的晶胞结构可知,晶胞中亚铁离子的个数为4×false=false,铁离子的的个数为4×false=false,氰酸根离子的个数为12×false=3,则阴离子为[Fe2(CN)6]—,由化合价代数和为0可知,MxFey(CN)6只能为MFe2(CN)6。
【详解】
A.由分析可知,该晶体的化学式为MFe2(CN)6,故A正确;
B.由题意可知,该晶体为M+离子和[Fe2(CN)6]—离子形成的离子晶体,故B正确;
C.由题意可知,该晶体为M+离子和[Fe2(CN)6]—离子形成的离子晶体,该晶体中M呈+1 价故C错误;
D.由阴离子的晶胞结构可知,位于顶点的铁离子与位于棱上的氰酸根离子的距离最近,则每个铁离子距离最近且等距离的CN—为6个,故D正确;
故选C。
11.D
【详解】
A.乙烯的实验式即最简式,应该为CH2,A错误;
B.电镀铜时,铁制镀件上的电极反应式:false,B错误;
C.false在水中完全电离,电离方程式:false,C错误;
D.NaCl为离子化合物,用电子式表示false的形成过程:,D正确;
答案选D。
12.B
【分析】
实验式为PtCl4?2NH3的物质,其水溶液不导电说明它不是离子化合物,在溶液中不能电离出阴、阳离子,加入AgNO3不产生沉淀,用强碱处理没有NH3放出,说明不存在游离的氯离子和氨分子,所以该物质的配位化学式为[PtCl4(NH3)2]。
【详解】
A. 配合物中中心原子的电荷数电荷数为4,配位数为6,故A错误;
B. false和false分子均与false形成配位键,形成的配合物为[PtCl4(NH3)2],故B正确;
C. 由分析可知,Cl-和NH3分子均与Pt4+配位,故C错误;
D. 每个[PtCl4(NH3)2]分子中含4个σPt-Cl键、2个σPt-N键、6个σN-H键,false该配合物中有false键,故D错误;
故选B。
13.C
【详解】
①石英是SiO2,其空间结构示意图为,其最小环中有12个原子,①错误;
②晶体只要有阴离子就一定有阳离子,②正确;
③金刚砂为SiC。金刚石和金刚砂均为原子晶体,原子半径越小,键长越小,化学键越强,熔点越高;键长C-C<Si-C,化学键的强弱C-C>Si-C,金刚石的熔点高于金刚砂。原子晶体的熔点比分子晶体熔点高。冰中水分子间存在氢键,使得熔点升高,使得冰的熔点大于CO2;因此金刚石、金刚砂、冰、干冰晶体的熔点依次降低,③正确;
④石墨晶体中,C原子形成3个C-C,而1个C-C键由2个C构成,则碳原子数和C-C键个数比为2:3,④错误;
⑤Al2O3晶体中离子键成分百分数较小,可以当作共价晶体处理,⑤正确;
⑥石墨晶体中除含有的C-C键为σ键,还含有π键,⑥错误;
综上只有3项是正确的;
答案选C。
【点睛】
晶体中含有阳离子,但不一定含有阴离子,如金属晶体由金属阳离子和电子构成。
14.D
【详解】
A.二氧化硅型骨架:,晶体中Al和Si在顶角处有硅与铝原子不相连,故A错误;
B.晶体中Li=12×false+1=4,Al=8×false+6×false=4,Si=4,三种微粒的比例为1:1:1,故B错误;
C.Si原子从1s22s22p63s23pfalse3pfalse转变为1s22s22p63s23pfalse3pfalse能量不改变,不产生吸收光谱,故C错误;
D.由图中晶胞可知,观察顶角的Al原子,晶体中与每个Al紧邻的Si有4个,故D正确;
故选D。
15.D
【详解】
A.它的熔点很高,硬度很大,该晶体为原子晶体,故A正确;
B.晶胞中false原子数目=4,false原子数目=false,在该晶体中false和false的配位数均为4,故B正确;
C.每个false、false都形成4个共价键,均没有孤电子对,所有原子均满足8电子稳定结构,故C正确;
D.晶胞中原子总体积false,晶胞质量 false,晶胞体积false,原子的体积占晶胞体积的百分率为 false×100%=false×100%,故D错误;
故选D。
16.D
【详解】
A.NH4Cl是离子化合物,但是其含有共价键,故离子化合物中可能含共价键,A项正确;
B.F元素的非金属性强于Cl的,则NH4F也是离子化合物,B项正确;
C.离子化合物中可含金属元素,也可含false等类金属离子原子团,C项正确;
D.在加热过程中会生成NH3,说明false离子失去了H,故有N-H键断裂,故反应中也有共价键断裂,D项错误;
答案选D。
17.1s22s22p63s23p63d10或[Ar]3d10 3mol或3NA sp3杂化 sp杂化 false ①>④>②>⑤>③ B(硼) Si(硅) 配位键 N sp3杂化 sp2杂化
【详解】
(1)Zn是30号元素,其原子核外有30个电子,失去最外层两个电子生成锌离子,根据构造原理书写其核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;Zn为中心离子,H2O为配体,配位数为4,所以配合物离子[Zn(H2O)4]2+中的配位键为;
(2)单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键,HCHO分子中含有2个C-H键、1个C= O双键,分子中含有3个σ键,所以1mol甲醛(HCHO)分 子中含有的σ键数目为3mol或3NA,故为:3 mol或3NA;
(3)根据HOCH2CN的结构简式,其中与羟基(-OH)相连的一个碳为饱和碳原子,价层电子对为4+0=4,杂化类型为sp3,另一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,价层电子对为2+false ,所以杂化类型为sp杂化;
(4)原子个数相等、价电子数相等的微粒为等电子体,与水互为等电子体的微粒该是3原子最外层电子数为8 的分子或离子,这样的微粒有:H2S、 NHfalse ,阴离子为: NHfalse,故答案为NHfalse;
(5)①CO2是直线结构,键角为180°;②SiF4为正四面体结构,键角为109°28′;③SCl2中S采用sp3杂化,为V形结构;④COfalse 中C采用sp2杂化,为正三角形结构,键角为120°;⑤H3O+中O采用sp3杂化,为三角锥形结构,③中2个孤电子对之间的斥力较大,使得③中键角小于⑤,同理⑤中键角小于②,因此键角由大到小顺序排列为①④②⑤③,故答案为:①>④>②>⑤>③;
(6)①根据同一周期从左到右主族元素的原子半径逐渐减小,可知H、B、N中原子半径最大的是B(硼);元素周期表中B与Si(硅)处于对角线上,二者化学性质相似;
②NH3BH3中N有孤电子对,B有空轨道,N和B形成配位键;电子对由N提供;NH3BH3中B形成四个σ键,为sp3杂化,B3Ofalse 中B形成3个σ键,为sp2杂化。
18.ABD false 共价键、范德华力 4 4 false
【详解】
(1)A.N2O与CO2分子中含有的原子总数相等,价电子总数也相等,因此二者互为等电子体,其结构式为N=N=O,选项A正确;
B.由于相对分子质量O3>O2,相对分子质量越大,分子之间作用力越大,物质的熔沸点就越高所以O3的沸点大于O2,选项B正确;
C.在CH2=CHCHO分子中碳原子的杂化方式都是为sp2杂化,选项C错误;
D.HCOOH分子与水分子之间会形成氢键,使其在水中溶解度大,选项D正确;
答案选ABD;
(2)在配合物中,微粒NH3、NH2OH的N原子上都有孤对电子,可以形成配位键,能够作配体,而false无孤对电子,不可以形成配位键,因此不能作配体;答案为false;
(3)根据六方氮化硼晶体结构示意图可知,在层内原子之间以共价键结合,而在层间以范德华力结合。故该晶体含用的作用力的类型有共价键、范德华力;
(4)在立方氮化硼晶体结构中,每个晶胞中含有的B原子个数是false×8+false×6=4;含有的N原子数是1×4=4;所以在一个晶胞中含有4个B原子,4个N原子。由于晶胞的边长是dcm,所以立方氮化硼的密度false,答案为4;4;false。
19.2P false 可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性O>S. > > 溴 As2O3 sp3 CD 立方最密堆积 12 false
【分析】
前四周期元素,由M原子内的电子只有一种运动状态知M为H,由N原子的双原子分子内的键能在同周期非金属元素的单质中最大知N为氮,由A与B同主族,且A元素的原子序数是B元素原子序数的false知A为氧,B为硫,由D属于第IIB的元素,且是第四周期知D是锌,由E元素原子的4p轨道上有3个未成对电子知E是As。
【详解】
(1)A为O原子,电子排布式是false,所以能量最高的能层的符号是2P,D原子电子的排布式为false,价电子的排布式为false,故答案为:2P;false。
(2)设计实验比较O与S的非金属性,可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性O>S。故答案为:可利用气态氢化物的稳定性,H2O在通电条件下分解,H2S加热下分解,可说明非金属性O>S
(3)因为氮的电负性强于砷的,所以键角false,因为氨气中存在氢键,所以沸点false,故答案为:>;>.
(4)同周期的主族元素中从左到右第一电离能逐渐增大,所以是溴,根据O和As形成的分子结构可知化合物的分子式为As2O3, As原子形成了三个共价键,且有一对孤电子,所以原子的杂化类型为sp3.故答案为:As2O3; sp3.
(5)SO2分子的中心原子价电子对为false=2+1=3几何构型为平面三角形,但分子构型为V形。
A.BeCl2分子的中心原子价电子对为false=2+1=3几何构型为平面三角形,但分子构型为V形。
B.PH3分子的中心原子价电子对为false=3+1=4几何构型为正四面体形,但分子构型为三角锥形。
C.H2O分子的中心原子价电子对为false=2+2=4几何构型为正四面体形,但分子构型为V形。
D.OF2分子的中心原子价电子对为false=2+2=4几何构型为正四面体形,但分子构型为V形。
故与SO2分子的中心原子价电子对几何构型不同但分子构型相同的是CD.故答案为:CD
(6)由金属锌晶体中的原子堆积方式图示可知,堆积方式称为立方最密堆积,配位数为12,图中结构单元中Zn原子数目为false,结构单元中Zn的总质量为false,晶体密度为falsefalse,故答案为: 立方最密堆积;12;false
【点睛】
本题考查物质结构和性质,涉及核外电子排布式书写及排布规律、电离能、晶体类型与性质,晶胞结构及计算等,要求学生知识面比较全,难度较大,是物质结构与性质的综合题。
20.C+4HNO3(浓)falseCO2↑+4NO2↑+2H2O 低 H-O-H false 4SO2+4NO2+3O2+6H2O=4HNO3+4H2SO4 15 0.5
【分析】
A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大B、F原子的最外层电子数均为其电子层数的两倍,由于F的原子序数大于B,则B是C元素,F是S元素;D、F元素原子的最外层电子数相等,二者为同主族元素,则D为O元素;C的原子序数介于B、D之间,所以C为N元素;X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应,则甲、乙分别为浓硝酸和浓硫酸,相对分子质量甲<乙,所以甲为浓硝酸,乙为浓硫酸;由转化关系图可知,X为NO2,W为SO2;元素E形成的单质是“21世纪的能源”,是目前应用最多的半导体材料,则E为Si元素;由于A原子序数最小,结合反应过程的物质所含元素,可知A是H元素;据此答题。
【详解】
通过上述分析可知A是H元素;B是C元素;C是N元素;D是O元素;E是Si元素;F是S元素;甲是浓硝酸,乙是浓硫酸;X是NO2;Y、Z一种是CO2,一种是H2O;W是SO2;由于NO2、SO2、CO2、H2O属于同一类物质,且X、Y、W都能与Z反应,则Z为H2O,Y是CO2;
(1)M是C单质,C与浓硝酸在加热时发生反应,产生CO2、NO2、H2O,反应的方程式为:C+4HNO3(浓)falseCO2↑+4NO2↑+2H2O;
(2)NO2、SO2、CO2、H2O属于同一类物质,这类化合物固态时的晶体类型为都为分子晶体,通常熔沸点较低,X、Y、W都能与Z反应,则Z为H2O,它的结构式为H-O-H;
(3)NO2、SO2与O2按1∶1∶n的物质的量之比通入H2O中,充分反应后无气体剩余或生成,则根据反应过程中电子转移数目相等,可得反应方程式:4SO2+4NO2+3O2+6H2O=4H2SO4+4HNO3,可见n(SO2):n(NO2):n(O2)=4:4:3=1:1:false,所以n=false;
(4)化合物SiO2与C在高温下发生反应:SiO2+2CfalseSi+2CO,根据价态变化可知反应1molSiO2转移4mol电子,所以转移1mol电子时消耗SiO2的物质的量是0.25mol,所以反应的SiO2的质量是m(SiO2)=0.25mol×60g/mol=15g;
(5)元素B的另一种单质具有平面层状结构,则该单质是石墨,在同一层中的C原子构成许许多多的正六边形,每个C原子与相邻的3个C原子形成共价键,C原子之间形成正六边形,每个正六边形含有这样的6个C原子,所以一个正六边形中含有的C原子数目为6×false=2,12g石墨中含有C原子物质的量是1mol,则其中含有的正六边形的物质的量是1÷2=0.5mol,则含有的正六边形的数目为0.5NA个正六边形。
